Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Chapingo serie ciencias forestales y del ambiente
On-line version ISSN 2007-4018Print version ISSN 2007-3828
Rev. Chapingo ser. cienc. for. ambient vol.28 n.1 Chapingo Jan./Apr. 2022 Epub Feb 02, 2024
https://doi.org/10.5154/r.rchscfa.2021.05.026
Artículo científico
Fitoquímicos antioxidantes y modulación de estrés oxidativo en hojas de Coffea mediante infusión y extracción asistida por ultrasonido
1 TecNM/Instituto Tecnológico de Durango, UPIDET. Bulevar Felipe Pescador 1830 Oriente. C. P. 34080. Durango, Durango, México.
2 Universidad Autónoma de Querétaro, Facultad de Química. Centro Universitario, Cerro de las Campanas s/n, Circuito Universitario. C. P. 76010. Santiago de Querétaro, Querétaro, México.
3 Guelph Research and Development Centre, Agriculture and Agri-Food Canada. 93 Stone Road West, Guelph, Ontario N1G 5C9, Canada.
Introducción:
Más allá del valor comercial de los granos de café, existe interés reciente por el aprovechamiento no maderero y las propiedades medicinales tradicionales de sus hojas.
Objetivo:
Determinar la composición fitoquímica, las propiedades antioxidantes y la inhibición del estrés oxidativo de los extractos de hojas de Coffea, obtenidos por asistencia de ultrasonido, como una oportunidad para la producción de bioactivos vegetales.
Materiales y métodos:
La composición fitoquímica de 10 extractos de hojas de Coffea arabica L. cv. Catimor 5000 se evaluó de acuerdo con su contenido de fenoles y metilxantinas; su actividad antioxidante in vitro, mediante ensayos de óxido nítrico (ON), capacidad de absorción de radicales de oxígeno (ORAC), poder antioxidante reductor férrico (FRAP) y radicales ABTS (2,2'-azino-bis [3-etilbenzotiazolina-6-ácido sulfónico]); y su efecto en la inhibición del estrés oxidativo inducido, por peróxido de hidrógeno en células humanas de adenocarcinoma de colon (HT-29). Los extractos se obtuvieron por asistencia de ultrasonido en diferentes condiciones de amplitud de onda, proporción de solvente y tiempo de extracción.
Resultados y discusión:
El contenido de fenoles y cafeína, y la mayor respuesta de inhibición de estrés oxidativo en el modelo HT-29, ensayos ORAC y ON fueron mayores con 60/40 de agua/metanol, 40 % de amplitud y 6 min de tiempo de extracción. Se identificaron por primera vez dos flavanonas en hojas de Coffea: neohesperidina y naringenina. En cuanto a los ácidos fenólicos, se identificaron los ácidos vanílico, shikímico, siríngico, elágico, 2,4,6 trihidroxibenzaldehído, y 2,3 dihidroxibenzoico, no reportados previamente en hojas de café.
Conclusión:
La novedosa composición fitoquímica de los extractos bioactivos de las hojas de Coffea por asistencia de ultrasonido es significativa, lo que representa una fuente potencial de nutracéuticos.
Palabras clave: composición fitoquímica; extractos bioactivos; flavonoides; mangiferina; ácidos fenólicos
Introduction:
Beyond the commercial value of coffee grains there is recent interest for the non-timber benefit and traditional medicinal properties of the Coffea tree leaves.
Objective:
To determine the phytochemical composition, antioxidant properties and inhibition of oxidative stress by extracts from Coffea leaves obtained by ultrasound assistance as an opportunity for production of plant bioactives.
Material and methods:
The phytochemical composition of ten extracts of Coffea arabica L. leaves cv. Catimor 5000 was evaluated in their phenolic and methylxanthines contents as well their antioxidant activity in vitro through nitric oxide (NO), absorbance capacity of oxygen radicals (ORAC), ferric reducing antioxidant power (FRAP), and radical ABTS (2,2'-azino-bis [3-ethylbenzothiazoline-6-sulfonic acid]) assays, and their effect on inhibition of oxidative stress induced by hydrogen peroxide in human colon adenocarcinoma cells (HT-29). Extracts were obtained by ultrasound assistance under different conditions (wave amplitude, solvent ratio, and extraction time).
Results and discussion:
The higher phenolics and caffeine contents, as well the greater oxidative stress inhibition response in the HT-29 model, ORAC and NO assays were obtained at 60/40 water/methanol, 40 % amplitude and 6 min of extraction time. In this work, identification of two flavanones have been reported for the first time in Coffea leaves: neohesperidin and naringenin. Regarding phenolic acids, it was detected and identified a group of hydroxybenzoic acids not previously reported in coffee leaves, such as vanillic, shikimic, syringic, and ellagic acids, along with 2,4,6 trihydroxybenzaldehyde and 2,3 dihydroxybenzoic acid.
Conclusion:
The novel phytochemical composition of bioactive extracts from Coffee leaves by ultrasound assistance is significant, representing a potential source of food nutraceuticals.
Keywords: phytochemical composition; bioactive extracts; flavonoids; mangiferin; phenolic acids
Introducción
El cafeto (Coffea spp.) es un arbusto perenne que puede garantizar un suministro constante de hojas durante todo el año. Este recurso no maderable puede utilizarse, ya que representa una parte no comercial de la planta a la que se le atribuyen propiedades medicinales (Chen, 2019). Las hojas de café se consumen desde la antigüedad, principalmente en forma de infusión, para tratar diversas enfermedades (Rosales-Villarreal et al., 2019) como infecciones respiratorias (Tabuti, Kukunda, & Waako, 2010), problemas estomacales (Belayneh & Bussa, 2014), obesidad, dolor de cuerpo y cabeza, tos, fiebre y caída del cabello (Heredia-Díaz et al., 2018).
Los efectos terapéuticos podrían estar influenciados por la composición fitoquímica de la matriz foliar, que contiene compuestos fenólicos como ácidos fenólicos (ferúlico, sináptico, cafeico, clorogénico y p-cumárico) y flavonoides (kaempferol, rutina, quercetina e isoquercitrina) (Patay, Benczik, & Papp, 2016). Se ha señalado que los ácidos 5-O-cafeoilquínico y feruloilquínico también están presentes en las hojas de Coffea canephora Pierre ex A. Froehner junto con otros componentes, entre los que se encuentran la xantona mangiferina (Campa et al., 2012), lípidos (Delaroza, Rakocevic, Malta, Bruns, & Scarminio, 2014), alcaloides (Zheng & Ashihara, 2004) y carbohidratos (Brum, Melo, Barquero, Alves, & Chalfun-Júnior, 2013). Muchos de estos metabolitos biológicamente activos pueden obtenerse mediante infusiones convencionales; sin embargo, la implementación de técnicas limpias de extracción puede permitir mayores rendimientos de fitoquímicos, principalmente compuestos fenólicos, que pueden suministrar ingredientes profilácticos y ampliar el conocimiento sobre la composición. Particularmente, existe un proceso optimizado de extracción para la recuperación de estos metabolitos vegetales; es decir, la EAU (extracción asistida por ultrasonido), tecnología emergente que acelera la transferencia de calor y masa, y que ha sido propuesta para la extracción de bioactivos de hojas de café (Chen, Ding, Ji, He, & Ma, 2020). Por lo tanto, estos mecanismos de transferencia, junto con los efectos de cavitación, facilitan la liberación de componentes extraíbles como los fenólicos bioactivos y su difusión en masa al romper las paredes celulares de la planta (Chemat et al., 2017). El proceso de EAU mejora la calidad y novedad de los extractos obtenidos en comparación con los métodos tradicionales como la infusión (Chemat et al., 2017).
Por ello, el objetivo de este estudio fue determinar el perfil químico completo y actualizado de los bioactivos fenólicos como los flavonoides, las metilxantinas y los ácidos fenólicos, así como la respuesta antioxidante y estrés oxidativo in vitro de los extractos derivados de las hojas de Coffea, mediante el uso de la extracción asistida por ultrasonido.
Materiales y métodos
Reactivos y materiales biológicos
Hojas de Coffea arabica L. cv. Catimor 5000, secadas al aire, se consiguieron a través del Instituto Nacional de Investigaciones Forestales Agrícolas y Pecuarias (INIFAP) en Xalapa, Veracruz, México. Todos los reactivos utilizados fueron Sigma-Aldrich (Estado de México, México). Las células de adenocarcinoma de colon (HT-29) provinieron de American Type Culture Collection (ATCC® HTB-38™, CDMX, México).
Preparación de extractos
Para la preparación de las infusiones de hojas de Coffea se añadió 1 g de material molido a 100 mL de agua destilada a 80 °C y se dejó reposar durante 10 min. Las infusiones se liofilizaron y se mantuvieron protegidas de la luz y la humedad hasta su análisis.
El material vegetal se sometió a EAU a temperatura constante (<35 °C), utilizando una sonda de 13 mm (Sonifer® SFX250, BRANSON®) con profundidad de 2.5 cm, volumen de solvente de 200 mL, relación solvente-sólido (10:1.5), frecuencia de 20 KHz, potencia de 250 W y pulsos intermitentes de 5 s ON / 5 s OFF (Hossain et al., 2012). Los factores variables fueron el tiempo de extracción (3, 6 y 9 min), el porcentaje de amplitud de onda (20, 30 y 40 %) y la relación de solventes agua/metanol (100/0, 60/40 y 20/80 v/v).
Contenido de fenoles totales
En una microplaca de 96 pozos se colocaron 25 μL de extracto a una concentración de 0.1 mg∙mL-1 por triplicado, luego se añadieron 80 μL de agua destilada y 5 μL de reactivo Folin-Ciocalteu 2 N. La placa se tapó y se agitó durante 5 min, después se añadieron 80 μL de Na2CO3 al 7 % a cada pozo. Las muestras reposaron durante 30 min y se leyó su absorbancia a 765 nm (ELISA SYNERGY HT, Microplate Reader BioTek; Winooski, VT, EE. UU.). Los resultados se expresaron como mg equivalentes de ácido clorogénico por mg de extracto.
Contenido de flavonoides
En una microplaca transparente de 96 pozos se colocaron 20 μL de extracto a 0.1 mg∙mL-1 y, posteriormente, 7.5 μL de NaNO2 al 5 %, 15 μL de AlCl3 al 10 %, 50 μL de NaOH 1 M y 157 μL de agua destilada se añadieron en cada pozo. La placa se agitó durante 1 min y se dejó reposar en la oscuridad durante 5 min. Después, se leyó la absorbancia a 570 nm como se indicó anteriormente. Los resultados se expresaron como mg de equivalentes de catequina por mg de extracto.
Identificación de compuestos fenólicos por HPLC-ESI-MS/MS
Los extractos se prepararon a 10 mg∙mL-1 disueltos en metanol para HPLC. Se utilizó un cromatógrafo líquido de ultra alta resolución Acquity HPLC® (Waters, Milford, MA, EE. UU.) acoplado a un espectrómetro de masas (HPLC/MS) con un módulo de ionización por electrospray negativo (ESI-). Se utilizó una columna ZORBAX RRHD Eclipse XDB-C18 de fase inversa (2.1 x 150 mm, 1.8 μm) (Agilent, Santa Clara, CA, EE. UU.) y se mantuvo a 30 °C. Se utilizaron las fases móviles 7.5 mM de ácido fórmico en agua desionizada (fase A) y acetonitrilo (fase B) a 0.21 mL∙min-1 y 20 min de tiempo total de ejecución. El programa de gradiente binario fue: 0 min, 97 % A; 1.88 min, 91 % A; 5.66 min, 84 % A; 16.9 min, 50 % A; 19.62 a 20 min, 97 % A (Díaz-Rivas et al., 2018).
El espectrómetro de masas se ajustó a 150 °C, temperatura de solvatación de 450 °C, flujo de gas de cono de 151 L∙h-1 y flujo de N2 de 796 L∙h-1. Como cosolvente se usó metanol con 0.1 % de ácido fórmico. Se utilizó el modo de ionización de reacciones múltiples para los ensayos LC-MS/MS a un voltaje capilar de 2.5 kV, temperatura de desolvatación de 400 °C, temperatura de la fuente de 150 °C, flujo de gas de desolvatación de 800 L∙h-1 y flujo de gas de cono de 150 L∙h-1; el flujo de gas de colisión fue de 0.13 mL∙min-1, energía de colisión de modo MS de 5.0 y la energía de colisión de modo MS/MS de 20.0. El volumen de inyección fue de 1 µL. La abundancia de ácidos fenólicos y flavonoides se calculó mediante curvas de calibración de varios estándares y se expresaron en µg∙g-1.
Identificación de metilxantinas por HPLC-ESI-MS/MS
Se utilizó un espectrómetro ACQUITY HPLC® con acoplamiento de masa (HPLC/MS-MS) en módulo de ionización por electrospray positivo (ESI+) y un detector de triple cuadrupolo. Se utilizó una columna ACQUITY HPLC® HSS T3 de 1.8 μm a 40 °C; las muestras se mantuvieron a 6 °C y el volumen de inyección a 1 μL. Los extractos se prepararon a 10 mg∙mL-1 disueltos en metanol para HPLC. Se utilizó una fase móvil binaria con solventes A (ácido fórmico a 0.1 % en agua) y B (ácido fórmico a 0.1 % en metanol) a 0.3 mL∙min-1 y 12 min de tiempo total de ejecución. El gradiente de elución fue: 0 min, 99 % A; 1.5 min, 95 % A; 3 min, 80 % A; 5.5 min, 45 % A; 5.8 min, 2 % A; 7.6 a 12 min, 99 % A. Los parámetros de MS fueron temperatura de la fuente, 150 °C; temperatura de solvatación, 450 °C; voltaje del cono, 30 V; flujo de gas del cono, 150 L∙h-1; y flujo de N2, 800 L∙h-1. Los patrones de fragmentación para 1,3,7-trimetilxantina (cafeína), 1,3-dimetilxantina (teofilina) y 3,7-dimetilxantina (teobromina) se evaluaron como lo indican Huck, Guggenbichler, y Bonn (2005). La abundancia se calculó mediante curvas de identificación de picos y se expresaron en mg∙g-1.
Actividad antioxidante por capacidad de absorción de radicales de oxígeno (ORAC)
En una microplaca oscura de 96 pozos se añadieron 20 μL de extracto preparado a 0.01 mg∙mL-1 en solución salina tamponada con fosfato (PBS) con pH 7.4 y 200 μL de fluoresceína a 1.09 µM. Después de la incubación (15 min a 37 °C) se tomó una primera lectura, luego se añadieron 75 μL de dihidrocloruro de 2,2-azobis (2-metilpropionamidina) (AAPH) a cada pozo, y la placa se leyó a intervalos de 210 s durante 120 min a 485 nm para excitación y 580 nm para longitudes de onda de emisión. El área bajo la curva se obtuvo con el software SigmaPlot® versión 12.0 (Systat Software Inc., 2014). Se utilizó PBS como blanco y los resultados se expresaron en μM equivalentes de trolox por mg de extracto.
Capacidad antioxidante determinada por ensayo de óxido nítrico
La actividad de barrido de ON se determinó utilizando nitroprusiato de sodio (SNP) como donante de ON. En tubos de ensayo, 1 000 μL de extracto/solvente a 0.1 mg∙mL-1 se mezclaron con 200 μL de 113 mM de SNP y la mezcla se incubó durante 2 h. Posteriormente, se transfirieron 100 μL de cada mezcla a pozos de una microplaca transparente de 96 pozos y se mezclaron con 100 μL de reactivo de Griess modificado (Sigma-Aldrich). La placa se agitó durante 15 min a 25 °C y la absorbancia se leyó a 546 nm, reportando el porcentaje de inhibición.
Actividad antioxidante por capacidad de barrido del radical ABTS
En microplacas transparentes de 96 pozos se mezclaron 10 μL de extracto en solución salina de fosfato (pH 7.4, 0.75 M) con 190 μL de ABTS (radical 2,2'-azino-bis [ácido 3-etilbenzotiazolina-6-sulfónico]) preparado 16 h antes del ensayo. La placa se agitó y se dejó reposar durante 10 min, después la absorbancia se leyó a 750 nm. Los resultados se expresaron como mg de equivalentes de trolox por mg de extracto.
Ensayo de poder antioxidante reductor férrico (FRAP)
El radical se preparó mezclando 400 mM de solución tampón de acetato, 30 mM de 2,4,6-tripiridil-s-triazina (TPTZ) y 60 mM de cloruro férrico hexahidratado al 1:1:10 (v/v/v). En una microplaca transparente de 96 pozos se mezclaron 10 μL de extracto a 0.1 mg∙mL-1 y 190 μL de mezcla de reactivos, se agitó y se dejó reposar durante 20 min en la oscuridad. La absorbancia se leyó a 593 nm. Los resultados se expresaron como mM equivalente de trolox por mg de extracto.
Experimentos de cultivo celular
Cultivo celular
La línea celular de adenocarcinoma de colon humano HT-29 se cultivó en medio RPMI-1640 con 10 % de suero fetal bovino (SFB) y 1 % de penicilina-estreptomicina en placas Petri de 100 mm y se incubó a 37 °C y en una atmósfera humidificada con 5 % de CO2. El medio se cambió cada dos días.
Ensayo de citotoxicidad
La citotoxicidad de la infusión y de los extractos de las hojas de Coffea en las células HT-29 se evaluó mediante el método de tinción con azul tripán. Las células se sembraron en placas de 24 pozos con 30 000 células por pozo en 0.5 mL de medio RPMI 1640 con 10 % de FBS y antibióticos. Las células HT-29 se trataron con muestras a 5, 10, 30, 100, 200, 500, 1 000, 10 000 y 15 000 ng∙mL-1 durante 24 h. Posteriormente, se lavaron con PBS, se añadieron con tripsina al 0.015 % disuelta en EDTA y se incubaron 10 min. La tripsina se neutralizó con 0.35 mL de RPMI con FBS. Las células vivas se contaron en una cámara Neubauer mediante el método de tinción con azul tripán y el resultado se expresó como concentración inhibitoria media (IC50) en µg∙mL-1.
Medición de especies reactivas de oxígeno inducidas por H2O2
Las células se sembraron en placas oscuras de 96 pozos con 9 600 células por pozo en 0.2 mL de RPMI con 10 % de SFB y, como antibióticos, sulfato de estreptomicina (0.6 mg∙mL-1) y penicilina (1 mg∙mL-1), incubadas durante 72 h a 37 °C y 5 % de CO2. Las células se mantuvieron con 200 µL de extractos a 50 ng∙mL-1 durante 4 h. Posteriormente, las células se cargaron con diclorofluoresceína-diacetato (10 mM) y se incubaron durante 15 min a 37 °C; luego se lavaron con PBS y se expusieron a H2O2 (100 mM) durante 1 h. Finalmente, la fluorescencia se midió a 37 °C a 485/530 nm de longitud de onda de excitación/emisión, respectivamente.
Análisis estadístico
Para reducir el número de ejecuciones experimentales, energía y materiales correspondientes, se utilizó un diseño experimental basado en el criterio D-óptimo con 10 combinaciones que comprendieron todas las variables experimentales, como se muestra en el Cuadro 1. Los resultados se expresaron como media ± desviación estándar. Los datos se analizaron mediante un análisis de varianza de una vía y las diferencias entre tratamientos se determinaron por comparación de medias mediante pruebas de Fisher con una significación estadística de P < 0.05, utilizando el programa Minitab versión 7 (Minitab Inc., 2009). El análisis de componentes principales (ACP) se realizó con el programa XLSTAT.
Cuadro 1 Condiciones experimentales para el diseño D-óptimo en extracción asistida por ultrasonido de hojas de Coffea.
| Extracto muestra | Condición de extracción | Relación agua/metanol (%) | Tiempo de extracción (min) | Amplitud (%) |
|---|---|---|---|---|
| 1 | 20/03/2020 | 20/80 | 3 | 20 |
| 2 | 100-3-20 | 100/0 | 3 | 20 |
| 3 | 100-9-20 | 100/0 | 9 | 20 |
| 4 | 40-3-30 | 60/40 | 3 | 30 |
| 5 | 100-6-30 | 100/0 | 6 | 30 |
| 6 | 20/09/1930 | 20/80 | 9 | 30 |
| 7 | 20/03/1940 | 20/80 | 3 | 40 |
| 8 | 100-3-40 | 100/0 | 3 | 40 |
| 9 | 60-6-40 | 60/40 | 6 | 40 |
| 10 | 100-9-40 | 100/0 | 9 | 40 |
Resultados y discusión
Identificación fitoquímica
Las extracciones de hojas de Coffea se realizaron con ultrasonidos e infusiones (forma convencional). El contenido de fenoles totales y flavonoides en las extracciones se muestra en la Figura 1, en la cual se observa que la infusión tuvo la mayor concentración de compuestos fenólicos totales. Los flavonoides representaron aproximadamente 20 a 40 % del contenido de fenoles totales. Esta determinación está influenciada por la capacidad del reactivo Folin-Ciocalteu de interactuar con los compuestos reductores de la muestra; por ello, para una identificación más precisa se utilizó cromatografía líquida acoplada a espectrometría de masas (LC-MS).
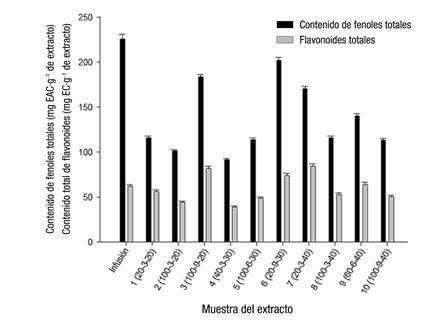
Figura 1 Contenido de fenoles totales y flavonoides en infusión y extractos de hojas de Coffea. Infusión: 1 g de material molido en 100 mL de agua destilada a 80 °C, reposado durante 10 min. Condiciones de extracción: Relación agua/metanol (%) - Tiempo de extracción (min) - Amplitud (%). EAC: equivalentes de ácido clorogénico; EC: equivalentes de catequina. Literales distintas indican diferencias significativas (Fisher P = 0.05).
Se identificaron ácidos fenólicos, flavonoides y xantona mangiferina (Cuadro 2). Los extractos acuosos 2, 3, 5, 8, 10 y la infusión tuvieron contenidos más bajos de compuestos flavonoides específicos (<197.0 µg∙g-1), especialmente flavanoles como la catequina, procianidina y mangiferina en comparación con los extractos hidroalcohólicos 1, 4, 6, 7 y 9 (>274.0 µg∙g-1); sin embargo, la mangiferina en los extractos fue el doble (>54.0 µg∙g-1) que la encontrada en infusiones (25.8 ± 0.12 µg∙g-1). Por el contrario, se encontraron concentraciones más elevadas de ácidos fenólicos (735.6 a 899.7 µg∙g-1) en todos los extractos obtenidos con ultrasonido en comparación con la infusión (597.2 µg∙g-1) (Cuadro 3). No se observaron diferencias significativas entre extractos acuosos y mezclas de agua/metanol. El grupo de ácidos hidroxicinámicos fue el predominante con ácidos quínico, 3-4/4-5 dicaffeoilquínico y clorogénico como los principales compuestos identificados tanto en la infusión como en los extractos.
Cuadro 2 Compuestos flavonoides identificados en extractos de hojas de Coffea obtenidos por asistencia de ultrasonido en diferentes condiciones.
| Compuesto (µg∙g-1 extracto*) | Infusión | Extracto 1 20-3-20 | Extracto 2 100-3-20 | Extracto 3 100-9-20 | Extracto 4 60-3-30 | Extracto 5 100-6-30 | Extracto 6 20-9-30 | Extracto 7 20-3-40 | Extracto 8 100-3-40 | Extracto 9 60-6-40 | Extracto 10 100-9-40 |
|---|---|---|---|---|---|---|---|---|---|---|---|
| Flavanonas | |||||||||||
| Naringenina | traces | 10.39 ± 4.2 ab | traces | traces | 6.49 ± 2.6 bc | traces | 8.38 ± 3.4 ab | 10.0 ± 4.0 ab | traces | 17.52 ± 7.1 a | 6.10 ± 2.5 b |
| Neohesperidina | traces | 0.14 ± 0.0 a | 0.19 ± 0.1 a | 0.26 ± 0.1 a | 0. 13 ± 0.0 a | 0.25 ± 0.1 a | 0.18 ± 0.1 a | 0.15 ± 0.1 a | 0.18 ± 0.1 a | 0.16 ± 0.1 a | 0.13 ± 0.0 a |
| Flavanoles | |||||||||||
| Catequina | 3.02 ± 0.12 a | 3.14 ± 0.8 a | 1.19 ± 0.3 cd | 0.28 ± 0.1d | 2.42 ± 0.6 abc | 1.21 ± 0.3 bcd | 2.92 ± 0.7 a | 2.27 ± 0.6 abc | 0.57 ± 0.1 d | 2.64 ± 0.7 ab | 0.41 ± 0.1 d |
| Epicatequina | 10.6 ± 0.52 b | 35.37 ± 6.2 a | 13.82 ± 2.4 b | 11.16 ± 1.9 b | 29.71 ± 5.2 a | 9.29 ± 1.6 b | 32.19 ± 5.6 a | 33.20 ± 5.8 a | 13.14 ± 2.3 b | 28.22 ± 4.9 a | 8.08 ± 1.4 b |
| Procianidina B1 | 13.94 ± 2.13 e | 1.99 ± 0.4 ab | 0.67 ± 0.1 a | 0.96 ± 0.2 d | 1.32 ± 0.3 bcd | 0.77 ± 0.2 d | 2.42 ± 0.5 a | 2.41± 0.5 a | 0.72 ± 0.1 d | 1.71 ± 0.3 abc | 0.57 ± 0.1 d |
| Procianidina B2 | 14.03 ± 2.15 bc | 47.64 ± 15.5 a | 17.70 ± 5.8 abc | 16.51 ± 5.4 abc | 39.07 ± 12.8 b | 12.94 ± 4.2 c | 40.35 ± 3.2 abc | 41.02 ± 13.4 abc | 16.91 ± 5.5 bc | 43.80 ± 14.3 ab | 13.66 ± 4.5 bc |
| Flavonoles | |||||||||||
| Quercetina | 0.18 ± 0.06 c | 0.19 ± 0.0 c | 0.10 ± 0.0 c | 0.12 ± 0.0 c | 1.19 ± 0.2 ab | 0.10 ± 0.0 c | 0.43 ± 0.1 c | 0.27 ± 0.0 c | 0.11 ± 0.0 c | 2.34 ± 0.4 a | 0.16 ± 0.0 c |
| Quercetina 3-O-glucósido | 11.98 ± 0.14 d | 30.88 ± 3.9 abc | 23.68 ± 3.0 c | 28.74 ± 3.6 c | 36.18 ± 4.5 ab | 30.74 ± 3.8 abc | 36.16 ± 4.5 ab | 31.76 ± 4.0 abc | 25.71 ± 3.2 bc | 40.67 ± 5.1 a | 31.07 ± 3.9 abc |
| Rutina | 21.76 ± 0.17 c | 63.52 ± 9.5 b | 66.66 ± 10 ab | 74.14 ± 11.1 ab | 87.05 ± 13 a | 82.99 ± 12.4 ab | 78.53 ± 11.7 ab | 71.68 ± 10.7 ab | 70.56 ± 10.5 ab | 97.47 ± 14.6 a | 79.00 ± 11.8 ab |
| Kaempferol 3-O-glucósido | 0.84 ± 0.04 | nd | nd | nd | nd | nd | nd | nd | nd | nd | nd |
| Xantonas | |||||||||||
| Mangiferina | 25.8 ± 0.12 c | 82.66 ± 3.7 a | 53.45 ± 2.4 b | 56.25 ± 2.5 b | 78.25 ± 3.5 a | 58.56 ± 2.6 b | 84.06 ± 3.7 a | 81.71 ± 3.6 a | 56.51 ± 2.5 b | 78.80 ± 3.5 a | 54.44 ± 2.4 b |
| Total | 97.04 c | 274.84 a | 177.45 b | 188.39 b | 281.79 a | 196.83 b | 285.61 a | 274.45 a | 184.45 b | 313.31 a | 193.61 b |
Infusión: 1 g de material molido con 100 mL de agua destilada a 80 °C en reposo durante 10 minutos. Condiciones de extracción: Relación agua/metanol (%) - Tiempo de extracción (min) - Amplitud (%). Valores en filas con letras distintas son estadísticamente diferentes (Fisher, P = 0.05). nd: no detectado (fuera del límite de detección del equipo 0.0001 µg∙g-1 de extracto). *Base seca. Trazas <0.001 µg∙g-1.
Cuadro 3 Ácidos fenólicos identificados en extractos de hojas de Coffea obtenidos por asistencia de ultrasonido en diferentes condiciones.
| Compuesto (µg∙g-1 extracto*) | Infusión | Extracto 1 20-3-20 | Extracto 2 100-3-20 | Extracto 3 100-9-20 | Extracto 4 60-3-30 | Extracto 5 100-6-30 | Extracto 6 20-9-30 | Extracto 7 20-3-40 | Extracto 8 100-3-40 | Extracto 9 60-6-40 | Extracto 10 100-9-40 |
|---|---|---|---|---|---|---|---|---|---|---|---|
| Ácidos hidroxibenzoicos | |||||||||||
| Ácido benzoico | 0.475 ± 0.04 f | 3.69 ± 0.15 bcd | 3.86 ± 0.15 bc | 3.02 ± 0.12 e | 3.52 ± 0.14 cd | 4.05 ± 0.16 ab | 3.89 ± 0.15 bc | 3.82 ± 0.15 bcd | 4.32 ± 0.17 a | 3.08 ± 0.12 e | 3.41 ± 0.13 de |
| Ácido 4-hidroxibenzoico/salicílico | 0.115 ± 0.00 b | 0.57 ± 0.08 a | 0.52 ± 0.08 a | 0.49 ± 0.07 a | 0.44 ± 0.06 a | 0.50 ± 0.07 a | 0.60 ± 0.09 a | 0.48 ± 0.07 a | 0.51 ± 0.07 a | 0.42 ± 0.06 a | 0.59 ± 0.09 a |
| ácido 2,5 dihidroxibenzoico | 0.035 ± 0.00 c | 0.10 ± 0.01 ab | 0.08 ± 0.01 b | 0.06 ± 0.01 b | 0.07 ± 0.01 b | 0.09 ± 0.01 ab | 0.07 ± 0.01 b | 0.12 ± 0.02 a | 0.07 ± 0.01 b | 0.06 ± 0.01 b | 0.09 ± 0.01 ab |
| Ácido 2,4,6 trihidroxi-benzaldehído | 0.085 ± 0.02 b | 0.03 ± 0.01 a | 0.03 ± 0.01 a | 0.03 ± 0.01 a | 0.02 ± 0.01 a | 0.02 ± 0.01 a | 0.02 ± 0.01 a | 0.03 ± 0.01 a | 0.03 ± 0.01 a | 0.03 ± 0.01 a | 0.02 ± 0.01 a |
| Ácido protocatéquico | 0.05 ± 0.00 e | 1.82 ± 0.09 a | 1.64 ± 0.08 ab | 1.62 ± 0.08 abc | 1.20 ± 0.06 abc | 1.51 ± 0.08 bc | 1.81 ± 0.09 a | 1.82 ± 0.09 a | 1.65 ± 0.09 ab | 1.37 ± 0.07 cd | 1.57 ± 0.08 abc |
| Ácido vanílico | 5.84 ± 1.56 f | 23.58 ± 1.56 cd | 26.67 ± 1.7 bc | 26.32 ± 1.74 bc | 18.15 ± 1.2 bc | 25.18 ± 1.66 c | 33.12 ± 2.19 a | 22.0 ± 1.45 cde | 22.89 ± 1.51 cde | 19.41 ± 1.28 de | 30.53 ± 2.01 ab |
| Ácido gálico | 1.38 ± 0.13 e | 14.92 ± 3.51 a | 2.62 ± 0.62 d | 3.54 ± 0.83 bcd | 9.65 ± 2.27 bcd | 3.83 ± 0.90 bcd | 14.55 ± 3.42 a | 11.81 ± 2.78 a | 3.48 ± 0.82 cd | 9.13 ± 2.15 abc | 3.29 ± 0.77 cd |
| Ácido shikímico | 5.74 ± 0.03 bcd | 5.13 ± 0.18 de | 5.49 ± 0.20 cde | 5.49 ± 0.20 cde | 5.84 ± 0.21 cde | 6.29 ± 0.23 ab | 5.71 ± 0.20 bcd | 5.20 ± 0.19 de | 5.48 ± 0.20 cde | 5.06 ± 0.18 e | 6.31 ± 0.23 a |
| Ácido siríngico | 0.075 ± 0.00 e | 0.34 ± 0.03 bc | 0.29 ± 0.03 bcd | 0.37 ± 0.03 b | 0.25 ± 0.02 b | 0.34 ± 0.03 bc | 0.32 ± 0.03 bcd | 0.30 ± 0.03 bdc | 0.36 ± 0.03 bc | 0.27 ± 0.02 cd | 0.47 ± 0.04 a |
| Ácido elágico | 0.73 ± 0.03 b | 0.82 ± 0.05 a | 0.71 ± 0.04 b | 0.36 ± 0.02 d | 0.16 ± 0.01 d | 0.49 ± 0.03 c | 0.90 ± 0.06 a | 0.36 ± 0.02 d | 0.53 ± 0.03 c | 0.23 ± 0.01 e | 0.55 ± 0.03 c |
| Ácidos hidroxicinámicos | |||||||||||
| Ácido transcinámico | 25.04 ± 1.31 d | 54.99 ± 5.38 abc | 48.4 ± 4.73 bc | 41.30 ± 4.04 c | 49.05 ± 4.8 bc | 55.12 ± 5.4 abc | 48.58 ± 4.75 bc | 54.1 ± 5.28 abc | 59.22 ± 5.79 ab | 48.23 ± 4.71 bc | 63.96 ± 6.25 a |
| Ácido cumárico | 0.25 ± 0.09 d | 0.47 ± 0.03 ab | 0.47 ± 0.03 ab | 0.46 ± 0.03 ab | 0.37 ± 0.02 c | 0.52 ± 0.03 a | 0.48 ± 0.03 ab | 0.46 ± 0.03 ab | 0.45 ± 0.03 abc | 0.44 ± 0.02 bc | 0.52 ± 0.03 a |
| Ácido cafeico | Traces | 10.67 ± 0.53 ab | 9.79 ± 0.49 b | 10.93 ± 0.54 ab | 10.46 ± 0.52 ab | 10.3 ± 0.51 ab | 10.62 ± 0.53 ab | 9.85 ± 0.49 ab | 10.12 ± 0.50 ab | 10.58 ± 0.53 ab | 11.31 ± 0.56 a |
| Ácido qunico | 519.35 ± 6.19 d | 393.81 ± 8.1 abc | 409.27 ± 8.4 a | 407.66 ± 8.35 a | 381.22 ± 7.81 bc | 396.1 ± 8.1 abc | 410.95 ± 8.42 a | 373.1 ± 7.64 c | 412.78 ± 8.46 a | 401.6 ± 8.23 ab | 408.07 ± 8.36 a |
| Ácido ferúlico | 0.27 ± 0.04 d | 0.41 ± 0.02 bc | 0.52 ± 0.03 a | 0.51 ± 0.03 a | 0.39 ± 0.02 bc | 0.51 ± 0.03 a | 0.49 ± 0.03 a | 0.35 ± 0.02 c | 0.53 ± 0.03 a | 0.46 ± 0.03 ab | 0.46 ± 0.03 ab |
| Ácido sináptico | Trazas | 0.30 ± 0.04 a | 0.16 ± 0.02 b | 0.18 ± 0.03 b | 0.32 ± 0.05 a | 0.15 ± 0.02 b | 0.31 ± 0.04 a | 0.29 ± 0.04 a | 0.18 ± 0.03 b | 0.37 ± 0.05 a | 0.18 ± 0.03 b |
| Ácido caftárico | 0.31 ± 0.08 b | 14.81 ± 4.64 a | 7.56 ± 2.37 a | 13.65 ± 4.28 a | 11.31 ± 3.54 a | 14.39 ± 4.51 a | 15.59 ± 4.89 a | 14.44 ± 4.53 a | 14.69 ± 4.60 a | 14.67 ± 4.60 a | 11.86 ± 3.72 a |
| Ácido 4-O-cafeoilquínico | Traces | 9.78 ± 0.72 ab | 8.78 ± 0.65 b | 8.71 ± 0.64 b | 10.37 ± 0.76 ab | 9.28 ± 0.68 ab | 10.05 ± 0.74 ab | 9.14 ± 0.67 ab | 8.77 ± 0.65 b | 11.07 ± 0.82 a | 8.78 ± 0.65 b |
| Ácido clorogénico | 1.32 ± 0.4 f | 145.01 ± 4.56 a | 115.4 ± 3.63 e | 116.02 ± 3.65 de | 127.64 ± 4.0 bcd | 125.4 ± 3.9 cde | 138.39 ± 4.35 ab | 133.0 ± 4.2 bc | 118.16 ± 3.71 de | 139.0 ± 4.37 ab | 122.9 ± 3.86 cde |
| Ácido 3,4/4,5 dicafeoilquínico | 36.13 ± 0.09 e | 193.52 ± 9.46 bc | 93.47 ± 4.57 d | 116.23 ± 5.68 d | 215.1 ± 10.52 ab | 102.0 ± 4.99 d | 203.28 ± 9.94 ab | 185.9 ± 9.09 c | 107.15 ± 5.24 d | 222.2 ± 10.87 a | 110.96 ± 5.43 d |
| Total | 597.15 f | 874.75 ab | 735.67 e | 756.90 e | 845.46 abc | 756.09 e | 899.69 a | 826.60 bcd | 771.32 de | 887.66 ab | 785.76 cde |
Infusión: 1 g de material molido con 100 mL de agua destilada a 80 °C en reposo durante 10 minutos. Condiciones de extracción: Relación agua/metanol (%) - Tiempo de extracción (min) - Amplitud (%). Valores en filas con letras distintas son estadísticamente diferentes según Fisher con P = 0.05. *Base seca. Trazas <0.001 µg∙g-1.
Las cantidades de cafeína en las muestras de hojas de Coffea se ilustran en la Figura 2. A excepción del extracto 9 (relación agua/metanol [60/40 %] - tiempo de extracción [6 min] - amplitud [40 %]), la infusión superó el contenido de cafeína con respecto al resto de los extractos. Una taza de café contiene aproximadamente 137 mg de cafeína (Setiawan et al., 2015) y, según los resultados, una taza de infusión de hojas de Coffea tiene alrededor de 1.4 mg. Se ha informado la disminución de la concentración de cafeína en los extractos obtenidos por asistencia de ultrasonido, probablemente debido a su degradación por efecto de sonicación (Guglielmetti, D'Ignoti, Ghirardello, Belviso, & Zeppa, 2017). La teofilina y la teobromina fueron bajas en todas las muestras.
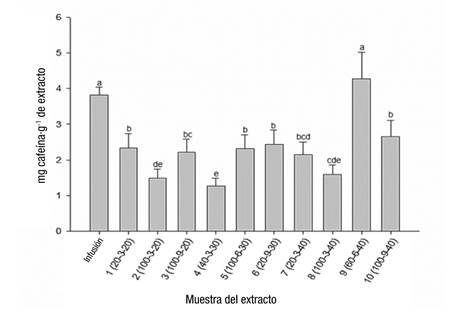
Figura 2 Contenido total de cafeína en la infusión y extractos de hojas de Coffea. Infusión: 1 g de material molido con 100 mL de agua destilada a 80 °C en reposo durante 10 min. Condiciones de extracción: Relación agua/metanol (%) - Tiempo de extracción (min) - Amplitud (%). Letras distintas indican diferencias significativas (Fisher P = 0.05).
Varios compuestos fenólicos y alcaloides como la cafeína se han reportado previamente en las hojas de Coffea (Ratanamarno & Subkar, 2017) y muchos de estos fitoquímicos pueden estar relacionados con las propiedades terapéuticas. En particular, el ácido clorogénico y la mangiferina muestran importantes efectos farmacológicos como antidiabético, antilipidémico (Ong, Hsu & Tan, 2013), antinflamatorio (Hwang, Kim, Park, Lee, & Kim, 2014), anticancerígeno (Ebkatan, Li, Ghorbani, Azadi, & Kubow, 2018; Yamagata, Izawa, Onodera, & Tagami, 2018) y aumento de capacidad antioxidante (Shi et al., 2016).
En este trabajo se ha señalado por primera vez la identificación de dos flavanonas en las hojas de Coffea: neohesperidina y naringenina. Su detección fue posible principalmente en los extractos realizados por sonicación y con disolventes hidroalcohólicos (extractos 1, 4, 6, 7 y 9). Dichos compuestos también se extrajeron con agua, pero con la mayor amplitud y tiempos de extracción; es decir, solo con mayor energía administrada al extracto o en combinación con metanol fue posible la obtención de estas flavanonas. La aglicona naringenina y la forma glucósida de hesperetina, neohesperidina son flavanonas importantes. Estas han mostrado varias propiedades funcionales como actividades antioxidantes, antiproliferativas, antivirales, antialérgicas, antinflamatorias, antiateroscleróticas y anticancerígenas (Kim et al., 2011). La naringenina ha sido muy estudiada por su actividad antidiabética. Algunos mecanismos de esta flavanona son sus efectos moduladores sobre la secreción y la sensibilidad a la insulina; la producción hepática, los transportadores, la captación periférica y la absorción intestinal de glucosa; los lípidos sanguíneos y la biosíntesis del colesterol; así como el estrés oxidativo y la inflamación (Joshi, Kulkarni, & Wairkar, 2018). La naringenina es una flavanona primaria que abunda en muchos cítricos como las naranjas (1.47 a 11.15 mg∙100 g-1) y toronjas (14.17 a 53 mg∙100 g-1) (Nogata et al., 2006); en este estudio, la mayor concentración fue de 1.75 mg∙100 g-1 en el extracto 9.
En cuanto a los ácidos fenólicos, se identificó un grupo de ácidos hidroxibenzoicos no reportados previamente en las hojas de café, como los ácidos vanílico, shikímico, siríngico y elágico, junto con el 2,4,6 trihidroxibenzaldehído y el ácido 2,3 dihidroxibenzoico. Entre estos, el ácido vanílico se encontró en mayor concentración y está relacionado con múltiples actividades farmacológicas como la inhibición de la actividad del veneno de serpiente, además de propiedades antioxidantes, antimicrobianas y antinflamatorias (Dhananjaya, Nataraju, Raghavendra Gowda, Sharat, & D’Souza, 2009; Tai, Sawano, & Ito, 2012).
Actividad antioxidante
Los resultados de los ensayos antioxidantes se muestran en el Cuadro 4. Los ensayos ABTS y FRAP cuantifican esencialmente la capacidad del extracto para neutralizar un radical por transferencia de un solo electrón (SET); sin embargo, el ensayo ABTS también podría actuar bajo el mecanismo de una transferencia de átomos de hidrógeno (HAT). Los ensayos ORAC y ON evalúan el mecanismo de HAT. La actividad de barrido de radicales ABTS mostró correlación positiva y estadísticamente significativa con el contenido de fenoles totales (Pearson 0.754, P = 0.007) y flavonoides (Pearson 0.854, P = 0.001).
El extracto 6 (relación agua/metanol [20/80 %] - tiempo de extracción [9 min] - amplitud [30 %]) mostró los valores más altos de ABTS y FRAP, mientras que el extracto 9 (relación agua/metanol [60/40 %] - tiempo de extracción [6 min] - amplitud [40 %]), la mayor actividad en los ensayos ORAC y ON. El extracto 9 mostró mayor concentración de flavanonas, flavonoles y cafeína en comparación con el extracto 6. Se ha reportado que bajas concentraciones de cafeína pueden favorecer un efecto antioxidante al ejercer una fuerte capacidad de atrapamiento del radical •OH (Petrucci, Zollo, Curulli, & Marrosu, 2018). No obstante, también se ha sugerido que la cafeína no influye en la capacidad antioxidante mediante ensayos basados en el mecanismo HAT (Petrucci et al., 2018). Por otra parte, el extracto 6 también mostró mayor concentración de epicatequina y mangiferina en comparación con el extracto 9.
Está comprobado que tanto el estrés oxidativo como el nitrosativo, debido a circunstancias tanto intrínsecas como extrínsecas, inducen a los mecanismos biológicos para perder el control sobre los radicales libres con el consiguiente desequilibrio entre las condiciones oxidantes y defensas antioxidantes celulares. Por ello, es interesante evaluar no solo el potencial antioxidante de un material vegetal, sino también su capacidad antinitrosativa. El potencial inhibidor del óxido nítrico de los extractos evaluados osciló entre 36 y 58 % y el extracto 9 fue el más eficiente para eliminarlo.
Cuadro 4 Ensayos para la evaluación de la capacidad antioxidante in vitro en infusión y extractos de hojas de Coffea.
| Muestra de extracto | Condiciones de extracción | ABTS mM TE∙mg-1 extracto | FRAP mM TE∙mg-1 extracto | ORAC mM∙TE mg-1 extracto | ON (% inhibición) |
|---|---|---|---|---|---|
| Infusión* | - | 180.71 ± 7.14 d | 198.33 ± 23.09 bcd | 166.17 ± 9.82 f | 36.25 ± 2.46 g |
| 1 | 20/03/2020 | 178.81 ± 0.15 d | 238.33 ± 21.53 a | 112.56 ± 0.52 i | 50.74 ± 2.03 b |
| 2 | 100-3-20 | 120.95 ± 0.10 h | 223.33 ± 20.17 ab | 159.82 ± 0.74 g | 42.67 ± 1.71 de |
| 3 | 100-9-20 | 289.76 ± 0.26 b | 126.66 ± 11.44 f | 120.77 ± 0.56 h | 45.32 ± 1.82 cd |
| 4 | 40-3-30 | 86.42 ± 0.077 i | 188.33 ± 17.01 cd | 103.59 ± 0.48 j | 40.64 ± 1.63 ef |
| 5 | 100-6-30 | 144.52 ± 0.13 g | 196.66 ± 17.76 bcd | 156.32 ± 0.73 g | 38.62 ± 1.55 fg |
| 6 | 20/09/1930 | 343.09 ± 0.31 a | 218.33 ± 19.72 abc | 182.92 ± 0.85 e | 47.06 ± 1.88 c |
| 7 | 20/03/1940 | 230.71 ± 0.21 c | 245.00 ± 22.13 a | 197.85 ± 0.92 d | 47.71 ± 1.91 bc |
| 8 | 100-3-40 | 154.04 ± 0.14 f | 150.00 ± 13.55 ef | 232.84 ± 1.08 b | 46.85 ± 1.88 c |
| 9 | 60-6-40 | 165.47 ± 0.15 e | 175.00 ± 15.81 de | 259.05 ± 1.21 a | 58.71 ± 2.35 a |
| 10 | 100-9-40 | 152.14 ± 0.13 f | 193.33 ± 17.46 bcd | 214.82 ± 1.00 c | 50.65 ± 2.03 b |
*Infusión: 1 g de material molido con 100 mL de agua destilada a 80 °C en reposo durante 10 min. Condiciones de extracción: Relación agua/metanol (%) - Tiempo de extracción (min) - Amplitud (%). Valores en la misma columna con letras distintas son significativamente diferentes (Fisher P = 0.05). Ensayos: capacidad de absorción de radicales de oxígeno (ORAC), poder antioxidante férrico reductor (FRAP), radical ABTS (ácido 2,2'-azino-bis [3-etilbenzotiazolina-6-sulfónico]), óxido nítrico (ON). TE: equivalente de trolox.
Viabilidad celular
Diferentes concentraciones de extractos e infusiones en cultivos HT-29 se evaluaron y se obtuvieron sus IC50. El Cuadro 5 muestra que los valores de IC50 de todas las muestras fueron inferiores de 13 µg∙mL-1. Según estos resultados, se propuso una concentración fija de extractos e infusiones de 50 ng∙mL-1 (donde la viabilidad celular fue de 100 %) para evaluar su efecto protector. Los fitoquímicos presentes en los extractos e infusiones en esta concentración baja fueron capaces de inhibir el estrés generado en las células por exposición a H2O2. En comparación con el 100 % de estrés en el control positivo con H2O2, todos los tratamientos fueron capaces de reducir el estrés en 5.9 a 16 %, especialmente el extracto 9 (Figura 3). Las condiciones de extracción del proceso 9 favorecieron un extracto rico en mangiferina, la cual muestra protección celular atenuando la expresión del estrés oxidativo (Rocha, Bonet, Tambeli, de-Faria, & Parada, 2018).
Cuadro 5 Resultados de viabilidad celular expresados como IC50 (concentración inhibitoria media) de infusiones y extractos de hojas de Coffea, evaluados en células de adenocarcinoma de colon humano (HT-29).
| Muestra de extracto | Condiciones de extracción | IC50 (µg∙mL-1) |
|---|---|---|
| Infusión* | - | 9.16 ± 0.9 b |
| 1 | 20/03/2020 | 6.50 ± 0.8 c |
| 2 | 100-3-20 | 8.97 ± 1.1 b |
| 3 | 100-9-20 | 5.05 ± 0.6 c |
| 4 | 40-3-30 | 2.86 ± 0.4 d |
| 5 | 100-6-30 | 12.09 ± 1.5 a |
| 6 | 20/09/1930 | 12.50 ± 1.6 a |
| 7 | 20/03/1940 | 6.19 ± 0.8 c |
| 8 | 100-3-40 | 5.22 ± 0.7 c |
| 9 | 60-6-40 | 5.70 ± 0.7 c |
| 10 | 100-9-40 | 9.82 ± 1.2 b |
*Infusión: 1 g de material molido con 100 mL de agua destilada a 80 °C en reposo durante 10 min. Condiciones de extracción: Relación agua/metanol (%) - Tiempo de extracción (min) - Amplitud (%). Valores con letras distintas son significativamente diferentes (Fisher P = 0.05).
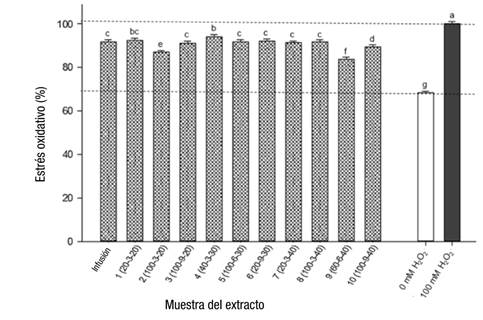
Figura 3 Capacidad de los extractos de hojas de Coffea para inhibir el estrés oxidativo en un ensayo de células de adenocarcinoma de colon humano (HT-29). Control positivo con H2O2. Letras distintas indican diferencias significativas (Fisher, P = 0.05). Infusión: 1 g de material molido con 100 mL de agua destilada a 80 °C en reposo durante 10 min. Condiciones de extracción: relación agua/metanol (%) - tiempo de extracción (min) - amplitud (%).
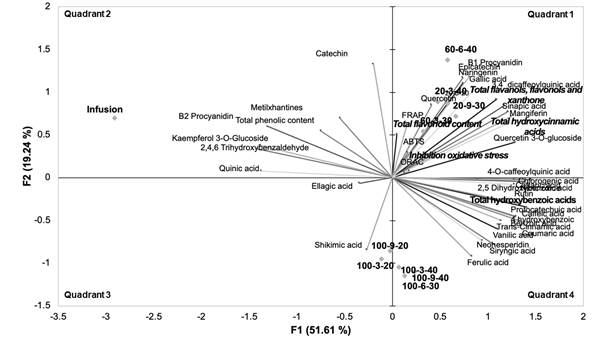
En la Figura 4 se muestra el ACP de las variables respuesta y de los procesos de extracción (ultrasonidos e infusión). En el cuadrante 1 se observa un grupo con la mayoría de las respuestas y todos los procesos de extracción por ultrasonido en los que se utilizó un medio hidroalcohólico (agua/metanol). En este grupo, todas las respuestas antioxidantes (ON, ORAC, ABTS y FRAP) están relacionadas con extractos hidroalcohólicos, así como con la evaluación del estrés oxidativo en las células. También se observan compuestos fenólicos con actividad terapéutica importante. La correlación entre las respuestas observadas, así como los fitoquímicos de importancia biológica, convierten estas condiciones de extracción en una buena alternativa para la obtención de compuestos fenólicos con capacidad potencial como ingredientes nutracéuticos.
En los cuadrantes inferiores se observaron los procesos de extracción con asistencia de ultrasonido, exclusivamente en el medio acuoso, y se relacionaron con la recuperación de compuestos fenólicos simples, mientras que la infusión se encontró en el cuadrante 2. Este proceso de extracción tiene una alta correlación específicamente con la recuperación de ácido quínico. Los 11 procesos evaluados mostraron la capacidad de recuperación de los compuestos fenólicos, y los obtenidos por sonicación y combinación con alcohol como solvente tuvieron, además, una actividad antioxidante importante.
Conclusiones
El contenido de fenoles y metilxantinas se evaluó en los extractos de las hojas de Coffea arabica. Su actividad antioxidante in vitro se determinó mediante ensayos ON, ORAC, FRAP y ABTS e inhibición del estrés oxidativo por H2O2 en células HT-29. El efecto de las condiciones de extracción asistida por ultrasonido se constató y extractos a 60/40 agua/metanol, 40 % de amplitud y 6 min de extracción (extracto 9) mostraron las mayores concentraciones de fenólicos y cafeína, y la mayor inhibición de estrés oxidativo en el modelo HT-29, ensayos ORAC y ON. Asimismo, fue posible identificar nuevos compuestos fenólicos como flavanonas (naringenina y neohespiridina) y ácidos hidroxibenzoicos (ácido vanílico). El contenido total de compuestos identificados siempre fue mayor en extractos asistidos por ultrasonido, mientras que el rendimiento de la extracción fenólica mejoró con la adición de alcohol. La composición fitoquímica de los extractos asistidos por ultrasonido de hojas de Coffea representa una oportunidad para utilizar este material vegetal como una nueva fuente de nutracéuticos para tratar diversas condiciones de salud relacionadas con estrés oxidativo; sin embargo, es necesario realizar más investigaciones.
Agradecimientos
La primera autora (MCRV) agradece al Consejo Nacional de Ciencia y Tecnología (CONACyT) por haberle otorgado una beca de doctorado. Se agradece la recolección de muestras de M. C. Rosalío López-Morgado del PICIP (café), S.E. Teocelo, INIFAP. Se agradece el apoyo financiero parcial del Tecnológico Nacional de México (TecNM) mediante el proyecto núm. 5690.19-P.
REFERENCIAS
Belayneh, A., & Bussa, N. F. (2014). Ethnomedicinal plants used to treat human ailments in the prehistoric place of Harla and Dengego valleys, eastern Ethiopia. Journal of Ethnobiology and Ethnomedicine, 10(1), 18. doi: 10.1186/1746-4269-10-18 [ Links ]
Brum, C. N. F., Melo, E. F., Barquero, L. O. B., Alves, J. D., & Chalfun-Júnior, A. (2013). Modifications in the metabolism of carbohydrates in (Coffea arabica L. cv. siriema) seedlings under drought conditions. Coffee Science, 8(2), 140‒147. Retrieved from http://www.coffeescience.ufla.br/index.php/Coffeescience/article/view/384 [ Links ]
Campa, C., Mondolot, L., Rakotondravao, A., Bidel, L. P. R., Gargadennec, A., Couturon, E., La Fisca, P., …Davis, A. P. (2012). A survey of mangiferin and hydroxycinnamic acid ester accumulation in coffee (Coffea) leaves: Biological implications and uses. Annals of Botany, 110(3), 595‒613. doi: 10.1093/aob/mcs119 [ Links ]
Chemat, F., Rombaut, N., Sicaire, A. G., Meullemiestre, A., Fabiano-Tixier, A. S., & Abert-Vian, M. (2017). Ultrasound assisted extraction of food and natural products. Mechanisms, techniques, combinations, protocols and applications. A review. Ultrasonics Sonochemistry, 34, 540‒560. doi: 10.1016/j.ultsonch.2016.06.035 [ Links ]
Chen, X. (2019). A review on coffee leaves: Phytochemicals, bioactivities and applications. Critical Reviews in Food Science & Nutrition, 59(6), 1008‒1025. doi: 10.1080/10408398.2018.1546667 [ Links ]
Chen, X., Ding, J., Ji, D., He, S., & Ma, H. (2020). Optimization of ultrasonic-assisted extraction conditions for bioactive components from coffee leaves using the Taguchi design and response surface methodology. Journal of Food Science, 85(6), 1742‒1751. doi: 10.1111/1750-3841.15111 [ Links ]
Delaroza, F., Rakocevic, M., Malta, G. B., Bruns, R. E., & Scarminio, I. S. (2014). Spectroscopic and chromatographic fingerprint analysis of composition variations in Coffea arabica leaves subject to different light conditions and plant phenophases. Journal of the Brazilian Chemical Society, 25(11), 1929‒1938. doi: 10.5935/0103-5053.20140172 [ Links ]
Dhananjaya, B. L., Nataraju, A., Raghavendra Gowda, C. D., Sharat, B. K., & D’Souza, C. J. M. (2009). Vanillic acid as a novel specific inhibitor of snake venom 5′-nucleotidase: A pharmacological tool in evaluating the role of the enzyme in snake envenomation. Biochemistry (Moscow), 74, 1315‒1319. doi: 10.1134/s0006297909120037 [ Links ]
Díaz-Rivas, J. O., González-Laredo, R. F., Chávez-Simental, J. A., Montoya-Ayón, J. B., Moreno-Jiménez, M. R., Gallegos-Infante, J. A., & Rocha-Guzman, N. E. (2018). Comprehensive characterization of extractable phenolic compounds by UPLC-PDA-ESI-QqQ of Buddleja scordioides plants elicited with salicylic acid. Journal of Chemistry, ID 4536970. doi: 10.1155/2018/4536970 [ Links ]
Ebkatan, S. S., Li, X. Q., Ghorbani, M., Azadi, B., & Kubow, S. (2018). Chlorogenic acid and its microbial metabolites exert anti-proliferative effects, S-phase cell-cycle arrest and apoptosis in human colon cancer Caco-2 cells. International Journal of Molecular Sciences, 19(3), 723. doi: 10.3390/ijms19030723 [ Links ]
Guglielmetti, A., D'Ignoti, V., Ghirardello, D., Belviso, S., & Zeppa, G. (2017). Optimisation of ultrasound and microwave-assisted extraction of caffeoylquinic acids and caffeine from coffee silverskin using response surface methodology. Italian Journal of Food Science, 29(3), 409‒423. doi: 10.14674/IJFS-727 [ Links ]
Heredia-Díaz, Y., García-Díaz, J., López-González, T., Chil-Nuñez, I., Arias-Ramos, D., Escalona-Arranza, J. C., Gonzalez-Fernandez, R., …Martinez-Figueredo, Y. (2018). An ethnobotanical survey of medicinal plants used by inhabitants of Holguín, Eastern Region, Cuba. Boletin Latinoamericano y del Caribe de Plantas Medicinales y Aromáticas, 17(2), 160‒196. Retrieved from https://blacpma.ms-editions.cl/index.php/blacpma/article/view/41 [ Links ]
Hossain, M. B., Brunton, N. P., Patras, A., Tiwari, B., O’Donnell, C., Martin-Diana, A. B., & Barry-Ryan, C. (2012). Optimization of ultrasound assisted extraction of antioxidant compounds from marjoram (Origanum majorana L.) using response surface methodology. Ultrasonics and Sonochemistry, 19(3), 582‒590. doi: 10.1016/j.ultsonch.2011.11.001 [ Links ]
Huck, C., Guggenbichler, W., & Bonn, G. (2005). Analysis of caffeine, theobromine and theophylline in coffee by near infrared spectroscopy (NIRS) compared to high-performance liquid chromatography (HPLC) coupled to mass spectrometry. Analytica Chimica Acta, 538(1-2), 195‒203. doi: 10.1016/j.aca.2005.01.064 [ Links ]
Hwang, S. J., Kim, Y. W., Park, Y., Lee, H. J., & Kim, K. W. (2014). Anti-inflammatory effects of chlorogenic acid in lipopolysaccharide-stimulated RAW 264.7 cells. Inflammation Research, 63(1), 81‒90. doi: 10.1007/s00011-013-0674-4 [ Links ]
Joshi, R., Kulkarni, Y. A., & Wairkar, S. (2018). Pharmacokinetic, pharmacodynamic and formulations aspects of naringenin: An update. Life Sciences, 215, 43‒56. doi: 10.1016/j.lfs.2018.10.066 [ Links ]
Kim, M. C., Kim, S. J., Kim, D. S., Jeon, Y. D., Park, S. J., Lee, H. S., Um, J. Y., & Hong, S. H. (2011). Vanillic acid inhibits inflammatory mediators by suppressing NF-κB in lipopolysaccharide-stimulated mouse peritoneal macrophages. Immunopharmacology and Immunotoxicology, 33(3), 525‒532. doi: 10.3109/08923973.2010.547500 [ Links ]
Minitab Inc. (2009). Minitab® Statistical Software, version 7. State College, PA, USA: Author. [ Links ]
Nogata, Y., Sakamoto, K., Shiratsuchi, H., Ishii, T., Yano, M., & Ohta, H. (2006). Flavonoid composition of fruit tissues of citrus species. Bioscience, Biotechnology and Biochemistry, 70(1), 178‒192. doi: 10.1271/bbb.70.178 [ Links ]
Ong, K. W., Hsu, A., & Tan, B. K. H. (2013). Anti-diabetic and anti-lipidemic effects of chlorogenic acid are mediated by ampk activation. Biochemical Pharmacology, 85(9), 1341‒1351. doi: 10.1016/j.bcp.2013.02.008 [ Links ]
Patay, É. B., Bencsik, T., & Papp, N. (2016). Phytochemical overview and medicinal importance of Coffea species from the past until now. Asian Pacific Journal of Tropical Medicine, 9(12), 1127‒1135. doi: 10.1016/j.apjtm.2016.11.008 [ Links ]
Petrucci, R., Zollo, G., Curulli, A., & Marrosu, G. (2018). A new insight into the oxidative mechanism of caffeine and related methylxanthines in aprotic medium: May caffeine be really considered as an antioxidant? Biochimica et Biophysica Acta (BBA)-General Subjects, 1862(8), 1781‒1789. doi: 10.1016/j.apjtm.2016.11.008 [ Links ]
Ratanamarno, S., & Surbkar, S. (2017). Caffeine and catechins in fresh coffee leaf (Coffea arabica) and coffee leaf tea. Maejo International Journal of Science and Technology, 11(3), 211‒218. Retrieved from http://www.mijst.mju.ac.th/vol11/211-218.pdf [ Links ]
Rocha, L. W., Bonet, I. J. M., Tambeli, C. H., de-Faria, F. M., & Parada, C. A. (2018). Local administration of mangiferin prevents experimental inflammatory mechanical hyperalgesia through CINC-1/epinephrine/PKA pathway and TNF-α inhibition. European Journal of Pharmacology, 830, 87‒94. doi: 10.1016/j.ejphar.2018.04.030 [ Links ]
Rosales-Villarreal, M. C., Rocha-Guzmán, N. E., Gallegos-Infante, J. A., Moreno-Jiménez, M. R., Reynoso-Camacho, R., Pérez-Ramírez, I. F., & Gonzalez-Laredo, R. F. (2019). Significance of bioactive compounds, therapeutic and agronomic potential of non-commercial parts of the Coffea tree. Biotecnia, 21(3), 143‒153. doi: 10.18633/biotecnia.v21i3.1046 [ Links ]
Setiawan, V. W., Wilkens, L. R., Lu, S. C., Hernandez, B. Y., Le Marchand, L., & Henderson, B. E. (2015). Association of coffee intake with reduced incidence of liver cancer and death from chronic liver disease in the US multiethnic cohort. Gastroenterology, 148(1), 118‒125. doi: 10.1053/j.gastro.2014.10.005 [ Links ]
Shi, H., Shi, A., Dong, L., Lu, X., Wang, Y., Zhao, J., Dai, F., & Guo, X. (2016). Chlorogenic acid protects against liver fibrosis in vivo and in vitro through inhibition of oxidative stress. Clinical Nutrition, 35(6), 1366‒1373. doi: 10.1016/j.clnu.2016.03.002 [ Links ]
Systat Software Inc. (2014). SigmaPlot® version 12. Exact graphs for exact science. San Jose, CA, USA: Author. [ Links ]
Tabuti, J. R. S., Kukunda, C. B., & Waako, P. J. (2010). Medicinal plants used by traditional medicine practitioners in the treatment of tuberculosis and related ailments in Uganda. Journal of Ethnopharmacology, 127(1), 130‒136. doi: 10.1016/j.jep.2009.09.035 [ Links ]
Tai, A., Sawano, T., & Ito, H. (2012). Antioxidant properties of vanillic acid esters in multiple antioxidant assays.Bioscience, Biotechnology and Biochemistry, 76(2), 314-318. doi: 10.1271/bbb.110700 [ Links ]
Yamagata, K., Izawa, Y., Onodera, D., & Tagami, M. (2018). Chlorogenic acid regulates apoptosis and stem cell marker-related gene expression in A549 human lung cancer cells. Molecular and Cellular Biochemistry, 441(1-2), 9‒19. doi: 10.1007/s11010-017-3171-1 [ Links ]
Zheng, X., & Ashihara, H. (2004). Distribution, biosynthesis and function of purine and pyridine alkaloids in Coffea arabica seedlings. Plant Science, 166(3), 807‒813. doi: 10.1016/j.plantsci.2003.11.024 [ Links ]
Recibido: 04 de Mayo de 2021; Aprobado: 10 de Diciembre de 2021











 text in
text in