Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Chapingo serie ciencias forestales y del ambiente
On-line version ISSN 2007-4018Print version ISSN 2007-3828
Rev. Chapingo ser. cienc. for. ambient vol.27 n.3 Chapingo Sep./Dec. 2021 Epub Mar 04, 2024
https://doi.org/10.5154/r.rchscfa.2020.06.041
Artículos científicos
Factores ante los que funciona la latencia física y su eliminación en dos géneros de leguminosas
1Universidad Autónoma Chapingo, División de Ciencias Forestales. km 38.5 carretera México-Texcoco, Chapingo. C. P. 56230. Texcoco, Estado de México, México.
2Instituto de Ecología A. C. Carretera antigua a Coatepec 351. C. P. 91070. Xalapa, Veracruz, México.
3Universidad Autónoma Chapingo, Laboratorio Nacional de Investigación y Servicio Agroalimentario y Forestal. km 38.5 carretera México-Texcoco, Chapingo. C. P. 56230. Texcoco, Estado de México, México.
Introducción:
Prosopis laevigata (Humb. & Bonpl. ex Willd.) M. C. Johnst, P. glandulosa Torr., Vachellia schaffneri (S. Watson) Seigler & Eibinger, V. pennatula (S. Watson) Seigler & Eibinger y V. farnesiana (L.) Wight & Arn. son especies características de zonas semiáridas. Sus semillas presentan latencia física y son escarificadas naturalmente mediante masticado, pisoteado, tracto digestivo de fauna, incendios o arrastre durante lluvias.
Objetivo:
Describir la morfología de la cubierta seminal de tres especies de Vachellia y dos de Prosopis, y evaluar la escarificación química, mecánica y térmica en las semillas.
Materiales y métodos:
Se aplicó escarificación química (HCl durante 30, 120, 150 y 180 min), térmica (80, 100, 120 y 140 °C durante 3 min) y mecánica (lijado). Se midió la resistencia a la ruptura por compresión. El diseño experimental fue en bloques completos al azar por especie.
Resultados y discusión:
Las semillas mostraron una capa de macroesclereidas lignificadas e impermeables, pero no se logró distinguir la capa de aleurona. El lijado permitió germinación de 81.2 a 100 %. Los tratamientos químicos y térmicos no mostraron diferencias, solo en el caso de P. laevigata, la escarificación química por 180 min provocó mayor germinación (72.5 %) que el testigo. Las semillas de V. schaffneri fueron más resistentes a la ruptura por compresión (669 N) y tuvieron latencia más intensa (0.83, de acuerdo con un índice de latencia propuesto), mientras que P. glandulosa fue la de menor latencia (0.42).
Conclusiones:
La escarificación mecánica fue el mejor método para eliminar la latencia en las semillas de Vachellia y Prosopis.
Palabras clave: Vachellia; Prosopis; escarificación mecánica; escarificación química; escarificación térmica
Introduction:
Prosopis laevigata (Humb. & Bonpl. ex Willd.) M. C. Johnst, P. glandulosa Torr., Vachellia schaffneri (S. Watson) Seigler & Eibinger, V. pennatula (S. Watson) Seigler & Eibinger and V. farnesiana (L.) Wight & Arn. are characteristic species of semi-arid areas. Their seeds show physical dormancy and are naturally scarified by chewing, trampling, digestive tract of fauna, fire, or washing away during rains.
Objective:
To describe the morphology of the seed coat of three species of Vachellia and two of Prosopis, and to assess the chemical, mechanical and thermal scarification of seeds.
Materials and methods:
Chemical (HCl for 30, 120, 150 and 180 min), thermal (80, 100, 120 and 140 °C for 3 min) and mechanical (sanding) scarification were applied. Resistance to breaking by compression was measured. The experimental design was randomized complete blocks per species.
Results and discussion:
Seeds showed a layer of lignified and impermeable macrosclereids, but the aleurone layer could not be detected. Sanding allowed germination from 81.2 to 100 %. Chemical and thermal treatments showed no differences, only in the case of P. laevigata, chemical scarification for 180 min caused higher germination (72.5 %) compared to the control. Vachellia schaffneri seeds were more resistant to compression (669 N) and had more intense dormancy (0.83, according to a proposed dormancy index), while P. glandulosa had the lowest dormancy (0.42).
Conclusions:
Mechanical scarification was the best method to eliminate dormancy in Vachellia and Prosopis seeds.
Key words: Vachellia; Prosopis; mechanical scarification; chemical scarification; thermal scarification
Introducción
En México, las regiones áridas se manifiestan en 52 % del territorio. La regeneración natural en estas zonas es marcada por la escasa y breve época de lluvias en verano, normalmente de 100 a 400 mm y 7 a 18 meses sin lluvia o más (Rzedowski, 2006), de modo que tal humedad es adecuada para que las semillas germinen (Sánchez et al., 2014).
En algunos ecosistemas, como los mediterráneos y las sabanas, más de 25 % de las especies presentan latencia física (Hudson, Ayre, & Ooi, 2015). Steinbrecher y Leubner-Metzger (2018) señalan que este fenómeno es originado por capas de células impermeables al agua que se hallan en la cubierta seminal o en el pericarpio. De acuerdo con Baskin y Baskin (2014), la latencia física está presente en 15 familias de plantas, incluidas las leguminosas. La importancia ecológica de esta familia radica en que son mejoradoras de suelo, fijadoras de N y fuente de alimento para animales silvestres (Odum & Barrett, 2008); en lugares áridos y semiáridos, cumplen doble función como refugio y alimento para la fauna y como plantas nodriza en la regeneración de especies.
La latencia puede eliminarse mediante el masticado y el paso por el tracto digestivo de animales, el arrastre por escurrimientos superficiales o por el fuego. Por ejemplo, en el caso de las leguminosas, las semillas de Prosopis flexuosa DC. y P. chilensis (Molina) Stuntz son depredadas, dispersadas y escarificadas físico-biológicamente (tracto digestivo) por roedores, otros mamíferos y hormigas (Velez, 2014). Por otra parte, cuando la producción de plantas de leguminosas es en vivero, la aplicación de prácticas de escarificación como el lijado, fractura, remojo en agua caliente e inmersión en ácido sulfúrico es necesaria (Minchala-Patiño et al., 2014; Miranda, Oliveira, Correia, Almeida, & Pompelli, 2011).
Con frecuencia se toma la presencia e intensidad de la latencia como una constante en especies que la tienen; sin embargo, en el caso de las leguminosas como Prosopis alba Griseb., se ha observado variabilidad en las características morfológicas de la semilla, particularmente en el tamaño (Fontana, Pérez, & Luna, 2015), las cuales posiblemente influyan en la intensidad de su latencia física. Jaganathan (2016) apunta que, durante el desarrollo de la semilla, el ambiente (humedad relativa, temperatura y precipitación) de la planta madre influye en la intensidad de la latencia.
Los genes que controlan la latencia y la germinación presentan selección más fuerte que otros caracteres (Penfield, 2017). En este sentido, el conocimiento de la anatomía de las capas de la cubierta seminal permite comprender mejor su papel en la latencia física. Con base en lo anterior, es importante profundizar en información específica al momento de la formación de la semilla. Por tanto, los objetivos del presente estudio fueron describir la morfología de las capas de la cubierta seminal y evaluar la escarificación química, mecánica y térmica en tres especies de Vachellia y dos de Prosopis. La hipótesis fue que los tratamientos químicos, mecánicos y térmicos permiten una germinación mayor.
Materiales y métodos
La morfología de las semillas y los mecanismos de eliminación de la latencia física de Vachellia schaffneri (S. Watson) Seigler & Eibinger, V. pennatula (S. Watson) Seigler & Eibinger, V. farnesiana, Prosopis laevigata (Humb. & Bonpl. ex Willd.) M.C. Johnst y P. glandulosa se analizaron en este estudio. Estos géneros se dispersan por barocoria, anemocoria (vainas con semillas maduras transportadas por el viento), hidrocoria (escurrimientos superficiales) y endozoocoria (Baskin & Baskin, 2014). Los huizaches, como Vachellia farnesiana (L.) Wight & Arn., son parte de la dieta del venado cola blanca y proveen cobertura, refugio y protección para varias especies de fauna silvestre. La especie V. farnesiana es excelente para postes, la flor se usa para perfumería en Europa, y los frutos y corteza se han empleado para elaboración de tinta y obtención de taninos (Schiltmeyer & Zouhar, 2020). Los mezquites como Prosopis glandulosa Torr. se utilizan para leña y carbón, así como en la manufactura de muebles. Los frutos sirven de alimento al ganado y a una gran diversidad de especies silvestres (Steinberg, 2001).
Para fines del estudio, las semillas se obtuvieron de entre cinco y 10 árboles de cada especie en los alrededores de la comunidad de Juchipila, Zacatecas (1 240 a 1 400 m en clima semiseco con temperatura media anual de 22.2 °C y precipitación media anual de 713 mm) en agosto de 2017. Las vainas se recolectaron y colocaron en bolsas de papel etiquetadas; la semilla se extrajo, se limpió manualmente y se almacenó en condiciones de cuarto fresco. En julio de 2018, la semilla se analizó bajo las normas del sistema ISTA, de acuerdo con Alberta Government (2016), determinando la pureza, peso, humedad, germinación (plántulas normales) y viabilidad (prueba con sales de tetrazolio).
Morfología y anatomía de la semilla
Las características morfológicas se evaluaron en una muestra tomada al azar compuesta por 25 semillas del lote. El peso (báscula Ohaus Scout®, precisión 0.001 g), longitud, anchura y grosor (vernier digital Truper®, precisión de 0.01 mm) se determinaron en cada semilla. La forma se describió con base en la terminología referida por Niembro (1988). La anatomía microscópica se describió a través de microfotos de la sección transversal de la cubierta seminal de semillas. Las fotografías se obtuvieron en muestras preparadas con las técnicas ambiental y ambiental complementada con tetróxido de osmio, para verlas al microscopio electrónico (FEI Quanta 450) con la técnica de barrido (MEB) (Sorrivas, Yañez, & Morales, 2014).
Escarificación y resistencia a la ruptura
Las semillas se sometieron a escarificación química, mecánica y térmica. Estos tratamientos emulan agentes naturales que terminan con la latencia física (Baskin & Baskin, 2014). Se buscó simular el paso de la semilla por el tracto digestivo de fauna, con escarificación química; el arrastre de semillas sobre el piso, mediante escarificación con lija; el masticado y pisoteo por fauna silvestre, mediante la prueba de resistencia a la ruptura; y el fuego con la escarificación térmica.
La escarificación química consistió en sumergir la semilla en HCl al 37 % (12 N) durante 30, 120, 150 y 180 min (tratamientos T1, T2, T3 y T4, respectivamente). La escarificación térmica se llevó a cabo introduciendo la semilla en un horno a 80, 100, 120 y 140 °C, durante 3 min (T5, T6, T7 y T8, respectivamente). La escarificación mecánica (T9) de la semilla de las dos especies de mezquite (Prosopis) se hizo con lija para madera calibre 150, grano fino (marca Truper®). Para las tres especies de huizache (Vachellia) se usó lija para lámina, calibre 60 X-86 de la marca Fandeli®. El lijado se hizo por un costado de la semilla hasta notar el desgaste de la cubierta y apreciar los cotiledones. También se tuvo un testigo no tratado (T10).
La variable resistencia a la ruptura por compresión se evaluó en muestras de 25 semillas por especie, con la máquina universal de pruebas Instron® (Norwood, Massachusetts, EUA, modelo 2285H) y el software Instron Bluehill (Instron, 2006). La velocidad de desplazamiento fue de 0.60 mm∙min-1 con una cédula de carga de 51.521 kN. La prueba era detenida cuando se detectaba un crujido ocasionado por la ruptura de la cubierta seminal, lo cual corresponde con la “caída” súbita de la curva en la gráfica generada por el programa del equipo.
Siembra y diseño experimental
Las semillas se sembraron en cajas de plástico (30 x 20 x 15 cm). La preparación de las semillas incluyó la desinfección con alcohol al 98 % hasta su evaporación, después se colocó tela fieltro de color crema como sustrato y se aplicaron 80 mL de fungicida comercial Bravo 720® (ingrediente activo Clorotalonil: Tetracloroisoftalonitrilo) al 10 %.
El experimento para cada especie se llevó a cabo mediante un diseño en bloques completos al azar con 10 tratamientos (considerando los niveles de los factores escarificación química, mecánica, térmica y testigo; la compresión se consideró un experimento aparte). En cada caja germinadora (bloque o repetición) se sembraron 20 semillas (unidad experimental) por cada uno de los 10 tratamientos. Cada especie involucró un experimento con cuatro bloques o repeticiones. En total se sembraron 20 semillas por unidad experimental x 10 tratamientos x 5 especies x 4 repeticiones (bloques) = 4 000 semillas.
Las cajas se colocaron en cámaras de ambiente controlado (marca Biotronette®) con un fotoperiodo (luz fluorescente) de 12 h día y 12 h noche, y un termoperiodo de 30 °C y 20 °C. La semilla se consideró germinada cuando la longitud de la radícula igualó la de la longitud de la semilla.
Intensidad de la latencia
Para definir la especie con la latencia más intensa y versátil ante los agentes naturales, se propuso el índice siguiente. Primero, se asignaron clases con base en los porcentajes de germinación: 1 = 0 a 67 %, 2 = 68 a 83 %, 3 = 84 a 100 %; para el caso de la resistencia, los intervalos y valor de calificación fueron: 1 = 341 a 450.4 N, 2 = 450.4 a 559.8 N, 3 = 559.8 a 669 N. Las cifras se sumaron y dividieron entre el total máximo, igual a 12 (4 factores x la calificación máxima posible [3]). A mayor valor del índice (máximo = 1), más intensa la latencia física ante los agentes.
Análisis estadístico
La germinación y la presión para la ruptura se analizaron con ANDEVA, utilizando el programa estadístico SAS® versión 9.4 (Statistical Analysis System Inc., 2015). Las medias se compararon con la prueba de comparación múltiple de medias de Tukey (α = 0.05). Los datos de germinación se transformaron con la función arco seno debido a que se trata de una variable binomial. El modelo estadístico fue:
donde,
yijk = valor de la respuesta
µ = media general
Ti = efecto del i-ésimo tratamiento
Bj = efecto del j-ésimo bloque
εijk = error experimental independiente e idénticamente distribuido con N (0, σ2).
Resultados
Calidad de los lotes de semillas
De acuerdo con el Cuadro 1, los lotes de semilla de las especies evaluadas tuvieron pureza mayor de 93 %; las impurezas fueron residuos de la vaina. El número de semillas por kilogramo varió de acuerdo con el tamaño en cada especie. Las semillas de V. schaffneri fueron relativamente grandes, con 7 400 semillas∙kg-1 (1 000 semillas pesaron 135.14 g); las más pequeñas fueron las de P. laevigata, con 24 313 semillas∙kg-1 (1 000 semillas pesaron 41.13 g). La viabilidad de V. farnesiana fue de 96 % y en el resto de las especies alcanzó 100 %. Todas las semillas fueron ortodoxas, debido a su bajo contenido de humedad (<6 %).
Cuadro 1 Características de los lotes de semillas de dos géneros de leguminosas recolectadas en Zacatecas.
| Tipo de análisis | Vachellia schaffneri | Vachellia pennatula | Vachellia farnesiana | Prosopis laevigata | Prosopis glandulosa |
|---|---|---|---|---|---|
| Pureza (%) | 95 | 95 | 95 | 94 | 93 |
| Núm. semillas∙kg-1 | 7 400 | 7 448 | 14 368 | 24 313 | 22 306 |
| Peso de 1 000 semillas (g) | 135.1 | 134.3 | 69.6 | 41.1 | 44.8 |
| Humedad (%) | 5.7 | 5.9 | 4.2 | 4.2 | 6.4 |
| Viabilidad (%) | 100 | 100 | 96 | 100 | 100 |
Anatomía y características morfológicas de la semilla
La cubierta seminal presentó cutícula, esclerénquima y parénquima. A la cubierta seminal siguen endospermo y el embrión cotiledonar (Figuras 1 y 2). En las cinco especies, el parénquima presentó una pared con poros en forma de eslabón a lo largo del endospermo, el cual está presente en diferentes proporciones de la cavidad seminal, y el pleurograma está bien marcado con areolas largas. No obstante, existe una diferencia entre los géneros estudiados; en Vachellia, la areola presenta líneas de fracturas y en Prosopis son lisas, como en el resto de la cubierta seminal.
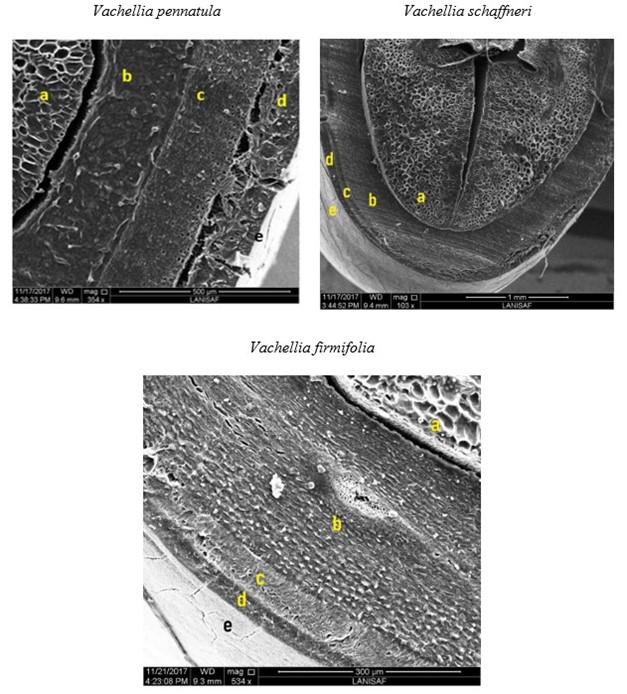
Figura 1 Microfotografías de la semilla de las especies estudiadas de Vachellia. a) cotiledón, b) endospermo y capas de su cubierta seminal, c) parénquima esponjoso, d) esclerénquima y e) cutícula.

Figura 2 Microfotografías de la semilla de las especies estudiadas de Prosopis: a) cotiledones, b) endospermo y capas de su cubierta seminal, c) parénquima, d) esclerénquima y e) cutícula.
El Cuadro 2 indica que las semillas del género Vachellia tuvieron longitud, anchura, grosor y peso mayores que las semillas de Prosopis, siendo V. pennatula la más voluminosa y P. laevigata la más pequeña. Con respecto a la forma, las semillas de Vachellia son ovaladas, mientras que las de Prosopis son ovoides y menos gruesas.
Cuadro 2 Características morfológicas de las semillas de dos géneros de leguminosas recolectadas en Zacatecas.
| Atributos | Vachellia schaffneri | Vachellia pennatula | Vachellia farnesiana | Prosopis laevigata | Prosopis glandulosa |
|---|---|---|---|---|---|
| Longitud (mm) | 6.96 ± 0.69 | 7.75 ± 0.90 | 6.12 ± 0.60 | 6.26 ± 0.72 | 6.81 ± 0.89 |
| Anchura (mm) | 5.94 ± 0.5 | 5.50 ± 0.57 | 4.72 ± 0.39 | 4.62 ± 0.46 | 4.59 ± 1.06 |
| Grosor (mm) | 3.90 ± 0.23 | 3.75 ± 0.33 | 3.17 ± 0.27 | 2.60 ± 0.22 | 2.38 ± 0.20 |
| Peso (g) | 0.14 ± 0.13 | 0.14 ± 0.03 | 0.07 ± 0.01 | 0.04 ± 0.01 | 0.05 ± 0.01 |
| Forma | Oblong | Oblong | Oblong | Ovoid | Ovoid |
| Color | Black | Brown | Olive green | Yellow brown | Yellow brown |
| Pleurograma (%) | 90 | 90 | 90 | 90 | 90 |
El color de la semilla se determinó subjetivamente por apreciación. El porcentaje del pleurograma es con respecto al 100 % que representaría un óvalo completo.
Germinación
La curva de germinación acumulada en las dos especies de mezquite fue muy similar; su germinación fue rápida y uniforme, por ello, la Figura 3 solo ilustra la germinación de P. laevigata. Por el contrario, la Figura 4 muestra que la germinación en las semillas de los huizaches (Vachellia) fue más lenta y un poco menor (también se muestra solo una especie).

Figura 3 Curvas de germinación acumulada en semillas de Prosopis laevigata. Escarificación química con HCl: T1 = 30 min, T2 = 120 min, T3 = 150 min y T4 = 180 min; escarificación térmica por 3 min: T5 = 80 °C, T6 = 100 °C, T7 = 120 °C y T8 = 140 °C; T9 = lijado; y T10 = testigo.

Figura 4 Curvas de germinación acumulada en semillas de Vachellia schaffneri. Escarificación química con HCl: T1 = 30 min, T2 = 120 min, T3 = 150 min y T4 = 180 min en HCl; escarificación térmica por 3 min: T5 = 80 °C, T6 = 100 °C, T7 = 120 °C y T8 = 140 °C; T9 = lijado; y T10 = testigo.
Acorde con el Cuadro 3, la escarificación mecánica (lijado) permitió 100 % de germinación final en los dos mezquites, siendo estadísticamente superior a los demás tratamientos. En P. laevigata, la inmersión en HCl por 180 min (72.5 %) resultó superior al testigo (31.3 %) y al resto de los tratamientos con escarificación química y térmica.
Para las especies de Vachellia, el tratamiento de lijado (81.2 a 96.2 % de germinación) superó en gran medida al resto de los tratamientos, los cuales no mostraron diferencias con respecto al testigo (27.5 %).
Cuadro 3 Germinación con tres métodos de escarificación en semilla de dos géneros de leguminosas recolectadas en Zacatecas.
| Método | Tratamientos | Germinación (%) | ||||
|---|---|---|---|---|---|---|
| Vachellia schaffneri | Vachellia farnesiana | Prosopis glandulosa | Vachellia pennatula | Prosopis laevigata | ||
| Químico (HCl) | 30 min | 7.5 b | 5.0 b | 50.0 b | 21.3 c | 28.8 d |
| 120 min | 15.0 b | 8.7 b | 48.7 b | 31.3 bc | 62.5 bc | |
| 150 min | 6.2 b | 5.0 b | 57.5 b | 33.8 bc | 57.5 bcd | |
| 180 min | 7.5 b | 3.7 b | 53.7 b | 35.0 bc | 72.5 b | |
| Térmico (3 min) | 80 °C | 6.2 b | 3.7 b | 56.2 b | 15.0 c | 30.0 d |
| 100 °C | 1.2 b | 7.5 b | 55.0 b | 31.3 bc | 40.0 cd | |
| 120 °C | 6 2 b | 3.7 b | 66.2 b | 40.0 bc | 58.8 bcd | |
| 140 °C | 3.7 b | 5.0 b | 71.2 b | 58.8 b | 57.5 bcd | |
| Mecánico | Lijado | 96.2 a | 81.2 a | 100.0 a | 92.5 a | 100 a |
| Testigo | Testigo | 1.2 b | 5.0 b | 53.7 b | 27.5 bc | 31.3 d |
En cada especie, valores de germinación con distinta letra mostraron diferencias estadísticamente significativas entre tratamientos de acuerdo con la prueba de Tukey (P ≤ 0.05).
Resistencia a la ruptura
El Cuadro 4 muestra que existen diferencias en los valores de resistencia a la compresión hasta la ruptura de la cubierta seminal. Las especies V. schaffneri y V. pennatula mostraron los valores más altos (669 y 653 N, respectivamente) y V. farnesiana (482 N) solo fue superior a P. laevigata (341 N).
Cuadro 4 Cargas por compresión hasta ruptura de la cubierta seminal de semillas de cinco especies de leguminosas recolectadas en Zacatecas.
| Especie | Carga por compresión (N) | ||
|---|---|---|---|
| Media | Mínima | Máxima | |
| Vachellia schaffneri | 669 a | 140 | 1 028 |
| Vachellia pennatula | 653 a | 349 | 1 350 |
| Vachellia farnesiana | 482 b | 215 | 840 |
| Prosopis glandulosa | 473 bc | 134 | 473 |
| Prosopis laevigata | 341 c | 188 | 758 |
Valores medios con distinta letra mostraron diferencias estadísticamente significativas de acuerdo con la prueba de Tukey (P ≤ 0.05).
Intensidad de latencia
Con base en el índice propuesto, la especie con la latencia más intensa fue V. schaffneri, pues mostró mayor resistencia a la ruptura mecánica y a la escarificación química y térmica, mientras que la especie con la latencia más leve fue P. glandulosa. En general, las tres especies de Vachellia tuvieron una latencia física más intensa que las dos especies de Prosopis (Cuadro 5).
Cuadro 5 Intensidad de la latencia en semillas de dos géneros de leguminosas recolectadas en Zacatecas.
| Especie | Resistencia a la ruptura (Pisoteo) | Jugos gástricos (HCl) | Fuego (Calor seco) | Arrastre (Lijado) | Índice |
|---|---|---|---|---|---|
| Vachellia schaffneri | 3 | 3 | 3 | 1 | 0.83 |
| Vachellia pennatula | 3 | 2 | 3 | 1 | 0.75 |
| Vachellia farnesiana | 2 | 2 | 2 | 1 | 0.58 |
| Prosopis laevigata | 1 | 2 | 2 | 1 | 0.5 |
| Prosopis glandulosa | 2 | 1 | 1 | 1 | 0.42 |
Discusión
Análisis y anatomía de las semillas
Al parecer no se ha publicado la anatomía macroscópica de las semillas de V. farnesiana y V. pennatula, por lo que su comparación anatómica se hizo con las de P. juliflora (Sw.) DC. (Niembro, 1988). Capparelli (2008) reconoce para P. chilensis y P. flexuosa DC.: epidermis, subepidermis, parénquima esponjoso, células empalizadas, albumen y cotiledón. Las partes observadas en la semilla, en especial la cubierta seminal, son consistentes con las de otras especies de los géneros estudiados (Capparelli, 2008; Niembro, 1988) y similares a otras leguminosas como Glycine max L. Merr. (Shao, Meyer, Ma, Peterson, & Bernards, 2007) y Crotalaria juncea L. (Beltramini & Pascualides, 2017). La impermeabilidad al agua de la cubierta seminal en diversas leguminosas es proporcionada por la capa en empalizada de macroesclereidas lignificadas, que están impregnadas con sustancias impermeables del tipo de fenoles y suberina (Lazarević et al., 2017; Robles-Díaz, Flores, & Yañez-Espinosa, 2016; Steinbrecher & Leubner-Metzger, 2018). La semilla de las cinco especies estudiadas muestra claramente esta capa de macroesclereidas lignificadas e impermeables. Beltramini y Pascualides (2017) y Shao et al. (2007) reportan la presencia de una capa de células, la más externa del endospermo vecina a la cubierta seminal, llamada aleurona. Dicho tejido puede ser otro mecanismo que ayuda a regular la entrada de agua a la semilla una vez superada la latencia física, pues una imbibición súbita causa daños e inhibe la germinación (Sato, Jitsuyama, Yamada, Liu, & Abe, 2019). En el presente trabajo no se logró distinguir con claridad la capa de aleurona en las especies estudiadas, por lo menos con la técnica utilizada, pero no se descarta su posible presencia.
Germinación
Los resultados de germinación de los mezquites coincidieron con los de Miranda et al. (2011), quienes también determinaron una germinación potencial de 100 % para P. juliflora en semillas sin endocarpo. De igual forma, Sánchez-Soto et al. (2016) hallaron 98.9 % de germinación con abrasión, utilizando lija, en Caesalpinia platyloba S. Watson. Los datos de Ffolliott y Thames (1983) muestran que la germinación en especies del género Prosopis en América Latina es de 95 %. Las semillas de V. schaffneri de la Mixteca Alta oaxaqueña tuvieron 87 % de germinación por el método de lijado (Martínez-Pérez, Orozco-Segovia, & Martorell, 2006). En V. farnesiana,Godínez-Álvarez y Flores-Martínez (2000) lograron 86.7 %, y Maldonado-Arciniegas, Ruales, Caviedes, Ramírez, y León-Reyes (2018) obtuvieron 45 % de germinación con el lijado de semillas de la especie sudamericana Vachellia macracantha (Humb. & Bonpl. ex Willd.) Seigler & Ebinger. Estos valores son menores que los conseguidos en la presente investigación, debido posiblemente a que la semilla utilizada en esos experimentos pudo tener menor viabilidad, no ser tan reciente o a que no se logró proporcionar el mejor ambiente para la germinación, como la temperatura.
Escarificación química
En Norteamérica, las semillas de P. velutina Wooton son parte de la dieta de especies como ratones (Peromyscus), ratas canguro (Dipodomis), ratas de la madera (Neotoma), ardillas de tierra (Sciuridae), ardillas de las rocas (Otospermophilus), conejos cola de algodón (Leporidae), zorrillos (Mephitidae), codornices (Cyrtonix montezumae Vigors), palomas (Columbidae), cuervos (Corvidae), liebres (Lepus), mapache (Procyon lotor Linnaeus), coyote (Canis latrans Say), venado cola blanca (Odocoileus virginianus Zimmermann), venado bura (Odocoileus hemionus Rafinesque), pavo silvestre (Meleagris gallopavo Linnaeus), entre otros (Uchytil, 1990). La relevancia ecológica de la endozoocoria en semillas con latencia física es clara (Jaganathan, Yule, & Liu, 2016). El paso de la semilla por el tracto digestivo de estas especies con jugos gástricos que incluyen ácido clorhídrico, la escarifican, por lo que la escarificación química con ácidos emula tal proceso natural.
El ramoneo o consumo de los frutos de mezquite y huizache por los animales silvestres o domesticados, como los rumiantes, son un factor importante en la dispersión de las semillas. El abomaso es el cuarto y último compartimento del estómago del rumiante, en este se concentran los jugos gástricos que contienen HCl, entre otros compuestos (Rodríguez-Carias & Valencia-Chin, 2007). Kneuper, Scott, y Pinchak (2018) hallaron que la semilla de P. glandulosa Torr. var. glandulosa es consumida y dispersada de manera viable por bovinos, mientras que los ovinos y caprinos consumen el fruto y reducen la viabilidad.
Los resultados de germinación utilizando HCl (método químico) fueron bajos (28.8 a 72.5 %) para los tiempos mayores de inmersión (hasta 180 min), comparados con 99 % de germinación de semillas de P. juliflora sin endocarpo, escarificadas con H2SO4 por 5 a 40 minutos (Miranda et al., 2011) y con 100 % de germinación de semillas de P. velutina, sometidas a H2SO4 por 10 min (Martínez-Rodríguez, Rivera-Maya, & Santamaría-César, 2000). También en Acacia tortilis ssp. tortilis Forsk. (Hayne), de Egipto y Qatar, la germinación del control (25 %) incrementó a 67, 70 y 75 % con escarificación química (H2SO4 al 98 %) por 20, 25 y 30 min, respectivamente (El-Azazi, Sourour, Belal, & Khalifa, 2013). En contraste, D’Aubeterre, Principal, y García (2002) obtuvieron 9 % de germinación en semillas de P. laevigata escarificadas en H2SO4 por 8 minutos. Es claro que el tipo de ácido (el ácido sulfúrico es más fuerte), el tiempo de inmersión y la concentración empleada pueden ser la diferencia entre un valor de germinación alto y bajo. El tiempo de inmersión adecuado maximizará la germinación, pero una inmersión muy breve, por ejemplo <120 min para P. laevigata, no afectará la cubierta seminal lo suficiente, en tanto que un tiempo muy largo de inmersión puede dañar el embrión. Ghassali, Salkini, Petersen, Niane, y Louhaichi (2012) probaron tratamientos con agua hirviendo, mecánicos y con ácido sulfúrico en 14 especies de Acacia y encontraron que el mejor tratamiento fue el químico pues produjo la germinación máxima en siete especies (Acacia farnesiana [L.] Willd., A. victoriae Benth., A. deanei ssp. deanei [R. T. Baker] M. B. Welch et al., A. deanei ssp. paucijuga [F. Muell. ex N. A. Wakef.], A. karroo Hayne, A. pruinocarpa Tindale y A. saligna [Labill.] H. L. Wendl).
Escarificación térmica
En un incendio forestal, el fuego (≥250 °C) consume todo material vegetal, pero si las semillas están un poco enterradas resultan protegidas; sin embargo, reciben temperaturas menores que pueden degradar los tegumentos o escarificar las cubiertas seminales duras de especies como las leguminosas (Scott, Bowman, Bond, Pyne, & Alexander, 2014).
En este estudio, la escarificación térmica no causó mayor germinación que el testigo en las especies estudiadas, pero tampoco afectó adversamente a las semillas. Es posible que, a temperaturas mayores o con tiempos de exposición más altos, se pudiera estimular la germinación de las especies estudiadas; por ejemplo, en la leguminosa Stylosanthes montevidensis Vogel de un pastizal brasileño, su germinación se estimuló a 120 °C durante 1 min (Fidelis, Daibes, & Redondo-Martines, 2015). Incluso Liyanage y Ooi (2015) hallaron en un matorral australiano que las temperaturas de hasta 100 °C estimulan la germinación de Acacia linifolia (Vent.) Willd., Viminaria juncea (Schard.) Hoffmans., Aotus ericoides (Vent.) Don, Dillwynia floribunda Sm. y Bossiaea heterophylla Vent.; sin embargo, hubo variabilidad en la intensidad de la latencia y respuesta a los tratamientos térmicos. También la semilla de la leguminosa brasileña Mimosa calodendron Mart. tuvo mayor germinación que el control cuando fue sometida a tratamientos térmicos (Campos-Dayrell, Goncalves-Alvym, Negreiros, Fernandes, & Oliveira-Silveira, 2015). Prosopis juliflora tuvo mayor germinación a una temperatura constante de 35 °C durante 24 h (Ffolliott & Thames, 1983) y P. velutina de Durango germinó 71 % luego de 10 min de inmersión en agua caliente (85 °C), mientras que la germinación fue 0 % en el control (Martínez et al., 2000).
En otra investigación llevada a cabo por Sabiiti y Wein (1987) se produjo una germinación de 65 % en un banco de semillas de V. siberiana (DC.) Kyal. & Boatwr. recolectadas del suelo de áreas quemadas, en comparación con 10 % de la semilla procedente de áreas no quemadas. Por otra parte, Zalamea, Sarmiento, Arnold, Davis, y Dalling (2015) señalan que, en bosques tropicales de Panamá, la variación en la temperatura del suelo fue suficiente para romper la latencia física en la semilla de cuatro especies arbóreas pioneras. En algunas especies de los géneros estudiados se encontró que el humo de incendios forestales favorece la germinación. En Australia, fue el caso para Acacia hebeclada DC., y en Sudáfrica, para Acacia mearnsii De Wild. (Kulkarni, Sparg, & Van Staden, 2007); sin embargo, en el presente trabajo no se investigó el posible efecto del humo.
Resistencia a la ruptura
Durante el consumo por grandes herbívoros o ganado, la semilla puede ser sometida a fuerte presión física por mordidas, pero también puede ser pisoteada. La fuerza de fractura en la cubierta seminal es un indicador de la resistencia a la compresión que la semilla ofrece ante los factores referidos. De aquí el interés de establecer cuál es la resistencia de la cubierta seminal a la ruptura. Los valores de resistencia obtenidos en la máquina universal de pruebas sugieren que las semillas escarificadas por pisadas de bovinos, ovinos, caprinos o animales silvestres deben ser pocas, ya que el peso vivo de los animales pequeños está en un intervalo de 70 a 75 kg, aunque pueden darse las condiciones para que esto suceda (sobre las rocas, por ejemplo). No obstante, la mordida de herbívoros grandes y ganado es potente y puede afectar la cubierta de las semillas mecánicamente. El presente trabajo establece la presión requerida para romper la cubierta seminal y superar la latencia física en las cinco especies estudiadas.
La escarificación mecánica se compara con tres agentes naturales: dispersión hidrócora, por escurrimientos superficiales y pisoteo o masticado de animales. En las zonas áridas y semiáridas, generalmente, las lluvias escasas se presentan como tormentas. Esto provoca que algunas semillas sean arrastradas por los escurrimientos superficiales y que en su trayectoria vayan chocando y friccionando con otros materiales, principalmente rocas y partículas de suelo. Durante dicho arrastre es posible que las semillas sufran raspaduras ligeras o que se les formen grietas pequeñas; es decir, una escarificación natural (observaciones personales de los autores). En el medio natural puede darse la combinación de la ruptura por pisoteo o masticado y la escarificación en el aparato digestivo de animales. Las semillas pueden ser masticadas, consumidas y defecadas por los animales y, posteriormente, pisadas por otros. Estas pueden resultar beneficiadas o perjudicadas, según la intensidad de cada tratamiento y la latencia física de la especie involucrada.
Conclusiones
La escarificación mecánica fue la más efectiva para la germinación de todas las especies. La germinación por escarificación química fue más alta solo a 180 min en Prosopis laevigata. En este estudio se propone un índice de la intensidad y versatilidad de la latencia física ante factores ambientales, pero solo funciona para comparaciones entre especies en un mismo experimento. Hay relación directa entre el tamaño de semilla e intensidad de latencia. Las semillas de huizaches (Prosopis) tuvieron índices mayores de latencia que las de mezquites (Vachellia), por lo que las primeras están más adaptadas para sobrevivir a los agentes de escarificación natural. En este estudio se comprobó que, gracias a su latencia física, la cubierta seminal de las semillas de las especies estudiadas provee protección ante agentes físicos, bióticos y fuego.
Agradecimientos
Agradecemos el financiamiento proporcionado por CONACYT y la Universidad Autónoma Chapingo.
REFERENCIAS
Alberta Government. (2016). Alberta seed testing standards. Alberta, Canada: Government of Alberta. [ Links ]
Baskin, C. C., & Baskin, J. M. (2014). Seeds (2nd. ed.). San Diego, USA: Academic Press. [ Links ]
Beltramini, V. S., & Pascualides, A. L. (2017). Effect of seed coat color on imbibition, germination and seed structure of Crotalaria juncea (Fabaceae). Lilloa, 54(2), 101−109. Retrieved from http://lillo.org.ar/revis/lilloa/2017/v54n2/lilloa-v54n2a02.pdf [ Links ]
Campos-Dayrell, R. L., Goncalves-Alvym, S. de J., Negreiros, D., Fernandes, G. W., & Oliveira-Silveira, F. A. (2015). Environmental control of seed dormancy and germination of Mimosa calodendron (Fabaceae): implications for ecological restoration of a highly threatened environment. Brazilian Journal of Botany, 38, 395−399. doi: 10.1007/s40415-015-0145-y [ Links ]
Capparelli, A. (2008). Caracterización cuantitativa de productos intermedios y residuos derivados de alimentos del algarrobo (Prosopis flexuosa y P. chilensis, Fabaceae): aproximación experimental aplicada a restos arqueobotánicos desecados. Darwiniana, 46(2), 175−201 . doi: 10.14522/darwiniana.2014.462.282 [ Links ]
D'Aubeterre, R., Principal, J., & García, J. (2002). Efecto de diferentes métodos de escarificación sobre la germinación de tres especies del género Prosopis. Revista Científica, 12(2), 575−577. Retrieved from http://produccioncientificaluz.org/index.php/cientifica/article/view/14933 [ Links ]
El-Azazi, E. S., Sourour, M. M., Belal, A. H., & Khalifa, E. A. (2013). Improving Acacia tortilis seeds germination by breaking dormancy treatments. International Journal of Advanced Biological Research, 3(1), 103−109. Retrieved from http://connection.ebscohost.com/c/articles/86893786/improving-acacia-tortilis-seeds-germination-by-breaking-dormancy-treatments [ Links ]
Ffolliott, P. F., & Thames, J. L. (1983). Recolección, manipuleo, almacenaje y pretratamiento de las semillas de Prosopis en América Latina. Roma: FAO. [ Links ]
Fidelis, A., Daibes, L. F., & Redondo-Martines, A. (2015). To resist or to germinate? The effect of fire on legume seeds in Brazilian subtropical grasslands. Acta Botanica Brasilica, 30(1), 147‒151. doi: 10.1590/0102-33062015abb0187 [ Links ]
Fontana, M. L., Pérez, V. R., & Luna, C. V. (2015). Influencia de la procedencia geográfica sobre los parámetros morfométricos de semillas de Prosopis alba. Multequina, 24, 33−45. Retrieved from https://ri.conicet.gov.ar/handle/11336/7688 [ Links ]
Ghassali, F., Salkini, A. K., Petersen, S. L., Niane, A. A., & Louhaichi, M. (2012). Germination dynamics of Acacia species under different seed treatments. Range Management & Agroforestry, 33(1), 37−42. Retrieved from https://www.researchgate.net/publication/265167382_Germination_dynamics_of_Acacia_species_under_different_seed_treatments [ Links ]
Godínez-Álvarez, H., & Flores-Martínez, A. (2000). Germinación de 32 especies de plantas de la costa de Guerrero: Su utilidad para la restauración ecológica. Polibotánica, 11, 1−29. Retrieved from http://www.polibotanica.mx/pdf/pb11/germinacionsemillas.pdf [ Links ]
Hudson, A. R., Ayre, D. J., & Ooi, M. K. J. (2015). Physical dormancy in a changing climate. Seed Science Research, 25(2), 66−81. doi: 10.1017/S0960258514000403 [ Links ]
Instron (2006). Instron BlueHill® referencia de cálculos. Manual de referencia de software. Revisión A (versión 2.3) (software de cómputo). Norwood, Massachusetts, Estados Unidos: Instron Corporation. [ Links ]
Jaganathan, G. K. (2016). Influence of maternal environment in developing different levels of physical dormancy and its ecological significance. Plant Ecology, 217, 71−79. doi: 10.1007/s11258-015-0560-y [ Links ]
Jaganathan, G. K., Yule, K., & Liu, B. (2016). On the evolutionary and ecological value of breaking physical dormancy by endozoochory. Perspectives in Plant Ecology, Evolution and Systematics, 22, 11−22. doi: 10.1016/j.ppees.2016.07.001 [ Links ]
Kneuper, C. L., Scott, C. B., & Pinchak, W. E. (2018). Consumption and dispersion of mesquite seeds by ruminants. Range Management, 56(3), 255−259. doi: 10.2458/azu_jrm_v56i3_kneuper [ Links ]
Kulkarni, M. G., Sparg, S. G., & Van Staden, J. (2007). Germination and post-germination response of Acacia seeds to smoke-water and butenolide, a smoke derived compound. Journal of Arid Environments, 69(1), 177‒187. doi: 10.1016/j.jaridenv.2006.09.001 [ Links ]
Lazarević, J. M., Zorić, L., Karagć, Ð., Miloević, B., Karanović, D., Milić, D., … Luković, J. (2017). Anatomical and micromorphological characteristics of the seed coat of field pea (Pisum sativum L.) genotypes in relation to cracks and damage of seeds. Archives of Biological Sciences, 69(3), 503‒512. doi: 10.2298/ABS160612126L [ Links ]
Liyanage, G. S., & Ooi, M. K. J. (2015). Intra-population level variation in thresholds for physical dormancy-breaking temperature. Annals of Botany, 116(1), 123−131. doi: 10.1093/aob/mcv069 [ Links ]
Maldonado-Arciniegas, F., Ruales, C., Caviedes, M., Ramírez, X. D., & León-Reyes, A. (2018). An evaluation of physical and mechanical scarification methods on seed germination of Vachellia macracantha (Humb. & Bonpl. ex Willd.) Seigler & Ebinger. Acta Agronómica, 67(1), 120−125. doi: 10.1S446/acag.v67n1.60696 [ Links ]
Martínez-Pérez, G., Orozco-Segovia, A., & Martorell, C. (2006). Efectividad de algunos tratamientos pre-germinativos para ocho especies leñosas de la Mixteca Alta oaxaqueña con caracteristicas relevantes para la restauración. Boletín de la Sociedad Botánica de México, 79, 9−20. Retrieved from https://www.redalyc.org/pdf/577/Resumenes/Resumen_57707902_1.pdf [ Links ]
Martínez-Rodríguez, O. A., Rivera-Maya, J., & Santamaría-César, E. (2000). Evaluación de 25 tratamientos pregerminativos en semillas de mezquite (Prosopis velutina Wooton) en área de influencia de la URUZA. Revista Chapingo Serie Zonas Áridas, 1(2), 93‒99. Retrieved from https://docplayer.es/63104387-Evaluacion-de-25-tratamientos-pregerminativos-en-semillas-de-mezquite-prosopis-velutina-wooton-en-area-de-influencia-de-la-uruza.html [ Links ]
Minchala-Patiño, J., Poma-Angamarca, R., Muñóz-Chamba, L., Yaguana-Arévalo, M., González-Zaruma, D., Eras-Guamán, V. H., …Delgado-Paredes, G. E. (2014). Propagación in vitro de Prosopis limensis Benth. in Hook. (Fabaceae-Mimosoideae). Quebracho-Revista de Ciencias Forestales, 22(1−2), 88−99. Retrieved from https://www.redalyc.org/pdf/481/48133884010.pdf [ Links ]
Miranda, R. Q., Oliveira, M. T., Correia, R. M., Almeida-Cortez, J. S., & Pompelli, M. F. (2011). Germination of Prosopis juliflora (Sw) DC seeds after scarification treatments. Plant Species Biology, 26(2), 186−192. doi: 10.1111/j.1442-1984.2011.00324.x [ Links ]
Niembro, R. A. (1988). Semillas de árboles y arbustos: Ontogenia y estructura. México: Limusa. [ Links ]
Odum, E. P., & Barrett, G. W. (2008). Fundamentos de ecología. México: CENGAGE Learning. [ Links ]
Penfield, S. (2017). Seed dormancy and germination. Current Biology Magazine, 27(17), 874−878. doi: 10.1016/j.cub.2017.05.050 [ Links ]
Robles-Diaz, E., Flores, J., & Yañez-Espinosa, L. (2016). Paths of water entry and structures involved in the breaking of seed dormancy of Lupinus. Journal of Plant Physiology, 192, 75−80. doi: 10.1016/j.jplph.2016.01.005 [ Links ]
Rodríguez-Carias, A. A., & Valencia-Chin, E. (2007). El estómago del pequeño rumiante. Ruminantia, 3(2), 1−4. Retrieved from http://agricultura.uprm.edu/inpe/ruminantia/ruminantia3-2-2007.pdf [ Links ]
Rzedowski, J. (2006). Vegetación de México (1.a ed. digital). México: Limusa . [ Links ]
Sabiiti, E. N., & Wein, R. W. (1987). Fire and Acacia seeds : A hypothesis of colonization success. Journal of Ecology, 74, 937−946. Retrieved from https://www.jstor.org/stable/2260305?seq=1 [ Links ]
Sánchez, J., Estrada-Castillón, E., Arias-Montes, S., Muro-Pérez, G., García-Aranda, M., & García-Morales, L. J. (2014). Diversidad cactoflorística de la zona árida y semiárida de Durango, México. Interciencia, 39(11), 794‒802. Retrieved from https://www.interciencia.net/wp-content/uploads/2017/11/794-MURO-.pdf [ Links ]
Sánchez-Soto, B. H., Pacheco-Aispuro, E., Reyes-Olivas, Á., Lugo-García, G. A., Casillas-Álvarez, P., & Sauceda-Acosta, C. P. (2016). Ruptura de latencia física en semillas de Caesalpinia platyloba S. Watson. Interciencia, 41(10), 691‒695. Retrieved from https://www.interciencia.net/wp-content/uploads/2017/10/691-BARDO-41-10.pdf [ Links ]
Sato, K., Jitsuyama, Y., Yamada, T., Liu, B., & Abe, J. (2019). Structural features of the aleurone layer of the seed coat associated with imbibition injury in soybean. Breeding Science, 69(2), 364−370. doi: 10.1270/jsbbs.18181 [ Links ]
Shao, S., Meyer, C. J., Ma, F., Peterson, C. A., & Bernards, M. A. (2007). The outermost cuticle of soybean seeds: chemical composition and function during imbibition. Journal of Experimental Botany, 58(5), 1071−1082. doi: 10.1093/jxb/erl268 [ Links ]
Schiltmeyer, A. V., & Zouhar, K. (2020). Vachellia farnesiana, huisache. Fire effects information system. Retrieved from https://www.fs.fed.us/database/feis/plants/shrub/vacfar/all.pdf [ Links ]
Scott, A. C., Bowman, D. M. J. S., Bond, W. J., Pyne, S. J., & Alexander, M. E. (2014). Fire on earth. An introduction. Chichester: Wiley Blackwell. [ Links ]
Sorrivas de L., V., Morales, A., & Yañez, M. J. (2014). Principios y práctica de la microscopía electrónica. Buenos Aires, Argentina: UAT, CONICET, Bahía Blanca. [ Links ]
Statistical Analysis System Inc. (SAS). (2015). SAS® 9.4. in database products: User’s guide (6th ed.). Cary, NC, USA: Author. [ Links ]
Steinberg, P. (2001). Prosopis glandulosa. Fire effects information system. Retrieved July 9, 2021, from https://www.fs.fed.us/database/feis/plants/tree/progla/all.html [ Links ]
Steinbrecher, T., & Leubner-Metzger, G. (2018). Tissue and cellular mechanics of seeds. Current Opinion in Genetics & Development, 51, 1−10. doi: 10.1016/j.gde.2018.03.001 [ Links ]
Uchytil, R. J. (1990). Prosopis velutina. Fire effects information system. Retrieved July 9, 2021, from https://www.fs.fed.us/database/feis/plants/tree/provel/all.html [ Links ]
Velez, S. (2014). Interacciones entre Prosopis, insectos y mamíferos: implicancias en la depredación y supervivencia de las semillas. Mastozoología Neotropical, 21(2), 386−388. Retrieved from https://www.sarem.org.ar/wp-content/uploads/2014/12/SAREM_MastNeotrop_21-2_21_RTesis.pdf [ Links ]
Zalamea, P. C., Sarmiento, C., Arnold, A. E., Davis, A. S., & Dalling, J. W. (2015). Do soil microbes and abrasion by soil particles influence persistence and loss of physical dormancy in seeds of tropical pioneers? Frontiers in Plant Science, 5, 1−14. doi: 10.3389/fpls.2014.00799 [ Links ]
Recibido: 08 de Junio de 2020; Aprobado: 23 de Julio de 2021











 text in
text in 


