Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Chapingo serie ciencias forestales y del ambiente
On-line version ISSN 2007-4018Print version ISSN 2007-3828
Rev. Chapingo ser. cienc. for. ambient vol.26 n.2 Chapingo May./Aug. 2020 Epub Apr 23, 2021
https://doi.org/10.5154/r.rchscfa.2019.04.026
Artículo científico
Crecimiento y metabolitos secundarios de Stevia pilosa Lag. en tres condiciones edafoclimáticas en el estado de Hidalgo, México
1Colegio de Postgraduados, Campus Montecillo. km 36.5 carretera México-Texcoco. C. P. 56230. Montecillo, Texcoco, Estado de México, México.
2Instituto Nacional de Investigaciones Forestales, Agrícolas y Pecuarias, Centro Nacional de Investigación Disciplinaria en Relación Agua, Suelo, Planta, Atmósfera. km 6.5 margen derecha Canal de Sacramento. C. P. 35140. Gómez Palacio, Durango, México.
Introducción:
La distribución de Stevia pilosa Lag. y su contenido de metabolitos con propiedades terapéuticas se han documentado; sin embargo, no hay reportes del desarrollo in situ y de los factores que influyen en el crecimiento de la planta.
Objetivo:
Cuantificar el crecimiento, contenido fitoquímico y nutrimental de plantas de S. pilosa in situ bajo tres condiciones edafoclimáticas del estado de Hidalgo, México.
Materiales y métodos:
En los sitios denominados Huasca de Ocampo (HO), Mineral del Chico (MCh) y Mineral del Monte (MM), con clima, suelo y altitud diferentes, se colectó suelo y se hicieron tres muestreos de plantas para dar seguimiento al desarrollo de la especie. En el último muestreo se cuantificó la concentración nutrimental y fitoquímica.
Resultados y discusión:
La cantidad de plantas varió en función de los sitios de muestreo, siendo mayor en MCh (12 plantas·m-2). La tasa de crecimiento y el área foliar se relacionaron directamente. En plantas de MCh y MM, la fotosíntesis neta solo abasteció la demanda en los dos primeros muestreos, donde hubo acumulación significativa (P ≤ 0.05) de materia, mientras que en HO abasteció todos los muestreos. Las plantas de MCh y HO tuvieron mayor concentración nutrimental (P ≤ 0.05). Las plantas de MCh y MM presentaron mayor concentración de fenoles y flavonoides, y las de HO sobresalieron en terpenos totales.
Conclusiones:
Las condiciones edafoclimáticas en los tres sitios del estado de Hidalgo modificaron la presencia, forma de crecimiento y desarrollo de S. pilosa.
Palabras clave: desarrollo in situ; Mineral del Chico; índices de crecimiento; concentración nutrimental; terpenos
Introduction:
The distribution of Stevia pilosa Lag. and its metabolite content with therapeutic properties have been documented; however, there are no reports of in situ development and factors influencing plant growth.
Objective:
To quantify the growth and phytochemical and nutrient content of S. pilosa plants in situ under three edaphoclimatic conditions in the state of Hidalgo, Mexico.
Materials and methods:
At the three sites called Huasca de Ocampo (HO), Mineral del Chico (MCh) and Mineral del Monte (MM), with different climates, soil types and elevation ranges, soil was collected and three plant samplings were carried out to follow the development of the species.
Results and discussion:
The number of plants varied according to the sampling sites, being higher in MCh (12 plants·m-2). Growth rate and leaf area were directly related. In MCh and MM plants, net photosynthesis only supplied the demand in the first two samplings, where there was significant accumulation (P ≤ 0.05) of matter, while in HO it supplied all the samplings. MCh and HO plants had a higher nutrient concentration (P ≤ 0.05). MCh and MM plants showed a higher concentration of phenols and flavonoids, and HO plants stood out in total terpenes.
Conclusions:
The edaphoclimatic conditions at the three sites in the state of Hidalgo modified the presence, form of growth and development of S. pilosa.
Keywords: in situ development; Mineral del Chico; growth rates; nutrient concentration; terpenes
Introducción
El género Stevia tiene 116 especies en México, de las cuales 107 son endémicas, (Villagómez-Flores, Hinojosa-Espinosa, & Villaseñor, 2018). De estas, Stevia rebaudiana (Bertoni) Bertoni es la más estudiada por sus propiedades edulcorantes (Goyal, Samsher, & Goyal, 2010), mientras que Stevia pilosa Lag. es utilizada como ornato y en la herbolaria por su potencial farmacéutico (Villavicencio & Pérez, 2006). Algunas especies de Stevia se han colectado y analizado para identificar sus compuestos (Álvarez et al., 2005; García & Pereda, 2002; Hernández, Catalan, & Joseph-Nathan, 1998) y algunas propiedades del suelo y clima donde crecen.
La información edafoclimática del lugar donde S. pilosa se desarrolla es escasa. Algunos reportes indican que esta planta se encuentra en altitudes entre 2 300 y 4 000 m, y precipitaciones entre 700 y 1 200 mm anuales (Calderón & Rzedowski, 2005) o bien entre 1 800 y 3 200 m con floración de junio a octubre (Villagómez-Flores et al., 2018). Soejima et al. (2017) indican que la especie crece en bosques de Pinus y Quercus y en sitios con acumulación de materia orgánica en el horizonte superficial y con diferentes grados de descomposición. A diferencia de S. pilosa, son múltiples los estudios de S. rebaudiana que demuestran que la zona geográfica de crecimiento influye en la concentración nutrimental y calidad de los esteviósidos (Khiraoui et al., 2017). La fisiología característica del género Stevia permite que la planta se adapte fácilmente a cambios de clima y hábitats. Jarma, Rengifo, y Araméndiz-Tatis (2006) evaluaron la respuesta de Stevia a niveles de radiación de acuerdo con el sitio y encontraron diferencias en el tamaño de la planta y en el desarrollo floral.
La especie S. pilosa crece en forma silvestre en Hidalgo, México (Calderón & Rzedowski, 2005). Esta entidad se caracteriza por tener climas tropicales, templados y secos, y altitudes de 100 a 3 000 m, debido a la presencia de tres provincias fisiográficas (Instituto Nacional de Estadística y Geografía [INEGI], 2015). Esto significa que S. pilosa se ha adaptado a condiciones edafoambientales distintas (Molina, Galván, Patiño, & Fernández, 2012), debido a ello, se cree que el crecimiento, concentración de metabolitos y contenido nutrimental son diferentes.
La eficiencia de una planta para la producción de tejido en función del tiempo se puede medir a través de índices de crecimiento (Azarpour, Moraditochaee, & Bozorgi, 2014). Con esta información es posible cuantificar la demanda de cualquier órgano, actividad fotosintética in situ y su relación con la producción de materia seca (Hunt, 2017). Jarma, Combatt, y Cleves (2010) indicaron que la concentración de macro y microelementos determinan la calidad de Stevia; por tanto, también es importante la evaluación del contenido nutrimental bajo condiciones ambientales distintas.
El objetivo de la presente investigación fue cuantificar el crecimiento, contenido fitoquímico y nutrimental de plantas de S. pilosa in situ bajo tres condiciones edafoambientales del estado de Hidalgo, México.
Materiales y métodos
A partir de la publicación de “Flora fanerogámica del Valle de México” (Calderón & Rzedowski, 2005), de recorridos de campo y entrevistas a productores sobre S. pilosa, se seleccionaron tres localidades del estado de Hidalgo con tipo de suelo y condiciones ambientales diferentes: Huasca de Ocampo (HO), Mineral del Chico (MCh) y Mineral del Monte (MM) (Cuadro 1).
Cuadro 1 Características de los sitios de recolecta de Stevia pilosa en Hidalgo, México.
| Elemento | Huasca de Ocampo | Mineral del Chico | Mineral del Monte |
|---|---|---|---|
| Altitud (m) | 2 204 | 2 509 | 2 822 |
| Latitud | 20° 10' 29'' N | 20° 14' 40.7" N | 20° 08' 44" N |
| Longitud | 98° 33' 31" W | 98° 46' 08.6" W | 98° 41' 06" W |
| Temperatura (°C, máx-mín) | 22.6 - 4.0 | 20.9 - 8.7 | 18.5 - 7.5 |
| Precipitación (mm) | 856.2 | 1 427.8 | 870.7 |
| Evaporación (mm) | 1 253.4 | 131.5 | 1 137.9 |
| Niebla (días) | 0.7 | 69.40 | 62.2 |
| Vegetación | Pinus patula, P. teocote, P. michoacana, Quercus crassifolia y Q. rugosa | P. teocote, Abies religiosa, Juniperus monosperma y Q. rugosa | Pinus montezumae, Q. rugosa, A. religiosa y Juniperus monticola |
En cada sitio se colectaron tres muestras compuestas de suelo del horizonte superficial para el análisis de las propiedades edáficas siguientes: textura (pipeta), pH (1:1 agua:suelo), capacidad de intercambio catiónico (acetato de amonio), materia orgánica (Walkley y Black), nitrógeno (Kjeldahl), fosfatos solubles (Olsen), densidad aparente (terrón y parafina), saturación de bases (%) y carbón orgánico (Van Reeuwijk, 2002).
En cada sitio se colectaron ocho plantas de S. pilosa a los 20, 52, 82 y 110 días después del muestreo de suelo y se determinaron la altura de planta, diámetro del tallo y número de hojas. El material vegetal se secó en una estufa (Blue Island, modelo BLUE M, Illinois, USA) con circulación de aire a 47 °C durante 96 h. Posteriormente, se utilizó una balanza analítica (ADAM EQUIPMENT®, modelo PW254) para obtener el peso seco de hojas y tallo. El área foliar se midió con una cámara fotográfica (Samsung, semiprofesional modelo WB1100F) con la metodología propuesta por Rincón, Olarte, y Pérez (2012). Con los valores obtenidos se calcularon los índices: Tasa Relativa de Crecimiento (TRC = lnPS2-lnPS1/T2-T1), Tasa de Asimilación Neta [TAN = (PS2-PS1/AF2-AF1) (lnAF2-lnAF1/T2-T1)], Área Foliar Específica (AFE = AF/PSH) y Razón de Área Foliar (RAF = AF/PSP); donde ln = logaritmo natural, T1 = tiempo 1, T2 = tiempo 2, PS = peso seco, AF = área foliar, PSH = peso seco de hojas y PSP = peso de hojas y tallo (Hunt, 2017; Nassi, Roncucci, Triana, Tozzini, & Bonari, 2011).
En el último muestreo, además de las determinaciones ya mencionadas, se hizo el análisis nutrimental de las plantas y se cuantificó la concentración de macroelementos (P, K, Ca, Mg y S) y microelementos (Fe, Zn, Mn, Co, Cu, Ni, Na y B) por espectroscopia de emisión atómica de inducción por plasma acoplado (ICP-OES, Varian®, modelo 725-ES). El contenido de N total se determinó por el método semimicro-Kjeldahl (Bremner & Mulvaney, 1982). Con los valores de concentración y peso seco se calculó la extracción de cada elemento por planta.
Con el material vegetal seco se identificaron fenoles con el reactivo Folin-Ciocalteu, flavonoides por la reacción de Shinoda, y terpenos por la reacción de Liebermann-Burchard (Cannon et al., 2001; Tholl, Chen, Petri, Gershenzon, & Pichersky, 2015); la cuantificación se realizó con los métodos descritos por Waterman y Mole (1994), Chang, Yang, Wen, y Chern (2002), y Harborne (1998), respectivamente. Los resultados se sometieron a un análisis de varianza (ANDEVA) y pruebas de comparación de medias de Tukey (α = 0.05).
Resultados y discusión
Condiciones edafoclimáticas
Los tres sitios donde S. pilosa crece en Hidalgo presentan diferencias en altitud, precipitación pluvial, temperatura, vegetación y tipo de suelo, aunque comparten algunas condiciones ambientales (Cuadros 1 y 2). MCh y MM tienen el mismo número de días con niebla y suelo con drenaje deficiente, mientras que HO y MM presentan valores similares en evaporación y precipitación. Estas variables climáticas definen las áreas de distribución de las especies, así como sus límites de sobrevivencia (Cabrera, 2002).
Los suelos donde S. pilosa crece varían de muy ácidos a ácidos, pobres a moderados en materia orgánica, con texturas finas y medias (Ortiz-Solorio, 2019), y la densidad aparente es baja (MCh = 1.21 g·cm-3 y HO = 1.25 g·cm-3), condiciones edáficas que difieren de donde S. rebaudiana se desarrolla (Goyal et al., 2010).
El uso del suelo y la perturbación de la vegetación varió entre los sitios; en MM hay tala de árboles, en MCh se siembran cultivos de subsistencia y en HO hay pastoreo, actividades que tienen efecto en la densidad y crecimiento de las plantas de S. pilosa.
El Cuadro 2 indica que las concentraciones nutrimentales de los suelos variaron; por ejemplo, los valores más altos en nitrógeno, capacidad de intercambio catiónico y saturación de bases (PSB) corresponden a MM; mientras que los valores más bajos en fósforo y PSB se presentan en HO. El contenido de materia orgánica en el suelo se correlaciona con la cantidad de hojas y peso seco de las plantas (Mishra & Kumar, 2016) como sucede en MCh. Zaman, Chowdhury, y Chowdhury (2015) reportaron que S. rebaudiana se desarrolla en suelos con alto contenido de materia orgánica, lo cual sugiere que S. pilosa requiere menos calidad nutrimental para su crecimiento.
Cuadro 2 Características físicas y químicas de los suelos donde Stevia pilosa crece en el estado de Hidalgo, México.
| Sitio | Textura | Da (g·cm-3) | pH | CO (%) | MO (%) | N (%) | P (mg·kg-1) | CIC (cmol(+)·kg-1) | PSB (%) |
|---|---|---|---|---|---|---|---|---|---|
| HO | limoso | 1.25 | 4.6 | 0.92 | 1.59 | 0.061 | 7.94 | 18.77 | 11.56 |
| MCh | arcilloso | 1.21 | 5.1 | 1.29 | 2.23 | 0.096 | 10.48 | 25.79 | 23.72 |
| MM | arcilloso | 1.61 | 5.8 | 1.82 | 3.22 | 0.225 | 8.37 | 31.63 | 63.47 |
HO = Huasca de Ocampo, MCh = Mineral del Chico, MM = Mineral del monte. Da = densidad aparente, CO = carbono orgánico, MO = materia orgánica, N = nitrógeno, P = fósforo, CIC = capacidad de intercambio catiónico, PSB = porcentaje de saturación de bases.
La cantidad de plantas presentes en los sitios fue diferente y dependió de las condiciones edafoclimáticas. En MCh se encontraron poblaciones de hasta 12 plantas por m2, alrededor de los árboles o donde se filtraba la luz solar; en contraste, en HO, donde los suelos tuvieron menor contenido nutrimental y mayor temperatura y cantidad de luz, se cuantificaron en promedio dos plantas por 9 m2.
De acuerdo con el Cuadro 3, existen diferencias estadísticas significativas (P ≤ 0.05) en el desarrollo de S. pilosa de acuerdo con el sitio de muestreo, de ahí la importancia del ecosistema donde se desarrolla y el manejo agronómico de la planta (Wahid, Farooq, Hussain, Rasheed, & Galani, 2012). Las plantas de MCh y MM incrementaron notablemente su altura en los primeros 52 días, pero entre los 82 y 110 días, el crecimiento fue más lento. En contraste, las plantas de HO aumentaron su altura constantemente desde el primero hasta el último día de muestreo. Esto se refleja en el crecimiento de 0.383 y 0.328 cm por día en las plantas de MCh y MM, respectivamente, y de 0.625 cm en las plantas de HO. En dicho sitio, gran parte de los días del año son soleados y con temperaturas más altas que en MCh y MM, donde los días con niebla representan hasta poco más de 2.5 meses (Cuadro 1). De acuerdo con Hatfield y Prueger (2015), es necesario realizar investigaciones para cuantificar las interacciones entre la temperatura, la humedad del suelo y la especie, y así entender las posibles estrategias de los cultivos para su desarrollo bajo diferentes condiciones climáticas.
Cuadro 3 Variables de crecimiento de Stevia pilosa desarrollada en tres sitios del estado de Hidalgo, México.
| Sitio | Días de muestreo | AP (cm) | DT (mm) | NH | AF (cm2) | PSH (mg) | PST (mg) |
|---|---|---|---|---|---|---|---|
| Huasca de Ocampo | 20 | 13.68 | 1.37 | 37 | 27.58 | 233.8 | 183.3 |
| 52 | 25.59 | 1.77 | 78.13 | 44.62 | 312.2 | 302.8 | |
| 82 | 43.64 | 2.26 | 196.50 | 92.95 | 626.2 | 504.1 | |
| 110 | 72.36 | 2.68 | 366.75 | 182.49 | 914.7 | 1 738.1 | |
| Mineral del Chico | 20 | 14.18 | 1.49 | 45.25 | 99.06 | 330.2 | 411.4 |
| 52 | 34.50 | 2.37 | 224.75 | 197.99 | 740.6 | 840.6 | |
| 82 | 43.83 | 2.64 | 274.75 | 237.93 | 1 127.3 | 1 227.9 | |
| 110 | 48.71 | 2.90 | 417.25 | 311.50 | 1 347.5 | 1 977.1 | |
| Mineral del Monte | 20 | 15.86 | 1.32 | 36.00 | 21.78 | 152.1 | 135.8 |
| 52 | 27.13 | 1.73 | 81.25 | 40.45 | 244.9 | 210.9 | |
| 82 | 43.21 | 2.23 | 245.75 | 144.62 | 540.2 | 609.1 | |
| 110 | 42.45 | 2.53 | 261.75 | 200.88 | 704.3 | 935.8 | |
| Media general | 29.07 | 1.91 | 135.49 | 100.78 | 478.5 | 491.8 | |
| DMS | 3.04 | 0.22 | 34.05 | 16.07 | 125.7 | 111.4 | |
| Tukey (α = 0.05) | ** | ** | ** | ** | ** | ** |
DMS: diferencia mínima significativa. AP = altura de la planta, DT = diámetro del tallo, NH = número de hojas, AF = área foliar, PSH = peso seco de hojas, PST = peso seco del tallo.
Por otra parte, el diámetro del tallo de las plantas incrementó linealmente en HO y MM; mientras que en MCh, el mayor crecimiento (hasta 40 %) se registró entre los 52 y 82 días. Las plantas de MCh tuvieron de 15 a 47 % más hojas (pequeñas, lanceoladas y más delgadas) y mayor superficie foliar que las de MM y HO, respectivamente. Si se analiza el último registro (110 días), es posible verificar que las hojas de HO fueron mucho más gruesas (5.01 mg·cm-2) que las de MCh (4.32 mg·cm-2) y MM (3.50 mg·cm-2); sin embargo, los valores más altos de PSH y PST se obtuvieron en las plantas de MCh. Estos datos demuestran que la cantidad de radiación solar que la planta intercepta y usa durante su desarrollo, en conjunto con la humedad y nutrimentos, son factores determinantes en el crecimiento para obtener altos rendimientos (Pereira, Storck, Lopes, Martin, & Bisognin, 2016).
Índices de eficiencia fisiológica
La TRC indica la eficiencia de la planta para producir biomasa en un periodo determinado. En la Figura 1 se puede apreciar que la TRC de S. pilosa fue diferente en los tres sitios estudiados. En MCh, los valores más altos se registraron en las primeras fechas de muestreo, lo que indica eficiencia en la producción de biomasa porque hubo hojas grandes; sin embargo, en fechas posteriores, las hojas fueron más pequeñas y algunas fueron senescentes.

Figura 1 Tasa relativa de crecimiento en plantas de Stevia pilosa en Huasca de Ocampo (HO), Mineral del Chico (MCh) y Mineral del Monte (MM), estado de Hidalgo, México. DMS: Diferencia mínima significativa.
En HO y MM, S. pilosa creció y continuó la actividad meristemática de tal forma que duplicaron y triplicaron la TRC, respectivamente, entre los 32 y 62 días; el crecimiento del tallo y yemas vegetativas incrementó y hubo nuevas ramificaciones. Las plantas de MM fueron muy eficientes en la producción de biomasa hasta los 60 días; posteriormente, el tamaño de las hojas disminuyó. Las plantas de HO produjeron lentamente su biomasa solo en los primeros días, después aumentó notablemente conforme el tiempo pasó, lo cual estuvo relacionado con la presencia de lluvias.
La tasa de asimilación neta (TAN) registra la velocidad de la fotosíntesis neta en un lapso. La Figura 2 indica que, en los primeros 30 días, los valores más altos (5.01 mg·cm-2·d-1) se registraron en MCh, mientras que el valor fue tres veces menor en MM y HO. Esto muestra, en forma indirecta, que las plantas son menos eficientes autotróficamente por lo que su sobrevivencia depende en gran parte de las reservas de la raíz. Un caso particular fue el de las plantas de HO, donde la TAN incrementó en cada muestreo, lo cual está relacionado directamente con el peso de hoja por área (cm2) y con la eficiencia del follaje en la producción de fotoasimilados (Morales et al., 2015). Además, en este sitio hubo mayor exposición a la luz directa del sol, situación que modifica la intensidad y calidad de luz captada por los órganos que realizan la fotosíntesis (Casierra-Posada & Peña-Olmos, 2015), lo cual permitió reponer las pérdidas de biomasa, respiración y movimiento de fotosintatos a los órganos reproductivos.

Figura 2 Tasa de asimilación neta en plantas de Stevia pilosa durante su crecimiento en Huasca de Ocampo (HO), Mineral del Chico (MCh) y Mineral del Monte (MM) estado de Hidalgo, México. DMS: diferencia mínima significativa.
El crecimiento y desarrollo de un vegetal están influenciados, entre otros factores, por la intensidad y la calidad de la luz captada por los órganos que realizan la fotosíntesis. El AFE incrementó constantemente en las plantas de HO y MM. Este resultado está relacionado con el espesor de la hoja y la disponibilidad de la luz, tal como lo mencionan Quero et al. (2008). Acorde con la Figura 3, a los 32 días, los valores más altos correspondieron a las plantas de MCh con 291.68 cm2·g-1. En las plantas de HO y MM, el AFE incrementó en función del tiempo; el segundo sitio generó el valor más alto (324.25 cm2·g-1) en el último muestreo (110 días). El AFE es el índice más sensible a cambios ambientales y el más propenso a los ontogenéticos, por lo que, el sombreado excesivo provoca aumento del AFE y repercute negativamente en la TAN (Morales et al., 2015), tal como se observó en el presente estudio.
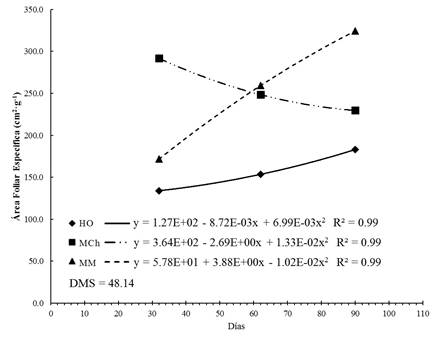
Figura 3 Área foliar específica en plantas de Stevia pilosa durante el crecimiento en Huasca de Ocampo (HO), Mineral del Chico (MCh) y Mineral del Monte (MM) estado de Hidalgo, México. DMS: diferencia mínima significativa.
Wright, Reich, y Westoby (2001) determinaron correlaciones positivas entre el AFE, la capacidad fotosintética y el contenido nutrimental, y demostraron que cuando hay índices altos de AFE hay menor dureza en las hojas y mayor calidad nutrimental en la planta. La información sobre S. pilosa es muy escasa; no obstante, con base en el trabajo realizado, es posible afirmar que los valores significativamente menores reflejan mayor dureza de la hoja, lo cual se puede interpretar como una adaptación al ambiente (Romero-Figueroa et al., 2017).
La RAF, que representa la superficie asimiladora por unidad de peso seco, presentó la misma tendencia que el AFE. Las plantas que crecieron en MCh tuvieron las hojas más densas a los 30 días, pero las hojas se hicieron más delgadas conforme el tiempo pasó; en contraste, en MM, la RAF fue 20 % más alta a los 110 días (Figura 4). Estas diferencias se deben principalmente a las condiciones de sombreado y temperaturas bajas que modifican las actividades metabólicas y respiratorias de la planta. Además, el aumento o disminución en el valor de la RAF significa que los cambios en el AF son mucho más críticos en la floración y formación de semilla que en la fase inicial del crecimiento (Pommerening & Muszta, 2016).
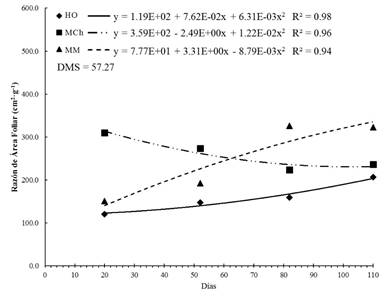
Figura 4 Razón de área foliar en plantas de Stevia pilosa durante su crecimiento en Huasca de Ocampo (HO), Mineral del Chico (MCh) y Mineral del Monte (MM) en el estado de Hidalgo, México. DMS: diferencia mínima significativa.
La discrepancia en el comportamiento de los índices a través del tiempo se debe en gran medida a las condiciones climáticas, al número de muestreos realizados y a la poca información sobre las etapas fenológicas precisas de la especie.
Concentración de metabolitos
La Figura 5 muestra las concentraciones de metabolitos en S. pilosa. Las plantas de los tres sitios no mostraron diferencias estadísticas significativas (P > 0.05) en la concentración de fenoles; los valores promedio variaron de 1.79 a 2.6 mg·g-1 de materia seca. Estas concentraciones son inferiores a las encontradas por Gawel-Beben et al. (2015) en hojas de S. rebaudiana (6 a 16 mg·g-1 de materia seca). La concentración de flavonoides también fue similar entre sitios (P > 0.05) y varió de 1.3 a 1.8 mg·g-1 de materia seca; al respecto, Gawel-Beben et al. (2015) reportaron valores de 2.2 a 3.5 mg·g-1. Por otra parte, el análisis mostró diferencias estadísticas significativas (P ≤ 0.05) en el total de terpenos (TT) y, de acuerdo con lo reportado por Cerda-García-Rojas y Pereda-Miranda (2001), se deduce que este tipo de metabolitos en S. pilosa son de tipo diterpénico. Asimismo, se encontró que el TT tiene una correlación inversa con el porcentaje de bases intercambiables; es decir, a mayor cantidad de TT menor presencia de cationes en el sistema de intercambio. En general, la presencia o ausencia de los metabolitos secundarios en las plantas tiene que ver con las condiciones climáticas y la altitud del lugar (Cui, Nakamura, Tian, Kayahara, & Tian, 2006), así como con el estrés generado por la presencia de plagas y enfermedades (Magangana & Makunga, 2016), el contenido nutrimental del suelo (Zhao et al., 2016) y la interacción con otras especies.
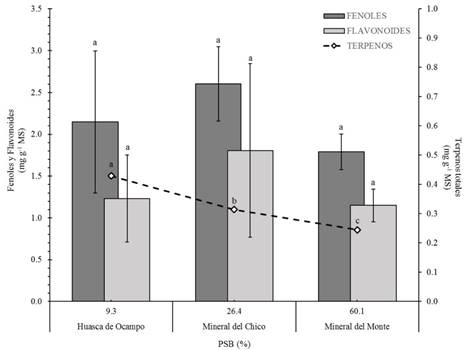
Figura 5 Concentración de fenoles, flavonoides y terpenos totales en plantas de Stevia pilosa y su relación con el porcentaje de saturación de bases (PSB) de los suelos de tres sitios del estado de Hidalgo, México. Letras distintas indican diferencias significativas en las concentraciones de metabolitos entre sitios, de acuerdo con la prueba de Tukey (P ≤ 0.05).
En estudios del género Stevia se han reportado metabolitos triterpénicos y lactonas sesquiterpénicas (García & Pereda, 2002) que tienen propiedades antinflamatorias (Hohmann et al., 2016) y de prevención del cáncer (Sampaio, Edrada-Ebel, & Da Costa, 2016), motivo por el cual es importante la identificación de los metabolitos y el estudio de sus propiedades.
A pesar de que existe poca información sobre el manejo o la relación edafoambiental en la producción de metabolitos secundarios de Stevias mexicanas, es posible inferir que factores como la disponibilidad de agua, microorganismos en la rizósfera (Borda, Pardo, Montaña, & Martínez, 2011), temperatura (Kumar et al., 2015) y calidad de luz (Ahmad, Rab, & Ahmad, 2016) pueden incrementar la concentración de fenoles, flavonoides y diterpenos.
Análisis nutrimental
De acuerdo con el Cuadro 4, la concentración y extracción de los minerales en S. pilosa variaron significativamente (P ≤ 0.05) en función del sitio de muestreo. Las plantas con los rendimientos más altos en extracción fueron las de MCh y las de menor rendimiento fueron las de MM. Los elementos más extraídos por la planta fueron N, K, Ca y Mg, y los de menor extracción fueron Fe, Zn, Mn y Mo. Una tendencia similar fue encontrada por Khiraoui et al. (2017) en un análisis de S. rebaudiana de seis sitios en Indiana, donde K, Ca y Mg fueron los minerales con mayor cantidad en el tejido vegetal, y Mn, Fe y Zn los más bajos. Estos resultados se relacionan con la capacidad de resiliencia de la planta silvestre, las condiciones edafoclimáticas contrastantes entre los sitios y el desarrollo de la especie. Por otro lado, Rather, Singh, Suhail, y Patel (2019) reportan que el Ca y K son los minerales de mayor concentración en la planta y el Fe, P y Na los de menor concentración. Al parecer, el género Stevia tiene la misma tendencia en concentración y extracción mineral.
Cuadro 4 Extracción nutrimental de plantas de Stevia pilosa desarrolladas en tres localidades del estado de Hidalgo, México.
| Sitio | N | P | K | Ca | Mg | S | Fe | Zn | Mn | Mo |
|---|---|---|---|---|---|---|---|---|---|---|
| (mg·g-1 materia seca) | ||||||||||
| Huasca de Ocampo | 8.25 a | 1.61 a | 3.68 a | 3.11 b | 2.42 a | 1.62 a | 0.58 a | 0.33 a | 0.78 a | 0.08 a |
| Mineral del Chico | 8.80 a | 2.07 a | 3.81 a | 4.41 a | 2.32 a | 1.84 a | 0.98 a | 0.32 a | 0.68 ab | 0.12 a |
| Mineral del Monte | 6.15 b | 1.83 a | 2.42 b | 2.67 b | 1.71 b | 0.63 b | 0.36 b | 0.36 b | 0.40 b | 0.10 a |
Conclusiones
Las condiciones edafoclimáticas presentes en los tres sitios del estado de Hidalgo modifican la presencia, forma de crecimiento y el desarrollo de Stevia pilosa. Las plantas con mayor crecimiento, producción de biomasa y extracción nutrimental se encontraron en Mineral del Chico, donde hay clima húmedo y suelo de mayor fertilidad química, mientras que la mayor producción de terpenos totales se encontró en plantas provenientes de Huasca de Ocampo, donde el clima es seco y los suelos son pobres en nutrientes. Este estudio representa la primera investigación en la que se documenta el desarrollo, contenido nutrimental y metabolitos secundarios de S. pilosa in situ.
Agradecimientos
Al Consejo Nacional de Ciencia y Tecnología (CONACYT) por la beca de posgrado otorgada al primer autor.
REFERENCIAS
Ahmad, N., Rab, A., & Ahmad, N. (2016). Light-induced biochemical variations in secondary metabolite production and antioxidant activity in callus cultures of Stevia rebaudiana (Bert). Journal of Photochemistry & Photobiology, B: Biology , 154, 51-56. doi: 10.1016/j.jphotobiol.2015.11.015 [ Links ]
Álvarez, G. R., Torres, V. J., Román, L., Hernández, J., García, R. C. C., & Nathan, P. J. (2005). Absolute configuration of the a-methylbutyryl residue in longipinene derivatives from Stevia pilosa. Phytochemistry, 66(6), 639-642. doi: 10.1016/j.phytochem.2004.12.001 [ Links ]
Azarpour, E., Moraditochaee, M., & Bozorgi, H. R. (2014). Effect of nitrogen fertilizer management on growth analysis of rice cultivars. International Journal of Biosciences, 4(5), 35-47. doi: 10.12692/ijb/4.5.35-47 [ Links ]
Borda, M. D., Pardo, J. M. G., Montaña, J. S. L., & Martínez, M. M. (2011). Influencia de la materia orgánica y Azotobacter nigricans en un cultivo de Stevia rebaudiana. Universitas Scientiarum, 16(3), 282-293. doi: 10.11144/javeriana.CS16-3.ioom [ Links ]
Bremner, J. M., & Mulvaney, C. S. (1982). Nitrogen-total. In A. L. Page, R. H. Miller, & D. R. Keeney (Eds.), Methods of soil analysis. Chemical and microbiological properties (2nd ed., pp. 595-624). Madison, WI, USA: American Society of Agronomy-Soil Science Society of America. doi: 10.2134/agronmonogr9.2.2ed.c31 [ Links ]
Cabrera, H. M. (2002). Respuestas ecofisiológicas de plantas en ecosistemas de zonas con clima mediterráneo y ambientes de alta montaña. Revista Chilena de Historia Natural, 75(3), 625-637. doi: 10.4067/S0716-078X2002000300013 [ Links ]
Calderón, G., & Rzedowski, J. (2005). Flora fanerogámica del Valle de México. México: Instituto de Ecología, A. C. - Comisión Nacional para el Conocimiento y Uso de la Biodiversidad. Retrieved from http://www.biodiversidad.gob.mx/publicaciones/librosDig/pdf/Flora_del_Valle_de_Mx1.pdf [ Links ]
Cannon, J., Li, D., Wood, S. G., Owen, N. L., Gromova, A., & Lutsky, V. (2001). Investigation of secondary metabolites in plants. A general protocol for undergraduate research in natural products. Journal Chemistry Education, 78(9), 1234-1237. doi: 10.1021/ed078p1234 [ Links ]
Casierra-Posada, F., & Peña-Olmos, J. E. (2015). Modificaciones fotomorfogénicas inducidas por la calidad de la luz en plantas cultivadas. Revista de la Academia Colombiana de Ciencias Exactas, Físicas y Naturales, 39, 84-92. doi: 10.18257/raccefyn.276 [ Links ]
Cerda-García-Rojas, C. M., & Pereda-Miranda, R. (2001). The phytochemistry of Stevia: a general survey. In A. D. Kinghorn (Ed.), Stevia. The genus Stevia (vol. 19, pp. 87-118). London: CRC Press. Retrieved from https://www.taylorfrancis.com/books/e/9780429217487 [ Links ]
Chang, C. C., Yang, M. H., Wen, H. M., & Chern, J. C. (2002). Estimation of total flavonoids content in propolis by two complementary colorimetric methods. Journal of Food and Drug Analysis, 10(3), 178-182. Retrieved from https://search.proquest.com/openview/8ed5f78aa3317908039c7a8ca3740050/1?pq-origsite=gscholar&cbl=906352 [ Links ]
Cui, T., Nakamura, K., Tian, S., Kayahara, H., & Tian, Y. (2006). Polyphenolic content and physiological activities of chinese hawthorn extracts. Bioscience, Biotechnology, and Biochemistry, 70(12), 2948-2956. doi: 10.1271/bbb.60361 [ Links ]
García, R. C., & Pereda, M. R. (2002). The phytochemistry of the Stevia: a general survey. In A. D. Kinghorn (Ed.), Stevia: The genus Stevia; medicinal and aromatic plants-industrial profiles (vol. 19, pp. 86-118). London, UK: Ed. Taylor & Francis. [ Links ]
Goyal, S., Samsher, K., & Goyal, R. K. (2010). Stevia (Stevia rebaudiana) a bio-sweetener: a review. International Journal of Food Science and Nutrition, 61(1), 1-10. doi: 10.3109/09637480903193049 [ Links ]
Harborne, J. B. (1998). Phytochemical methods. A guide to modern techniques of plant analysis (3rd. ed.). London, UK: Chapman & Hall. [ Links ]
Hatfield, J. L., & Prueger, J. H. (2015). Temperature extremes: Effect on plant growth and development. Weather and Climate Extremes, 10(A), 4-10. doi: 10.1016/j.wace.2015.08.001 [ Links ]
Hernández, L. R., Catalan, C. A. N., & Joseph-Nathan, N. P. (1998). The chemistry of the genus Stevia (Asteraceae). Revista de la Academia Colombiana de Ciencias Exactas, Física y Naturales, 22(83), 229-279. Retrieved from https://www.researchgate.net/publication/270511131_THE_CHEMISTRY_OF_THE_GENUS_STEVIA_ASTERACEAE [ Links ]
Hohmann, M. S. N., Longhi-Balbinot, D. T., Guazelli, C. F. S., Navarro, S. A., Zarpelon, A. C., Casagrande, R., …Verri, W. A. (2016). Sesquiterpene lactones: structural diversity and perspectives as antiinflammatory molecules. In Atta-ur-Rahman (Ed.), Studies in natural products chemistry (pp. 243-264). New York, NY, USA: Elsevier. [ Links ]
Hunt, R. (2017). Growth analysis, individual plants. In B. Thomas, D. J. Murphy, & B. G. Murray (Eds.), Encyclopedia of applied plant sciences (2nd. ed., pp. 579-588). London, UK: Academic Press. [ Links ]
Instituto Nacional de Estadística y Geografía (INEGI). (2015). División municipal del estado de Hidalgo. Retrieved June 6, 2017 from http://cuentame.inegi.org.mx/monografias/informacion/hgo/territorio/div_municipal.aspx?tema=me&e=13 [ Links ]
Gaweł-Bęben, K., Bujak, T., Nizioł-Łukaszewska, Z., Antosiewicz, B., Jakubczyk, A., Karaś, M., & Rybczyńska, K. (2015). Stevia rebaudiana Bert. leaf extracts as a multifunctional source of natural antioxidants. Molecules, 20(4), 5468-5486 doi: 10.3390/molecules20045468 [ Links ]
Jarma, O. A. J., Combatt, C., & Cleves, C. (2010). Aspectos nutricionales y metabolismo de Stevia rebaudiana (Bertoni): una revisión. Agronomía Colombiana, 28(2), 199-208. Retrieved from http://www.scielo.org.co/pdf/agc/v28n2/v28n2a09.pdf [ Links ]
Jarma, A., Rengifo, T., & Araméndiz-Tatis, H. (2006). Fisiología de estevia (Stevia rebaudiana) en función de la radiación en el Caribe colombiano. II. Análisis de crecimiento. Agronomía Colombiana, 24(1), 38-47. Retrieved from https://www.redalyc.org/articulo.oa?id=180316238005 [ Links ]
Khiraoui, A., Bakha, M., Amchra, F., Ourouadi, S., Booulli, A., Al-Faiz, C., & Hasib, A. (2017). Nutritional and biochemical properties of natural sweeteners of six cultivars of Stevia rebaudiana Bertoni leaves grown in Morocco. Journal of Materials and Environmental Sciences, 8(3), 1015-1022. Retrieved from http://www.jmaterenvironsci.com/ [ Links ]
Kumar, P. P., Mahajan, M., Prasad, R. V., Pathania, V., Singh, B., & Singh, P. A. (2015). Harvesting regimes to optimize yield and quality in annual and perennial Stevia rebaudiana in alloxan-induced diabetic rats. Pharmacognosy Research, 2(4), 258-263. doi: 10.4103/0974-8490.69128 [ Links ]
Magangana, T. P., & Makunga, N. P. (2016). The effect of various factors on seed germination and the influence of abiotic stresses on growth productivity, physiology and differences in metabolite profiles (diterpene glycosides) of Stevia rebaudiana Bertoni. South African Journal of Botany, 103, 324-325. doi: 10.1016/j.sajb.2016.02.080 [ Links ]
Mishra, G., & Kumar, R. (2016). Plant litter decomposition: drivers insight to the ecological process. European Journal of Biological Research, 6(3), 176-185. doi: 10.5281/zenodo.58752 [ Links ]
Molina, M. J. L., Galván, V. R., Patiño, S. A., & Fernández, N. R. (2012). Plantas medicinales y listado florístico preliminar del municipio de Huasca de Ocampo, Hidalgo, México. Polibotánica, 34, 239-271. Retrieved from http://www.redalyc.org/pdf/621/62123051012.pdf [ Links ]
Morales, M. E. J., Morales-Rosales, E. J., Díaz-López, E., Cruz-Luna, A. J., Medina-Arias, N., & Guerrero-De la Cruz, M. (2015). Tasa de asimilación neta y rendimiento de girasol en función de urea y urea de liberación lenta. Agrociencia, 49(2), 163-176. Retrieved from http://www.scielo.org.mx/scielo.php?script=sci_arttext&pid=S1405-31952015000200005 [ Links ]
Nassi, D. N., Roncucci, N. N., Triana, F., Tozzini, C., & Bonari, E. (2011). Productivity of giant reed (Arundo donax L.) and miscanthus (Miscanthus x giganteus Greef et deuter) as energy crops: growth analysis. Italian Journal of Agronomy, 6(3), 141-147. doi: 10.4081/ija.2011.e22 [ Links ]
Ortiz-Solorio, C. A. (2019). Edafología. México: Editorial Trillas. [ Links ]
Pereira, C., Storck, L., Lopes, S., Martin, T. N., & Bisognin, D. A. (2016). Dry biomass and glycosides yield from Stevia rebaudiana leaves under different harvesting times. Bioscience Journal, 32(6), 1462-1471. doi: 10.14393/BJ-v32n6a2016-31574 [ Links ]
Pommerening, A., & Muszta, A. (2016). Relative plant growth revisited: Towards a mathematical standardisation of separate approaches. Ecological Modelling, 320, 383-392. doi: 10.1016/j.ecolmodel.2015.10.015 [ Links ]
Quero, J. L., Villar, R., Marañón, T., Zamora, R., Vega, D., & Sack, L. (2008). Relating leaf photosynthetic rate to whole-plant growth: drought and shade effects on seedlings of four Quercus species. Functional Plant Biology, 35(8), 725-737. doi: 10.1071/FP08149 [ Links ]
Rather, H. A., Singh, S., Suhail, B., & Patel, G. (2019). Stevia (Meethi Patti) as an alternative form of sugar. Journal of Drug Delivery and Therapeutics, 9(2), 453-457. Retrieved from https://www.researchgate.net/publication/332256012_Stevia_Meethi_Patti_as_an_alternative_form_of_sugar [ Links ]
Rincón, G. N., Olarte, Q. M. A., & Pérez, N. J. C. (2012). Determinación del área foliar en fotografías tomadas con una cámara Web, un teléfono celular o una cámara semiprofesional. Revista Facultad Nacional de Agronomía Medellín, 65(1), 6399-6405. Retrieved from http://www.redalyc.org/articulo.oa?id=179924340010 [ Links ]
Romero-Figueroa, J. C., Rodríguez-Mendoza, M. N., Escalante-Estrada, J. A. S., Gutiérrez-Castorena, M. C., Peña-Valdivia, C. B., Cueto-Wong, J., & Burguete-Hernández, E. (2017). Dinámica de crecimiento de Stevia cultivada en sustratos orgánicos en invernadero. Revista Fitotecnia Mexicana, 40(3), 341-350. Retrieved from https://www.revistafitotecniamexicana.org/documentos/40-3/11r.pdf [ Links ]
Sampaio, B. L., Edrada-Ebel, R. A., & Da Costa, F. B. (2016). Effect of the environment on the secondary metabolic profile of Tithonia diversifolia: a model for environmental metabolomics of plants. Scientific Reports, 6, 1-14. doi: 10.1038/srep29265 [ Links ]
Servicio Meteorológico Nacional (SMN). (2010). Información climatológica por estado. Retrieved June 2, 2017 from http://smn.cna.gob.mx/es/informacion-climatologica-ver-estado?estado=hgo [ Links ]
Soejima, A., Tanabe, A. S., Takayama, I., Kawahara, T., Watanabe, K., Nakazawa, M., … Yahara, T. (2017). Phylogeny and biogeography of the genus Stevia (Asteraceae: Eupatorieae): an example of diversification in the Asteraceae in the new world. Journal of Plant Research, 130(6), 953-972. doi: 10.1007/s10265-017-0955-z [ Links ]
Tholl, D., Chen, F., Petri, J., Gershenzon, J., & Pichersky, E. (2005). Two sesquiterpene synthases are responsible for the complex mixture of sesquiterpenes emitted from Arabidopsis flowers. Journal Plant, 42(5), 757-771. doi: 10.1111/j.1365-313X.2005.02417.x [ Links ]
Van Reeuwijk, L. (2002). Procedures for soil analysis (6th. ed.). The Netherlands: International Soil Reference and Information Centre-Food and Agriculture Organization of the United Nations. Retrieved from https://www.isric.org/sites/default/files/ISRIC_TechPap09.pdf [ Links ]
Villavicencio, M. A., & Pérez, E. B. (2006). Plantas útiles del estado de Hidalgo (1.a ed.) Pachuca, México: Universidad Autónoma del Estado de Hidalgo. [ Links ]
Villagómez-Flores, E., Hinojosa-Espinosa, O., & Villaseñor, J. L. (2018). The genus Stevia (Eupatorieae, Asteraceae) in the state of Morelos, Mexico. Acta Botánica Mexicana, 125, 1-35. doi: 10.21829/abm125.2018.1315 [ Links ]
Wahid, A. M., Farooq, I., Hussain, R., Rasheed R., & Galani S. (2012). Responses and management of heat stress in plants. In P. Ahmad & M. N. V. Prasad (Eds.), Environmental adaptations and stress tolerance of plants in the era of climate change (pp. 135-137). New York, USA: Springer. [ Links ]
Waterman, P. G., & Mole, S. (1994). Analysis of phenolic plant metabolites (Methods in Ecology). Oxford, UK: Blackwell Scientific Publications. [ Links ]
Wright, I. J., Reich, P. B., & Westoby, M. (2001). Strategy shifts in leaf physiology, structure and nutrient content between species of high- and low-rainfall and high- and low-nutrient habitats. Functional Ecology, 15(4), 423-434. doi: 10.1046/j.0269-8463.2001.00542.x [ Links ]
Zaman, M. M., Chowdhury, M. A. H., & Chowdhury, T. (2015). Growth parameters and leaf biomass yield of stevia (Stevia rebaudiana, Bertoni) as influenced by different soil types of Bangladesh. Journal of the Bangladesh Agricultural University, 13(1), 31-37. doi: 10.3329/jbau.v13i1.28708 [ Links ]
Zhao, Y. H., Jia, X., Wang, W. K., Liu, T., Huang, S. P., & Yang, M. Y. (2016). Growth under elevated air temperature alters secondary metabolites in Robinia pseudoacacia L. seedlings in Cd- and Pb-contaminated soils. Science of the Total Environment, 565, 586-594. doi: 10.1016/j.scitotenv.2016.05.058 [ Links ]
Recibido: 06 de Abril de 2019; Aprobado: 16 de Enero de 2020











 text in
text in 


