Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Chapingo serie ciencias forestales y del ambiente
On-line version ISSN 2007-4018Print version ISSN 2007-3828
Rev. Chapingo ser. cienc. for. ambient vol.16 n.2 Chapingo Jul./Dec. 2010
https://doi.org/10.5154/r.rchscfa.2010.04.022
La lluvia ácida y los ecosistemas forestales
Acid rain and forest ecosystems
D. Granados Sánchez; G. F. López Ríos; M. Á. Hernández García
División de Ciencias Forestales, Universidad Autónoma Chapingo. km 38.5 Carr. México–Texcoco. Chapingo, Estado de México. C. P. 56230. MÉXICO.
Recibido: 21 de abril, 2010
Aceptado: 27 de abril, 2010
RESUMEN
Por efecto de la civilización industrial y del desarrollo tecnológico de nuestros tiempos, se origina la "lluvia ácida", que es la precipitación en forma de lluvia, nieve, aguanieve, granizo o niebla con altas concentraciones de ácido sulfúrico (H2SO4), ácido nítrico (HNO3) y ácido carbónico (H2CO3). El aumento de la lluvia ácida ha tenido efectos considerables en los ecosistemas: los bosques del mundo se están muriendo y sus cuerpos de agua no pueden sostener a las poblaciones normales de peces. Asimismo, disminuye el rendimiento agrícola y se corroen el mármol, metal y piedra en las ciudades.
Palabras clave: bosques, contaminación industrial, suelos forestales.
ABSTRACT
The industrial civilization and technological development of our times has given birth to "acid rain," which is precipitation in the form of rain, snow, sleet, hail or fog with high concentrations of sulfuric acid (H2SO4), nitric acid (HNO3) and carbonic acid (H2CO3). The increase in rain acid has had significant effects on ecosystems: the world's forests are dying and their water bodies cannot sustain normal fish populations. It also reduces crop yields and corrodes marble, metal and stone in cities.
Keywords: forests, industrial pollution, forest soils.
INTRODUCCIÓN
El término lluvia ácida fue utilizado por primera vez por Robert Angus Smith, quien investigaba la química del aire de las industrias británicas en 1850. Los molinos de algodón y las poderosas industrias pesadas que funcionaban gracias al carbón, vertían grandes cantidades de humo a la calle. Smith demostró que estas fábricas hacían emisiones directas al aire de hollín y sustancias que cambiaban la química de la lluvia haciéndola más ácida. Al Anal de 1950 fueron detectados los resultados de esta contaminación proveniente de las industrias por el incremento que presentó en la atmósfera, haciéndose evidente por el efecto adverso en los bosques. Aunque esta forma de contaminación es comúnmente conocida como lluvia ácida, el término más adecuado es deposición ácida, porque la acidez puede ser liberada como gas o como polvo, y estas partículas son arrastradas a la tierra por medio de la lluvia (Hendrey y Vertucii, 1980; Last y Nichoison, 1982; Torres y Galván, 1999).
Por mucho tiempo se pensó que el problema de la lluvia ácida era consecuencia, en gran parte, de los gases ricos en azufre producidos por la quema de algunos combustibles fósiles (especialmente de carbones de pobre calidad) y por la fundición de minerales metálicos. Ahora sabemos que esta descripción está muy lejos de ser así de simple (Miranda et al., 2009; Fleischer et al., 1993).
El estudio de los compuestos de azufre suele limitarse al gas dominante, el bióxido de azufre (SO2), que es el más perjudicial para las plantas. Las principales fuentes emisoras son la combustión de combustibles fósiles, la descomposición e incineración de materia orgánica, los volcanes y los aerosoles marinos. El SO2 se oxida fácilmente en la atmósfera y se convierte en SO3, un gas muy reactivo que reacciona con el agua y da ácido sulfúrico (H2SO4), uno de los principales responsables de la lluvia ácida, fenómeno que ha causado importantes daños en las masas forestales y en los ecosistemas (Newman, 1995).
Los óxidos de nitrógeno (NOx) se producen de procesos tales como la actividad bacteriana del suelo, las erupciones volcánicas, los relámpagos y la combustión de combustibles fósiles, tanto en fuentes estacionales como en automóviles. El bióxido de nitrógeno (NO2) puede transformarse en la atmósfera en ácido nítrico (HNO3), responsable, junto al ácido sulfúrico, de la lluvia ácida (Last y Nichoison, 1982).
Cuando estos contaminantes se combinan con vapor de agua, luz solar y oxígeno en la atmósfera, crean una "sopa" diluida de ácidos sulfúrico y nítrico. Una vez que esta mezcla es arrastrada por las lluvias, o en forma de partículas secas, aumenta la acidez de los lagos y arroyos de agua dulce (y en algunos casos del suelo), reduciendo así el valor de su pH. La escala pH mide la acidez y la alcalinidad. Una solución con un pH 7 es neutra, cualquier valor superior es alcalino y los valores inferiores son ácidos. Es una escala logarítmica, por lo que cada entero es equivalente a un factor de 10. Así, un pH 6 es diez veces más ácido que un pH neutro, y un pH 5 cien veces más (Blank et al., 1988).
La controversia acerca del efecto de la deposición ácida surgió cuando crecieron las concentraciones de ésta en los lagos, ríos y bosques. En algunas regiones fuertemente industrializadas, los gases de cloruro de hidrógeno liberados a la atmósfera producen ácido clorhídrico, que también puede ser un componente de lluvia ácida. Por todo ello, los ambientalistas han hecho un exitoso debate al hacer de la lluvia ácida un asunto de interés nacional e internacional (Minoura, y Iwasaka. 1996).
Génesis de la lluvia ácida
Ciclos del ácido atmosférico. El bióxido de azufre gaseoso, componente del ciclo del azufre, y los óxidos de nitrógeno, del ciclo del nitrógeno, se combinan en la atmósfera, así como los óxidos de carbono. La lluvia ácida y la nieve ácida se forman cuando estos gases contaminantes, los óxidos de azufre, de nitrógeno y de carbono, se combinan con el agua, teniendo como acelerador de las reacciones a la luz solar. Los óxidos de azufre se convierten en ácido sulfúrico (H2SO4), los óxidos de nitrógeno en ácido nítrico (HNO3) y el bióxido de carbono en ácido carbónico (H2CO3). Parte de esta mezcla, que vuelve a la tierra como finas partículas (sulfatos y nitratos), se conoce como deposición seca. Una porción mayor es transportada lejos de la fuente, y la dirección que toma depende en gran medida de la circulación atmosférica general. Durante su transporte por la atmósfera, el SO–2 y el NO2, y sus productos de oxidación, participan en reacciones complejas que incluyen al monóxido de cloro y otros compuestos, además del oxígeno y el vapor de agua. Estas reacciones producen ácidos fuertes, principalmente ácido nítrico y ácido sulfúrico, que se diluyen en vapor de agua, para anualmente caer a la tierra en forma de lluvia ácida, nieve y niebla, fenómeno que se conoce como deposición húmeda. La lluvia ácida se forma a través de las siguientes reacciones fotoquímicas (Kotz et al., 2008):

El agua de lluvia no contaminada, considerada agua pura, tiene un pH de 5.6, pero raramente llueve agua pura. Incluso en regiones no sometidas a contaminación industrial, la humedad atmosférica se ve expuesta a cantidades variables de ácidos de origen natural; de este modo las precipitaciones tienen un pH de alrededor de 5. Sin embargo, en las regiones que se extienden alrededor de centros de actividad humana, y que pueden llegar a cientos de kilómetros, el pH de la precipitación es más bajo, de 3.5 a 4.5 o aun menor ocasionalmente (Mohnen, 1988; Minoura, y Iwasaka. 1996).
La precipitación húmeda es más conocida por ser la causante de la acidificación en el medio, dejando muchas veces a un lado las precipitaciones secas. Este tipo de deposición tiene lugar cuando los compuestos gaseosos precursores de la lluvia ácida entran en contacto con el vapor de agua, la luz y el oxígeno de la atmósfera, y se forma una mezcla de ácido sulfúrico y ácido nítrico. Después de estos procesos y de estas reacciones catalíticas iniciadas en forma fotoquímica en la atmósfera, esta mezcla viaja muchos kilómetros, precipitándose y cayendo al medio en forma de deposición húmeda. El ácido producto de este proceso, se deposita en solución en el terreno y los vegetales durante las precipitaciones atmosféricas. El proceso de generación de las precipitaciones ácidas húmedas sigue, entonces, dos etapas:
Etapa fotoquímica: Esta ocurre en fase gaseosa. El bióxido de azufre y el óxido de nitrógeno se oxidan a trióxido de azufre (SO3) y bióxido de nitrógeno (NO2), respectivamente, gracias a la energía proporcionada por la radiación ultravioleta del Sol y por demás agentes oxidantes de la atmósfera.
Etapa catalítica: Tiene lugar en fase líquida y consiste en la transformación del SO2 original en ácido sulfúrico (H2SO4), por disolución acuosa, siendo catalizada principalmente por la reacción con sales de hierro y de manganeso presentes en las gotas de agua. Parte de este ácido es neutralizado en la atmósfera por el amoniaco, originándose iones amonio (NH4+); el resto aparece disuelto en las gotas de lluvia, acidificándola, en forma de iones sulfato (SO4–2) y de iones hidrógeno. A partir de aquí se forman los ácidos ya mencionados.
Estos contaminantes así precipitados son después transportados por ríos, lagos y océanos, evaporándose a la atmósfera y formando nubes que viajan empujadas por el viento, pudiendo así alcanzar casi cualquier lugar sobre la superficie terrestre. Los contaminantes como bióxido de azufre, óxido nitroso y en un grado menor los cloratos, pueden unirse al smog y a las partículas de polvo y caer como polvo ácido cerca de las fuentes que los emiten, o pueden permanecer en la atmósfera como gas. La lluvia es naturalmente ácida a causa de que es disuelta por el dióxido de carbono en su descenso a través del aire. La deposición húmeda ocurre cuando los compuestos de SOx y NOx son residentes por tanto tiempo en el aire como para combinarse con la humedad para formar ácidos sulfúrico y nítrico diluidos (Bush, 1997).
Estos ácidos están en la lluvia, en la nieve y en el aire. El bióxido de azufre y el óxido nitroso son producidos en forma natural por los volcanes. Los sulfuros atmosféricos fueron los primeros sustratos para metabolizar las primeras reacciones fotosintéticas hace 3.5 billones de años. El bióxido de azufre y los óxidos nítricos son gases raros que encontramos de forma natural en la atmósfera, pero las actividades humanas del siglo pasado hicieron que sus concentraciones se incrementaran en gran proporción, a partir de que se empezó a quemar el combustible fósil. Los óxidos de nitrógeno están relacionados con la combustión de la gasolina, y a pesar de la tecnología de los convertidores catalíticos, mofles, tuberías y escapes a la atmósfera, la emisión de los vehículos es hoy la fuente más importante de emisión de gases (Graveland et al., 1994).
El carbón es el resultado de la fosilización de plantas de pantano que murieron durante el período carbonífero. Los pantanos son ricos en bacterias descomponedoras que producen sulfuros de hidrógeno. A pesar de la actividad de las bacterias, las plantas se derrumbaron dentro de los pantanos donde no se degradaron completamente, y se acumularon como turba orgánica. A través del tiempo la turba se convirtió en carbón, y durante los procesos de fosilización los sulfuros provenientes de los cuerpos de las plantas se transformaron en moléculas de carbón. Sin embargo, hay un tipo de carbón que se conoce como carbón bajo en sulfuro (1 %). Cuando los restos de sulfuro en el carbón son quemados se transforma en bióxido de azufre (Schwartz, 1989).
El bióxido de sulfuro no es un gas reactivo, pero es soluble en agua y de esta forma no se acumula en la atmósfera. Dentro de un periodo entre los 7 y los 14 días, el bióxido de azufre que está en la atmósfera se disuelve con el vapor de agua. La lluvia lava el bióxido de sulfuro que no se ha disuelto, y las grandes cantidades de esta sustancia crean una solución de ácido sulfúrico. Aunque la lluvia ácida puede ser producida por causas naturales, tales como las erupciones volcánicas o las dosis emitidas por la naturaleza de óxidos de azufre y nitrógeno, éstas quedan minimizadas por la contaminación industrial. Todos los años se liberan en el mundo alrededor de 100 millones de toneladas métricas de bióxido de azufre, de las cuales sólo Europa y Norteamérica contribuyen con 38 millones de toneladas. Asimismo, más de un 90 por ciento del azufre depositado se ha fabricado por el hombre. Los países pertenecientes a la Organización para la Cooperación y el Desarrollo Económico (OCDE) generan alrededor de 37 millones de toneladas métricas de óxidos de nitrógeno al año (Fleischer et al., 1993).
Transporte de ácido y sistemas de amortiguamiento. La lluvia ácida ha estado con nosotros desde hace bastante más de un siglo. En algunas zonas esta lluvia probablemente era peor que ahora, aunque estaba más localizada. Sólo cuando se construyeron las altas chimeneas en las plantas industriales y centrales térmicas para la producción de electricidad, las cuales enviaban las emisiones a capas más altas de la circulación atmosférica, empezó la lluvia ácida a convertirse en un problema regional e internacional. La zona industrial del medio oeste de Estados Unidos y el valle del río Ohio envían contaminantes atmosféricos ácidos al este de Canadá y al noreste de Estados Unidos; el este de Canadá los envía al noreste de Estados Unidos, y las regiones industrializadas del centro de Europa y del Reino Unido los envían a Escandinavia (Lindberg y Page, 1996).
Los problemas con el depósito de contaminantes ácidos se presentan generalmente cerca de la fuente que los origina; esto ayuda a localizar rápidamente sus causas. Los efectos envenenadores de los ácidos sobre la vegetación son generalmente fáciles de arreglar si se detectan a tiempo; un punto importante es la regulación de la contaminación. Los gases ácidos que se encuentran disueltos en la atmósfera representan diversos problemas. Las industrias que emiten estos gases actualmente tienen que instalar conductos que ayudan a que se dispersen más fácilmente. Esto consiste en que si la emisión de ácido es pequeña, antes de salir se mezcla con una gran cantidad de aire. Cuando la fuente principal de contaminación toma estas medidas, disminuyen enormemente los efectos de estos contaminantes. Otra forma de detectar de dónde vienen los contaminantes es seguir la dirección del viento, y por medio de esta acción saber cuál es la fuente contaminante. Como el viento se mueve de un área de mayor presión a una de menor y por medio de sistemas de presión, al bióxido de azufre emitido le lleva dos semanas transformarse a ácido sulfúrico, y en este tiempo los gases recorren una larga distancia.
Este flujo de nutrientes puede encontrar eventualmente su ruta dentro del curso del agua y causa una reproducción de algas, comparable a la eutrofización. Uno de los efectos de la acidificación a largo plazo es el incremento de la disponibilidad de algunos metales, especialmente el aluminio, al que muchas plantas y animales encuentran tóxico en concentraciones significativas. Los lagos escandinavos han sufrido particularmente de acidificación. Las direcciones predominantes del viento implican que esta área reciba mucha de la contaminación atmosférica del noroeste y centro de Europa. La región está dominada por bosques de coníferas y de suelos delgados, con poca capacidad para amortiguar la acidez que entra. El resultado ha sido un gran número de lagos carentes de peces y muchos de los bosques quemados y moribundos. Finlandia y Noruega han tenido que recurrir, como último recurso, a agregar grandes cantidades de cal a estos ecosistemas para protegerlos o restaurarlos (Blank et al., 1988; Lindberg y Page, 1996).
La acidez de los ecosistemas naturales. El agua es importante para la mayor parte de las formas de vida; es el medio en el cual se llevan a cabo muchas de las reacciones químicas. El pH del agua local puede tener un efecto directo en el pH de los fluidos del cuerpo de un organismo y de esta forma puede afectar la velocidad de las reacciones químicas dentro del cuerpo. Por lo tanto, la gran mayoría de los organismos son altamente susceptibles a los cambios en el pH de su alrededor o al suministro de agua (Bush, 1997).
La mayor parte de los sistemas naturales son ligeramente ácidos, lo cual se debe al vapor de agua atmosférico que se está combinando con las moléculas de bióxido de carbono para formar una solución débil de ácido carbónico. La vida terrestre y acuática evolucionó para tratar con esta suave acidez como la entrada normal del agua a un sistema. Sin embargo, el pH del agua es usualmente modificado antes de ser absorbida por las raíces de las plantas. Las rocas que proporcionan el componente mineral de un suelo pueden por sí mismas ser ácidas o alcalinas, una propiedad que es reflejada en el suelo. Si las rocas son de un pH neutral, o resistentes a la erosión, ya que pueden aportar muy poca entrada de minerales, los suelos podrían ser ácidos (Espinosa, 1996; McLaughlin, 1985).
La acidez del suelo también puede ser afectada por la proporción de materia orgánica que es descompuesta, ya que al ser degradada se liberan ácidos. Consecuentemente, los suelos que son ricos en materia orgánica tienden a tener un pH bajo. Ejemplos de suelos acidificados por material orgánico son las turbas de tierras húmedas y los suelos del bosque tapizados de agujas de pinos o de abetos. Como la lluvia se percuela hacia abajo a través de un suelo ácido, éste absorbe los iones de hidrógeno libres que hacen al suelo ácido. El agua del suelo es entonces mas ácida que la lluvia, y las raíces de las plantas pueden estar rodeadas por agua con un pH 4 o uniformemente bajo (García, 2006).
Donde la geología es alcalina, como en el yeso o la piedra caliza rica en carbonatos, el agua del suelo puede ser deficiente en iones de hidrógeno libres y rica en iones hidróxido (OH–). Consecuentemente, el suelo y el agua del suelo pueden tener un pH tan alto como de 8 o 9, proporcionando condiciones alcalinas de vida para todos los organismos de aquella área. De este modo, aunque el agua de lluvia limpia que cae en sus hojas tiene un pH de 5.6, las plantas deben competir con un suministro de agua que puede ser considerablemente más ácido o alcalino (Cuadro 1).

La temperatura, la disponibilidad del agua y la acidez del suelo son los principales ejemplos de gradientes medioambientales. La mayor parte de las especies puede prosperar solamente bajo un estrecho rango de pH.
Efecto de la deposición de ácido en los bosques
La deposición ácida es un problema regional de contaminación, y se necesitan acuerdos internacionales para limitar las concentraciones atmosféricas. Sin control, las emisiones de las plantas de fuerza motriz y de los vehículos de motor causan un daño considerable a los bosques, lagos y ríos. No solamente hacen la deposición ácida al agregar grandes cantidades de azufre y nitrógeno a estos sistemas, sino que el descenso en el pH también incrementa la disponibilidad de algunos metales tóxicos (Miranda, et al., 2009).
En la Cuenca Aérea de la Ciudad de México (CACM), durante las épocas de invierno e inicios de primavera (periodo seco), se ha encontrado que las concentraciones promedio de la deposición seca (µ·m–3) de contaminantes de N fueron de 1.7 ± 1.4 para nitrato, 1.3 ± 0.8 para amonio y 1.5 ± 0.8 para ácido nítrico (HNO3). Las concentraciones promedio de S fueron de 2.8 ± 1.7 y 3.8 ± 2.4 µ·m–3 para sulfato y SO2 (Bravo et al., 2002). Las concentraciones de sulfato fueron similares a las encontradas en muchas partes de Europa (aunque bajas en relación con las de las regiones más contaminadas), pero las concentraciones de nitrato fueron mayores que para la mayor parte de Europa, aunque las concentraciones de nitrato y amonio fueron similares a las del área forestal de Czech (Fenn et al., 2002). Las concentraciones de bióxido de azufre fueron altas, lo que indica emisiones significativas en la Ciudad de México (Cruz et al., 2008).
Los datos del Desierto de los Leones (DL) sugieren que las concentraciones atmosféricas de sulfato y SO2 fueron mayores que para los contaminantes análogos de NOx, y HNO3. Sin embargo, si se incluyen las concentraciones atmosféricas de amonio y amoniaco, la carga atmosférica total de compuestos de nitrógenio inorgánico probablemente sea mayor que la carga atmosférica total de contaminantes de azufre inorgánico. Los reportes oficiales indican que las emisiones de SO2 en la CACM se han reducido en aproximadamente un 45 % en comparación a 1993, como resultado del uso de combustible diesel más limpio y la reducción de fuentes de energía contaminante por la industria, mientras que las emisiones de NOx han permanecido relativamente constantes desde 1989 (Fenn et al., 2002).
Los flujos de deposición seca de nitrato y sulfato hacia superficies locales fueron significativamente mayores en el Desierto de los Leones en comparación con el cerro del papayo sitio Zoquiapan (ZOQ), de acuerdo con las repetidas mediciones del Análisis de Varianza (Figura 1). Sin embargo, los flujos de sulfato fueron similares en ambos sitios en las dos últimas colectas de datos. Los flujos de amonio no fueron significativamente diferentes entre los dos sitios, debido presumiblemente a que las emisiones de combustible fósil con contaminantes de N, la principal fuente de contaminación en la Ciudad de México, son dominadas por compuestos de N oxidados. Los flujos de deposición de nitrato fueron en promedio del doble que los flujos de sulfato.

La deposición húmeda está compuesta de la deposición seca, la cual es removida o lavada de la atmósfera. Los datos de deposición húmeda son de valor limitado como una medida de la deposición atmosférica total hacia un bosque, debido a que incluye sólo una pequeña fracción de los contaminantes depositados en seco, que son con frecuencia la mayor entrada por deposición. El dosel forestal tiene una mayor área superficial que sirve como receptor efectivo para los contaminantes atmosféricos, especialmente los depositados en seco y los depositados con la niebla (Fenn et al., 2002).
La deposición húmeda como problemática comenzó en 1987 en una red de sitios urbanos. Datos independientes de los datos de inicios de los años ochenta del siglo XX, en seis sitios rurales de monitoreo, incluyendo el Desierto de las Leones y nueve sitios urbanos, demostraron la mucho mayor importancia de la deposición de azufre en comparación con la de nitrógeno en la CACM. En los sitios urbanos las concentraciones de sulfato fueron, en promedio, 3.9 veces mayores que las concentraciones de nitrato, aunque para 1997 se redujo a 1.8. Durante este espacio de tiempo, las concentraciones de nitrato en la precipitación aumentaron en 39 % y las de sulfato se redujeron en 33 %. El aumento en la deposición de nitrógeno se debe al creciente número de vehículos de motor en la CACM, y la reducción en la deposición de azufre se atribuye a las regulaciones que exigen el uso de fuentes de combustible industrial más limpias y de diesel con un contenido máximo de azufre de 0.005 %. No obstante, la deposición de azufre permanece alta en relación con la de nitrato y en comparación con muchas otras regiones forestales (Fenn et al., 2002).
La deposición anual por la lluvia a través del follaje de N (como amonio y nitrato) y de S (como sulfato) inorgánico en el Desierto de los Leones fue de 18.5 y 20.4 kg·ha–1. Los valores análogos en Zoquiapan (ZOQ) fueron de 5.5 y 8.8 kg·ha–1–año–1 (Fenn et al., 2002). La deposición de nitrógeno y azufre en el Desierto de los Leones fue relativamente alta comparada con muchos bosques del mundo, lo cual era esperado considerando las elevadas emisiones de óxidos de nitrógeno y azufre en la Ciudad de México. Las entradas anuales de precipitación fueron de 1,455 mm en el Desierto de los Leones y de 778 mm en Zoquiapan. Los patrones de deposición acumulada de nitrato y amonio se compararon con el volumen de la precipitación acumulada en el Desierto de los Leones, pero en Zoquiapan la deposición de nitrato y amonio fue menos sensible, encubriendo la tendencia de la precipitación acumulada. La tendencia de la deposición acumulada de sulfato generalmente siguió la huella de la precipitación acumulada en ambos sitios (Fenn et al, 1999; citado por Fenn et al., 2002).
La deposición de azufre por la lluvia a través del follaje generalmente se considera que es una estimación razonable de la deposición total de azufre en un bosque. Sin embargo, muchos estudios demuestran que de un 20 a 40 % del nitrógeno atmosférico depositado en un bosque es retenido dentro del dosel y por tanto no determinado en los análisis de la precipitación a través del follaje. Asumiendo que esa significativa reducción de nitrógeno por el dosel también ocurrió en este estudio, la deposición total de nitrógeno en el bosque, expresada como biomasa (kg·ha–1), fue ligeramente superior que la deposición total de azufre. Así, la deposición de nitrógeno y azufre en el bosque, en el Desierto de los Leones, es de 10 a 20 veces mayor que los niveles medidos en los bosques con una mínima deposición atmosférica antropogénica, asumiendo que los niveles subterráneos de la deposición de nitrógeno y azufre en bosques relativamente conservados es de aproximadamente 1 a 2 kg·ha–1·año–1 (Fenn et al., 2002). La deposición de nitrógeno y azufre fue aproximadamente de tres a nueve veces mayor que los niveles subterráneos.
En estas condiciones, los efectos de la deposición atmosférica sobre el nivel de nutrientes en el bosque, sugieren que la deposición atmosférica de los contaminantes nitrógeno y azufre, puede tener efectos significativos sobre el ciclo de nutrientes y en la función del ecosistema. Un efecto posible de las entradas atmosféricas crónicas de nitrógeno es que puede conducir al mantenimiento de altos niveles de nitrógeno en el suelo y en la solución del suelo, lo cual a su vez puede sostener poblaciones activas de microorganismos en el ciclo del nitrógeno, tales como nitrificadores, y como resultado se estimulan las tasas de nitrificación. Las entradas en la deposición de nitrógeno y los suelos con alta actividad de nitrificación, junto con una baja proporción C : N (carbono : nitrógeno) en el suelo y en el mantillo, son los principales factores en el desarrollo de bosques en saturación de nitrógeno; estos bosques o la cuenca son altamente propensos a perder el nitrógeno en exceso como nitrato en las corrientes de agua (Fenn et al., 2002).
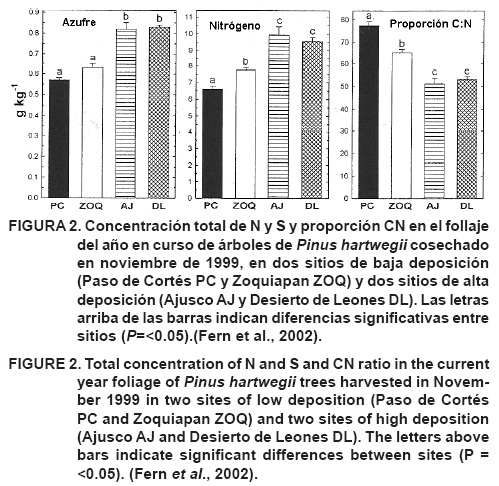
En relación con los indicadores foliares del status del N en el bosque, en un estudio previo se concluyó que, de acuerdo con el contenido total de N foliar y en las proporciones N : P, N : S y C : N, la fertilidad de N fue mayor en el DL que en ZOQ. Aunque las diferencias fueron estadísticamente significativas, las diferencias entre el DL y ZOQ no fueron tan dramáticas como las comparaciones entre los sitios de alta y baja deposición de N en las Montañas de San Bernardino (MSB). En cuatro análisis subsecuentes sobre el follaje del año, colectado en abril y noviembre de 1999, así como en enero y abril de 2000, las concentraciones de N en el follaje no fueron significativamente diferentes en los sitios de alta y baja deposición, excepto para la muestra de noviembre de 1999 (Figura 2), para la cual las concentraciones de N fueron aproximadamente 55 % inferiores que en los muestreos previos (Fenn et al., 2002).
Existe poca evidencia para mostrar que la lluvia ácida tiene un efecto directo sobre la mayoría de las plantas. La lluvia ácida, interceptada por la vegetación, lixivia nutrientes, particularmente el calcio, el magnesio y el potasio, de las hojas y las acículas. Tal lixiviación, un proceso normal en la circulación de los nutrientes, tiene efectos pequeños en la salud de los árboles, ya que éstos pueden reemplazar los nutrientes perdidos por absorción desde el suelo. Sin embargo, los bosques que se sitúan a elevadas alturas se encuentran frecuentemente envueltos por brumas y nieblas. Las gotitas de las nubes son más ácidas y contienen mayores concentraciones de otros contaminantes que la propia lluvia. Cuando están inmersas en una niebla, las coníferas con hojas aciculares peinan la humedad del aire y sus superficies húmedas permiten la absorción de los contaminantes que contiene. Una vez que se evapora el agua, ésta deja tras de sí altas concentraciones de contaminantes, algunos de los cuales son lavados durante la siguiente lluvia y caen al suelo. A esta deposición húmeda se suma la limpieza de la deposición seca que también también lixivia nutrientes de las hojas (Mohnen, 1988).
Entre los efectos que produce en los árboles de los ecosistemas forestales se encuentran: reducción del proceso fotosintético haciéndolo más lento (alteraciones como clorosis, defoliaciones y necrosis), modificación de la actividad enzimática, alteración del metabolismo de lípidos, proteínas y carbohidratos, reducción en la productividad de los bosques, disminución del crecimiento y baja producción de semillas viables, pérdida de resistencia a enfermedades. También lixivia y arrastra nutrientes del suelo como son el magnesio, el calcio y el potasio indispensables para la vida, libera el ion aluminio en el suelo, el cual es tóxico para todas las plantas (Godbold et al., 1988).
Los investigadores opinan que la lluvia ácida es una de las causas de la Waldsterben (muerte de los árboles) que afecta a más de la mitad de los bosques del norte de Europa. Se cree que la lluvia ácida es también uno de los principales causantes de la decadencia de los bosques suizos; un 43 % de las coníferas de la región central alpina están muertas o moribundas. La expansión de enfermedades de los árboles ha coincidido con un aumento de la contaminación atmosférica, causante del fenómeno conocido como lluvia ácida. Se ha calculado que la industria pesada europea desprende al año 55 millones de toneladas de dióxido de azufre y 37 millones de toneladas de óxidos de nitrógeno, que reaccionan con la humedad del aire, formando ácidos sulfúrico y nítrico (Arkley y Glauser, 1980).
La dificultad reside en lo circunstancial de la evidencia que relaciona la muerte de los árboles con la lluvia ácida. Durante mucho tiempo se culpó a la creciente acidez del suelo de los bosques. El agua acidificada se lleva importantes minerales del suelo del bosque y libera otros tóxicos, como el aluminio. Sin embargo, las zonas de mayor daño en los bosques no siempre se correlacionan con la intensidad de aportación de ácidos. Tampoco se ha podido corroborar la idea de que los contaminantes llevados por el aire dañan directamente a los árboles a través de las hojas, ya que todos los síntomas indican que la enfermedad afecta a todo el árbol, y no sólo a las hojas (Baltensweiler, 1985).
Sin embargo, el efecto de mayor seriedad es la movilización de elementos del suelo que, en cantidades mayores de lo normal, pueden llegar a tener toxicidad, entre ellos particularmente el aluminio y el magnesio, que se liberan de las partículas del suelo al ser reemplazadas por iones de hidrógeno. El aluminio afecta a la estructura y función de las raíces finas e interfiere con la absorción del calcio del suelo. También suprime el crecimiento del cambium en los árboles, que a su vez reduce la formación de albura nueva. A medida que disminuye la formación de la albura en las coníferas, la relación entre albura viva y duramen muerto disminuye. Cuando la albura representa menos del 25 por ciento de la sección transversal de un árbol, éste sucumbe y en consecuencia viene el declive del bosque.
Según una teoría que va ganando aceptación, los culpables son los óxidos de nitrógeno, que también se desprenden de los escapes de los vehículos. La mayoría de los árboles dependen mucho de los hongos que viven en las capas superficiales de sus raíces, en estructuras llamadas micorrizas. Los hongos obtienen vitaminas e hidratos de carbono del árbol, y éste recibe del hongo agua y minerales útiles. Si el exceso de nitrógeno en el aire (en forma de iones nitrato y amonio) daña a la micorriza, el árbol no crecerá bien y las raíces tenderán a pudrirse, especialmente en zonas donde el suelo está ya empobrecido (Grossman 1988).
El SO2 acarrea una gran variedad de efectos nocivos en las plantas, ya que reduce la fotosíntesis, modifica la actividad de ciertas enzimas y altera el metabolismo de los lípidos, proteínas y carbohidratos. A mayor escala, las alteraciones más frecuentes comienzan con la aparición de manchas lechosas en las hojas, que se vuelven rojizas cuando los síntomas se agudizan. Las lesiones a largo plazo se manifiestan por la aparición de clorosis en las hojas, así como por la disminución del crecimiento y de la producción de semillas viables en diversas especies. Un importante efecto negativo del SO2 es que favorece la aparición de mutaciones a consecuencia del incremento de la exposición a las radiaciones ultravioleta. Además, actúa en sinergia con el ozono y los NOx, lo que potencia sus efectos nocivos y agudiza las consecuencias posteriores de otros patógenos como insectos parásitos y hongos (Ulrich, 1983).
Además, las bajas concentraciones de NOx no suelen provocar efectos nocivos para las plantas, aunque conforme aumenta el tiempo de exposición comienzan a aparecer alteraciones como defoliaciones y clorosis. Como efecto de las exposiciones de varios días se observan necrosis, e incluso pueden llegar a anular el crecimiento de plantas sensibles cuando el contacto con los NOx es muy prolongado (Adams, 1988).
Lluvia ácida, plagas y enfermedades. Recientes estudios han demostrado que los contaminantes químicos interactúan para producir un sinergismo de destrucción. El ataque de insectos y de áfidos se ha tomado como una explicación alternativa, por los políticos industriales, ante la amplia propagación de la mortalidad de los árboles en los bosques. Ciertamente, en los últimos años se ha observado una aparición repentina de áfidos y de polillas en los árboles de los Montes Apalaches. Los áfidos succionan los productos fotosintéticos de sus hospederos y provocan un gran número de muertes en los árboles; un daño similar es causado por las orugas de las mariposas polillas o gitanas, que resulta en la defoliación de todas las laderas.
Sin embargo, la declinación de los árboles no puede ser considerada solamente en términos de un incremento en la acción depredatoria, ya que el bosque debe su principal debilitamiento a la contaminación química del ambiente, y entre los contaminantes se encuentra la lluvia ácida, pues tiene un efecto que debilita y hace muy vulnerables a los árboles al ataque de plagas y enfermedades. La muerte de los árboles sigue un patrón que es consistente con áreas de altas concentraciones de ozono, deposición ácida significativa y la ausencia de un amortiguador químico natural. Si la salud del bosque está siendo reducida por la fricción química, los insectos pueden estar simplemente apresurando la muerte de un hospedero ya debilitado (Baltensweiler, 1985).
Suelos y lluvia ácida
Los efectos de la lluvia ácida estarían mucho más extendidos si la naturaleza no hubiera previsto a muchas áreas con su propia protección. Los suelos alcalinos pueden resistir la lluvia ácida porque el calcio de sus suelos neutraliza, o "tampona", los ácidos. La lluvia ácida altera también el contenido en nutrientes de los suelos forestales. Lixivia y arrastra nutrientes fundamentales de los suelos, tales como el potasio, el calcio y el magnesio, privando a los árboles y otra vegetación de estos elementos básicos para la vida. Si no hay una cantidad suficiente de nutrientes en el suelo, los árboles se vuelven más susceptibles a las agresiones climáticas como las heladas y los daños invernales, así como a los daños producidos por otros contaminantes (Abrahamsen y Stuanes 1986).
En algunas áreas el suelo contiene suficientes iones de calcio, lo que le brinda alcalinidad como un potencial amortiguador para el incremento de la acidez. Si la acción amortiguadora es lo bastante fuerte, el pH del suelo puede permanecer a pesar de la deposición de ácido. Este amortiguador se da por la clase de minerales que tenga el suelo con una carga eléctrica negativa, que se opone a la carga de los iones positivos. La resistencia de esta carga negativa es llamada capacidad de intercambio catiónico (CIC). En este proceso el problema es el intercambio, ya que el balance de los iones entre los suelos cambia, los iones que están en la superficie de los suelos arcillosos pueden cambiar. Existe una jerarquía de reemplazamiento entre los iones: el aluminio es el ion difícil de desalojar, le sigue el hidrógeno, después el calcio, el magnesio y el potasio.

De esta manera, cuando los iones de hidrógeno se adhieren al suelo pueden liberar calcio en la superficie del suelo. La absorción del ion hidrógeno por las arcillas favorece que cambien las reacciones químicas del suelo, y el potencial a transformarse en ácido se ve disminuido.
La jerarquía antes mencionada hace que los iones para el CIC sean igualmente importantes, pero el orden de este sistema se rompe si uno de ellos, por ejemplo el hidrógeno, se presenta en una concentración mayor con relación a los otros. Si hay insuficiencia de calcio en el suelo, éste puede llegar a ser ácido; si se incrementan los iones hidrógeno en él, son más vulnerables a los efectos de la lluvia ácida (Newman, 1995).
La precipitación ácida tiene su mayor impacto en suelos que son pobres en cationes y que presentan un escaso taponamiento. Tales suelos, la mayoría podsólicos y derivados en gran parte de lechos graníticos, ubicados en bosques de coníferas son muy sensibles a los ácidos. En estas regiones, los ecosistemas terrestres son pobres en nutrientes y sus suelos ácidos. Con el tiempo la precipitación ácida puede tener efectos adversos, puesto que aumenta la lixiviación del calcio, magnesio y potasio del suelo que la recibe y reemplaza estos cationes por iones de hidrógeno, aumentando aún más la acidez del suelo. La precipitación ácida puede reducir la solubilidad y disponibilidad de fósforo y la tasa de fijación del nitrógeno. Si la tasa de lixiviación supera la reposición de estos nutrientes por la meteorización de la corteza terrestre, la precipitación ácida altera el balance de nutrientes de los árboles y de otros tipos de vegetación. Además, la lluvia ácida puede inhibir la actividad de los hongos y bacterias del suelo, con lo cual reduce las tasas de producción de humus, la mineralización y la fijación de nutrientes. Todas estas interacciones causan suelos deficientes en nutrientes.
Cuando el suelo incrementa sus niveles de acidez, surge un gran número de iones de hidrógeno libres, y el sitio ocupado por el aluminio es ocupado por hidrógeno. Este reemplazo de iones representa un fuerte impacto local en el ecosistema porque el aluminio puede ser un veneno potencial. Si el aluminio se combina con el oxígeno se transforma en óxido de aluminio, que produce un daño menor; pero si se encuentra como ion libre, es venenoso. Los iones libres de aluminio se relacionan con la acidificación del suelo, y son altamente tóxicos para las plantas y animales. De esta manera se incrementa la acidez del suelo y se incrementan las toxinas que pueden matar árboles, y si están cerca de cuerpos de agua son acarreados hasta allí por la lluvia, envenenándose así ríos y lagos. Esta acidez también afecta enormemente los procesos de descomposición que se llevan a cabo en el suelo y por consiguiente limitan la transformación de nutrientes para las plantas, lo cual repercute en la producción primaria neta, que se verá reducida.
La causa del lento proceso de descomposición se debe a un incremento del aluminio en el suelo y al exceso de acidez. Este factor limita el crecimiento de las plantas y afecta las micorrizas de los hongos que viven de manera simbiótica en las raíces de los árboles y, consecuentemente, mueren por no poder absorber nutrientes, ya que éstos también se ven afectados en sus procesos químicos. Por estas razones, la acumulación de nutrientes en los suelos ácidos es un signo seguro de que la productividad está fallando (Young et al., 1988).
Los árboles resienten los efectos negativos que tiene la lluvia ácida en el suelo. Mientras se acumulan los contaminantes en la atmósfera, el agua se vuelve más ácida, lo que la hace tener un pH mas bajo. El exceso de acidez afecta directamente la producción de clorofila y reduce la capacidad fotosintética de la planta; la planta utiliza un amortiguador interno, el calcio, que neutraliza la acidez. El aluminio es un químico importante en la depositación de ácido, pero no es el único agente tóxico que las afecta. Otras toxinas pueden ser el cadmio, cobre, zinc y arsénico, los cuales pueden estar relacionados con el incremento de la acidez. El sitio en que se encuentre depositado el ácido, en cascadas o suelos, no indica que sea un amortiguador efectivo para la reducción del pH en ellos. Más específicamente, se encuentran muchas áreas gravemente afectadas por la lluvia ácida; las que están cerca de los contaminantes son especialmente vulnerables, e incrementan sus rangos de mortalidad por los siguientes factores (Abrahamsen y Stuanes, 1986):
• La formación de neblina en las tierras altas puede disolver contaminantes y de esta forma los árboles se rodean con vapor de agua ácida, con un pH de 3.5.
• La lluvia ácida mata las micorrizas de los hongos que viven en las raíces de los árboles y reduce la absorción de nutrientes.
Las entradas de nitrógeno y azufre tienen un efecto de fertilización en algunos ecosistemas. Las entradas de nitrógeno desde el aire representan un incremento del 500 % sobre el fondo, con lo que conducen a la floración en algunas comunidades de plantas, en aquellas áreas donde el abastecimiento de nutrientes es escaso. Desafortunadamente, mientras que las plantas pueden llegar a florecer, se continúan rápidamente otros cambios. Muchas plantas que crecen en suelo arenoso o yesoso cuentan con la lluvia como su fuente principal de nutrientes y están así adaptadas a niveles bajos de nutrientes. La abundante presencia de nitrógeno significa que otras especies pueden invadir y competir externamente con la flora nativa. Los pastizales pobres en nutrientes y los matorrales pueden cambiar, especialmente aquellos cercanos a las principales fuentes de nitrógeno, parecidos a los que tienen caminos densamente traficados. La lluvia ácida daña a los ecosistemas no solamente a causa de los nutrientes que agrega, sino también debido a su acidez, a la entrada de iones reactivos de hidrógeno. Generalmente la acidificación del suelo moviliza los nutrientes del suelo, promoviendo un oleaje inicial de crecimiento. Sin embargo, esta acidez desplaza a los nutrientes y cationes clave (Ca y Mg), los cuales pueden llegar entonces a ser limitantes para un crecimiento posterior (McLaughlin, 1985; Pearce, 1982).
La interacción entre los hidrocarburos, dióxido de nitrógeno y los rayos UV producen ozono en la atmósfera. La combinación del ozono y el ácido atmosférico se convierten en sustancias tóxicas para los árboles. La mortalidad de los árboles se le atribuye a la combinación de altas concentraciones de ozono y la deposición de ácido. Irónicamente, los mismos árboles pueden liberar terpenos, altamente reactivos con los hidrocarburos; esta combinación con bióxido de nitrógeno forma ozono. Estos ácidos atmosféricos son arrastrados por el viento. La presencia del ácido solo no es suficiente para que mueran los árboles, sino que es necesaria una determinada concentración de ozono. Sin embargo, estudios recientes demostraron que los contaminantes químicos pueden actuar para producir sustancias destructivas. Los experimentos han mostrado que con la exposición de las plantas a bajos niveles de contaminantes como ozono o dióxido de azufre, éstas no se ven afectadas; pero si se les expone a los mismos niveles de los dos contaminantes, hay un marcado incremento en los rangos de mortalidad (Minoura, y Iwasaka. 1996).
Lagos y la lluvia ácida
La deposición ácida tiene sus efectos más pronunciados en los ecosistemas acuáticos. Las entradas de la precipitación ácida a los cuerpos de agua llegan directamente de la lluvia e indirectamente de los suelos de la cuenca hidrográfica circundante. El agua ácida lixiviada de los suelos incrementa los niveles de nutrientes de las corrientes de agua y lagos de la cuenca. Puesto que los suelos presentan reservas apreciables de calcio, éste se infiltra a través del suelo y neutraliza al tiempo que libera iones básicos y los transporta hasta corrientes y lagos. Sin embargo, tal enriquecimiento es frecuentemente anulado por las precipitaciones ácidas que fluyen sobre la superficie del suelo, siguiendo antiguos canales de las raíces y los túneles de animales hasta llegar a las masas de agua receptoras. De este modo, muchas de las precipitaciones acaban en forma de aguas ácidas, quedando las aguas receptoras acidificadas a pesar de los efectos tampona–dores del suelo (Schindler, 1988).
En el agua, los iones sulfato y cloruro reemplazan a los iones bicarbonato, el pH disminuye, y la concentración de algunos iones metálicos en estado soluble aumenta. Cuando el pH de las aguas subterráneas y superficiales de la cuenca hidrográfica circundante es de 5 o inferior, altas concentraciones de iones de aluminio son transportadas hacia los ríos y lagos. Entonces el aluminio tiende a precipitar en forma de unos sedimentos oscuros que, al actuar como agente floculante, eliminan partículas en suspensión y aumentan la transparencia del agua. El aumento de la penetración de la luz en el agua puede estimular la producción de fitoplancton y el crecimiento de algas bénticas y de briofitas, pero la biomasa y el número de especies de zooplancton, y por tanto la biodiversidad, disminuyen (Bailey et al., 1995).
Aunque los peces adultos y algunos otros organismos acuáticos pueden tolerar una alta acidez, una combinación de ésta y un elevado nivel de aluminio, situación que se puede presentar, puede matarlos. Concentraciones de 0.1 y 0.3 mgL–1 de aluminio en el agua retrasan el crecimiento y el desarrollo gonadal de los peces y aumenta su mortalidad (Schindler, 1988).
El relleno de depresiones y charcas temporales con el agua de escorrentía superficial, incluso en regiones sin lagos o cursos de agua acidificados, inhibe la reproducción de ranas y salamandras, cuyos huevos y larvas son sensibles al agua ácida. Este efecto puede explicar en parte la rápida disminución de anfibios. Las aguas ácidas también son tóxicas para los invertebrados, debido a que los mata directamente o interfiere en el metabolismo del calcio, provocando en los crustáceos la pérdida de la capacidad para recalcificar sus exoesqueletos después de la muda. A medida que disminuye la reproducción con nuevos individuos y el alimento, los peces también van desapareciendo de las aguas afectadas (Baker, 1991).
La lluvia ácida afecta especialmente a los lagos en regiones montañosas. Observaciones más recientes indican la progresiva acidificación de lagos. Los efectos de un pH bajo sobre los peces consisten en la pérdida de calcio en sus cuerpos, lo cual hace que tengan huesos débiles o deformes, incapacidad para el desarrollo de muchos huevos y daños en las branquias, causados por el aluminio que se separa de los suelos por acción de la acidez (Bailey et al., 1995).
Por efecto de la acidificación en los cuerpos de agua, las poblaciones de peces virtualmente han sido eliminadas de los lagos de algunas regiones del mundo. Se ha sugerido que mucha de la toxicidad para los peces se debe en realidad al incremento de las concentraciones de aluminio, más que a la acidificación del medio donde viven. El aluminio, que comprende alrededor de un 5 % de la corteza terrestre, es prácticamente insoluble en agua alcalina o neutra y por lo tanto no es biológicamente aprovechable. Sin embargo, como consecuencia de la lluvia ácida, la concentración de aluminio disuelto en algunos lagos puede aumentar hasta niveles tóxicos para los peces y otros organismos acuáticos. La solubilidad de otros metales tóxicos como el plomo, el cadmio y el mercurio también aumenta enormemente con el descenso del pH (Bailey et al., 1995; Young et al., 1988).
Solución a los problemas de la lluvia ácida
La restricción en la quema de carbón o la reducción en el uso de químicos pueden reducir el problema. Sin embargo, la solución no es tan sencilla, pues el carbón es un importante combustible y genera el 28 % de la energía global. Los principales usuarios de carbón son los países que intentan una rápida industrialización. China maneja el 75 % de energía proveniente del carbón, y actualmente cuenta con el 25 % de carbón que se quema globalmente. La India ocupa el cuarto lugar entre los países consumidores de carbón. Las naciones en vías de desarrollo generalmente tienen bajos controles de contaminación, ya que la prioridad es básicamente el desarrollo social y económico; por tanto, el cuidado del medio ambiente se define como un lujo que se puede atender después. Los efectos de la deposición de ácido no se manifiestan en una escala global, y la legislación local puede marcar diferencias sustanciales en la calidad de la pesquería y la actividad forestal (Graveland et al., 1994; Grossman, 1988).
Los óxidos de azufre pueden ser dañinos para la vegetación, como fue evidente ya en los primeros años del siglo, cuando una gran planta de tratamiento de cobre se instaló en un área montañosa de Tennessee, Estados Unidos. En pocos años, toda la fauna y vegetación que rodeaba a la fundición quedó destruida. La solución ideada para dar una solución al problema, y que se sigue usando hoy, es construir chimeneas muy altas, de manera que el viento se lleve los contaminantes lejos del área inmediata. Se suponía, aunque de manera incorrecta, como se demostró más tarde, que los contaminantes se dispersarían tan ampliamente que llegarían a ser inofensivos por su baja concentración.
Cuando una compañía mantiene el límite permitido en sus emisiones, y tomando en cuenta los procesos a futuro (la expansión de la compañía o la reducción de sus emisiones contaminantes), se puede explotar esto en el ámbito publicitario y venderse como una "industria limpia". De este modo, la contaminación provocada a causa del bióxido de azufre emitido por la industria tiene la opción de pagar por la reducción de estas emisiones a fin de cumplir con los estándares marcados en la legislación. Una parte importante de estos procesos es el dinero que se utiliza para comprar tecnología destinada a reducir los procesos que contaminan, por lo que deben representar para la empresa una importante reducción de impuestos como recompensa por ser una industria limpia. Hoy en día todas las compañías deben cumplir con los estándares y los límites permitidos que se establecen en la legislación que las alienta al desarrollo y a la instalación de tecnologías cada vez más limpias.
CONCLUSIÓN
En la década de los años sesenta del siglo XX, era claro que los óxidos de azufre que salían de las chimeneas eran transportados a cientos o miles de millas con los vientos predominantes que luego retornaban a la tierra, con la lluvia o con la nieve. Los óxidos de nitrógeno que dejan escapar los automóviles son igualmente arrastrados por el viento. No obstante, lo que antes era un problema local ahora ha alcanzado nivel internacional, pues para los contaminantes no hay fronteras.
El aumento de la lluvia ácida ha tenido efectos considerables en los bosques y lagos de las naciones industrializadas del norte, porque sus suelos son naturalmente ácidos y sus aguas superficiales son apenas levemente alcalinas (básicas). Los bosques de esas áreas están muriendo y sus cuerpos de agua no pueden sostener a las poblaciones normales de peces. La lluvia ácida disminuye el rendimiento agrícola y corroe el mármol, metal y piedra, efectos apreciables en las ciudades.
Recientemente se ha visto que los bosques del Ajusco de la Ciudad de México, están seriamente perjudicados. Un espectacular declive en la velocidad de crecimiento ha ocurrido durante los últimos 10 años y en algunas localidades elevadas los oyameles mueren en gran número. Parece evidente que, entre otros efectos, la lluvia ácida disminuye la tolerancia al frío y a las plagas en dicha especie.
La acumulación de pruebas señala que la lluvia ácida es uno de los aspectos más graves de la contaminación y que tiene alcance mundial. Las consecuencias posibles sobre los sistemas biológicos incluyen la disminución del rendimiento de las cosechas, una menor producción de madera, la necesidad de usar más fertilizantes para compensar las pérdidas de nutrientes, la pérdida de importantes pesquerías de agua dulce y, posiblemente, también de los bosques.
LITERATURA CITADA
ABRAHAMSEN, G.; STUANES, A. O. 1986. Lysimeter study of effects of acid deposition on properties and leaching of gleyed dystric brunisolic soil in Norway. Water Air Soil Pollute 31:865–878. [ Links ]
ADAMS, F. 1988. Soil Acidity and Liming, 2a. Edition. Monograph Núm. 12. American Society of Agronomy, Inc., Crop Science Society of America, Inc., and Soil Science Society of America. Inc., Madison WI. P,46. [ Links ]
ARKLEY, R. J.; GLAUSER, R. 1980. Effects of oxidant air pollutants on pine litter–fall and the forest floor. In: Proc. Symp. Eff. Air Pollute. Mediterr. Temperate For. Ecosystem. U.S. Dep. Agric. For. Serv. Gen. Tech. Rep. PSW–43:225 [ Links ]
BAILEY, S. W., DRISCOLL C. T.; HORNBECK J. W. 1995. Acid–base chemistry and aluminum transport in an acidic watershed and pond in New Hampshire. Biogeochemistry 28: 69–91. [ Links ]
BAKER, L. A.; HERLIHY, A. T.; KAUFMANN, P. R.; EILERS, J. M. 1991. Acidic lakes and strems in the United Status.: The role of acidic deposition. Science 252: 1151–1154. [ Links ]
BALTENSWEILER, W. 1985. "Waldsterben": Forest pests and air pollution. Z. Angew. Entomol. 99:77–85. [ Links ]
BLANK, L. W.; ROBERTS, T. M; SKEFFINGTON, R. A. 1988. "Chemical and physical characteristics of lakes in the northeastern United States", Environmental Science and Technology 22: 155–63. [ Links ]
BRAVO–ÁLVAREZ, H.; TORRRES, J. R. 2002. Air Pollution Levels and Trends in the Mexico City Metropolitan Area. In: MARK E. FENN; L. I. DE BAUER and TOMÁS HERNÁNDEZ–TEJEDA (edits.). Urban Air Pollution and Forests Resources at Risk in the Mexico City Air Basin. pp. 121–159. Springer–Verlag New York, Inc. Ecological Studies 156. [ Links ]
BUSH, M. B., 1997. Ecology of a Changing planet. Prentice Hall, Inc. New Yersey. 188 P. [ Links ]
CRUZ, R. M.; VENEGAS, G. S. L.; DÍAZ, A. C. 2008. Estado de Lluvia Ácida en la Zona Metropolitana del Valle de México. Serie de Análisis del Sistema de Monitoreo Atmosférico de la Ciudad de México., Secretaría del Medio Ambiente, D.F. MÉXICO, P. 1–8 [ Links ]
ESPINOSA, J. 1996. Liming tropical soils – A management challenge. Better Crops 60: 28–311. [ Links ]
FENN, M. E.; BAUER, L. I.; ZELLER, K.; RODRÍGUEZ, C.; HERNÁNDEZ–TEJEDA, T. 2002. Nitrogen and Sulphur deposition in the Mexico City Air Basin: impacts of Forest nutrient status and nitrato levels in drainage waters. In: MARK E. FENN; L. I. DE BAUER; TOMÁS HERNÁNDEZ–TEJEDA (edits.). Urban Air Pollution and Forests Resources at Risk in the México City Air Basin. pp. 298–319. Springer–Verlag New York, Inc. Ecological Studies 156. [ Links ]
FLEISCHER, S.; ANERSSON, G.; BRODIN, Y.; DICKSON, W.; HERMANN, J.; MUNIZ, I. 1993. Acid water research in Sweden – knowledge for tomorrow? Ambio 22: 258–263. [ Links ]
GARCÍA, R. 2006 Measurenment of Chemical Elements in Rain From Ranchi Viejo, a Rural Wooded Area in State of México, México. Atmospheric Environment 40: p. 6088–6100. [ Links ]
GRIME, J. P. 1982. Estrategias de adaptación de las plantas y procesos que controlan la vegetación. Ed. Limusa, México. P.312. [ Links ]
GRAVELAND, J.; VAN DER WAL, R.; VAN BALEN, J. H.; VAN NOORD–WIJK, A. J. 1994. Poor reproduction in forest passerines from decline of snail abundance on acidified soils. Nature 368: 446–448. [ Links ]
GROSSMAN, W. D. 1988. Products of photo–oxidation as a decisive factor of the new forest decline? Results and considerations. Ecol. Modell. 41:281–305. [ Links ]
GODBOLD, D. L.; FRITZ, E.; HÜTTERMANN, A. 1988. Aluminum toxicity and forest decline. Proceedings of the Nacional Academy of Sciences, U.S.A. 85: 3888–3892. [ Links ]
HENDREY, G. R.; VERTUCCI, F. A. 1980. Benthic plant communities in acid Lake Colden, New York; Sphagnum and the algal mat; in Ecological Imnpac of Acid Precipitation, ed. D. Diablos & A. Tollan, SNSF, Sandefjord, Norway. pp. 266–267. [ Links ]
KOTZ, J. C.; TREICHEL, P. M.; TOWNSEND J. 2008 Química y Reactividad Química. Thompon. México. D. F. 234.P [ Links ]
LAST, E. T.; NICHOISON, I. A. 1982. "Acid rain". Biologist 29: 250–2. [ Links ]
LINDBERG A. L. 1996. Page (eds) Acidic Precipitation, Volume 4, Soils, Aquatic Processes and Lake Acidification, Springer–Verlag. New York.210 p. [ Links ]
McLAUGHLIN, S. B. 1985. Effects of air pollution on forests: A critical review. J. Air Pollut. Control Assoc. 35:512–534. [ Links ]
MIRANDA P., M. G.; RODRÍGUEZ M., S.; GARCÍA, G. E 2009, Parece que va a llover... Lluvia ácida. Revista Conversus (Instituto Politécnico Nacional) Núm. 76 Revista Conversus (Instituto Politécnico Nacional) Núm.76 : 32 – 37. [ Links ]
MINOURA, H.; IWASAKA, Y. 1996. Rapad change in nitrate and sulfate concentrations observed in early stage of precipitation an dtheir deposition processes. Journal of Atmospheric Chemistry 24: 39–55. [ Links ]
MOHNEN, VOLKER A.1988 The Challenge of Acid Rain", en Scientific American 259: 30–38. [ Links ]
NEWMAN, E. I. 1995. Phosphorus inputs to terrestrial ecosystems. Journal of Ecology 83: 713–726. [ Links ]
PEARCE, F. 1982 "Science and politics don't mix at acid rain debate", New Scientist 95 (1313): 80. [ Links ]
SCHINDLER, D. W. 1988. "Effects of Acid Rain on Freshwater Ecosystems" Science 239: 149–153. [ Links ]
SCHWARTZ, S. E. 1989. "Acid Deposition: Unraveling a Regional Phenomenon". Science 243: 753–761. [ Links ]
TORRES, A. G.; Galván, L. G. 1999., Lluvia Ácida. Dirección General de Prevención y Control de la Contaminación, Red Automática de Monitoreo Atmosférico r.a.ma. Secretaría del Medio Ambiente México DF. 39–42 p. [ Links ]
ULRICH, B. 1983. "A concept of forest ecosystem stability and of acid deposition as driving force for destabilization", in Ulrich B. Pankrath J. (eds) Effects of Accumulation of Air Pollutants in Forest Ecosystems, Dordrecht, Netherlands: Reidel. pp 1–29. [ Links ]
YOUNG, J. R.; Ellis, E. C.; Hidy, G. M. 1988. Deposition o fair–borne acidifiers in teh western environment. Journal of Environmental Quality 17: 1–26. [ Links ]














