Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista bio ciencias
On-line version ISSN 2007-3380
Revista bio ciencias vol.7 Tepic 2020 Epub Nov 18, 2020
https://doi.org/10.15741/revbio.07.e680
Artículos Originales
Características fisicoquímicas y térmicas de Fe microencápsulado por coacervación electroestática
1División de Investigación y Posgrado de la Facultad de Ingeniería. Universidad Autónoma de Querétaro. Cerro de las Campanas, s/n. Col. Las Campanas, CP 76010, Santiago de Querétaro, Querétaro. México.
2Posgrado en Ciencia y Tecnología de los Alimentos. Facultad de Química. Universidad Autónoma de Querétaro, Cerro de las Campanas S/N. Col. Centro, C.P. 76010 Santiago de Querétaro, Querétaro, México.
3Instituto Politécnico Nacional. CICATA-IPN Unidad Querétaro, Cerro Blanco N° 141, Col. Colinas del Cimatario, Santiago de Querétaro, Querétaro, C.P. 76090, México.
El Fe es uno de los micronutrientes que el cuerpo necesita. Cuando el Fe es adicionado en forma directa en los alimentos puede ocasionar cambios sensoriales, ocasionando rechazo por el consumidor. El uso de técnicas como la coacervación y la electroestática para obtener microcápsulas pueden ser una solución para la incorporación de Fe en alimentos. El objetivo del presente trabajo fue micro encapsular Fe en alginato de sodio por medio de coacervación electroestática usando como material reticulante el cloruro de calcio. En una suspensión de alginato de sodio al 1.5 %, se adicionó FeSO4 al 16 %, 33 % y 50 %. Se determinó la viscosidad de las suspensiones de alginato y FeSO4. Los resultados mostraron un aumento lineal en viscosidad respecto con el contenido de FeSO4. Las microcápsulas fueron obtenidas por goteo sobre una solución reticulante de CaCl2 al 5.5 % utilizando una bomba de jeringa, a un potencial eléctrico de 6, 7 y 8 KV y una distancia de 10 cm de la jeringa con la solución reticulante. A mayor potencial eléctrico menor diámetro de cápsulas debido a las fuerzas de atracción electrostática. Una vez obtenidas las microcápsulas de alginato de sodio/Fe se determinó: tamaño de las cápsulas, eficiencia de encapsulamiento y cinética de liberación del Fe. Los resultados mostraron que la mayor eficiencia de encapsulamiento fue de 66.94 ± 1.11 % usando 16 % de FeSO4 y 8 KV de alto voltaje. De acuerdo a las micrografías de SEM, el tamaño de las microcápsulas fue de 500 ± 100 µm con una forma esférica y no rugosa. A pH de 7 se obtuvo un 82.39 ± 0.72 % de liberación de Fe a los 240 minutos; Estos valores de tiempo y pH podrían indicar que la liberación de Fe seria en el intestino delgado. Los resultados muestran que la técnica de coacervación electrostática tiene potencial para obtener microcápsulas de alginato de sodio/Fe teniendo aplicación como aditivo en alimentos (fortificación).
PALABRAS CLAVE: Electroestática; microcápsulas; hierro; coacervación
Fe (iron) is one of the micronutrients required by the human body. When Fe is directly added to the food, it can cause sensory changes in flavor and color, causing rejection by consumers. The use of techniques such as coacervation and electrostatics (electrostatic coacervation) to micro encapsulate Fe can be a solution for Fe inclusion in food. The aim of the present work was to microencapsulate Fe in sodium alginate by electrostatic coacervation using calcium chloride as crosslinker material. In a suspension of 1.5 % sodium alginate, FeSO4 was added at 16 %, 33 % and 50 %. The viscosity of alginate and FeSO4 suspensions was determined. Results showed a linear increase in viscosity in relation with the FeSO4 content. The microcapsules were obtained by dripping on a 5.5 % CaCl2 crosslinker solution using a syringe pump, at an electric potential of 6, 7 and 8 KV and distance of 10 cm from the syringe with the crosslinker solution. The greater the electric potential, the smaller the diameter of the capsules, due to the electrostatic attraction forces. Once the sodium alginate/Fe microcapsules were obtained, the capsules size, encapsulation efficiency and Fe release kinetics were determined. The results showed that the highest encapsulation efficiency was 66.94 ± 1.11 % using 16 % FeSO4 at 8 KV. According to SEM micrographies , microcapsules size was 500 ± 100 μm with a spherical and smooth shape. At pH 7, 82.39 ± 0.72 % of Fe were released at 240 min, these values of time and pH could indicate that Fe release would be in the small intestine. The results showed that the technique of electrostatic coacervation has potential to obtain sodium/Fe alginate microcapsules, having application as an additive in food (fortification).
KEY WORDS: Electrostatics; microcapsules; iron; coacervation
Introducción
La encapsulación es la retención de un compuesto activo llamado “núcleo” por un material de recubrimiento llamado “pared” (Ray et al., 2016). El material del núcleo debe ser compatible con el material de pared para lograr el encapsulamiento. (Nava-Reyna et al., 2015; Costamagna et al., 2017) y el material de pared influirá en la morfología del encapsulado final (Valenzuela et al., 2013). Un material de pared ampliamente usado dentro de los carbohidratos es el alginato de sodio (SA) (Dias et al., 2017). El SA en un polímero formado por una estructura lineal polianiónica, compuesto por ácidos D-manúrico y L-gulurónico. El polímero es extraído de algas, no tóxico, biocompatible y biodegradable; presenta una buena capacidad para formar geles, esferas, micro y nanopartículas. Estas características hacen que el SA sea utilizado como material encapsulante (Hernández-Gálvez, 2015; Hernández-Torres et al., 2016; Babazadeh et al., 2016).
Una técnica de encapsulación que se reporta ampliamente en la literatura es la coacervación (Nazzaro et al., 2012; Zhao & Wang, 2017). La coacervación es definida como la separación de un coloide solvatado en dos fases líquidas, una de las cuales contiene una alta proporción de coloide (capa de coacervado) (Giro-Paloma et al., 2016). Durante la coacervación el núcleo es envuelto por una película fluida y viscosa del polímero. La película fluida es endurecida y solidificada para formar una cápsula dura alrededor del núcleo con la ayuda de una solución reticulante (CaCl2) (Dias et al., 2017). Una de las ventajas de la técnica de coacervación es su facilidad para implementarse, así como su bajo costo, sin embargo, una desventaja es que se obtienen partículas de tamaño milimétrico y micrométrico.
Otra técnica que ha permitido desarrollar partículas o cápsulas esféricas de tamaño micro y nanométrico es el electrospinning (Soto-Martínez, 2018). El electrospining es una técnica que utiliza las fuerzas electrostáticas para generar microfilamentos y macropartículas. El electrospinning es ampliamente utilizado tanto a nivel industrial como científico para obtener diferentes productos para diversas aplicaciones en el campo farmacéutico, metalurgia, pintura automotriz, inyección de combustible, cosméticos y alimentos (Zhang et al., 2013; Bock et al., 2011). Actualmente, muchos biopolímeros como lípidos, proteínas y carbohidratos han sido estudiados mediante técnicas de atomización electroestática como electrospinning para producir nanofibras y materiales de pared para procesos de encapsulación (López-Rubio et al., 2009) pero ninguno de ellos ha reportado el uso del electrospining y de la coacervación para la producción de microcápsulas de Fe.
Zhu et al. (2017), reportaron la coacervación electrostática como la combinación de la coacervación clásica utilizando alginato de sodio/cloruro de calcio con la electroestática. La finalidad de unir ambas técnicas es obtener cápsulas de tamaño micrométrico y nanométrico aprovechando la atracción electrostática entre el material del núcleo y el material de pared permitiendo una disminución en el tamaño de partícula. El resultado de esta combinación genera un producto en forma de micro-gotas o fibras desde 1000 µ hasta 0.5 µ (Soto-Martínez, 2018; Pérez-Calderón et al., 2018). En la actualidad, el desarrollo de nanofibras ha tenido gran auge, debido a los diferentes campos en que pueden ser empleadas, desde la industria textil, hasta la industria biomédica. Sin embargo, en el área de alimentos, son pocos los estudios que se han realizado en esta área y se encaminan a la utilización de compuestos de origen natural y comestible, como la proteína de amaranto. En la industria alimentaria, las nanofibras pueden ser de gran utilidad para la encapsulación de activos que sean sensibles al pH o que interaccionen con componentes del alimento y disminuyan su actividad biológica. En este proyecto, se incorporaron en nanofibras de amaranto y pululano, dos bacteriocinas (pediocina y nisina). Las propiedades de la solución, los parámetros del proceso y algunas condiciones ambientales pueden afectar el tamaño y las características de las micro-gotas (Wen et al., 2017).
Se ha reportado que las microcápsulas aumentan la absorción y la eficiencia del producto encapsulado, y disminuye la percepción sensorial del material encapsulado cuando es ingerido (Appelqvist et al., 2015; Wu et al., 2016; Zhao & Wang, 2017; Valenzuela et al., 2013). La ventaja de la microencapsulación por coacervacion Alginato de sodio/ cloruro de calcio es que protege los compuestos del núcleo (Zhu, 2017) de factores externos que lo afectan como la luz, oxígeno, pH y temperatura, entre otros (Dias et al., 2017; Ray et al., 2016; Aditya et al., 2017).
El hierro es un micronutriente vulnerable a condiciones digestivas. Es afectado por el pH gástrico, lo que disminuye su actividad antes de llegar al intestino, donde es absorbido (Galán et al., 2014). Al encapsular Fe para ser utilizado como aditivo para la fortificación de alimentos, debe considerar el pH del estómago y además su liberación en el intestino delgado. Se ha reportado el encapsulamiento de Fe utilizando almidón como material de pared por medio de secado por aspersión (Durán et al., 2017). Por otra parte, Valenzuela et al. (2014), reportaron la encapsulación de hierro obtenido de eritrocitos bovinos usando coacervación clásica. Los autores reportan tamaños de cápsulas de 830 µm a 1.57 mm y un bajo rendimiento de encapsulación.
Por lo anterior, el objetivo de este trabajo fue obtener microcapsulas de Fe por coacervación electrostática para ser utilizadas como aditivo en los alimentos. El trabajo de divide en 2 etapas: Una primera etapa corresponde a obtener la suspensión del material núcleo: Alginato de Sodio/Sulfato Ferroso (SA/FS). Una segunda etapa fue la obtener las micro capsulas por coacervación electrostática utilizando como material reticulante cloruro de calcio. Una vez obtenidas las micro capsulas de alginato de sodio/Fe se caracterizaron fisicoquímicamente midiendo el tamaño de partícula por medio de SEM, contenido de Fe, eficiencia de encapsulamiento, estabilidad térmica, perfil de liberación y viscosidad de la solución SA/FS.
Material y Métodos
Para la encapsulación de hierro se utilizó sulfato ferroso (FS) en forma de cristales heptahidratados (CAS 778263-0) de la marca Meyer, Química Suastes, S.A. de C.V., en diferentes concentraciones; se empleó alginato de sodio (SA) como material de pared (CAS 9005-38-3), y como material reticulante se usó cloruro de calcio (CaCl2) (CAS 10043-52-4) ambos de la marca Deiman S.A. de C.V. (México).
Preparación de la suspensión de alginato con sulfato ferroso y reticulante
Se prepararon cinco suspensiones usando 1.5 g de SA en 60 mL de agua. Las suspensiones se agitaron en una placa magnéticamente (Modelo SP46925, Barnstead Thermolyne, USA) por 30 minutos a 25 °C, posteriormente se aforó a 90 mL. Posteriormente, el FS fue solubilizado en 10 mL de agua. La solución se mezcló con 90 mL de la suspensión de SA para tener las siguientes concentraciones: 16, 25, 33, 50 y 75 % de material de pared. Las suspensiones se agitaron (Modelo SP46, Barnstead Thermolyne, USA) por 5 min. Se preparó la solución reticulante con una concentración de 1N de CaCl2.
Viscosidad y conductancia de suspensiones de SA/FS
Se determinó la viscosidad de las suspensiones de SA/ FS (16, 25, 33, 50 y 75 % con respecto al material de pared), usando un reómetro (modelo MCR-101, Anton Parr, Austria) a 25 °C, adaptado con una geometría ST24-2D/2v/2v-30. Además, se midió la conductancia, mediante un conductímetro (modelo PCE-CM 41, PCE Ibérica, España) a 25 °C.
Equipo de coacervación electrostática
El equipo de coacervación electrostática fue diseñado y construido en el CICATA-IPN Unidad Querétaro (Figura 1). El equipo consta de una bomba de jeringa motorizada construida en laboratorio donde se coloca la suspensión de SA/FS, una aguja de 30 G conectada a la bomba de jeringa por medio de manguera de silicón, una fuente de alto voltaje variable de 1 a 30 KV para generar las fuerzas de atracción electrostática (modelo 30A24-P30, Ultravolt, USA), fuente de bajo voltaje variable de 1 a 12 VDC (LM317) para control de la bomba de jeringa, un agitador magnético (modelo PC-320, CORNING, USA) con un vaso de precipitado de 250 mL para la solución de CaCl2. Se conectó el positivo del alto voltaje en la aguja de 30G y el negativo del alto voltaje se colocó debajo del vaso de precipitado, como se muestra en la Figura 1.

1) Panel de control: motores y alto voltaje. 2) Bomba de jeringa. 3) Jeringa de 1mL con aguja de 30 G. 4) Electrodo común. 5) Electrodo de alto voltaje posicionado en la aguja de la jeringa. 6) Suspensión reticulante de CaCl2.
Figura 1 Equipo de coacervación electrostática para obtener microcápsulas de SA/FS.
Obtención de microcápsulas mediante el proceso de coacervación electroestática
Las suspensiones de SA/FS se colocaron en jeringa de 10 mL con una aguja de 30 G, la cual se acoplo en el equipo de coacervación electroestática (Figura 1). syringe with a 30 G needle, which was attached to the electrostatic coacervation equipment (Figure 1). Las variables evaluadas fueron: alto voltaje, velocidad del flujo de avance y de la distancia entre electrodos sobre la obtención de microcápsulas. La suspensión de SA/FS se depositó en una jeringa, y con la ayuda de una bomba de jeringa se formaron gotas que al caer al CaCl2 formaron cápsulas por coacervación con el alginato. La velocidad de flujo vario entre 0.01 mL/ min hasta 0.02 mL/min. Se conectó el alto voltaje en la aguja polarizando la solución de SA/FS y por fuerzas electrostáticas de atracción se formaron gotas de menor que cayeron en la solución reticulante (CaCl2) en agitación continua a una distancia de 10 cm (Figura 1). Las microcápsulas formadas por coacervación electrostática se filtraron y enjuagaron con agua para eliminar el exceso de CaCl2. Las microcápsulas de cada tratamiento se almacenaron en frascos de vidrio de 50 mL en refrigeración y protegidas de la luz, hasta su análisis.
Caracterización de las microcápsulas de SA/FS
Contenido de hierro y eficiencia de encapsulamiento
El contenido de hierro en las microcápsulas se determinó empleando la técnica de volumetría usando permanganato de potasio al 1N (Verde et al., 2013). Se colocaron 2 mg de microcápsulas, 3 mL de agua destilada y 1 mL de ácido sulfúrico diluido al 10 %, posteriormente se agitaron por 2 min. Para determinar la eficiencia de encapsulamiento se aplicó la siguiente formula, donde Fet es el hierro total agregado y Fes es el hierro contenido en las microcápsulas (Ecuación 1).
Tamaño y morfología de la microcápsula
Para el estudio de la morfología de la microcápsula, se utilizó un microscopio electrónico de barrido ambiental Phenom Pro (Desktop SEM, Eindhoven, Países Bajos) que se acondicionó para trabajar en módulo de bajo vacío, con el haz de electrones ajustado a 5 kV. Las imágenes se tomaron a 150X y 500X. Para determinar el tamaño se empleó un microscopio óptico modelo digital con sensor 2 MP en un rango de 300x - 1000X en magnificación. Se evaluaron 60 microcápsulas por tratamiento, mostrando el tamaño promedio ± desviación estándar. Esta prueba se realizó por triplicado.
Estabilidad térmica de la microcápsula
La estabilidad térmica se analizó en un calorímetro diferencial de barrido Marca Mettler Toledo (modelo DSC1, Switzerland), se pesaron 3 g de muestra en un crisol de aluminio de 40 µL sellado mediante presión mecánica (modelo ME-00119410). La muestra se dejó reposar por 15 minutos. Posteriormente se realizó un isoterma de 30 a 240 °C a una razón de calentamiento de 10 °C/min. Se empleó un crisol vacío como referencia. Se reporta la temperatura de estabilidad y la entalpia de degradación. Las mediciones se realizaron por duplicado. Se reporta la medición ± desviación estándar.
Perfil de liberación de la microcápsula
El perfil de liberación se evaluó colocando 12 gramos de microcápsula en una solución buffer a pH 2, 4 y 7.4 a una temperatura de 37 °C durante 4 horas. Se analizó la cantidad de hierro liberado, cada 10 minutos los primeros 60 minutos, posteriormente se midieron cada 30 min. La cantidad de hierro fue analizada por titulación por volumetría (Cendejas & Ortega, 2017). Se reporta el porcentaje de liberación a un determinado tiempo. La prueba se realizó por triplicado.
Análisis estadístico
Se realizó un análisis aleatorio con un arreglo factorial 33. Las variables analizadas fueron la relación de SA/FS, el flujo de alimentación y el potencial aplicado. Los resultados se reportan con la media ± la desviación estándar. El análisis estadístico de las pruebas se empleó ANOVA y comparación de medias empleando la prueba de Tukey (p < 0.05) utilizando MINITAB 17.
Resultados y discusión
Caracterización de la suspensión de SA/FS
La Figura 2, muestra los valores de viscosidad y conductividad eléctrica de las suspensiones de SA adicionadas con FS (SA/FS). La viscosidad de las suspensiones estuvo entre 224 ± 4.37 mPa•s (relación 16 % de FS) hasta 1227 ± 11.01 mPa•s (relación 75 % de FS). Estos resultados están asociados con el peso molecular del SA que influye directamente en la viscosidad (Avendaño-Romero, 2013).

Figura 2 Viscosidad. (a) y conductividad eléctrica (b) de las suspensiones de alginato de sodio y sulfato ferroso.
La interacción de SA con FS mostró un efecto significativo sobre la viscosidad de las suspensiones (p < 0.05). En la Figura 2 (a), se puede observar que conforme aumenta la concentración de FS se incrementa la viscosidad. Soto-Martínez (2018), reportaron que la viscosidad de las suspensiones usadas es un factor determinante en la formación de las microcápsulas cuando se emplea la técnica de electrostática. Los autores reportan que a viscosidad menores de 800 cP es posible generar gotas, lo que favorece la formación de las microcápsulas. La concentración de 16 % de FS fue la solución de menor viscosidad y la que permitió la mejor formación de gotas y, en consecuencia, la de mayor eficiencia de encapsulamiento.
Otro factor determinante para la técnica de electrostática es la conductividad eléctrica. En la Figura 2(b), se muestra la conductividad en función de la concentración de FS. Los valores obtenidos de conductividad estuvieron entre 0.299 mS/m (relación de 16 % de FS) hasta 0.581 mS/m (relación de 75 % de FS). Los polisacáridos no son buenos conductores de electricidad aunado a que la concentración de alginato fue constante por lo que el cambio de conductividad es atribuido al FS. Colín-Orozco et al. (2013) reportan que la conductividad está influenciada por el tipo de solvente, el material disuelto y la disponibilidad de iones libres, estos últimos asociados con el contenido de FS. Lo anterior coincide con los resultados en donde el aumento en la conductividad eléctrica es proporcional al incremento en la cantidad de hierro añadida, ya que el FS es una sal que se disocia en agua. Pérez-Calderón et al. (2018), reportó que el agua tiene 0.04 mS/m hasta 0.2 mS/m, por otra parte, Quintero et al. (2018) reportaron valores de soluciones a base de quitosano al 2 % con conductividad eléctrica de 0.214x10-3 mS/m. La suspensión del 16 % de FS presento una conductividad de 0.299 mS/m, estos valores de conductividad son mayores que los reportadas debido a la adición del FS. Lo anterior se debe a que las sales se disocian en soluciones acuosas ocasionando mayor conductividad.
Contenido de hierro y porcentaje en eficiencia de encapsulamiento
En la Tabla 1, se muestra el efecto de las variables del proceso de coacervación electroestática en la formación de las microcápsulas. El alto voltaje y el flujo de alimentación no tuvieron efecto significativo en la formación de las microcápsulas mientras que la relación SA/FS influyó significativamente.
Tabla 1 Eficiencia de encapsulamiento y tamaño de microcápsulas de hierro obtenidas por coacervación electroestática.
| Sample | SA-FS suspension (%) | Flow (mL/min) | Voltage (KV) | Iron content (mg) | Encapsulation efficiency (%) | Tamaño de partícula (µm) |
|---|---|---|---|---|---|---|
| 1 | 16 | 0.012 | 6 | 164.06 ± 1.82c | 65.73 ± 0.73ª | 847.60 ± 57.80ª |
| 2 | 16 | 0.014 | 6 | 162.24 ± 1.82c | 65.00 ± 0.73ª | 643.95 ± 46.65c,d,e |
| 3 | 16 | 0.016 | 6 | 165.28 ± 1.05c | 66.22 ± 0.42ª | 455.80 ± 25.71g,h,i,j |
| 4 | 16 | 0.012 | 7 | 166.49 ± 2.78c | 66.46 ± 0.73ª | 842.95 ± 45.03a,b |
| 5 | 16 | 0.014 | 7 | 164.67 ± 1.05c | 65.97 ± 0.42ª | 482.50 ± 32.19e,f,g,h,i,j |
| 6 | 16 | 0.016 | 7 | 164.06 ± 4.82c | 65.73 ± 1.93ª | 365.10 ± 35.16j |
| 7 | 16 | 0.012 | 8 | 167.71 ± 3.16c | 66.94 ± 1.11ª | 632.30 ± 29.14c,d,e,f |
| 8 | 16 | 0.014 | 8 | 161.02 ± 1.05c | 64.51 ± 0.42ª | 545.95 ± 28.35d,e,f,g,h,i |
| 9 | 16 | 0.016 | 8 | 162.85 ± 2.10c | 65.24 ± 0.84ª | 456.15 ± 29.79 g,h,i,j |
| 10 | 33 | 0.012 | 6 | 329.94 ± 1.82b | 65.73 ± 0.36ª | 676.25 ± 32.70b,c,d |
| 11 | 33 | 0.014 | 6 | 330.55 ± 2.10b | 65.85 ± 0.42ª | 538.40 ± 46.68 d,e,f,g,h,i |
| 12 | 33 | 0.016 | 6 | 328.12 ± 4.82b | 65.36±0.96ª | 454.40 ± 27.87 g,h,i,j |
| 13 | 33 | 0.012 | 7 | 330.55 ± 1.05b | 65.50±0.21ª | 646.30 ± 13.37c,d,e |
| 14 | 33 | 0.014 | 7 | 328.12 ± 1.82b | 65.36 ± 0.36ª | 576.55 ± 14.83 c,d,e,f,g,h |
| 15 | 33 | 0.016 | 7 | 328.12 ± 1.82b | 65.36 ± 0.36ª | 462.15 ± 21.70 f,g,h,i,j |
| 16 | 33 | 0.012 | 8 | 326.91 ± 1.05b | 65.12 ± 0.21ª | 615.10 ± 22.52c,d,e,f,g |
| 17 | 33 | 0.014 | 8 | 328.73 ± 2.78b | 65.61 ± 0.56ª | 585.85 ± 21.71c,d,e,f,g |
| 18 | 33 | 0.016 | 8 | 328.73 ± 1.05b | 65.73 ± 0.36ª | 409.65 ± 14.66h,i,j |
| 19 | 50 | 0.012 | 6 | 449.65 ± 1.05b | 59.82 ± 0.14b | 717.60 ± 18.55a,b,c |
| 20 | 50 | 0.014 | 6 | 452.08 ± 0.00a | 60.14 ± 0.00b | 655.30 ± 20.81c,d |
| 21 | 50 | 0.016 | 6 | 447.82 ± 2.78ª | 59.57 ± 0.37b | 517.40 ± 18.86 d,e,f,g,h,i,j |
| 22 | 50 | 0.012 | 7 | 449.04 ± 1.05ª | 59.73 ± 0.14b | 662.45 ± 21.65c,d |
| 23 | 50 | 0.014 | 7 | 450.86 ± 1.05ª | 59.98 ± 0.02b | 557.90 ± 25.28 c,d,e,f,g,h |
| 24 | 50 | 0.016 | 7 | 450.26 ± 1.82ª | 59.90 ± 0.24b | 455.50 ± 23.16 g,h,i,j |
| 25 | 50 | 0.012 | 8 | 449.04 ± 1.05ª | 59.73 ± 0.02b | 508.75 ± 20.80,d,e,f,g,h,i,j |
| 26 | 50 | 0.014 | 8 | 449.04 ± 1.05ª | 59.73 ± 0.02b | 468.25 ± 23.04e,f,g,h,i,j |
| 27 | 50 | 0.016 | 8 | 448.43 ± 1.82ª | 59.49 ± 0.37b | 381.45 ± 19.17i,j |
SA: alginato de sodio, FS: sulfato ferroso. Medias con letra diferente en la misma columna indican diferencias significativas (p ≤ 0.05).
Los resultados obtenidos muestran que cuando la concentración de FS es menor (16 %), la eficiencia de encapsulamiento (EE) es mayor. La EE, estuvo entre 59.49 ±0.37%(50%deFS)y66.94±1.11%(16%deFS)(Tabla 1). Estudios previos sobre el efecto de la concentración de FS sobre la EE son variados. Valenzuela et al. (2014) reportó valores de 59.5 % a 75.7 % EE usando hierro hémico obtenido a partir de eritrocitos.
Por otro lado, en la Tabla 1 muestra que al aumentar la concentración de FS disminuyó la EE y aumento el contenido de hierro, es decir, la capacidad de retención disminuyó lo que indican que la sal se encuentra al interior de la micropartícula de alginato así como también podría estar adherida a su superficie. Otra razón por la que la EE, disminuye a medida que la relación de AS/FS se incrementa, puede estar asociada con una desproporción del material de pared, lo que genera incrustaciones de material que hacen que disminuya la EE (Cuatzo, 2010), e incrementando la viscosidad, lo cual interfiere con la formación de la gota. En la literatura se reporta que las sales de hierro III tienen hasta un 80 % de EE, sin embargo, son menos biodisponibles para el organismo (Durán et al., 2017).
Tamaño y morfología de la microcápsula
El tamaño de la microcápsulas obtenidas se muestra en la Tabla 1. Las condiciones del potencial electroestático, la relación de SA/FS tuvieron efecto significativo en este parámetro. Lo anterior puede estar relacionado debido a que, a mayor contenido de hierro, aumenta la viscosidad por el alto contenido de sales de hierro dificultando la formación de las microcápsulas.
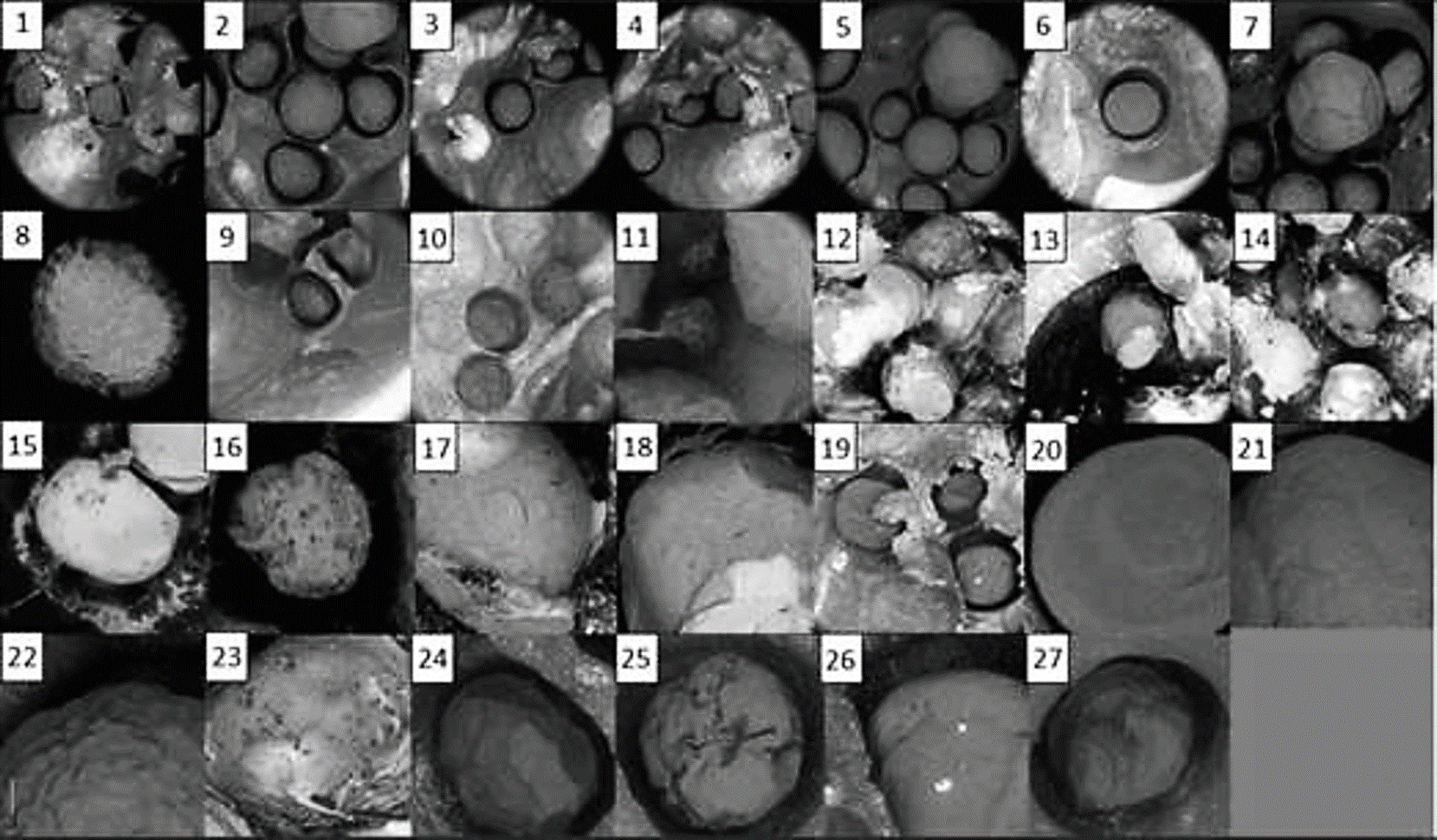
La morfología de las microcápsulas de hierro obtenidas por coacervación electroestática se presenta en la Figura 3. Las microcápsulas presentan una forma esférica y sus tamaños fluctuaron entre los 350 a 850 µm, valores más bajos que lo reportado en la literatura para cápsulas obtenidas por coacervación (Valenzuela et al., 2014). Se observaron microcápsulas que no presentan forma esférica, pero con tamaños similares. En las muestra 11-14, 18 y 23, se presentó un efecto propio del electro spinning el cual es la incorporación de monofilamentos adheridos a la micro capsula. (Figura 3). Otros tratamientos mostraron una apariencia rugosa en la superficie de la microcápsula (Figura 3, muestra 1, 8, 9, 22, 24 y 27), esto se puede deber a la combinación del flujo de alimentación y el potencial aplicado. Mientras que en los tratamientos 10, 16, 25 y 26 (Figura 3) se presentaron fisuras. Menger et al. (1998) indican que la unión electroestática de los iones puede formar agregados de positivo a negativo en la formación de coacervado, manifestándose en deformación, lo cual se puede acentuar por el potencial aplicado.
Los tratamientos 19, 20 y 21 (Figura 3) presentaron una apariencia lisa en la superficie, posiblemente debido a la diferencia de potencial eléctrico. Los tratamientos 2, 3, 4, 5 y 6 (Figura 3), que contienen un 16 % de FS fueron esféricos y con apariencia uniforme.
Valenzuela et al. (2014), reportaron cápsulas de 830 µm a 1.57 mm, usando como fuente de hierro Eritrocitos bovinos deshidratados (EBDA) usando coacervación clásica. Durán et al. (2017) reportan que la encapsulación de hierro usando secado por aspersión genera tamaños de partícula entre 200 a 600 µm, menores a los encontrados en el presente trabajo. Sin embargo, la técnica usada por los autores puede oxidar el hierro lo que afectaría su biodisponibilidad en el organismo.
Las condiciones de procesamiento de 16 % de FS con un voltaje de 8 KW y un flujo de 0.012 mL/min fueron las que permitieron obtener la mayor eficiencia de encapsulamiento (66.94 ± 1.11) además, con apariencia esférica, uniforme con un tamaño de 632.30 ± 29.14 µ. Por lo tanto, este tratamiento fue seleccionado para pruebas de estabilidad térmica y determinar el perfil de liberación del compuesto encapsulado.
Estabilidad térmica de la microcápsula
Para comparar la estabilidad térmica que ofrece la microcápsula al hierro se uso el FS libre, la microcápsula con hierro y sin hierro ambas obtenida con flujo de alimentación de 0.12 mL/min y un voltaje aplicado de 8 kw a 10 (Figura 4). El FS mostró dos endotermas, una entre los 66 °C y 80 °C, y la otra a 117 °C-131 °C (Figura 4), el primero corresponde a la inestabilidad (72 °C), lo que afecta su funcionalidad.

Figura 4 Estabilidad térmica de sulfato ferroso (FS), microcápsulas de alginato de sodio (SA) y microcápsulas de SA/FS.
Las microcápsulas de SA/FS obtenidas por coacervación electrostática presentaron un endoterma entre los 130 °C y 141 °C. Estos resultados demuestran que el material de pared (Alginato) ofrece una protección térmica al material encapsulado (FS). Rodríguez-Llimos et al. (2003) reportaron que el SA como material de pared brinda estabilidad térmica a los materiales encapsulados, al encapsular paracetamol.
Perfil de liberación de Fe de microcápsulas de SA/FS
Se evalúo el mecanismo de liberación controlada del FS a pH 2.0, 4 y 7.2 (Figura 5). Se observó una liberación más lenta de FS de los coacervados a pH 2 en comparación con los coacervados sometidos a pH 4 y 7 (p ≤ 0.05) (Figura 5). Barros et al. (2016) reportaron que esta misma combinación, haciendo pasar las microcápsulas de un medio ácido a uno básico, mostró una mejora en la liberación del compuesto.
Las microcápsulas que se sometieron a pH 7.4 presentó el efecto estallido (Gran porcentaje de material liberado en corto tiempo) en la segunda hora, seguido de una liberación gradual en el resto del tiempo (p ≤ 0.05) (Figura 5). La liberación a pH 4 y 7 no presentaron diferencias significativas hasta los 60 min de exposición al pH. Sin embargo, a los 240 min se tuvo un 82.39 ± 0.72 % a pH de 7.4, seguido de pH 4 con un 64.37 ± 0.28 % y a pH 2 la liberación fue de 21.52 ± 1.68 %
Sankalia et al. (2005), describieron tiempos muy cortos de liberación, para cápsulas de SA al encapsular papaína. Los autores liberaron el 100 % de su contenido en 60 minutos de incubación in vitro en solución intestinal simulada a pH 6.8; argumentando este hecho como consecuencia de un incremento en la afinidad entre el ion Ca2+ y el tampón fosfato de Na+, debilitando la reticulación del polímero, generando la desintegración total de la matriz de SA
Por otra parte, Durán et al. (2017) reportó un tiempo de liberación de tres horas de los componentes sensibles, como minerales y vitaminas, encapsulados con SA en medios a pH superior a 6.5, lo que corresponde con los resultados encontrados. Con base en los resultados encontrados sería recomendable la incorporación de las microcápsulas de hierro obtenidas por coacervación electroestática, en alimentos con pH ácidos para asegurar su integridad y conservación del Fe por mayor tiempo. Por otro lado, los resultados encontrados son alentadores ya que el pH del intestino delgado, lugar en donde debe liberarse el hierro para ser absorbido, es aproximadamente 7.
Conclusión
La técnica de coacervación electroestática permite microencapsular FS con una alta eficiencia de encapsulamiento (66.94 ± 1.11 %) en tamaños de partícula promedio de 600 µm, en condiciones de procesamiento de flujo de alimentación de 0.12 mL/min y un voltaje aplicado de 8 kw a 10 cm de separación entre electrodos.
Las microcápsulas de SA/FS obtenidas presentan una estabilidad térmica al hierro hasta una temperatura de 130 ºC de acuerdo a las mediciones realizadas con DSC. Esta estabilidad térmica de las capsulas de SA/FS permitirían adicionarlas a alimentos y someterlos a cocción por debajo de 120 °C sin comprometer la calidad nutricia del compuesto.
El perfil de liberación del Fe de las microcápsulas de SA/ FS obtenidas por coacervación electrostática muestra que el Fe se libera hasta un pH 7. Este valor de pH 7 permite inferir que el micronutriente podría liberarse en el intestino delgado y no en el estómago.
Agradecimientos
Mendoza-Meneses agradece al Consejo Na- cional de Ciencia y Tecnología (CONACYT) por su apoyo durante sus estudios de posgrados.
REFERENCIAS
Aditya, N. P., Espinosa, Y. G. and Norton, I. T. (2017). Encapsulation systems for the delivery of hydrophilic nutraceuticals: Food application. Biotechnology advances, 35(4): 450-457. https://doi.org/10.1016/j.biotechadv.2017.03.012 [ Links ]
Appelqvist, I. A., Cochet-Broch, M., Poelman, A. A. and Day, L. (2015). Morphologies, volume fraction and viscosity of cell wall particle dispersions particle related to sensory perception. Food Hydrocolloids, 44:198-207. https://doi.org/10.1016/j.foodhyd.2014.09.012 [ Links ]
Avendaño-Romero, G. C. (2013). Propiedades del alginato y aplicaciones en alimentos. 10. Babazadeh, A., Ghanbarzadeh, B. and Hamishehkar, H. (2016). Novel nanostructured lipid carriers as a promising food grade delivery system for rutin. Journal of Functional Foods, 26: 167-175. https://doi.org/10.1016/j.jff.2016.07.017 [ Links ]
Barros, A. P. H., Morantes, M. T. A., Hoyos, M. I. C. and Ospino, L. J. M. (2016). Preparation of chitosan nanoparticles modified with sodium alginate with potential for controlled drug release. Revista EIA/English version, 12(2): 75-83. [ Links ]
Bock, N. Woodruff, M. A. Hutmacher, D. W. and Dargaville, T. R. (2011). Electrospraying, a reproducibles Methid for Production of Polymeric Microspheres for Biomedical Applications. Polymers 3(1): 131-149 https://doi.org/10.3390/polym3010131 [ Links ]
Cendejas, X. L. M. & Ortega, I. A. Q. (2017). Síntesis y caracterización de esferas poliméricas para la liberación de fármacos. Jóvenes en la Ciencia revista de divulgacion de la ciencia, 3(2): 2696-2700. http://www.jovenesenlaciencia.ugto.mx/ [ Links ]
Colín-Orozco, J., Zapata-Torres, M., Pedroza-Islas, R. and Rodríguez-Gattorno, G. (2013). Crecimiento y caracterización de nanofibras obtenidas a partir de proteína aislada de suero lácteo y oxido de polietileno por la técnica de electrohilado. Superficies y vacío, 26 (2): 31-35. http://www.scielo.org.mx/scielo.php?script=sci_arttext&pid=S166535212013000200001&lng=es&tlng=es [ Links ]
Costamagna, M. S., Gómez-Mascaraque, L. G., Zampini, I. C., Alberto, M. R., Pérez, J., López-Rubio, A. and Isla, M. I. (2017). Microencapsulated chañar phenolics: A potential ingredient for functional foods development. Journal of Functional Foods , 37: 523-530. https://doi.org/10.1016/j.jff.2017.08.018 [ Links ]
Cuatzo, L., MI. (2010). Efecto de las condiciones de proceso en la conservación de alimentos encapsulados por el método de gelificación iónica [Maestría]. Instituto Politecnico Nacional, México. http://tesis.ipn.mx/jspui/bitstream/123456789/9472/1/120.pdf [ Links ]
Dias, D. R., Botrel, D. A., Fernandes, R. V. D. B. and Borges, S. V. (2017). Encapsulation as a tool for bioprocessing of functional foods. Current Opinion in Food Science, 13: 31-37. https://doi.org/10.1016/j.cofs.2017.02.001 [ Links ]
Durán, E., Villalobos, C., Churio, O., Pizarro, F. and Valenzuela, C. (2017). Encapsulación de hierro: Otra estrategia para la prevención o tratamiento de la anemia por deficiencia de hierro. Revista chilena de nutrición, 44(3): 234-243. https://scielo.conicyt.cl/scielo.phppid=S071775182017000300234&script=sci_arttext&tlng=e [ Links ]
Galán, M. G., Llopart, E., Tissera, E., Alladio, A. and Drago, S. R. (2014). Bioaccesibilidad de hierro de fortificación y zinc endógeno de fideos comerciales tipo spaghetti. Revista Española de Nutrición Humana y Dietética, 18(2): 74-80. https://doi.org/10.14306/renhyd.18.2.53 [ Links ]
Giro-Paloma, J., Martínez, M., Cabeza, L. F., and Fernández, A. I. (2016). Types, methods, techniques, and applications for microencapsulated phase change materials (MPCM). Renewable and Sustainable Energy Reviews, 53: 1059-1075. https://doi.org/10.1016/j.rser.2015.09.040 [ Links ]
Hernández-Gálvez, V. S. (2015). Encapsulación de hierro hemínico en cápsulas de alginato de sodio como un suplemento oral para cerdos neonatos: estudio in vitro. http://repositorio.uchile.cl/bitstream/handle/2250/136262/Encapsulaci%F3n-de-hierro-hem%EDnico-en-c%E1psulas-de-alginato-de-sodio-como-un-suplemento-oralpara-cerdos-neonatos-%20estudios-in-vitro.pdf?sequence=1!‚«P‚‚._&@ [ Links ]
Hernández-Torres J., Ilina, A., Ventura-Sobrevilla, J. M., Belmares-Cerda, R. E., Contreras-Esquivel, J. C., Álvarez, G. M. and Martínez-Hernández, J. L. (2016). La microencapsulación de bioactivos para su aplicación en la industria. Yeast Saccharomyces cerevisiae and the production of alcohol. 12. http://www.redalyc.org/articulo.oa?id=223148420003 [ Links ]
López-Rubio, A., E. Sanchez, Y. Sanz, and J. M. Lagaron. 2009. Encapsulation of Living Bifidobacteria in Ultrathin PVOH Electrospun Fibers. Biomacromolecules. 10:2823-2829. https://doi:10.1021/bm900660b. [ Links ]
Menger, F. M., R. Zana, and B. Lindman. 1998. Portraying the Structure of Micelles. J. Chem. Educ. 75:115. https://doi:10.1021/ed075p115 [ Links ]
Nava-Reyna, E., G. Michelena-Álvarez, A. Lliná, and J. L. Martínez-Hernandez. 2015. Microencapsulación de componentes bioactivos. Investigación y Ciencia: de la Universidad Autónoma de Aguascalientes. 23:64-70 [ Links ]
Nazzaro, F., Orlando, P., Fratianni, F. and Coppola, R. (2012). Microencapsulation in food science and biotechnology. Current opinion in biotechnology, 23(2): 182 186. https://doi.org/10.1016/j.copbio.2011.10.001 [ Links ]
Pérez-Calderón, J. F., Santos, M. V. and Zaritzky, N. E. (2018). Desestabilización de emulsiones petróleo/agua mediante la aplicación del biopolimero quitosano. Asociacion Quimica Argentina. Journal of the Argentine Chemical Society, 105(1): 1-13. http://hdl.handle.net/11336/86385 [ Links ]
Ray, S., Raychaudhuri, U. and Chakraborty, R. (2016). An overview of encapsulation of active compounds used in food products by drying technology. Food Bioscience, 13: 76 83. https://doi.org/10.1016/j.fbio.2015.12.009 [ Links ]
Rodríguez-Llimos, A. C., Chiappetta, D., Szeliga, M. E., Fernández, A. and Bregni, C. (2003). Micropartículas de alginato conteniendo paracetamol. Ars pharmaceutica, 44(4): 333-342. http://hdl.handle.net/10481/28182 [ Links ]
Quintero, B. P., Trujillo, V. C., Muñoz, G., Valbuena, W. L., Zuluaga, F., Parra, W. G. and Marmolejo, A. R. (2018). Preparación y caracterización de geles conductores a base de quitosano para posibles aplicaciones biomédicas. Revista de Ciencias, 21(1): 91-99. https://doi.org/10.25100/rc.v21i1.6349 [ Links ]
Soto-Martínez, K. M. (2018). Desarrollo y caracterización de nanofibras electroestiradas de proteína de amaranto y pululano cargadas con dos bacteriocinas: nisina A y pediocina PA-1 [Thesis]. http://ri-ng.uaq.mx/handle/123456789/1129 [ Links ]
Sankalia, M. G., Mashru, R. C., Sankalia, J. M. and Sutariya, V. B. (2005). Papain entrapment in alginate beads for stability improvement and site-specific delivery: physicochemical characterization and factorial optimization using neural network modeling. Aaps pharmscitech, 6(2): E209-E222. https://link.springer.com/content/pdf/10.1208%2Fpt060231.pdf [ Links ]
Valenzuela, C., Hernández, V., Rodríguez, F. and Carrillo, R. (2013). Tecnología de encapsulación y su aplicación en ciencias veterinarias. Avances en Ciencias Veterinarias, 28(2): 58-75. http://repositorio.uchile.cl/bitstream/handle/2250/122625/tecnologia-de-encapsulacion-y-su-aplicacion-en-ciencias-veterinarias.pdf?sequence=1¿ [ Links ]
Valenzuela, C., Hernández, V., Morales, M. S., Neira-Carrillo, A. and Pizarro, F. (2014). Preparation and characterization of heme iron-alginate beads. LWT-Food science and technology, 59(2): 1283-1289. https://doi.org/10.1016/j.lwt.2014.04.030 [ Links ]
Verde, C. J., Á. E. Vega, C. J. López, Z. M. Estrada, S. F. Malpica, Z. C. Pelayo, C. M. Pérez, S. P. Ruiz, A. G. Trejo, and C. L. Tovar. 2013. Manual de prácticas de laboratorio Química Orgánica I. primera. Universidad Autónoma Metropolitana, México. http://www.izt.uam.mx/ceu/publicaciones/MQA/analitica.pdf [ Links ]
Wen, P., Zong, M. H., Linhardt, R. J., Feng, K. and Wu, H. (2017). Electrospinning: A novel nano-encapsulation approach for bioactive compounds. Trends in Food Science & Technology. 70: 56.68. https://doi.org/10.1016/j.tifs.2017.10.009 [ Links ]
Wu, N., Liu, X., Zhao, C., Cui, C. and Xia, A. (2016). Effects of particle size on the magnetic and microwave absorption properties of carbon-coated nickel nanocapsules. Journal of Alloys and Compounds, 656: 628-634. https://doi.org/10.1016/j.jallcom.2015.10.027 [ Links ]
Zhao, W. & Wang, Y. (2017). Coacervation with surfactants: From single-chain surfactants to gemini surfactants. Advances in colloid and interface science, 239: 199-212. https://doi.org/10.1016/j.cis.2016.04.005 [ Links ]
Zhu, F. (2017). Encapsulation and delivery of food ingredients using starch based systems. Food Chemistry, 229: 542-552. https://doi.org/10.1016/j.foodchem.2017.02.101 [ Links ]
Zhang, X. Kobayashi, I. Uemura, K. Nakajima, M. Colloids Surf. (2013) A: Physicochem. Eng. Asp. 2013: 436, 937. [ Links ]
Fuentes de financiamiento
Este proyecto contó con el apoyo financiero del Fondo de Proyectos Especiales de Rectoría de la UAQ con folio FOPER-2018-00418. También fue financiado parcialmente con el proyecto SIP 20180197 y SIP20196083 del Instituto Politécnico Nacional
Como citar este artículo: Mendoza-Meneses, C.J., Gaytán-Martínez, M., Morales- Sánchez, E., Contreras-Padilla M. (2020). Physicochemical and thermal characteristics of microencapsulated Fe by electrostatic coacerva-tion. Revista Bio Ciencias 7, e680. doi: https://doi.org/10.15741/revbio.07.e680
Recibido: 06 de Febrero de 2019; Aprobado: 25 de Marzo de 2020











 text in
text in