Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista bio ciencias
On-line version ISSN 2007-3380
Revista bio ciencias vol.7 Tepic 2020 Epub Nov 18, 2020
https://doi.org/10.15741/revbio.07.e803
Artículos Originales
Identificación y actividad antagónica in vitro de aislados de bacterias contra hongos de importancia agrícola
1 Universidad Autónoma de Nayarit, Unidad Académica de Agricultura, Posgrado en Ciencias Biológico Agropecuarias; Carretera Tepic-Compostela Km. 9. Xalisco, Nayarit; México.
2 Centro de Investigación en Alimentación y Desarrollo, A.C., Unidad Cuauhtémoc, Av. Río Concho s/n Parque Industrial, Ciudad Cuauhtémoc, Chihuahua; México.
3 Universidad Autónoma de Nayarit, Unidad Académica de Agricultura; Carretera Tepic-Compostela Km. 9. C.P. 63155. Xalisco, Nayarit; México.
Debido al uso desmedido de moléculas químicas en el control de enfermedades que provocan desequilibrios ecológicos, efectos en la salud humana y daños ambientales, la implementación de estrategias de control biológico para el manejo de problemas fitosanitarios es una opción sustentable. Para generar alternativas que contribuyan a la gestión sostenible de los cultivos en Nayarit, México, se aislaron e identificaron bacterias antagónicas de suelo de la rizosfera de agroecosistemas de aguacate Hass (recolectadas de enero a diciembre de 2014). Se obtuvieron 10 aislados bacterianos: cuatro pertenecientes a B. subtilis, cuatro a B. amyloliquefaciens, una Bacillussp. y una perteneciente a Burkholderia cepacia. Se estimó el porcentaje de inhibición de crecimiento radial (PIRG) de estos aislados, al confrontarse in vitro contra los hongos Phytophthora cinnamomi, Fusarium oxysporum y Collectotrichum sp. principales hongos de importancia económica en México. El PIRG de las cepas bacterianas sobre P. cinnamomi fluctuó de 42.25 a 70.24 %, de 33.2 a 56.33 % para F. oxysporum y de 35 a 64.43 % para Collectotrichum sp. Los resultados mostraron el potencial de las bacterias evaluadas sobre P. cinnamomi, F. oxysporum y Collectotrichum sp.
Palabras clave: Bacillus; inhibición; antagonismo; hongos fitopatógenos; control biológico
Due to the excessive use of chemical molecules in the control of diseases that cause ecological imbalances, effects on human health and environment damage, the implementation of biological control strategies for the management of phytosanitary problems is a sustainable option. In order to generate alternatives that contribute to the sustainable management of crops in Nayarit, Mexico, antagonistic bacteria collected from the rhizosphere of the Hass avocado agroecosystem (January to December 2014) were isolated. We obtained 10 bacterial isolates, four belonging to B. subtilis, four to B. amyloliquefaciens, one to Bacillus sp. and one identified as Burkholderia cepacia. The percentage of inhibition of radial growth (PIRG) of these isolates was estimated when confronted in vitro against Phytophthora cinnamomi, Fusarium oxysporum and Colletotrichum sp. which are of economic importance in Mexico. The PIRG of the bacterial isolates on P. cinnamomi ranged from 42.25 to 70.24 %, 33.2 to 56.33 % for F. oxysporum and 35 to 64.43 % for Colletotrichum sp. The results showed the potential of the bacteria evaluated on P. cinnamomi, F. oxysporum, and Colletotrichum sp.
Key words: Bacillus; inhibition; antagonism; phytopathogenic fungi; biocontrol
Introducción
La mayoría de las enfermedades en los cultivos del mundo son causadas principalmente por hongos, bacterias, virus y nematodos, éstos son responsables de cuantiosas pérdidas económicas, debido a la disminución de la calidad del producto o la pérdida total del cultivo cuando la severidad es alta. Sin embargo, los hongos, son con mayor frecuencia los causantes del daño a los cultivos (Rios et al., 2016).
El manejo de enfermedades en los cultivos, depende básicamente de la aplicación de fungicidas químicos (APEAM, 2019), algunos de estos conocidos por sus impactos negativos al ambiente e incluso a la salud de trabajadores agrícolas y consumidores; así como en el desarrollo de hongos patógenos resistentes a los fungicidas sintéticos usados en respuesta a la fuerte presión de selección, además de la pérdida de la biodiversidad en los agroecosistemas. Ante la presión social por obtener alimentos inocuos, se ha intensificado la búsqueda de alternativas para el manejo de enfermedades en cultivos agrícolas (Fisher et al., 2012; Gerbore et al., 2014), entre ellas destacan las culturales y genéticas, y recientemente, el uso de agentes de control biológico con énfasis en microorganismos antagonistas nativos como cepas bacterianas (Zeilinger & Omann, 2007; Andrade et al., 2015), esto como alternativas sustentables en el manejo de enfermedades (Ait-Lahsen et al., 2001). Dentro de estas, las bacterias antagónicas como Pseudomonas, Burkholderia, Acinetobacter, Arthrobacter, Azospirillum, Serratia y Bacillus (Suárez & Rangel, 2013; Zavaleta et al., 2015), son una alternativa prometedora por su capacidad antagónica contra una gran variedad de fitopatógenos debido a la producción de diversos compuestos antimicrobianos y por sus múltiples efectos positivos sobre las plantas como promotoras del crecimiento vegetal (Kloepper et al., 2004; Carreras, 2011; Pliego et al., 2011).
Las especies del género Bacillus son las más ampliamente distribuidas y estudiadas debido a su capacidad antagónica contra una gran variedad de fitopatógenos (Pozo et al., 2007; Leelasuphakul et al., 2008). Se han aislado de diferentes hábitats, generalmente asociadas a la rizosfera o a tejidos de plantas, donde destaca B. megaterium, B. licheniformis, B. circulans y B. subtilis; esta última, como la más utilizada como antagonista de fitopatógenos (Cazorla et al., 2007; Tendulkar et al., 2007; Ali et al., 2009; Mehta et al., 2010; Rios et al., 2014). A pesar de la necesidad urgente de nuevas alternativas, en México, existen pocos productos comerciales disponibles para el control biológico de fitopatógenos, de los cuales se desconoce en su mayoría si los microorganismos antagonistas son nativos o exóticos (Zavaleta et al., 2015). Por lo tanto, el objetivo del estudio fue identificar y evaluar la actividad antifúngica in vitro de aislados bacterianos contra hongos de importancia económica para México.
Material y Métodos
Ubicación del sitio experimental.
Las bacterias antagónicas, se aislaron de muestras de suelo (500-600 g), asociado a la rizosfera de árboles de aguacate Hass (10-15 cm profundidad). Los muestreos se realizaron de enero a diciembre del 2014 (Rios et al., 2014), en 20 huertos comerciales de los municipios de Tepic y Xalisco, Nayarit, México (Tabla 1). Las muestras se trasladaron en bolsas de polietileno (Ecobolsas® 20 × 30 cm) al Laboratorio de Parasitología Agrícola del Centro Multidisciplinario de Investigación Científica (CEMIC) de la Universidad Autónoma de Nayarit (UAN) donde fueron almacenadas a 4 °C, hasta su procesamiento.
Tabla 1 Huertos de aguacate muestreados, ubicación geográfica de los municipios de Nayarit, México.
| Municipalities | |||||
|---|---|---|---|---|---|
| Xalisco | Tepic | ||||
| Locality | Geographic location |
Altitude (mamsl) |
Locality | Geographic location |
Altitude (mamsl) |
| Emiliano Zapata | 21°22'50" N 104°56'01" O |
1,191 | Camichin III | 21°29'57" N 104°46'39" O |
1,022 |
| Curva | 21°22'11" N 104°53'38" O |
1,033 | Camichin II | 21°29'31" N 104°47'22" O |
1,006 |
| Xalisco | 21°26'00" N 104°54'11" O |
1,002 | Libertad | 21°31'44" N 105°01'29" O |
1,008 |
| Tacote | 21°24'46" N 104°55'35" O |
1,129 | Yerba | 21°31'27" N 105°02'45" O |
850 |
| Cuarenteño | 21°27'49" N 105°01'38" O |
1,118 | Guayabitos | 21°31'11" N 104°59'51" O |
1,120 |
| Carbonera | 21°27'40" N 105°00'28" O |
1,423 | Venustiano Carranza | 21°31'00" N 104°58'58" O |
1,099 |
| Xalisco U.A.A. | 21°25'32" N 104°53'31" O |
977 | Ahuacate | 21°31" 03" N 104°56'26" O |
978 |
| Tezcalate | 21°31'44" N 105°01'29" O |
1,030 | Fortuna | 21°32'47" N 104°56'33" O |
862 |
| Comunidad Indígena |
21°23'35" N 104°53'46" O |
1,027 | Tintilagua | 21°29'02" N 104°46'38" O |
1,148 |
| Pantanal | 21°25'54" N 104°52'16" O |
952 | Noria | 21°30' 33" N 104°58'20" O |
1,254 |
* mamsl: metros sobre el nivel del mar.
Aislamiento e identificación de bacterias.
Para el aislamiento e identificación de bacterias, se homogeneizaron las muestras de suelo de cada huerto y se tomó una sub-muestra de 10 g, se colocó en 90 mL de agua destilada estéril, se mantuvo en agitación constante por 30 min. Subsecuentemente, se tomó una alícuota de 1 mL y se colocó en un tubo de ensayo con 9 mL de agua destilada estéril. Se realizaron diluciones consecutivas, hasta obtener las diluciones 10-3, 10-4 y 10-5, de las cuales se tomaron 80 µL y se depositaron por duplicado en cajas de Petri de 90 mm de diámetro que contenían medio de cultivo Papa Dextrosa Agar (PDA) y se homogenizaron mediante la técnica de difusión (Guigón & González, 2004). Se incubaron a 28 °C, hasta observar crecimiento bacteriano. Las colonias bacterianas que mostraron inhibición contra hongos u otras bacterias que crecieron en las cajas de Petri se aislaron y crecieron en PDA a las 48 h a 28 °C. La identificación bacteriana se llevó a cabo mediante el análisis de la secuencia de la región 16S rDNA. Para lo cual, el DNA genómico (DNAg) de las bacterias fue extraído con el kit comercial ZR Fungal/bacterial DNA Miniprep™ (Zymo Research, Irving CA, USA) con base en las instrucciones del fabricante. La calidad y cantidad de DNA fue determinada mediante espectrofotometría a D.O. 260 nm. La integridad del DNA se evaluó mediante electroforesis en geles de agarosa al 1 %. La región ribosomal 16S de cada uno de los aislados bacterianos se amplificó mediante la técnica de PCR, utilizando los oligonucleótidos FD1 (5´-TCGTC-GACAACAGAGTTTGATCCTGGCTCAG-3´) yRD1 (5´-CC-CGGGATCCAAGCTTAAGGAGGTGATCCAGCC-3´). Las condiciones de amplificación por PCR se llevaron a cabo a 94 °C por 2 min (1 ciclo), 94 °C por 30 s, 55 °C por 30 s, y 72 °C por 1.5 min (35 ciclos), con una extensión final a 72 °C por 5 min. Los productos de PCR amplificados fueron purificados con el Kit Gen Elute PCR Clean-up kit (Sigma, CA, USA) de acuerdo con las instrucciones del fabricante. La secuenciación fue hecha por el Instituto de Biotecnología UNAM (IBT-UNAM, Morelos, México). Las secuencias de los aislados bacterianos fueron comparadas con las bases de datos del Ribosomal Database Project (RDP) y NCBI GenBank, usando el algoritmo de BLAST para verificar el porcentaje de identidad correspondiente a la especie.
Ensayos in vitro de la actividad antifúngica.
La capacidad antagónica de las 10 cepas bacterianas aisladas de rizosfera de aguacate contra Phytophthora cinnamomi, Fusarium oxysporum y Collectotrichum sp., hongos obtenidos del cepario de microorganismos del CEMIC, se evaluaron mediante confrontaciones in vitro por medios difusibles con la prueba de cuatro cuadrantes. Los aislados de B. methylotrophicus (Bm-10) y B. amyloliquefaciens (Ba-01) incluidas en estos ensayos fueron proporcionadas por el Centro de Investigación en Alimentación y Desarrollo A. C. Dichas cepas han sido reportadas previamente con potencial para el control de hongos fitopatógenos (Rios et al., 2014).
Con respecto a las confrontaciones de bacterias contra hongos, se realizaron de acuerdo con la metodología descrita por Rios et al. (2014) con modificaciones. Se colocaron explantes de 5 mm de diámetro de hongo (conidios sin cuantificar) de ocho días de crecimiento, en el centro de la caja de Petri conteniendo PDA, la bacteria antagónica fue inoculada el mismo día, en los cuatro puntos cardinales de la caja de Petri con explantes de PDA del mismo diámetro de los hongos con crecimiento bacteriano de 72 h de edad. Los testigos consistieron en explantes de los hongos de 5 mm de diámetro crecidos en PDA en ausencia de los aislados bacterianos.
Las cajas se incubaron a 28 °C en una cámara bioclimática (Novatech Ei45) y se realizaron mediciones sistemáticas cada 24 h por 10 d, del crecimiento radial de las colonias de los hongos y bacterias antagonistas en confrontación y de los testigos. La capacidad antifúngica de los aislados bacterianos se determinó con base en el porcentaje de inhibición de crecimiento radial (PIRG) de acuerdo a la formula PIRG = (R1 - R2) / R1 × 100, donde R1 fue el radio del hongo testigo y R2 fue el radio del hongo en la confrontación con los antagonistas (Ezziyyani et al., 2004).
Para el análisis estadístico, se utilizó un diseño completamente al azar, el experimento consistió en 12 tratamientos (aislados de bacterias antagonistas), confrontados contra tres hongos putativamente fitopatógenos, además de un testigo para cada hongo, donde cada repetición constó de tres cajas de Petri (unidades experimentales). Todas las evaluaciones se realizaron por triplicado. Los datos del PIRG y halo de inhibición se analizaron mediante el paquete estadístico Statistical Analysis System versión 9.0 (SAS, 2002), para el análisis de varianza (ANOVA) y las medias fueron separadas con la prueba de Tukey (p=0.05).
Resultados y Discusión
Se obtuvieron 10 aislados bacterianos, la mayoría correspondió al género Bacillus de acuerdo con sus caracteres morfológicos. Mediante la comparación de las secuencias obtenidas de estos aislados bacterianos con las registradas en el NCBI GenBank y RDP, se corroboró su identidad morfológica previa (Tabla 2). El municipio de Tepic presentó la mayor frecuencia de aislamientos de bacterias antagónicas, una cepa perteneciente a Burkholderia cepacia, una a Bacillus sp., tres a B. amyloliquefaciens y tres a B. subtilis, mientras que en el municipio de Xalisco se obtuvieron dos aislados, una de B. amyloliquefaciens y otra de B. subtilis.
Tabla 2 Bacterias antagonistas identificadas molecularmente aisladas de rizosfera de huertos comerciales de aguacate de los municipios de Tepic y Xalisco, Nayarit, México.
| Origen/Locality | Key of the isolated | Molecular identification |
|---|---|---|
| Ahuacate | Bc-02 | Burkholderia cepacia |
| Camichin II | Ba-12 | Bacillus amyloliquefaciens |
| Camichin III | Bsp-03 | Bacillus sp. |
| Carbonera | Ba-04 | Bacillus amyloliquefaciens |
| Comunidad Indígena | Bs-06 | Bacillus subtilis |
| Fortuna | Bs-11 | Bacillus subtilis |
| Guayabitos | Bs-09 | Bacillus subtilis |
| Noria | Bs-07 | Bacillus subtilis |
| Noria | Ba-05 | Bacillus amyloliquefaciens |
| Yerba | Ba-08 | Bacillus amyloliquefaciens |
Actividad antagónica de aislados bacterianos contra fitopatógenos.
De acuerdo con las confrontaciones in vitro, se determinó que los 10 aislados bacterianos obtenidos, mostraron actividad antagónica contra Phytophthora cinnamomi, Fusarium oxysporum y Colletotrichum sp. (Figura 1). Los aislados Bc-02 y Ba-05, identificados como B. cepacia y B. amyloliquefaciens, respectivamente mostraron la mayor capacidad de inhibición 70.24 % y 61.08 % sobre P. cinnamomi, mientras que el aislado Bm-10 identificado como B. amyloliquefaciens mostró el menor PIRG (42.25 %) contra P. cinnamomi (Figura 1A). Adicionalmente, se observó una reducción en la tasa de crecimiento micelial de P. cinnamomi con el aislado Bc-02 de 9.1 mm/día.
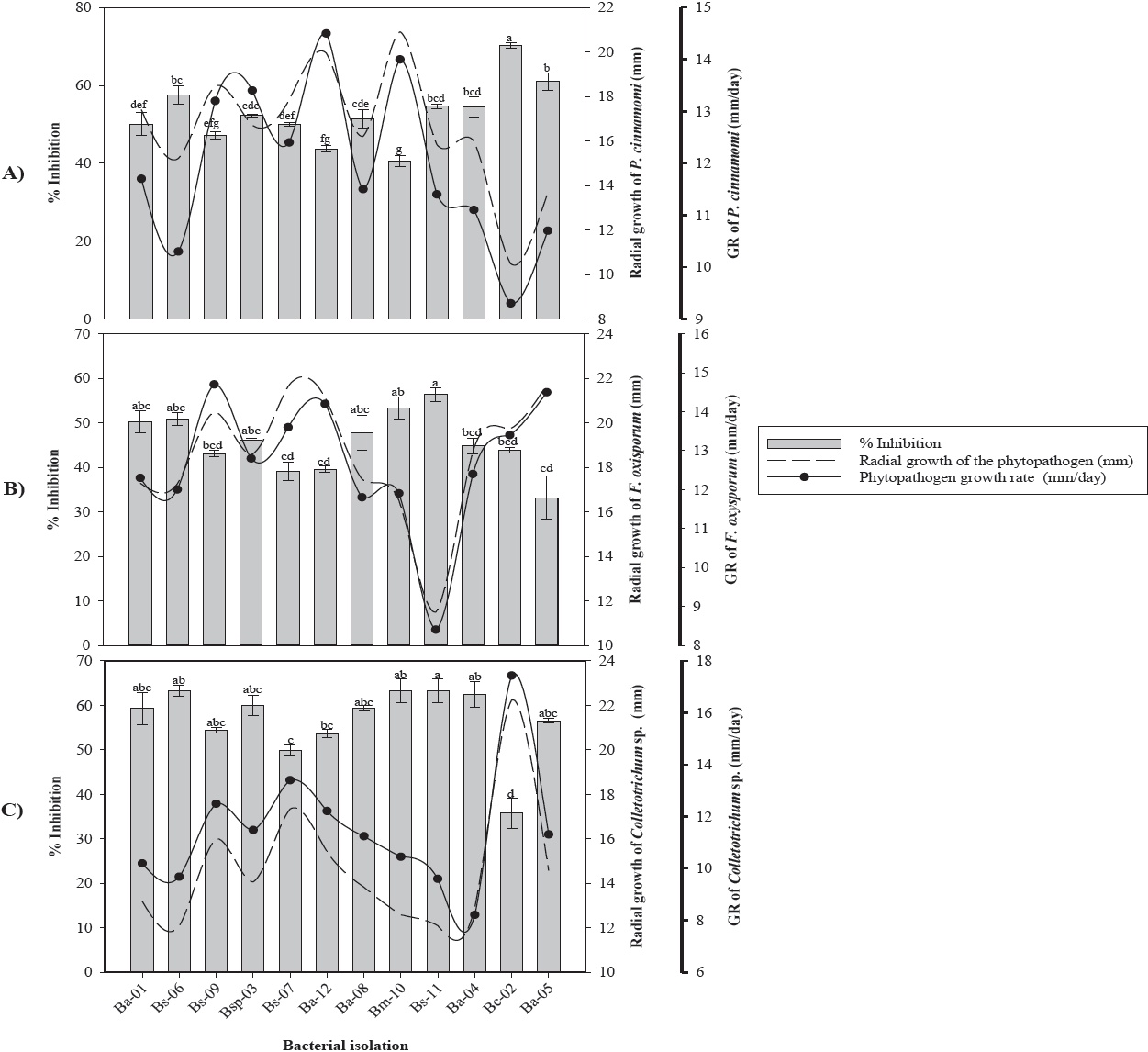
Figura 1 Efecto antifúngico de cepas bacterianas en el crecimiento radial, tasa de crecimiento y porcentaje de inhibición micelial de A) Phytophthora cinnamomi, B) Fusarium oxysporum y C) Colletotrichum sp. * GR= Tasa de crecimiento. Valores con la misma letra son estadísticamente iguales de acuerdo con la prueba Tukey (p=0.05).
Los ensayos in vitro de los aislados Ba-05 y Bs-11 contra F. oxysporum mostraron inhibiciones de 33 % a 56.33 % con reducciones en su tasa de crecimiento de 7.33 mm/ día, respectivamente (Figura 1B). Los aislados Bs-11 y Bs-06 identificadas como B. subtilis mostraron inhibiciones superiores al 63.24 % sobre Colletotrichum sp., mientras que el aislado B. cepacia (Bc-06) mostró la menor inhibición (35.72 %) con respecto al testigo (Figura 1C). En este hongo, se observó una reducción en la tasa de crecimiento micelial 10.47 mm/día al confrontarse con el aislado Bs-11 de B. subtilis.
De los 10 aislados bacterianos obtenidos de rizosfera de árboles de aguacate, 90 % perteneció al género Bacillus y el 10 % al género Burkholderia. Estos resultados concuerdan con los obtenidos por Pozo et al. (2007) quienes aislaron bacterias de diferentes regiones de la Habana, Cuba, con un gran número de cepas correspondientes al género Bacillus spp. Garbeva et al. (2003) en estudios de la microbiota de suelos agrícolas, determinaron que aproximadamente el 95 % del DNA presente en estos, pertenecía a los géneros Bacillus y Paenibacillus. El aislado Bc-02 de B. cepacia mostró la mayor inhibición de crecimiento (70.24 %) sobre P. cinnamomi, seguida por los aislados Ba-05 y Bs-06 pertenecientes a B. amyloliquefaciens y B. subtilis, con inhibiciones de crecimiento de 61.08 % y 57.54 %, respectivamente. Estos resultados coinciden con Ezziyyani et al. (2004), quienes reportaron a B. cepacia con una inhibición de Phytophthora capsici del 81 % a las 96 h y a los 8 d fue sobrecrecida por la bacteria. Este aislado tiene potencial de uso como agente de control biológico de fitopatógenos, por su alta capacidad inhibitoria atribuida a la producción de metabolitos secundarios como pirrolnitrina, altericidina, cepacina, entre otros compuestos volátiles y no volátiles (Kraus & Loper, 1995; Rosales et al., 1995; El-Banna et al., 1998; De La Fuente et al., 2001; Quan et al., 2006).
La inhibición del crecimiento de F. oxysporum y Colletotrichum sp., inducida por los aislados de Bacillus spp. fue significativamente diferente, estas diferencias pudieron deberse a la capacidad de cada aislado para producir compuestos antimicrobianos como bacilomicina, micosubtilina, fungimicina y zwittermicina que inhiben el crecimiento de diversos microorganismos incluidos los hongos (Pal & Gardener, 2006; Madhaiyan et al., 2010; Zhang et al., 2012). Al respecto, Edwards et al. (1994) menciona que la antibiosis es el modo de acción más común en el género Bacillus.
Fusarium oxysporum y Colletotrichum sp. mostraron inhibiciones en su crecimiento de 56.33 % y 64.43 %, inducidos por el aislado Bs-11 de B. subtilis. Corrales et al. (2011) reportaron a esta especie con una inhibición in vitro del 71.71 % sobre Fusarium spp. Kim et al. (2010) reportaron la producción de fracciones de iturina A y fengicina por una cepa de B. subtilis al confrontarse contra Colletotrichum gloeosporioides. Los antibióticos del grupo Iturin son secretados por la mayoría de las cepas de Bacillus spp. e inhiben el crecimiento micelial y la esporulación del hongo al alterar la permeabilidad de la membrana y la composición lipídica de la célula fúngica (Romero et al., 2007; Li et al., 2009). Las inhibiciones mostradas por Bacillus methylotrophicus (Bm-10) sobre Fusarium sp. (53.32 %) y Colletotrichum spp. (63.16 %), fueron similares a lo reportado por Rios et al. (2016). Al respecto, Madhaiyan et al. (2010) y Zhang et al. (2012), demostraron que B. methylotrophicus tiene capacidad antifúngica contra una gran diversidad de hongos fitopatógenos.
Bacillus methylotrophicus (Bm-10) y B. subtilis (Bs-11) mostraron la mayor capacidad antifúngica contra los tres hongos, lo cual pudiera deberse a la producción de antibióticos y/o compuestos volátiles como cianuro de hidrógeno, que se ha reportado como uno de los responsables de la inhibición del crecimiento de hongos fitopatógenos, además de sus efectos nocivos en el crecimiento in vitro de varios fitopatógenos al afectar la actividad de enzimas fúngicas específicas (Wheatley, 2002; Duffy et al., 2003; Correa et al., 2009; Zhang et al., 2012). Al respecto, Souto et al. (2004) reportaron que la capacidad antifúngica de B. amyloliquefaciens al ser confrontada in vitro se debe a la producción y liberación de péptidos y lipopéptidos al medio de cultivo, tales como fungicina, iturina, bacilomicina, entre otros. Conocer la capacidad antagónica de las cepas bacterianas sobre los diferentes fitopatógenos es de gran interés, ya que algunas cepas evaluadas en nuestro estudio mostraron mayor capacidad antifúngica in vitro contra P. cinnamomi y menor efecto al confrontarse con F. oxysporum (Figura 1B). Estos resultados muestran la variabilidad existente entre aislados, debido a la especificidad de los antibióticos producidos por bacterias (Schippers et al., 1987). Además de los mecanismos de defensa propios de los hongos.
Conclusión
En suelos rizosféricos de huertos de aguacate en Nayarit, existe diversidad de cepas bacterianas, ya que se identificaron las especies de Bacillus subtilis, Bacillus amyloliquefaciens, Burkholderia cepacia y Bacillus sp. con capacidad antagónica in vitro contra Phytophthora cinnamomi, Fusarium oxysporum y Colletotrichum sp. Algunas de estas podrían ser candidatas potenciales para incluirse en esquemas de manejo integrado de los tres hongos de interés agrícola estudiados.
Agradecimientos
Al Consejo Nacional de Ciencia y Tecnología (CONACyT) y a la Universidad Autónoma de Nayarit.
REFERENCIAS
Ait-Lahsen, H., Soler, A., Rey, M., de la Cruz, J., Monte, E. and Llobell, A. (2001). An antifungal exo-α-1, 3-glucanase (AGN13. 1) from the biocontrol fungus Trichoderma harzianum. Applied Environmental Microbiology, 67(12): 5833-5839. https://doi.org/10.1128/AEM.67.12.5833-5839.2001 [ Links ]
Ali, B., Sabri, A. N., Ljung, K. and Hasnain, S. (2009). Quantification of indole-3-acetic acid from plant associated Bacillus spp. and their phytostimulatory effect on Vigna radiata (L.). World Journal of Microbiology and Biotechnology, 25(3): 519. https://doi.org/10.1007/s11274-008-9918-9 [ Links ]
Andrade-Hoyos, P., Molina Gayosso, E., De León, C., Barquera, E., de la Cruz, M., Alvarado Rosales, D. and López Jiménez, A. (2015). Mecanismos de defensa en portainjertos de aguacate ante Phytophthora cinnamomi Rands. Revista Mexicana de Ciencias Agrícolas, 6(2): 347-360. http://www.scielo.org.mx/scielo.php?pid=S2007-09342015000200010&script=sci_arttext&tlng=en [ Links ]
APEAM (Asociación de Productores y Empacadores Exportadores de México, A. C.). (2019). Listado de fungicidas recomendados para el cultivo de aguacate. https://plaguicidas.apeamac.com/Fungicidas.aspx [ Links ]
Carreras, S. (2011). Aplicaciones de la bacteria entomopatógena Bacillus thuringiensis en el control de fitopatógenos. Corpoica. Ciencia y Tecnología Agropecuaria, 12(2): ISSN 0122-8706. https://www.redalyc.org/pdf/4499/449945031006.pdf [ Links ]
Cazorla, F., Romero, D., Pérez García, A., Lugtenberg, B., Vicente, A. d. and Bloemberg, G. (2007). Isolation and characterization of antagonistic Bacillus subtilis strains from the avocado rhizoplane displaying biocontrol activity. Journal of Applied Microbiology, 103(5): 1950-1959. https://doi.org/10.1111/j.1365-2672.2007.03433.x [ Links ]
Corrales, L. C., Sánchez, L. C., Cuervo, J., Bautista, D., González, L. y Guevara, M. (2011) Evaluación del efecto biocontrolador de Bacillus spp., frente a Fusarium spp., bajo condiciones de invernadero en Rosmarinus offiicinalis L. NOVA-Publicación Científica en Ciencias Biomédica. 8 (13): 63-75 [ Links ]
Correa, O. S., Montecchia, M. S., Berti, M. F., Ferrari, M. C. F., Pucheu, N. L., Kerber, N. L. and García, A. F. (2009). Bacillus amyloliquefaciens BNM122, a potential microbial biocontrol agent applied on soybean seeds, causes a minor impact on rhizosphere and soil microbial communities. Applied Soil Ecology, 41(2): 185-194. https://doi.org/10.1016/j.apsoil.2008.10.007 [ Links ]
De la Fuente, L., Bajsa, N., Bagnasco, P., Quagliotto, L., Thomashow, L. and Arias, A. (2001). Antibiotic production by Pseudomonas fluorescens isolated from forage legume rhizosphere. Journal of Applied Microbiology, 90: 421-429. [ Links ]
Duffy, B., Schouten, A. and Raaijmakers, J. M. (2003). Pathogen self-defense: mechanisms to counteract microbial antagonism. Annual Review of Phytopathology, 41(1): 501-538. https://www.researchgate.net/profile/Brion_Duffy/publication/40128372_Pathogen_self_defense_mechanisms_to_counteract_microbial_antagonism/links/53ee05e00cf26b9b7dc63f94.pdf [ Links ]
Edwards, S., McKay, T. and Seddon, B. (1994). Interaction of Bacillus species with phytopathogenic fungi. Methods of analysis and manipulation for biocontrol purposes. Ecology of Plant Pathogens, 101-118. [ Links ]
El-Banna, N., & Winkelmann, G. (1998). Pyrrolnitrin from Burkholderia cepacia: antibiotic activity against fungi and novel activities against streptomycetes. Journal of Applied Microbiology, 85(1): 69-78. https://doi.org/10.1046/j.1365-2672.1998.00473.x [ Links ]
Ezziyyani, M., Sánchez, C. P., Requena, M. E., Rubio, L. and Castillo, M. E. C. (2004). Biocontrol por Streptomyces rochei- Ziyani-, de la podredumbre del pimiento (Capsicum annuum L.) causada por Phytophthora capsici. Paper presented at the Anales de Biología. https://revistas.um.es/analesbio/article/view/30471 [ Links ]
Fisher, M. C., Henk, D. A., Briggs, C. J., Brownstein, J. S., Madoff, L. C., McCraw, S. L. and Gurr, S. J. (2012). Emerging fungal threats to animal, plant and ecosystem health. Nature, 484(7393): 186. https://doi.org/10.1038/nature10947 [ Links ]
Garbeva, P., Van Veen, J. and Van Elsas, J. (2003). Predominant Bacillus spp. in agricultural soil under different management regimes detected via PCR-DGGE. Microbial Ecology, 45(3): 302-316. https://doi.org/10.1007/s00248-002-2034-8 [ Links ]
Gerbore, J., Vallance, J., Yacoub, A., Delmotte, F., Grizard, D., Regnault-Roger, C. and Rey, P. (2014). Characterization of Pythium oligandrum populations that colonize the rhizosphere of vines from the Bordeaux region. FEMS Microbiology Ecology, 90(1): 153-167. https://doi.org/10.1111/1574-6941.12380 [ Links ]
Guigón López, C. & González González, P. A. (2004). Selección de cepas nativas de Trichoderma spp. con actividad antagónica sobre Phytophthora capsici Leonian y promotoras de crecimiento en el cultivo de chile (Capsicum annuum L.). Revista Mexicana de Fitopatología, 22(1): 117-124. https://www.researchgate.net/profile/Cesar_Guigon-Lopez/publication/242615786_Seleccion_de_Cepas_Nativas_de_Trichoderma_spp_con_Actividad_Antagonica_sobre_Phytophthora_capsici_Leonian_y_Promotoras_de_Crecimiento_en_el_Cultivo_de_Chile_Capsicum_annuum_L/links/0046353605cf28f89b000000/Seleccion-de-Cepas-Nativas-de-Trichoderma-spp-con-Actividad-Antagonica-sobre-Phytophthora-capsici-Leonian-y-Promotoras-de-Crecimiento-en-el-Cultivo-de-Chile-Capsicum-annuum-L.pdf [ Links ]
Kim, P. I., Ryu, J., Kim, Y. H. and Chi, Y.-T. (2010). Production of biosurfactant lipopeptides Iturin A, fengycin and surfactin A from Bacillus subtilis CMB32 for control of Colletotrichum gloeosporioides. Journal of Microbiology and Biotechnology, 20(1): 138-145. https://doi.org/10.4014/jmb.0905.05007 [ Links ]
Kloepper, J. W., Ryu, C.-M. and Zhang, S. (2004). Induced systemic resistance and promotion of plant growth by Bacillus spp. Phytopathology, 94(11): 1259-1266. https://doi.org/10.1094/PHYTO.2004.94.11.1259 [ Links ]
Kraus, J. & Loper, J. E. (1995). Characterization of a genomic region required for production of the antibiotic pyoluteorin by the biological control agent Pseudomonas fluorescens Pf-5. Applied and Environmental Microbiology., 61(3): 849-854. https://aem.asm.org/content/61/3/849.short [ Links ]
Leelasuphakul, W., Hemmanee, P. and Chuenchitt, S. (2008). Growth inhibitory properties of Bacillus subtilis strains and their metabolites against the green mold pathogen (Penicillium digitatum Sacc.) of citrus fruit. Postharvest Biology and Technology, 48(1): 113-121. https://doi.org/10.1016/j.postharvbio.2007.09.024 [ Links ]
Li, J., Yang, Q., Zhao, L.-h., Zhang, S.-M., Wang, Y.-X. and Zhao, X.-Y. (2009). Purification and characterization of a novel antifungal protein from Bacillus subtilis strain B29. Journal of Zhejiang University SCIENCE B, 10(4): 264-272. https://doi.org/10.1631/jzus.B0820341 [ Links ]
Madhaiyan, M., Poonguzhali, S., Kwon, S.-W. and Sa, T.-M. (2010). Bacillus methylotrophicus sp. nov., a methanol-utilizing, plant-growth-promoting bacterium isolated from rice rhizosphere soil. International Journal of Systematic and Evolutionary Microbiology, 60(10): 2490-2495. https://doi.org/10.1099/ijs.0.015487-0 [ Links ]
Mehta, P., Chauhan, A., Mahajan, R., Mahajan, P. K. and Shirkot, C. K. (2010) Strain of Bacillus circulans isolated from apple rhizosphere showing plant growth promoting potential. Current Sciencie. 98(4): 538-542. 2010. https://www.jstor.org/stable/24111705?seq=1 [ Links ]
Pal, K. & Gardener, B. (2006). The plant health Instructor in biological control of plant pathogens, Constable, London. English, 206p. [ Links ]
Pliego, C., Ramos, C., de Vicente, A. and Cazorla, F. M. (2011). Screening for candidate bacterial biocontrol agents against soilborne fungal plant pathogens. Plant and Soil, 340(1-2): 505-520. https://doi.org/10.1007/s11104-010-0615-8 [ Links ]
Pozo, Y. R., Flores, D. V., Romero, L. C., Pérez, E. G. and Álvarez-Rivera, V. P. (2007). Selección de cepas de Bacillus y otros géneros relacionados para el control biológico de hongos fitopatógenos. Fitosanidad, 11(1): 35-40. http://www.fitosanidad.cu/index.php/fitosanidad/article/view/246 [ Links ]
Quan, C., Zheng, W., Liu, Q., Ohta, Y. and Fan, S. (2006). Isolation and characterization of a novel Burkholderia cepacia with strong antifungal activity against Rhizoctonia solani. Applied Microbiology and Biotechnology, 72(6): 1276-1284. https://doi.org/10.1007/s00253-006-0425-3 [ Links ]
Rios Velasco, C., Caro Cisneros, J., Berlanga Reyes, D., Ruiz Cisneros, M., Ornelas Paz, J., Salas Marina, M. and Guerrero Prieto, V. (2016). Identificación y actividad antagónica in vitro de aislados de Bacillus spp. y Trichoderma spp. contra hongos fitopatógenos comunes. Revista Mexicana de Fitopatología, 34(1): 85-99. https://doi.org/10.18781/R.MEX.FIT.1507-1 [ Links ]
Rios, V. C., Ruiz, M. F. C., Berlanga, D. I. R., Acosta, C. H. M., Ornelas, J. J. P., Romo, A. C., Salas, M. A. M. and Ibarra, J. E. R. (2014) Enfermedades radiculares de árboles de manzano (Malus domestica Borkh) y su manejo en huertos del estado de Chihuahua. Boletín técnico generado en el proyecto 362, CIAD, A. C. Fundación Produce Chihuahua. 54 p. [ Links ]
Romero, D., de Vicente, A., Rakotoaly, R. H., Dufour, S. E., Veening, J.-W., Arrebola, E. and Pérez-García, A. (2007). The iturin and fengycin families of lipopeptides are key factors in antagonism of Bacillus subtilis toward Podosphaera fusca. Molecular Plant-Microbe Interactions, 20(4): 430-440. https://doi.org/10.1094/MPMI-20-4-0430 [ Links ]
Rosales, A., Thomashow, L., Cook, R. and Mew, T. (1995). Isolation and identification of antifungal metabolites produced by rice-associated antagonistic Pseudomonas spp. Phytopathology, 85(9): 1028-1032. https://doi.org/10.1094/Phyto-85-1028 [ Links ]
SAS INSTITUTE. SAS User’s Guide. Version 9.0. SAS Institute, Cary, NC. 2002. [ Links ]
Schippers, B., Bakker, A. W. and Bakker, P. A. (1987). Interactions of deleterious and beneficial rhizosphere microorganisms and the effect of cropping practices. Annual Review of Phytopathology, 25(1): 339-358. [ Links ]
Souto, G., Correa, O., Montecchia, M., Kerber, N., Pucheu, N., Bachur, M. and Garcia, A. (2004). Genetic and functional‐ characterization of a Bacillus sp. strain excreting surfactin and antifungal metabolites partially identified as iturin like compounds. Journal of Applied Microbiology, 97(6): 1247-1256. https://doi.org/10.1111/j.1365-2672.2004.02408.x [ Links ]
Suárez, C. L. Y. y Rangel, R. A. L. (2013) Aislamiento de microorganismos para control biológico de Moniliophthora roreri. Acta Agronómica. 62 (4): 370-378. [ Links ]
Tendulkar, S., Saikumari, Y., Patel, V., Raghotama, S., Munshi, T., Balaram, P. and Chattoo, B. (2007). Isolation, purification and characterization of an antifungal molecule produced by Bacillus licheniformis BC98, and its effect on phytopathogen Magnaporthe grisea. Journal of Applied Microbiology, 103(6): 2331-2339. https://doi.org/10.1111/j.1365-2672.2007.03501.x [ Links ]
Wheatley, R. (2002). The consequences of volatile organic compound mediated bacterial and fungal interactions. Antonie Van Leeuwenhoek, 81(1-4): 357-364. https://doi.org/10.1023/A:1020592802234 [ Links ]
Zavaleta, M. E., Bravo, L. L. and Guigón, L. C. (2015). Fitopatógenos con origen en el suelo In: Arredondo, B. H. C., Rodríguez Casos de Control Biológico en México, (2), B. L. A. Biblioteca Básica de Agricultura. 2015: 65-91. [ Links ]
Zeilinger, S. & Omann, M. (2007). Trichoderma biocontrol: signal transduction pathways involved in host sensing and mycoparasitism. Gene Regulation and Systems Biology, 1: 227-234. https://doi.org/10.4137/GRSB.S397 [ Links ]
Zhang, Q.-L., Liu, Y., Ai, G.-M., Miao, L.-L., Zheng, H.-Y. and Liu, Z.-P. (2012). The characteristics of a novel heterotrophic nitrification-aerobic denitrification bacterium, Bacillus methylotrophicus strain L7. Bioresource Technology, 108: 35-44. https://doi.org/10.1016/j.biortech.2011.12.139 [ Links ]
Como citar este artículo: De Dios Avila, N., Ríos Velasco, C., Luna Esquivel, G., Cambero Campos, O. J., Cambero Ayón, C. B., Estrada-Virgen, M. O. (2020). Identification and antagonic activity in vitro isolation of bacteria against fungi of agricultural important. Revista Bio Ciencias 7, e803. doi: https://doi.org/10.15741/revbio.07.e803
Recibido: 23 de Agosto de 2019; Aprobado: 10 de Febrero de 2020











 text in
text in 


