Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista bio ciencias
On-line version ISSN 2007-3380
Revista bio ciencias vol.6 Tepic Jan. 2019 Epub Oct 02, 2020
https://doi.org/10.15741/revbio.06.e433
Artículos Originales
Extracción de aceite de la semilla de Ricinus communis L. asistida por ultrasonido
1Departamento de Biotecnología, Facultad de Ciencias Químicas, Universidad Autónoma de Coahuila, V. Carranza s/n, Republica Oriente C.P. 25280, Saltillo, Coahuila de Zaragoza, México.
2Campo Experimental Saltillo. INFAP. Carretera Saltillo-Zacatecas km 8.5 No. 9515 Col. Hacienda de Buenavista Saltillo, Coahuila de Zaragoza, México
El objetivo de este trabajo fue determinar las condiciones óptimas de la extracción asistida con ultrasonido del aceite de semilla de Ricinus communis L. Se evaluó el efecto de 3 factores sobre el rendimiento de aceite extraído, los tratamiento fueron 1) pretratamiento de la semilla, 2) tiempo de incidencia del ultrasonido y 3) tipo de solvente utilizado. Los resultados fuero comparados con la extracción convencional Soxhlet para evaluar el efecto del ultrasonido. Las condiciones óptimas para la extracción de aceite consistieron en realizar un pretratamiento de lavado y secado de la semilla, asistiendo la extracción con ultrasonido en una mezcla de solventes hexano/isopropanol (1:1, v/v), durante 2.5 h. Bajo condiciones óptimas se alcanzó un máximo un rendimiento de extracción del 73.5 % y una velocidad de extracción de 1.8 g.h-1.
Palabras clave: Ricinus communis; semilla; aceite; ultrasonido
The aimed of this work was to determine the optimal conditions for oil extraction of Ricinus communis L. seed by means of ultrasound. The effect of 3 factors over oil yield extraction were evaluated: 1) seed pretreatment 2) ultrasound time and 3) solvent mixture ratio compared to conventional Soxhlet extraction. The optimal conditions for oil extraction were obtained with a pretreatment that consisted in washing and drying of the seed, with a 2.5 h exposure to ultrasound in a mixture of hexane/isopropanol solvents (1:1 v/v). The extraction yield was 73.5% with an extraction rate of 1.8 g.h-1.
Key words: Ricinus communis; seed; Oil; ultrasound
Introducción
La higuerilla (Ricinus communis L.), es una planta que pertenece a la familia Euphorbiaceae (Bauddh et al., 2015). Esta planta puede adaptarse a una gran variedad de condiciones climáticas. Las semillas de la higuerilla se consideran toxicas para los animales y humanos debido a la presencia de la toxina ricina (Vinayaka et al., 2017).
Actualmente en el país, la higuerilla ha sido calificada como un cultivo importante, dado que su semilla contiene un 40 % de aceite no comestible, considerado como una materia prima vital para la industria (Melo et al., 2008). El aceite obtenido de la semilla de R. communis, es un triglicérido de un ácido graso, y es uno de los pocos glicéridos naturales de alta pureza ya que la porción de ácido graso contiene casi 900 g kg-1 de ácido ricinoléico. El aceite es rico en un ácido graso de hidroxilo único, ácido ricinoléico (C18H34O3) estructuralmente conocido como ácido cis-12-hidroxioctadeca-9-enoico, ácido graso hidroxilado de 18 carbonos que tiene un doble enlace. La presencia de ácido ricinoléico proporciona al aceite de ricino sus propiedades únicas y versatilidad inusual. El aceite de ricino se diferencia de otros aceites por su alto valor de acetilo o hidroxilo, con un índice de yodo, viscosidad y gravedad específica comprable a otros aceites (Bhuiya et al., 2016).
Recientemente, la tecnología de ultrasonido ha surgido como una herramienta novedosa en los procesos de ingeniería de alimentos (Bhaskaracharya et al., 2009) siendo este campo de investigación donde más se ha estudiado. El ultrasonido de alta frecuencia y baja frecuencia, se ha aplicado con éxito para mejorar el proceso y/o los productos (Carcel et al., 2007), maceración (Carcel et al., 2007), inactivación microbiana y enzimática (Vercet et al., 2001), extracción de productos naturales (Vilkhu et al., 2008), operaciones de corte de alimentos (Arnold et al., 2009), procesos de sustitución de azúcar (García-Noguera et al., 2010), procesos de fermentación (Riener et al., 2010), entre otros. La aplicación de ultrasonido ha sido ampliamente estudiada para extraer compuestos de aceite de materiales vegetales (Willems et al., 2008), incluidos los de almendra en polvo (Riera et al., 2004), y las semillas de Copaifera langsdorfii (Stupp et al., 2008), Maclura pomifera y aceite de semilla de granada (Goula, 2012). Sin embargo, este proceso es complejo y su eficacia depende de muchos factores, por ejemplo, temperatura, tiempo, frecuencia de ultrasonido, tipo de disolvente y la relación sólida/líquido. La mayoría de las investigaciones se han centrado en los efectos de los parámetros en la velocidad de extracción y en los rendimientos (Vilkhu et al., 2008). La potenciación de la extracción por ultrasonido se ha atribuido a la propagación de ondas de presión ultrasónicas y fuerzas de cavitación resultantes, donde las burbujas pueden colapsar explosivamente y generar presión localizada que provoca la rotura del tejido vegetal y mejora la liberación de sustancias intracelulares en el disolvente (Knorr et al., 2002). De acuerdo con Vilkhu et al. (2008), la implosión de las burbujas de cavitación genera macro-turbulencia, colisiones entre partículas de alta velocidad y perturbación en partículas microporosas de la biomasa, lo que acelera la difusión de los remolinos y la difusión interna. Por lo tanto, el objetivo este trabajo fue determinar las mejores condiciones de la extracción asistida con ultrasonido de aceite de semilla de Ricinus communis L.
Materiales y Métodos
Acondicionamiento de la semilla
Las semillas de R. communis fueron proporcionadas por la Universidad Autónoma Agraria Antonio Narro, a las cuales se les retiró la cáscara de forma manual.
Definición de los parámetros de evaluación
Para la determinación de las mejores condiciones de extracción del aceite se utilizó un sistema Soxhlet como proceso convencional de referencia en donde se evaluaron 3 parámetros (Pretratamiento de la semilla, Tiempo de extracción, El tipo de solvente utilizado). En la Tabla 1 se muestra las variables utilizadas para cada parámetro.
Tabla 1 Variables utilizadas en cada parámetro a estudiar
| Parámetro | |||
| Pretratamiento de la semilla | Sin pretratamiento | Lavado con agua y secado a 50 ºC por 24 h en una estufa Thermo Scientific™ HERAtherm™ | Lavado con agua y secado a 50 ºC por 24 h en una estufa Thermo Scientific™ HERAtherm™ posteriormente las semillas fueron cortadas con un cortador casero dejando tamaños de partícula de aproximadamente 1-2 mm |
| Tiempo de extracción | 2, 4, 6, 8 y 10 h | ||
| Tipo de solvente utilizado | Hexano | Isopropanol | Mezcla hexano:Isoprpanol 1:1 |
Proceso de extracción Soxhlet
Las extracciones se llevaron a cabo en matraces redondos de fondo plano de 125 mL acoplados al sistema de extracción Soxhlet y un baño de agua con control de temperatura IKA® HB10. En cada extracción, 5 g de muestra y 50 mL de solvente (relación 1:10 m/v) fueron agregados a cada matraz, mantenidos a una temperatura en el rango de 63-65° C durante 4 h.
Proceso de extracción asistido por ultrasonido
Para el estudio llevado a cabo con ultrasonido se utilizó un baño ultrasónico marca Zenitron Modelo TS-200, con una energía ultrasónica de 40 kHz con controles de temperatura y de tiempo, acoplando el sistema de extracción Soxhlet (de la misma forma que los experimentos anteriores). Se utilizó el pretratamiento de las semillas y el tipo de solvente que resultaron mejores de los experimentos anteriores, variando solamente el tiempo de extracción: 0.5, 1.0, 1.5, 2.0 y 2.5 h. En todos los casos, una vez transcurrido el tiempo de extracción, se filtró la mezcla, y se recuperó el aceite del filtrado en un rotavapor (marca Yamato WATER BATH BM 400) calentando por encima del punto de ebullición del solvente utilizado. Los rendimientos de extracción fueron determinados por diferencia de pesos.
Análisis de resultados
Para el análisis de los datos se realizó un ajuste del modelo matemático para analizar las cinéticas y hacer una comparación entre las extracciones convencionales y las asistidas por ultrasonido con cada uno de los solventes a diferentes tiempos.
Donde:
Y= es el rendimiento de aceite
Y inf = es el rendimiento de aceite a tiempo infinito (máximo rendimiento)
k = velocidad de extracción de aceite y = tiempo de extracción.
Todos los análisis fueron llevados a cabo por triplicado y los valores promedio son los reportados. Un análisis de varianza (ANOVA) fue realizado con una prueba de Fisher F (p<0.05) utilizando el software Minitab® versión 17 (Minitab Inc., State College, PA, USA).
Resultados y Discusión
De acuerdo a los resultados obtenidos durante la etapa de evaluación de los diferentes pretratamientos se puede observar en la Figura 1 que el máximo rendimiento (1.54 g de aceite/5 g de semilla) fue obtenido en el pretratamiento T2, ligeramente superior al T1 con 1.42 g de aceite/5 g de semilla, y superior al pretratamiento T3 con 1.27 g de aceite/5 g de semilla. Este comportamiento es atribuido a que en T2 las semillas se encontraban libres de humedad en comparación con el control T1, lo que puede indicar que la presencia de humedad en la matriz de la semilla hace que el rendimiento de extracción disminuya ligeramente. La baja eficiencia del pretratamiento T3 es atribuido a la pérdida de aceite durante el corte de la semilla. Perea-Flores et al. (2011) describe que en la microestructura del cuerpo de la semilla de Ricinus communis L. es altamente porosa, lo cual favorece la extracción del aceite (Perea-Flores et al., 2011) durante el prensado o corte de la semilla, la cual fue evidenciada con el bajo rendimiento de extracción de aceite.
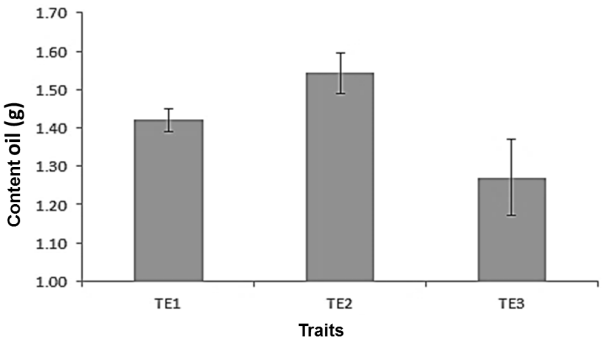
Figura 1 Influencia del pretratamiento de la semilla de higuerilla (Ricinus communis L.) para la extracción de su aceite, T1: semilla sin pretratamiento; T2: semilla lavada y secada a 50° C por 24 h; T3: semilla lavada, secada y cortada.
Se realizó un ajuste del modelo matemático para analizar las cinéticas y hacer una comparación entre las extracciones convencionales y las asistidas por ultrasonido con cada uno de los solventes a diferentes tiempos.
Donde:
Y= es el rendimiento de aceite
Y inf = es el rendimiento de aceite a tiempo infinito (máximo rendimiento)
k = velocidad de extracción de aceite
y = tiempo de extracción.
De acuerdo con los resultados con el ajuste al modelo (Figura 2) se muestra la comparación de los rendimientos obtenidos durante los procesos de extracción de aceite asistido por ultrasonido y el método convencional, donde el mejor solvente para las extracciones por el método convencional con Soxhlet fue la mezcla (hexano/isopropanol, relación 1:1) obteniendo un rendimiento máximo a tiempo infinito de 1.5 g de aceite de aceite/5 g de semilla, mientras que la extracción con hexano e isopropanol obtuvieron un rendimiento máximo fue de 1.3 g de aceite/5 g de semilla.

Figura 2 Comparación de los rendimientos máximos Yinf a tiempo infinito de la extracción convencional y la asistida con ultrasonido (US).
Por otra parte, los resultados que se obtuvieron del ajuste para las extracciones asistidas por ultrasonido se muestran Figura 2, los mejores rendimientos se obtienen usando como solvente el hexano (1.7 g, 74 %) y la mezcla de solventes (1.5 g, 73.5 %) lo cual resulta favorable comparado con lo reportado por Perdomo et al. (2013), en la cual reportaron una máxima de eficiencia de 56 % utilizando el método convencional de extracción con Soxhlet de aceite de semillas de R. communis. En la Figura 3 se comparan las velocidades iniciales de ambos procesos, el solvente que mostró una mayor velocidad inicial de extracción fue el hexano alcanzando 0.58 g.h-1, seguido del isopropanol con una velocidad inicial de 0.5 g h-1 y la mezcla mostrando una velocidad ligeramente menor a 0.49 g.h-1, lo que indica que las velocidades iniciales de extracción no son afectadas por el tipo de solvente cuando se realiza una extracción de tipo convencional, por otro lado, las mayores velocidades de extracción cuando el proceso fue asistido por ultrasonido resultaron ser el tratamiento con isopropanol con una velocidad de 3.7 g.h-1 contra 1.8 g.h-1 de la mezcla y 0.79 g.h-1 del hexano.

Figura 3 Comparación de las velocidades iniciales k en la extracción convencional y la extracción asistida por ultrasonido (US).
Al comparar y hacer un análisis de los resultados obtenidos de la extracción con hexano y la mezcla (Figura 3) para las velocidades de extracción con ultrasonido se puede inferir que el mejor tratamiento se tiene utilizando la mezcla de solventes en ambos casos ya que el rendimiento entre estos dos no es significativo, pero al momento de comparar las barras de la velocidad en la Figura 3 se observa un efecto positivo al utilizar la mezcla de solventes ya que excede hasta el doble la velocidad mostrada por el hexano. De lo cual se puede deducir que cuando se realiza una extracción con ultrasonido, el solvente influye directamente sobre la velocidad inicial de extracción siendo mayor hasta 3 veces como en el caso de la mezcla comparada con la asistencia del ultrasonido (extracción sólo en Soxhlet), en donde el tipo de solvente no influyó en la velocidad inicial. La diferencia de velocidad mostradas durante el tratamiento con ultrasonido se debe a la estructura molecular y propiedades químicas de los solventes (Akowuah et al, 2005), ya que el hexano es una molécula de mayor tamaño que el isopropanol por lo cual tarda más en penetrar la matriz de la semilla y la velocidad de extracción es más lenta mientras que el isopropanol penetra de forma más rápida la matriz por su estructura y se realiza una extracción más rápida. En las extracciones con el método convencional no se puede apreciar la diferencia de las velocidades debido a que no se genera la cavitación que se produce cuando se utiliza el ultrasonido, lo cual favorece al solvente de menor tamaño estructural y los rendimientos obtenidos responden a las polaridades de los solventes ya que mientras el hexano es un compuesto no polar y el isopropanol es un compuesto polar, las extracciones se ven favorecidas cuando se utiliza la mezcla ya que los triglicéridos presentes en el aceite una fracción polar por el grupo carbonilo y una fracción no polar representada por la cadena de hidrocarburo que lo conforma; y ambas partes se disuelven cuando se utiliza la mezcla de solventes favoreciendo la extracción y obteniendo un mayor rendimiento.
Conclusiones
De acuerdo a los resultados obtenidos se concluye que el ultrasonido mostró tener un efecto positivo en el proceso de extracción de aceite de Ricinus communis L. y que el tratamiento con la mezcla de solventes (isopropanol/ hexano 1:1, v/v) resultó ser el mejor en este proceso en ambos métodos, obteniendo un rendimiento del 73.5 % de extracción y una velocidad de 1.8 g.h-1 con ultrasonido, que excede casi en 4 veces a la velocidad mostrada en el método convencional que fue de 0.49 g.h-1 con un rendimiento del 70 %, de modo que el proceso asistido por ultrasonido mostró tener un mejor rendimiento en eficiencia de extracción en menor tiempo.
REFERENCIAS
Akowuah, G.A., Ismail, Z., Norhayati, I. and Sadikun, A. (2005). The effects of different extraction solvents of varying polarities of polyphenols of Orthosiphon stamineus and evaluation of the free radical-scavenging activity. Food Chemistry, 93)2): 311-317. https://doi.org/10.1016/j.foodchem.2004.09.028 [ Links ]
Arnold, G., Leiteritz, L., Zahn, S., and Rohm, H. (2009). Ultrasonic cutting of cheese: composition affects cutting work reduction and energy demand. International Dairy Journal, 19(5): 314-320. https://doi.org/10.1016/j.idairyj.2008.11.007 [ Links ]
Bauddh, K., Singh, K., Singh, B. and Singh, R.P. (2015). Ricinus communis: A robust plant for bio-energy and phytoremediation of toxic metals from contaminated soil. Ecological Engineering, 84: 640-652. https://doi. org/10.1016/j.ecoleng.2015.09.038 [ Links ]
Bhuiya, M.M.K., Rasul, M.G., Khan, M.M.K., Ashwath, N. and Azad, A.K. (2016). Prospects of 2nd generation biodiesel as asustainable fuel-Part: 1 selection of feedstocks, oil extraction techniques and conversion technologies. Renewable Sustainable Energy Reviews 55: 1109-1128. https://doi.org/10.1016/j.rser.2015.04.163 [ Links ]
Bhaskaracharya, R.K., Kentish, S., and Ashokkumar, M. (2009). Selected applications of ultrasonics in food processing. Food Engineering Reviews, 1: 31-49. https://doi.org/10.1007/s12393-009-9003-7 [ Links ]
Carcel, J.A., Benedito, J., Bon, J., and Mulet, A. (2007). High intensity ultrasound effects on meat brining. Meat Science, 76: 611-619. https://doi.org/10.1016/j.meatsci.2007.01.022 [ Links ]
Carcel, J.A., Benedito, J., Rossello, C., and Mulet, A. (2007). Influence of ultrasound intensity on mass transfer in apple immersed in a sucrose solution. Journal of Food Engineering, 78: 472-479. https://doi.org/10.1016/j. jfoodeng.2005.10.018 [ Links ]
García-Noguera, J., Weller, C.L., Oliveira, F.I.P., Rodrigues, S., and Fernandes, F.A.N. (2010). Dual-stage sugar substitution in strawberries with a Stevia-based sweetener. Innovative Food Science & Emerging Technologies, 11:225-230. https://doi.org/10.1016/j.ifset.2009.07.001 [ Links ]
Goula, A.M. (2012). Ultrasound-assisted extraction of pomegranate seed Oil-Kinetic modeling. Journal of Food Engineering , 117(4): 492-498. https://doi.org/10.1016/j.jfoodeng.2012.10.009 [ Links ]
Knorr, D., Ade-Omowaye, B.I.O., and Heinz, V. (2002). Nutritional improvement of plant foods by non-thermal processing. Proceedings of the Nutrition Society, 61 (2): 311-318. https://doi.org/10.1079/PNS2002162 [ Links ]
Melo, W.C., dos Santos, A.S., Santa-Anna, L.M.M., and Pereira, N. (2008). Acid and enzymatic hydrolysis of the residue from Castor Bean (Ricinus communis L.) Oil extraction for ethanol production: Detoxification and biodiesel process integration. Revista de la sociedad quimica bracileña, 19(3): 418-425. http://dx.doi.org/10.1590/S0103-50532008000300008 [ Links ]
Perea-Flores, M.J. (2011). Efecto del secado por lecho fluidizado en la estructura de semillas de Ricinus communis y en la extracción de su aceite como fuente alternativa de biocombustibles. Tesis Doctoral. Escuela Nacional de Ciencias Biológicas. Instituto Politécnico Nacional. 180 p. [ Links ]
Perdomo, F.A., Acosta, O. A. A., Herrera, G., Vasco, L. J. F., Mosquera, A. J. D., Millán, M. B. and Rodríguez, G. M. E. (2013). Physicochemical characterization of seven mexican Ricinus communis L. seeds & oil contents. Biomass Bioenergy, 48: 17-24. https://doi.org/10.1016/j.biombioe.2012.10.020 [ Links ]
Riera, E., Golás, Y., Blanco, A., Gallego, A., Blasco, M., and Mulet, A. (2004). Mass transfer enhancement in supercritical fluids extraction by means of power ultrasound. Ultrasonics. Sonochemistry, 11(1-4): 241-244. https://doi.org/10.1016/j.ultsonch.2004.01.019 [ Links ]
Riener, J., Noci, G., Cronin, D.A., Morgan, D.J., and Lyng, J.G. (2010). A comparison of selected quality characteristics of yoghurts prepared from thermosonicated and conventionally heated milks. Food Chemistry , 119(3): 1108-1113. https://doi.org/10.1016/j.foodchem.2009.08.025 [ Links ]
Stupp, T., de Freitas, R.A., Sierakowski, M.R., Deschamps, F.C., Wisniewski Jr., A., and Biavatti, M.W. (2008). Characteriza-tion and potential uses of Copaifera langsdorfii seeds and seed oil. Bioresour. Technol., 99(7): 2659-2663. https://doi.org/10.1016/j.biortech.2007.04.051 [ Links ]
Vercet, A., Burgos, J., Crelier, S., and Lopez-Buesa, P. (2001). Inactivation of proteases and lipases by ultrasound. Innova-tive Food Science & Emerging Technologies, 2(2): 139-150. https://doi.org/10.1016/S1466-8564(00)00037-0 [ Links ]
Vinayaka, D.L., Vijaykumar, G., Madhavi, D., Arpitha, M. and Narendra, R. (2017). Ricinus communis plant residues as a source for natural cellulose fibers potentially exploitable in polymer composites. Industrial Crops Products, 100: 126-131. https://doi.org/10.1016/j.indcrop.2017.02.019 [ Links ]
Vilkhu, K., Mawson, R., Simons, L., and Bates, D. (2008). Applications and opportunities for ultrasound assisted extrac-tion in the food industry: A review. Innovative Food Science & Emerging Technologies , 9(2): 161-169. https://doi. org/10.1016/j.ifset.2007.04.014 [ Links ]
Willems, P., Kuipers, N.J.M., and Haanb, A.B. (2008). Gas assisted mechanical expression of oilseeds: influence of pro-cess parameters on oil yield. The Journal of Supercritical Fluids, 45(3): 298-305. https://doi.org/10.1016/j.supf-lu.2008.01.010 [ Links ]
1Como citar este artículo: Salinas-de León, F., Castillo-Quiroz, D., Castillo-Reyes, F., Morales-Martínez, T.K., Rodríguez-De la Garza, J. A. 1 , Ríos-González, L.J. (2019). Ultrasound-assisted oil extraction from Ricinus communis L. seed. Revista Bio Ciencias 6, e433. doi: https://doi.org/10.15741/revbio.06.e433
Recibido: 17 de Enero de 2017; Aprobado: 18 de Abril de 2018











 text in
text in 


