Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista bio ciencias
On-line version ISSN 2007-3380
Revista bio ciencias vol.6 Tepic Jan. 2019 Epub Oct 02, 2020
https://doi.org/10.15741/revbio.06.e418
Artículos originales
Evaluación de cepas de Bacillus subtilis como promotoras de crecimiento vegetal
1 Universidad Autónoma Agraria Antonio Narro, México.
Bacillus subtilis es una rizobacteria promotora del crecimiento vegetal por la producción de metabolitos como auxinas, sideróforos, ácidos orgánicos y antibióticos. Sin embargo, en la literatura científica no existe suficiente evidencia en cuanto a esta bacteria, no obstante, se ha reportado que todas las cepas de B. subtilis tienen el mismo efecto promotor de crecimiento, aun cuando pudieran producir distintas concentraciones de metabolitos promotores de crecimiento. El objetivo del presente estudio consistió en evaluar el tipo de promoción de crecimiento de plantas que presenta cada una de las cepas de B. subtilis, así como la producción de sideróforos, fitohormonas indólicas y ácido jasmónico. Se utilizaron tres cepas de B. subtilis (BSN, BS8 y BS14). De los caldos de fermentación se cuantificaron las fitohormonas mediante cromatografía líquida de alta resolución y se detectaron sideróforos mediante medio cromo azurol S. Posteriormente se añadieron Bacillus subtilis a semillas de Solanum lycopersicum y Arabidopsis thaliana, y a plántulas de Solanum lycopersicum en cámara bioclimática. Los resultados mostraron que cada cepa promueve distintos parámetros. Algunas cepas son promotoras de la tasa de germinación, otras promueven las raíces o la longitud del tallo. Se concluye que las cepas de Bacillus subtilis deben elegirse dependiendo de la promoción de crecimiento deseado. La concentración de fitohormonas debe ser adecuada, ya que la deficiencia o exceso de ellos inhibe el crecimiento.
Palabras clave: Bacillus subtillis; fitohormonas; sideróforos; promoción de crecimiento de plantas
Bacillus subtilis are plant growth promoting rhyzobacteria due to their production of metabolites such as auxins, siderophores, organic acids and antibiotics. There is no sufficient scientific evidence to know if all B. subtilis strains have the same growth promoting effect, regardless their capacity of producing different growth promoting metabolite concentrations. This research work aimed to assess the plant growth promoting capacity of the different B. subtilis test strains, as well as the production of siderophores, indolic acids, plant hormones and jasmonic acid. This research work focused on three B. subtilis strains (BSN, BS8 and BS14). We quantified the plant hormones in the fermentation broths using high-resolution liquid chromatography, and we detected the siderophores with chrome azurol. We used S. Bacillus subtilis to treat Solanum lycopersicum and Arabidopsis thaliana seeds, as well as Solanum lycopersicum seedlings inside a bioclimatic chamber. The results showed that every strain promotes different parameters. Some strains promote high germination rates, while other strains promote root growth or stem elongation. Therefore, we must select Bacillus subtilis strains according to the desired growth promoting effect. However, the plant hormones concentration must be the right one, because too much of too low concentration will inhibit plant growth.
Keywords: Bacillus subtillis; phytohormones; siderophores; plant growth promotion
Introducción
Las rizobacterias promotoras de crecimiento de plantas (PGPR), estimula el crecimiento de plantas por mecanismos directos e indirectos. La promoción indirecta se produce mediante la producción de antibióticos y metabolitos que ayudan a la asimilación de nutrientes (Glick et al., 1995; Ahmad et al., 2008). La estimulación directa se realiza por producción de fitohormonas como auxinas, citoquininas y giberelinas, compuestos orgánicos y compuestos que aumentan la inmunidad vegetal; como ácido jasmónico, ácido salicílico y fitoalexinas (Ahmad et al., 2008; Rojas-Solis et al., 2013).
En Solanum lycopersicum (tomate) se han utilizado PGPR de los géneros Pseudomonas, Azospirillum, Azobacter, Bacillus, Agrobacterium y Streptomyces (Alfonso, et al., 2005; Haas & Défago, 2005; Nihorimbere et al., 2010; Rentería, 2013), los cuales pueden ser utilizados solos o en bioformulados (Berg, 2009; Choudhary & Johri, 2008; Clayet-Marcel et al., 2001). Del género Bacillus se utilizan B. subtilis para promover el crecimiento del tomate y para el control biológico de patógenos como Fusarium (Airola, 2010).
Bacillus subtilis produce metabolitos como citoquininas, sideróforos, auxinas, antibióticos, entre otros. Las citoquininas pueden ser producidas endógenamente por la planta, pero la adición exógena de citoquininas aumenta el proceso de crecimiento (Arkhipova, et al., 2005). Las funciones de las citoquininas son la inducción de la actividad amilasa y proteasa y la síntesis de auxinas (Mantilla, 2007). Mientras tanto, los sideróforos quelan el hierro ambiental y lo hacen más asequible para las plantas (Abdel-Aziz, 2013). Algunos sideróforos se consideran antibióticos porque limitan el hierro para el crecimiento de patógenos (Aguado-Santacruz et al., 2012). El ácido 3-indólico acético (IAA), una de las auxinas más importantes, controla el proceso como la división celular, la diferenciación del tejido vascular, la formación del dominio apical y el desarrollo del órgano (Blakeslee et al., 2005; Tsavkelova et al., 2006). En cuanto a los antibióticos, B. subtilis es capaz de producir más de una docena de antibióticos con una gran diversidad de estructuras químicas, entre ellos surfactina, iturina A y bacillibactina (Stein, 2005). Los cuales son capaces de controlar el crecimiento de patógenos de tomate.
No obstante, autores como Bharucha & Patel (2013) y Buensanteai et al. (2008) han señalado que la promoción del crecimiento depende del equilibrio entre las auxinas y otras fitohormonas (Buensanteai et al., 2008). La presencia de triptófano, ácido jasmónico y sideróforos en el medio de cultivo puede mejorar la producción de auxinas (Bharucha & Patel, 2013), y por lo tanto regular la promoción de crecimiento.
En cuanto a B. subtilis, no existe suficiente evidencia científica, no obstante se conoce que las cepas de B. subtilis tienen el mismo efecto promotor de crecimiento, aun cuando pudieran producir distintas concentraciones de metabolitos promotores de crecimiento. El objetivo del presente estudio consistió en evaluar el tipo de promoción de crecimiento de plantas que presenta cada una de las cepas de B. subtilis, así como la producción de sideróforos, fitohormonas indólicas y ácido jasmónico.
Material y Métodos
Cepas y semillas utilizadas
Fueron utilizadas tres cepas de B. subtilis para la presente investigación (BSN, BS14, and BS8). La cepa BSN fue proporcionada por el Centro de investigación y de estudios avanzados del IPN (CINVESTAV) unidad Irapuato, por su parte, BS8 y BS14 fueron provistas por el Departamento de parasitología molecular de la Universidad Autónoma Agraria Antonio Narro. Las cepas fueron activadas en medio TGE (triptona glucolsa extracto de levadura) a 28 °C (Calvo & Zuñiga, 2010). Las semillas de Arabidopsis thaliana fueron provistas por el CINVESTAV Irapuato.
Obtención de caldos de fermentación de B. subtilis
La fermentación fue realizada en medio Landy adicionado con triptófano. El medio Landy fue preparado como sigue: ácido glutámico 5.0 g/L, KH2PO4 0.5 g/L, K2HPO4 0.5 g/L, MgSO4 .7 H2O 0.2 g/L, MnSO4 .H2O 0.01 g/L, NaCl 0.01 g/L, FeSO4 .7 H2O 0.01 g/L, CuSO4 .7 H2O 0.01 g/L, CaCl2 .2 H2O 0.015 g/L y triptófano (concentración final 5mM). Posteriormente, fue adicionada una solución de glucosa esterilizada por microfiltración (filtro de 0.2 μm) para una concentración final de 1 %. Fue realizado un preinóculo de Bacillus en 50 mL de medio Landy e incubado a 28 °C por 48 h. Del preinóculo fueron preparados los caldos de fermentación a una concentración de 1x107 CFU/mL en el medio, se agitaron a 120 rpm a 25 °C por 72 h (Awais et al., 2010).
Obtención de sobrenadante libre de células
Para la obtención de los sobrenadantes libres de células, los caldos de fermentación de B. subtilis (BS8, BS14 y BSN) fueron centrifugados a 4 °C y 12,000 g (centrífuga 5810/5810 R) por 10 min y posteriormente fueron filtrados para esterilización con un microfiltro de 0.20 μm.
Detección de sideróforos por medio CAS
Para la detección de sideróforos se utilizó la técnica de Brian et al. (2011). La técnica está basada en el uso de cromo azurol S (CAS) y bromuro dehexadeciltrimetilamonio (HDTMA) e indicadores (Abdel-Aziz, 2013).
Cuantificación de auxinas y ácido jasmónico por HPCL
Se utilizó HPLC acoplado a UV para la cuantificación de auxinas (IAA, triptamina, 3-indolilacetonitrilo) y ácido jasmónico en los caldos de fermentación de B. subtilis. Para las curvas de calibración se utilizaron estándares grado reactivo en un rango de 1 a 1000 ppm en fase móvil (metanol-agua-ácido acético en una relación 60:40:1). Para la preparación de las muestras, se tomaron 50 mL del sobrenadante de fermentación, se ajustó el pH a 2.8 con HCl 1M y se realizaron 3 extracciones con 50 mL de acetato de etilo. Las fases orgánicas se combinaron y se les añadió sulfato de sodio anhidro para remover la humedad (Castillo, et al., 2005). El solvente fue removido con rotavapor a 60 °C. Finalmente, el residuo fue resuspendido con 2 mL de fase móvil (metanol-agua-ácido acético en una relación 60:40:1) y se microfiltró. La separación cromatográfica se realizó en fase reversa con una columna C18, utilizando la fase móvil mencionada (previamente desgasificada) con un flujo de 0.7 mL/min. La detección se realizó con un UV a 296 nm y se interpoló en la curva de calibración (Castillo et al., 2005).
Evaluación de promoción de crecimiento en semillas
Semillas de Solanum lycopersicum y Arabidopsis thaliana fueron tratadas con sobrenadante libre de células y con caldo de fermentación para la evaluación del porcentaje de germinación. Para la evaluación de los sobrenadantes, se mezcló medio Murasige y Skoog (MS) con 1 mL del sobrenadante por caja, antes de la solidificación del medio, y posteriormente se colocaron las semillas previamente esterilizadas. Para la evaluación de los caldos de fermentación, las semillas previamente esterilizadas, se sumergieron durante 30 min en los caldos y posteriormente las cajas petri se colocaron en las cajas con medio MS. Las cajas fueron colocadas verticalmente en una cámara bioclimática a 25 °C con fotoperiodo de 16/8 h de luz-obscuridad. El porcentaje de germinación de semillas fue evaluado después de 7 días que inició el experimento. El experimento fue realizado con 9 réplicas (semillas) con un diseño ANOVA totalmente al azar con un nivel de significancia de 0.05 y comparación de medias de Tukey.
Evaluación de promoción de crecimiento en plántulas tratadas con caldos de fermentación de B. subtilis
La promoción de crecimiento se evaluó adicionando caldo de fermentación de B. subtilis a plántulas de Solanum lycopersicum. Las plántulas de Solanum lycopersicum se germinaron en charolas con sustrato turba de musgo. A los 21 días después de la germinación se transplantaron a contenedores con turba de musgo, perlita y verniculita (3:2:1). Se adicionó a las plántulas 3 mL del caldo de fermentación (BS8, BS14 y BSN), homogenizado por agitación antes de la adición, cerca de las raíces con ayuda de una jeringa. Se utilizaron plantas sin tratamiento y con medio Landy como control. Cada tratamiento fue realizado con 7 repeticiones (Mena-Violante et al., 2009). A partir de la aplicación del tratamiento se tomaron mediciones diarias del largo del tallo y número de foliolos por 60 días. En el día 60 se evaluaron: largo de raíz, peso húmedo de plántulas, peso húmedo de raíz, peso seco de plántula, peso seco de raíz, peso húmedo de tallo y hojas, porcentaje de humedad de plántulas y porcentaje de humedad de raíz (Gómez-Luna et al., 2012; Mena-Violante et al., 2009; Airola, 2010). El experimento fue realizado bajo un diseño ANOVA completamente al azar con un nivel de significancia de 0.05 y comparación de medias de Tukey.
Resultados y Discusiones
Síntesis de sideróforos
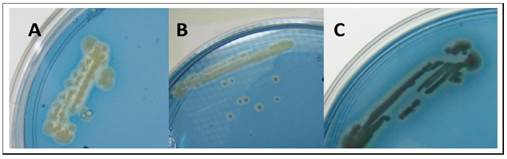
Las tres cepas de B. subtilis fueron capaces de producir sideróforos, según los halos observados en los medios CAS (Figura 1). Según Bolívar-Anillo et al. (2016), los sideróforos hacen más asequible el hierro para las plantas y promueven el crecimiento de las mismas. La producción de sideróforos se considera importante en la supresión de microorganismos deletéreos al monopolizar el hierro disponible en el suelo, y en algunos casos parece desencadenar resistencia sistémica inducida en las plantas (Suárez-Moreno et al., 2012).
Producción de índoles
En la cuantificación de compuestos indólicos se observó que las cepas evaluadas producen IAA y otras índoles en concentraciones variables. La concentración de índoles en las cepas se presenta en la Tabla 1. La concentración de IAA fue elevada en comparación con estudios previos (Wahyudi et al., 2011; Luna et al., 2013), razón por la que las cepas tuvieron un efecto positivo en la promoción de crecimiento. La presencia de precursores de IAA (triptamina y 3-indolilacetonitrilo) indican el potencial de las cepas para producir más IAA bajo condiciones específicas de fermentación. En general, la producción de auxinas por las bacterias, especialmente el IAA, ha evidenciado influir significativamente en sobre el crecimiento y desarrollo de las plantas (Sánchez et al., 2012).
Tabla 1 Concentración de IAA, triptamina y 3-indolilacetonitrilo en caldos de fermentación de B. subtilis cuantificado por HPLC. Expresado en μg/L ± D.E. L.
| IAA | Tryptamine | 3-indoleacetonitrile | |
|---|---|---|---|
| BS8 | 129.53 ±3.23 | 387.64 ±29.84 | 352.64 ±19.37 |
| BS14 | 147.80 ±3.03 | 136.74 ±50.20 | 194.33 ±8.73 |
| BSN | 113.39 ±6.8 | 605.54 ±39.60 | 118.04 ±4.74 |
Producción de ácido jasmónico
De las tres cepas evaluadas solo la BS8 mostró producción de ácido jasmónico a una concentración de 54.48 ppm. Microorganismos promotores de crecimiento como Thrichoderma sp. activa el mecanismos de defensa de la planta a través del ácido jasmónico, pudiendo también intervenir en la producción del ácido salicílico, mensajero de resistencia sistémica adquirida (Alcedo & Reyes, 2018). De esta forma estimulan el crecimiento de plantas.
Porcentaje de germinación
No se mostró incremento en los porcentajes de germinación de semillas de Solanum lycopersicum tratadas con B. subtilis o sus metabolitos. En cuanto a Arabidopsis thaliana el porcentaje de germinación incrementó con la adición del sobrenadante (metabolitos) de BS14, y con los caldos de fermentación de BS8 y BS14. BSN provocó un decremento en los porcentajes de germinación. Los porcentajes de germinación de Arabidopsis thaliana se muestran en la Figura 2.
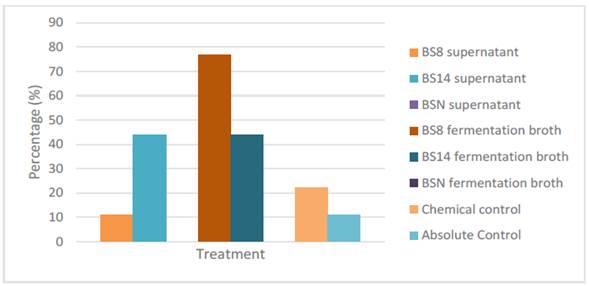
Figura 2 Porcentajes de germinación de semillas de Arabidopsis thaliana a los 7 días de ser tratadas con sobrenadantes o caldos de fermentación de cepas de B. subtilis.
Liu et al. (2013), demostraron que la dormancia de las semillas es reducida por la presencia de auxinas a través de la estimulación de señalización del ácido abcísico. Las cepas de estudio demostraron la capacidad para producir auxinas (IAA, triptamina y 3-indolilacetonitrilo), por lo que la promoción en el porcentaje de germinación esta posiblemente relacionada a estos metabolitos. Posteriormente a la toma de lecturas de germinación, las semillas control se contaminaron con patógenos, pero no aquellas semillas con tratamiento de B. subtilis, esto se puede atribuir a la capacidad de las cepas de producir sideróforos, que según investigaciones previas, tienen la capacidad de controlar patógenos por limitar la disponibilidad de hierro (Jung et al., 2006; Cazorla et al., 2007; Woo & Kim, 2008; Tejera-Hernández et al., 2011; Yu et al., 2011).
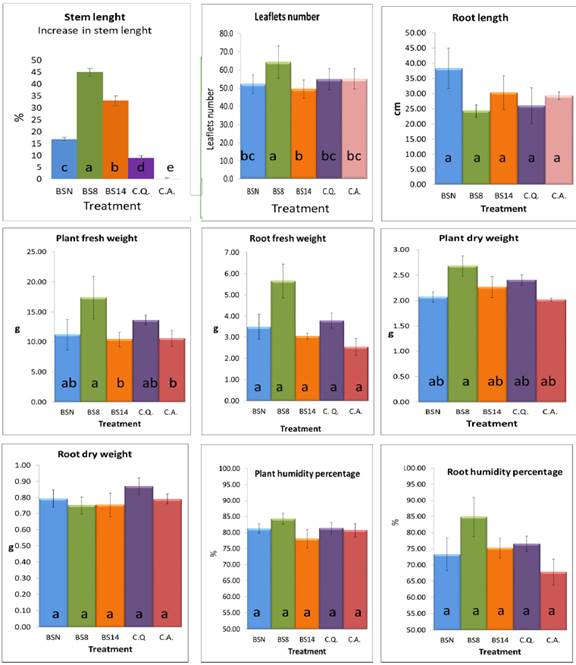
Largo de tallo
Las cepas de B. subtilis evaluadas mostraron promoción en el largo del tallo de las plántulas de Solanum lycopersicum. Los tres tratamientos presentaron diferencias significativas según el análisis estadístico (Figura 3). BS8 (a) incrementó el largo del tallo en un 45 %, BS14 (b) en 33 %, y BSN (c) en un 17 % respecto al CA (e).
Número de foliolos
BS8 (a) mostró el mayor número de foliolos, seguido de aquellos tratados con BS14 (b), BSN (bc) y los controles (bc) (Figura 3). El incremento en número de foliolos se relaciona a la presencia de auxinas en los caldos de fermentación. Las auxinas retrasan la abcisión de órganos (hojas, flores y fruto joven) por inhibición de la hormona etileno (Van Doorn & Stead, 1997). Como se muestra en las evaluaciones del largo del tallo y número de foliolos, BS8 es el mejor tratamiento, probablemente se debe a la producción de otro tipo de fitohormonas como citoquininas. En previos estudios se ha asociado la acumulación de citoquininas al incremento de peso de plantas (30 %), en complejo con altos niveles de hormonas como IAA y ácido abcísico (ABA) (Arkhipova et al., 2005; Rojas-Solis et al., 2013).
Largo de raíz
No se observaron diferencias significativas en el largo de raíces respecto a los controles (Figura 3). No obstante, BS8 presentó mayor cantidad de raíces secundarias. Jordan & Cassareto (2006) indican que altas concentraciones de IAA promueven la elongación del tallo pero inhibe el crecimiento de raíz, mientras que bajas concentraciones de IAA induce el crecimiento de raíz. La concentración óptima de IAA depende de cada especie vegetal, sin embargo, en el presente trabajo, las concentraciones de metabolitos promovieron el largo del tallo pero no el largo de raíz.
Peso húmedo
Los resultados del peso húmedo de raíz no muestran diferencia significativa entre tratamientos (Figura 3). En cuanto al peso húmedo de plántula, BS8 (a) es mejor que CA (b) y BS14 (b), pero no mejor que CQ (ab) y BSN (ab). La efectividad de BS8 en el incremento de peso húmedo se podría lograr incrementando la concentración de L-triptófano en el medio de cultivo. Ali et al. (2009) encontraron que diferentes aislamientos de Bacillus sp. aumentaron la concentración de IAA producido al aumentar la concentración de L-triptófano.
Peso seco
No se observó diferencia significativa en el peso seco de raíz (Figura 3). En la prueba de peso seco de plántula, solo el tratamiento BS8 (a) fue mejor que CA (b), BS14 (ab), BSN (ab), CQ (ab) no presentaron diferencias significativas a los antes mencionados. Según los estudios de Marquina et al. (2018) la adición de triptófano a las plantas puede promover el incremento en el peso seco. Por lo que probablemente mayor concentración de triptófano en los medios de cultivo habría promovido el peso seco de las plántulas.
Porcentaje de humedad
En cuanto al porcentaje de humedad de plántula y raíz no se observaron diferencias significativas de los tratamientos respecto a los controles (Figura 3). Esto se relaciona a los resultados obtenidos tanto de peso húmedo como seco de raíz y plántula. Las cuales en su mayoría no mostraron diferencia significativa a excepción de los tratamientos con BS8. Los resultados muestran que las cepas evaluadas podrían ser mezcladas en bioformulados para promover diferentes parámetros agronómicos a los que promueven de forma individual. Se ha demostrado que las interacciones de las rizobacterias del hospedero interaccionan favorablemente con Bacillus spp. para la promoción de crecimiento (Martínez-Viveros et al., 2010).
Conclusiones
Las concentraciones de los metabolitos promotores de crecimiento así como su interacción con otros metabolitos (antagonismo o sinergismo) influyen en el crecimiento de las plantas en un parámetro en particular. Por lo que la realización de perfiles metabólicos de las PGPR podría ser utilizada para predecir el efecto que tendrán en la planta. Las bacterias que producen las concentraciones correctas de metabolitos promueven el crecimiento, mientras que las que producen metabolitos en cantidades deficientes o excesivas inhiben el crecimiento de plantas. Por lo que se concluye que para seleccionar una cepa se debe definir el parámetro y etapa en la que se quiere promover el crecimiento.
References
Abdel-Aziz (2013). Extracellular Metabolites produced by a novel strain, Bacillus alvei NRC-14:5. Multiple plant-growth promoting properties. J. Basic Appl. Sci. Res 3(1): 670-682. [ Links ]
Aguado-Santacruz, Gerardo A., Moreno-Gómez, B., Jiménez-Francisco, B., García-Moya, E., and Preciado-Ortiz, R.E. (2012). Impacto de los sideróforos microbianos y fitosidéforos en la asimilación de hierro por las plantas: una síntesis. Revista fitotecnia mexicana, 35(1): 9-21. http://www.scielo.org.mx/scielo.php?pid=S0187-73802012000100004&script=sci_arttext&tlng=en [ Links ]
Ahmad, F., Ahmad, I., and Khan, M.S. (2008). Screening of free-living rhizospheric bacteria for their multiple plant growth promoting activities. Microbiological Research 163: 173-81. https://doi.org/10.1016/j.micres.2006.04.001 [ Links ]
Airola, G.V.M. (2010). Compostas líquidas con bacterias promotoras de crecimiento en la nutrición de tomate (Solanum lycopersicum). Tesis. Instituto Politécnico Nacional. Cd. De México, México. [ Links ]
Alcedo, Y. C., & Reyes, I. (2018). Microorganismos promotores de crecimiento en el biocontrol de Alternaria alternata en tomate (Solanum lycopersicum L.). Bioagro, 30(1): 59-66 http://www.ucla.edu.ve/bioagro/Rev30(1)/6.%20ms%201705.pdf [ Links ]
Alfonso, E.T., Leyva, A.H. and Hernandez, A. (2005). Microorganismo Benéficos como Biofertilizantes eficientes para el cultivo del tomate (Lycopersicum esculentum Mill). Revista Colombiana de Biotecnología, 2: 47-54. https://dialnet.unirioja.es/servlet/articulo?codigo=2351591 [ Links ]
Ali, B.; Sabri, A.; Ljung, K. and Hasnain, S. (2009). Quantification of indole-3-acetic acid from plant associated Bacillus spp. and their phytostimulatory effect on Vigna radiata (L.). World J. Microbiol. Biotechnol. 25(3): 519-526. https://doi.org/10.1007/s11274-008-9918-9 [ Links ]
Arkhipova, T.N., Veselov, S.U., Melentiev, A.I., Martynenko, E.V., and Kudoyarova, G.R. (2005). Ability of bacterium B. subtilis to produce cytokinins and to influence the growth and endogenous hormone content of lettuce plants. Plant and Soil 272: 201-209. https://doi.org/10.1007/s11104-004-5047-x [ Links ]
Awais, M., Pervez, A., Yaqub, A., and Shah, M. M. (2010). Production of Antimicrobial Metabolites by B. subtilis immobilized in Polyacrylamide Gel. Pakistan J. Zool, 42(3): 267-275, http://zsp.com.pk/pdf/267-276%20(11).pdf [ Links ]
Berg, G. (2009) Plant-microbe interactions promoting plant growth and health: perspectives for controlled use of microorganisms in agriculture. Appiled Microbiology and Biotechnology, 84: 11-18. https://doi.org/10.1007/s00253-009-2092-7 [ Links ]
Bharucha, U., & Patel, K. (2013). Optimization of Indole Acetic Acid Production by Pseudomonas putida UB1 and its Effect as Plant Growth-Promoting Rhizobacteria on Mustard (Brassica nigra). Investigacion Agricola 2(3): 215-221. https://doi.org/10.1007/s40003-013-0065-7 [ Links ]
Blakeslee, J.J., Ann, P. W., and Murphy, A. (2005). mdr/PGP Auxin transport proteins and endocytic cycling. Plant Endocytosis 1: 159-176. https://link.springer.com/chapter/10.1007/7089_010 [ Links ]
Bolívar-Anillo, H. J., Contreras-Zentella, M. L., and Teherán-Sierra, L. G. (2016). Burkholderia tropica una bacteria con gran potencial para su uso en la agricultura. TIP. Revista especializada en ciencias químico-biológicas, 19(2), 102-108. http://dx.doi.org/10.1016/j.recqb.2016.06.003 [ Links ]
Brian, C., Daniel, H. and Aeron, M. (2011). Use of blue agar CAS assay for siderophore detection. Journal of Microbiology & Education, 12(1), https://doi.org/10.1128/jmbe.v12i1.249 [ Links ]
Buensanteai, N., Yuen, G.Y. and Prathuangwong, S. (2008) The biocontrol bacterium Bacillus amyloliquefaciens KPS46 produces auxin, surfactin and extracellular proteins for enhanced growth of soybean plant. Thai Journal of Agricultural Science. 41(3-4): 101-116. http://www.researchgate.net/profile/Natthiya_Buensanteai2/publication/268337617_The_Biocontrol_Bacterium_Bacillus_amyloliquefaciens_KPS46_Produces_Auxin_Surfactin_and_Extracellular_Proteins_for_Enhanced_Growth_of_Soybean_Plant/links/56e51f4408ae98445c1efdff.pdf [ Links ]
Calvo, P. & Zuñiga, D. (2010). Caracterización fisiológica de cepas de Bacillus spp. aisladas de la rizósfera de papa (Solanum tuberosum). Ecología Aplicada, 9(1): 31-39 http://www.scielo.org.pe/pdf/ecol/v9n1/a04v9n1 [ Links ]
Castillo, G., Altuna, B., Michelena, G., Sánchez-Bravo, J. and Acosta, M. (2005). Cuantificación del contenido de ácido indolacético (AIA) en un caldo de fermentación microbiana. Anales de Biología 27:137-142,2005. https://digitum.um.es/xmlui/bitstream/10201/2255/1/AB27%20(2005)%20p%20137-142.pdf [ Links ]
Cazorla, F.M., Romero, D., Pérez-García, A., Lugtenberg, B.J.J., de Vicente, A., and Bloemberg, G. (2007). Isolation and characterization displaying biocontrol activity. Journal of Applied. https://doi.org/10.1111/j.1365-2672.2007.03433.x [ Links ]
Choudhary, D. K. & Johri, B.N. (2009). Interactions of Bacillus spp. and plants-with special reference to induced systemic resistance (ISR). Microbiological research. 164(5), 493-513. https://doi.org/10.1016/j.micres.2008.08.007 [ Links ]
Clayet-Marcel, J., Larcher, M., Bartrand, H., Rapior, S. and Pinochet, X. (2001). Plant growth enhancement by rhizobacteria. Nitrogen assimilation by plant: physiological, biochemical, and molecular aspects. En: JF Morot-Gaudry, editor. Science publishers Inc., Enfield. [ Links ]
Glick, B. R.., Karaturovic, D. M. and Newell, P. C. (1995). A novel procedure for rapid isolation of plant growth promoting pseudomonads. Canadian journal of microbiology, 41(6), 533-536. https://www.researchgate.net/profile/Bernard_Glick/publication/237194178_A_novel_procedure_for_rapid_isolation_of_plant_growth_promoting_pseudomonads/links/5b8d94d145851540d1c3d72c/A-novel-procedure-for-rapid-isolation-of-plant-growth-promoting-pseudomonads.pdf [ Links ]
Gómez-Luna, B. A., Hernández-Morales, A., Herrera Méndez, C.H.G., Arroyo-Figueroa, G., Vargas-Rodríguez, L. and Olalde-Portugal, V. (2012). Aislamiento de bacterias promotoras del crecimiento de la rizósfera de plantas de guayaba.(Psidium guajava). Ra Ximhai, septiembre - diciembre, año/Vol. 8, Número 3. pp. 97-102. ISSN: 1665-0441. Disponible en: http://uaim.edu.mx/webraximhai/Ej-25aarticulosPDF/10.-AISLAMIENTO%20DE%20BACTERIAS%20PROMOTORAS-Blanca_Alejandro_Carlos_Gabriela_Lorena_Victor.pdf [ Links ]
Haas, H. & Défago, G. (2005). Biological control of soil-borne pathogens by fluorescent pseudomonads. Nature Reviews Microbiology, 3: 307-319. https://doi.org/10.1038/nrmicro1129 [ Links ]
Jordan, M. & Casaretto, J. (2006) Hormonas y Reguladores del crecimiento: Auxinas, Giberilinas y Citocininas. Capítulo XV. Fisiología Vegetal. F.A. Squeo y L. Cardemil, eds. Ediciones Universidad de la Serena, Chile(2006)15;xx-xx. http://listas.exa.unne.edu.ar/biologia/fisiologia.vegetal/Auxinasgiberelinasycitocininas.pdf [ Links ]
Jung, H. K., Kim, J. R., Woo, S. M., and Kim, S. D. (2006). An auxin producing plant growth promoting rhizobacterium B. subtilis AH18 which has siderophore-producing biocontol activity. Korean Journal of Microbiology and Biotechnology. http://www.koreascience.or.kr/article/JAKO200629734295650.page [ Links ]
Liu, X., Zhang, H., Zhao, Y., Feng, Z., Li, Q., Yang, H. Q., Luan, S., Li, J., and He, Z. H. (2013). Auxin controls seed dormancy through stimulation of abscisic acid signaling by inducing ARF-mediated ABI3 activation in Arabidopsis. Proceedings of the National Academy of Sciences, 110(38): 15485-15490. https://doi.org/10.1073/pnas.1304651110 [ Links ]
Luna Martínez, L., Martínez Peniche, R. A., Hernández Iturriaga, M., Arvizu Medrano, S. M., and Pacheco Aguilar, J. R. (2013). Caracterización de rizobacterias aisladas de tomate y su efecto en el crecimiento de tomate y pimiento. Revista fitotecnia mexicana, 36(1): 63-69. http://www.scielo.org.mx/scielo.php?script=sci_arttext&pid=S0187-73802013000100007 [ Links ]
Mantilla, M.E. (2007). Evaluación de la acción de un bioinoculante sobre un cultivo de crisantemo (Chrysanthemum morifolium var. Yoko ono) en período de enraizamiento. Tesis. Pontificia Universidad Javeriana. Facultad de Ciencias. Bogotá. 1-127 https://repository.javeriana.edu.co/bitstream/handle/10554/8381/tesis35.pdf?sequence=1 [ Links ]
Marquina, M. E., Ramírez, Y., and Castro, Y. (2018). Efecto de bacterias rizosféricas en la germinación y crecimiento del pimentón Capsicum annuum L. Var. cacique gigante. Bioagro, 30(1), 3-16. https://www.scielo.sa.cr/pdf/ac/v42n2/0377-9424-ac-42-02-75.pdf [ Links ]
Martínez-Viveros, O., Jorquera, M. A., Crowley, D. E., Gajardo, G. and Mora, M. L. (2010) Mechanisms and practical considerations involved in plant growth promotion by rhizobacteria. Journal of soil science and plant nutrition 10(3): 293-319. http://dx.doi.org/10.4067/S0718-95162010000100006 [ Links ]
Mena-Violante, H., Cruz-Hernández, A., Paredes-López, O., Gómez-Lim, M. A. and Olalde-Portugal, V. (2009). Fruit texture related changes and enhanced shelf-life through tomato root inoculation B. subtilis BEB-13BS. Agrociencia. http://www.redalyc.org/html/302/30215549001 [ Links ]
Nihorimbere, V., Ongena, M., Cawoy, H, Brostaux, Y., Kakana, P., Jourdan, E. and Thonart, P. (2010). Beneficial effects of B. subtilis on field-grown tomato in Burundi: Reduction of local Fusarium disease and growth promotion. African Journal of Microbiology Research, 4(11): 1135-1142. https://www.researchgate.net/profile/Helene_Cawoy/publication/208603658_Beneficial_effects_of_Bacillus_subtilis_on_field-grown_tomato_in_Burundi_Reduction_of_local_Fusarium_disease_and_growth_promotion/links/00b4952cc0c1733e63000000/Beneficial-effects-of-Bacillus-subtilis-on-field-grown-tomato-in-Burundi-Reduction-of-local-Fusarium-disease-and-growth-promotion.pdf [ Links ]
Rentería, G. A. (2013). Nutrición de tomate y producción de licopeno (Tesis de Maestría) Ciencias con especialidad de Edafología. Colegio de Postgraduados. México. [ Links ]
Rojas-Solis, D., Contreras-Pérez, M. and Santoyo, G. (2013). Mecanismos de estimulación del crecimiento vegetal en bacterias del género Bacillus. Biológicas 15(2): 36-41. https://s3.amazonaws.com/academia.edu.documents/35324550/Mecanismos_promotores_de_Bacillus.pdf?response-content-disposition=inline%3B%20filename%3DBiologicas_Diciembre_2013_15_2_36-41_Mec.pdf&X-Amz-Algorithm=AWS4-HMACSHA256&X-Amz-Credential=AKIAIWOWYYGZ2Y53UL3A%2F20190703%2Fus-east-1%2Fs3%2Faws4_request&X-Amz-Date=20190703T193817Z&X-Amz-Expires=3600&X-Amz-SignedHeaders=host&X-Amz-Signature=b8a9dff3fff8bcd882d661f0f655c97cafa363023e4fb336de7336939c0c2035 [ Links ]
Sánchez López, D. B., Gómez-Vargas, R. M., Garrido Rubiano, M. F. and Bonilla Buitrago, R. R. (2012). Inoculación con bacterias promotoras de crecimiento vegetal en tomate bajo condiciones de invernadero. Revista mexicana de ciencias agrícolas, 3(7), 1401-1415. http://www.scielo.org.mx/scielo.php?pid=S2007-09342012000700009&script=sci_arttext [ Links ]
Stein, T. (2005). Bacillus subtilis antibiotics: structures, syntheses and specific functions. Molecular microbiology, 56(4): 845-857. https://doi.org/10.1111/j.1365-2958.2005.04587.x [ Links ]
Suárez-Moreno, Z.R. et al. Common Features of Environmental and Potentially Beneficial Plant-Associated Burkholderia. Ecologia Microbiana. 63: 249-266 (2012). https://doi.org/10.1007/s00248-011-9929-1 [ Links ]
Tejera-Hernández, B., Marcia, M. Rojas-Badía, M. and Heydrich-Pérez (2011). Potencialidades del género Bacillus en la promoción del crecimiento vegetal y el control biológico de hongos fitopatógenos. Revista CENIC Ciencias Biologicas 42(3): 131-138. http://www.redalyc.org/html/1812/181222321004/ [ Links ]
Tsavkelova, E.A., Klimova, S.Y., Cherdyntseva, T.A. and Netrusov, A.I. 2006. Microbial producers of plant growth stimulators and their practical use: a review. Applied Biochemistry Microbiology 42(2): 117-126. https://link.springer.com/article/10.1134%2FS0003683806020013?LI=true [ Links ]
Van Doorn & Stead. 1997. Abscission of flowers and floral parts. Journal of Experimental Botany 48: 821-837. https://doi.org/10.1093/jxb/48.4.821 [ Links ]
Wahyudi, A. T., Astuti, R. P., Widyawati, A., Meryandini, A. and Nawangsih, A. (2011) Characterization of Bacillus sp. strains isolated from rhizosphere of soybean plants for their use as potential plant growth for promoting rhizobacteria. Jounal of Microbiology and Antimicrobials 3: 34-40. http://www.academicjournals.org/journal/JMA/article-fulltext-pdf/148DAF29759 [ Links ]
Woo, S. M., & Kim, S. D. (2008). Structural Identification of Siderophore∧ AH18 from B. subtilis AH18, a Biocontrol agent of Phytophthora Blight Disease in Red-pepper. Korean Journal of Microbiology and Biotechnology 36(4): 326-335. http://www.koreascience.or.kr/article/ArticleFullRecord.jsp?cn=MSMSBV_2008_v36n4_326 [ Links ]
Yu, X., Ai, C., Xin, L., and Zhou, G. (2011). The siderophore-producing bacterium, B. subtilis CAS15, has a biocontrol effect on Fusarium wilt and promotes the growth of pepper. European Journal of Soil Biology, 47(2): 138-145. https://doi.org/10.1016/j.ejsobi.2010.11.001 [ Links ]
Recibido: 20 de Diciembre de 2017; Aprobado: 18 de Abril de 2019











 text in
text in