Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista bio ciencias
On-line version ISSN 2007-3380
Revista bio ciencias vol.6 Tepic Jan. 2019 Epub Oct 02, 2020
https://doi.org/10.15741/revbio.06.e407
Artículos originales
Germinación de semillas de Moringa oleifera sometidas a dos tratamientos de escarificación
1 Instituto Tecnológico de Chiná, Calle 11 s/n entre 22 y 28 Chiná, Campeche, México. C.P. 24520
2 Colegio de Postgraduados Campus Campeche. Carretera Haltunchén-Ezdna, km 17.5, Sihochac, Champotón, Campeche, México.
3 Catedrática-CONACYT, Colegio de Postgraduados Campus Campeche. Carretera Haltunchén-Ezdna, km 17.5, Sihochac, Champotón, Campeche, México.
Se probó el efecto del remojo en agua potable por 24 h (RA) y fisura de la testa de la semilla (FT) sobre la germinación de semillas de Moringa oleifera con seis meses de edad y el desarrollo de plántulas en fase de vivero. Como control se usó un tratamiento sin escarificación (C). Por cada tratamiento se sembraron 10 charolas de unicel con 77 cavidades. Se midió el porcentaje de germinación del día 3 al 15 posterior a la siembra. A 10 plántulas de cada charola se les midió altura, diámetro de tallo basal y número de ramas cada cinco días a partir del día 16 posterior a la siembra durante 25 días. Los datos se analizaron mediante un ANOVA para evaluaciones repetidas en el tiempo de GLM y prueba de medias por Tukey p <0.05. Los métodos no afectaron la germinación, y fue de 80, 78.4 y 73.5% para RA, FT y C La altura de las plántulas de semillas tratadas con RA fue mayor que FT y C con valores de 19.07, 16.44 y 15.62 cm. No se observó efecto sobre el diámetro del tallo y número de ramas, se presentaron valores de 1.7, 1.7 y 1.8 mm y 4.84, 4.9 y 5.0 mm para FT, C y RA, respectivamente. Los dos métodos de escarificación física empleados no mejoran la germinación de semillas de M. oleifera de seis meses de edad, pero mejoran el crecimiento de las plántulas obtenidas de estas semillas en los primeros días de aviveramiento.
Palabras clave: Germinabilidad de las semillas; testa; pregerminación; vivero; arbórea forrajera
The effect of soaking in drinking water for 24 h (RA) and fissuring of the seed coat (FT) was tested on the germination percentages of six-month-old Moringa oleifera seeds and on the development of seedlings at the nursery stage. A non-scarification treatment (C) was used as control. For each treatment, 10 styrofoam trays with 77 wells were planted. The percentage of germination was measured from day 3 to 15 after sowing. The following were measured on ten seedlings of each tray: height, stem basal diameter and number of branches, every five days from day 16 post-sowing for 25 days. The data were analyzed by ANOVA for repeated measures in time by GLM, and Tukey means test p < 0.05. The methods did not affect germination, and it was 80, 78.4 and 73.5 % for RA, C and FT. The height of seedlings treated with RA was higher than FT and C with values of 19.07, 16.44 and 15.62 cm. No effect was observed on stem diameter and number of branches and presented values of 1.7, 1.7 and 1.8 mm, and 4.84, 4.9 and 5.0 mm for C, FT and RA, respectively. The two physical methods of scarification employed do not improve the seed germination of M. oleifera of six months old, but they improve significantly the development of the seedlings obtained from these seeds in the first days of nursery stage.
Keywords: Seed germinability; seed coat; pre-germination; plant nurseries; forage tree
Introducción
La planta moringa (Moringa oleifera) es una especie nativa de la India que crece en las regiones tropicales y subtropicales de todo el mundo (Jahn, 1998; Parrota, 2000; Gopalakrishnan et al., 2016). Su follaje es rico en minerales, vitaminas y otros compuestos fotoquímicos esenciales (Gopalakrishnan et al., 2016), además de un alto contenido de compuestos antioxidantes (Tesfay et al., 2016). Con posible uso para el consumo humano, alimentación animal, medicinal, purificación de agua (Rashid et al., 2008), así como cerca viva, cortina rompevientos, abono verde y producción de etanol (Pérez et al., 2010). Se han reportado usos tradicionales para sus hojas, flores, frutos, semillas y vainas (Coppin, 2008). Actualmente una de las propiedades más promovidas es su capacidad de combatir la malnutrición humana, por su alto contenido de vitaminas A y C, calcio, proteína, hierro y potasio (Lakshmipriya et al., 2016). En la alimentación animal de la ganadería tropical, se recomienda el uso del follaje, como una alternativa agroecológica para hacer frente a la estacionalidad de la cantidad y calidad de los forrajes (Pérez et al., 2010), debido a su elevado contenido de proteína de 21.5 a 28.7 (García et al., 2006; Teixeira et al., 2014) y un rendimiento de biomasa del follaje de hasta 27 kg MS corte-1 arbol-1 (García et al., 2009). Por su parte Martín et al. (2013) reportan que los frutos y semillas se usan para obtener otros recursos alimenticios de alta calidad como el aceite. La moringa presenta una alta capacidad de adaptación a diferentes condiciones edafoclimáticas con rangos de temperatura de -1 a 48 ºC, siendo el rango ideal de 25 a 35ºC (Gopalakrishnan et al., 2016); en este sentido, se ha demostrado que a temperaturas más elevadas disminuye el contenido de nutrientes del follaje (Asante et al., 2014). En latitudes sin variaciones importantes de temperatura presenta floración y producción de follaje estable a lo largo del año (Ramachandran, 1980). Se adapta a altitudes de 0 a 1800 m (García-Roa, 2003); con regímenes de lluvia de 250 a 3,000 mm en suelos ligeramente ácidos o alcalinos, planos o lomeríos (Thurber & Fahey, 2010). Tolera periodos secos de más de seis meses (Mendieta-Araica et al., 2013) y puede reproducirse sexual y asexualmente (Pérez et al., 2010). Las semillas jóvenes de moringa presentan una tasa de germinación hasta del 90 % en condiciones naturales (Ahmed, 2014), en estas circunstancias de edad de la semilla, la escarificación no es necesaria ya que no mejora los índices de germinación (Parrota, 2000), estas semillas pierden viabilidad después de seis meses posteriores a su cosecha (Fotouo et al., 2016). El tratamiento de escarificación puede ser una opción en semillas viejas con más de tres meses de edad, en las cuales la germinación puede aumentar hasta un 7.5 % (Sharma & Raina, 1982; Baskin & Baskin, 2014). Por lo que resulta necesario probar métodos de escarificación de bajo costo y fáciles de aplicar para romper la dormancia en semillas de moringa. Con base en lo anterior, el objetivo del presente trabajo fue determinar el efecto de dos métodos físicos de escarificación sobre la germinación de semillas de Moringa oleifera con seis meses de edad y el desarrollo de las plántulas en fase de vivero.
Material y Métodos
Localización y ubicación del estudio
El trabajo se realizó en el vivero del Colegio de Postgraduados, Campus Campeche. Ubicado en el kilómetro 17.5 de la carretera federal Haltunchén-Edzná en el municipio de Champotón, Campeche. Localizado en las coordenadas 19º 29’56.80’’N - 90º 32’ 34.65’’W; 19º 29’ 46.02’’N - 90º 32’ 21.89’’W; 19º 29’ 48.01’’N - 90º 31’ 56.64’’W; 19º 30’ 11.56’’N - 90º 32’ 13.55’’W). En la región predomina el clima cálido subhúmedo con lluvias en verano (García, 2004). La precipitación anual varía entre 900 y 1200 mm. El sitio presenta temperatura media anual de 25.5 a 26.4°C y una elevación de 21 m.
Tratamientos y procedimiento
Se utilizaron semillas de M. oleifera con seis meses de edad, colectada en plantaciones comerciales de Yucatán, México. Se sembraron en charolas forestales de poliestireno con 77 cavidades y una capacidad por cavidad de 210 mL. El sustrato consistió en una mezcla de tierra negra local y peat moss (50-50). Se aplicaron tres tratamientos: 1) remojo en agua potable por 24 horas, 2) fisura de la testa con bisturí (se realizó de manera individual en laboratorio, asegurando que no se lastimará el embrión), y 3) semilla sin tratamiento como control. Cada charola constituyó una unidad experimental y se tuvieron 10 réplicas por tratamiento. Las semillas de los tres tratamientos se sembraron el mismo día previa preparación según tratamiento.
Variables evaluadas
Germinación
Se midió el porcentaje de germinación de todas las charolas sembradas de cada tratamiento, se monitorearon diariamente a partir del día 3 al 15 posterior a la siembra. Con el valor acumulado al día 15, se calculó el porcentajede germinación con la siguiente fórmula: % G= % [np*100] /77; donde: %G = porcentaje de germinación, np = númerode plántulas germinadas y 77 corresponde al número decavidades de cada charola.
Altura, diámetro basal y número de ramas
Se seleccionaron al azar cinco charolas de cada tratamiento. De cada charola se seleccionaron e identificaron 10 plántulas en las que se registraron tres variables.
Altura: de cada plántula seleccionada se midió la longitud tomando como punto de inicio el sustrato de la charola hasta la hoja de la rama más alta con auxilio de una regla graduada.
Diámetro del tallo basal: de todas las plántulas seleccionadas se midió el diámetro a una altura de 1 cm a partir de la superficie del sustrato con auxilio de un vernier digital.
Número de ramas: se contabilizaron las ramas de cada planta seleccionada.
De todas las variables se realizaron cinco mediciones cada 5 días, contados a partir del día 16 posterior a la siembra hasta el día 40.
Análisis de los datos
Los datos se analizaron mediante un ANOVA con mediciones repetidas en el tiempo del GLM con el programa STATISTICA V 7.1 (StatSoft, 2005). Se realizó correlación de Spearman para las variables evaluadas y prueba de medias por Tukey p < 0.05.
Resultados y discusión
Germinación
No se observaron diferencias por efecto del método de escarificación en la germinación de las semillas de M. oleifera, los valores observados fueron de 80, 78.4 y 73.5 % para el tratamiento de remojo en agua potable, control y fisura de la testa. Los valores de germinación observados en el presente estudio son superiores a los reportados por Barraza, (2017) de 54, 37 y 28 % de germinación en semillas de moringa con 24, 48 y 72 horas de remojo. Son similares a los reportados por Toral et al. (2013) en ocho procedencias de semillas de moringa para las que reportaron un rango de germinación de 49 a 84 % en condiciones de vivero sin tratamiento pregerminativo de las semillas. Sin embargo, los valores encontrados en el presente estudio con el tratamiento de fisura de la testa, son inferiores a los reportados por González & Navarro (2001) con un tratamiento similar en semillas de Albizia lebbeck en donde obtuvieron una germinación de 96.8 % moringa, estas diferencias se deben a que la semilla de M. oleifera presenta dormancia fisiológica, mientas que A. lebbeck presenta dormancia física, por lo que responde mejor a este tipo de tratamientos de escarificación (Baskin & Baskin, 2014). Por otro lado, el efecto del tratamiento en inmersión en agua resulta más eficiente en semillas de leguminosas debido a que la presencia de suberina en las semillas permite incrementar la imbibición de agua y el intercambio de gases necesarios para la renovación del crecimiento embrionario y la germinación (Sanabria et al., 2004).
Altura
La mayor altura de las plántulas de M. oleifera se observó con el tratamiento de remojo en agua potable con un promedio de 19.07 cm (p < 0.05). La altura fue diferente en las cinco evaluaciones realizadas (p < 0.05), fue mayor a los 25 días con un promedio de 26.04 cm (Figura 1). La interacción tratamiento de escarificación con la edad de la plántula presentó efecto (p < 0.05) y los valores más elevados se encontraron con el tratamiento de fisura de la testa a los 25 días, el remojo en agua a los 25 y 20 días y control a los 20 días con valores de 26.2, 26.2, 24.2 y 22.7 cm respectivamente (Tabla 1). Los valores de altura de plántulas registrados en el presente estudio son superiores a los observados por Valdés-Rodríguez et al. (2014), quienes reportan valores a los 25 días post germinación de 7.5 a 18 cm con diferentes sustratos. La tendencia de valores más elevados con el tratamiento de imbibición en agua coincide con lo reportado por Ramírez et al. (2012) en plántulas de Leucaena leucocephala. Este comportamiento puede deberse a que la disponibilidad de agua determina la imbibición, que conduce a la activación de los procesos metabólicos, incrementa el metabolismo de los nutrientes, acelerando la rehidratación y activando los mecanismos de reparación de membranas y biomoléculas que posibilitan la elongación celular, germinación y el desarrollo de tejido estructural (Doria, 2010; Dubreucq et al., 2000). Así como al efecto descrito por Jones & Sharitz (1989), quienes plantean que las semillas que germinan primero toman ventaja de factores ambientales presentes de forma temporal al momento de la germinación como luminosidad, disponibilidad de agua y nutrientes.
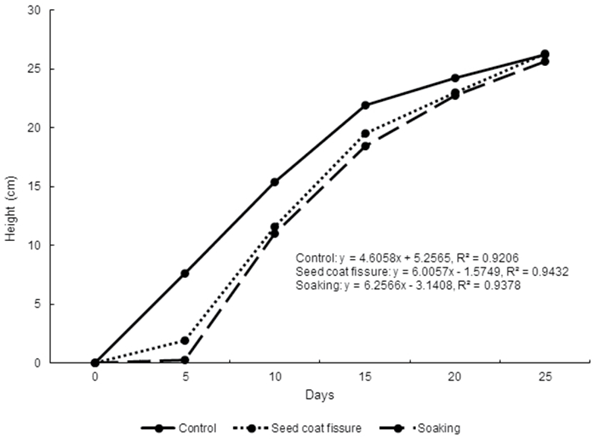
Figura 1 Altura de plántulas de M. oleifera en fase temprana de aviveramiento con tres métodos de escarificación.
Tabla 1 Efecto de dos métodos de escarificación de semillas de M. oleifera sobre sobre la altura, diámetro basal y generación de ramas en etapa de vivero.
| Treatment | Age (days) | ||||
|---|---|---|---|---|---|
| 5 | 10 | 15 | 20 | 25 | |
| Basal diameter of the stem (mm) | |||||
| Control | N.R. | 1.2b±0.09 | 1.8ª±0.07 | 1.9ª±0.07 | 1.9ª±0.07 |
| Soaking in water | N.R. | 1.6a±0.08 | 1.9ª±0.04 | 1.9ª±0.06 | 1.9ª±0.05 |
| Seed coat fissure | N.R. | 1.3ab±0.11 | 1.8ª±0.08 | 1.8ª±0.06 | 1.9ª±0.03 |
| Average | N.R. | 0.14b | 0.18a | 0.19a | 0.19a |
| Number of branches | |||||
| Control | N.R. | 3.1ª±0.15 | 4.7ª±0.15 | 5.5ª±0.13 | 5.9ª±0.17 |
| Soaking in water | N.R. | 3.1ª±0.11 | 5.0ª±0.09 | 5.6ª±0.11 | 6.1ª±0.10 |
| Seed coat fissure | N.R. | 3.0ª±0.11 | 4.8ª±0.16 | 5.6ª±0.15 | 6.2ª±0.18 |
| Average | N.R. | 3.1d | 4.8c | 5.6b | 6.1a |
N.R. No registrado. Literales diferentes en la misma fila y columna indican diferencia estadística significativa, Tukey p < 0.05.
Diámetro basal
El método de escarificación de las semillas de M. oleifera no influyó sobre el desarrollo del diámetro basal, y se observaron promedios de 1.7, 1.7 y 1.8 mm para control, fisurado de testa y remojo en agua potable. La edad de la plántula mostró efecto sobre el diámetro basal de las plántulas (p < 0.05) el valor más bajo se registró a los 10 días con un valor de 1.4 mm, los valores registrados a los 15, 20 y 25 días fueron similares (Tabla 1). Por efecto de la interacción tratamiento con edad de la plántula se observó diferencia (p < 0.05), los menores valores se observaron con control y fisurado de la testa a los 10 días con 1.2 y 1.3 mm, mientras que el tratamiento remojo en agua potable y todos los tratamientos a partir de los 15 días de edad de las plántulas fueron similares. Los valores de diámetro de tallos de las plántulas de moringa a los 25 días de edad observados en el presente estudio son menores a los reportados por Valdés-Rodríguez et al. (2014) quienes encontraron valores de 2.7 a 4.5 mm. En el presente estudio no se observó efecto del método de escarificación sobre el desarrollo del diámetro basal, lo que difiere con lo reportado por Ramírez et al. (2012) quienes encontraron efecto del remojo en agua potable sobre el diámetro de tallo en plántulas de Ziziphus mauritiana.
Número de ramas
No se observaron diferencias entre tratamientos con respecto al número de ramas con valores de 4.84, 4.9 y 5.0 para control, fisurado de testa y remojo en agua potable. La edad de la plántula mostró efecto (p < 0.05) sobre el número de ramas fue mayor a los 25 días con 6.06 ramas (Tabla 1). Por efecto de la interacción tratamiento de escarificación y edad de la plántula los valores más altos se observaron en los tres tratamientos con edad de 20 y 25 días de edad. Tampoco se observó efecto del tipo de escarificación sobre el número de ramas en los primeros días de las plántulas. Los valores observados en el presente estudio son menores a los reportados por Valdés-Rodríguez et al. (2014) quienes encontraron valores de 5.2 a 7.3 ramas en plántulas de moringa de 25 días de edad en diferentes sustratos orgánicos. Así mismo, la tendencia observada en el presente estudio difiere con lo reportado por Ramírez et al. (2012), quienes observaron efecto del tratamiento pregerminativo con remojo en agua potable, lijado de semilla y ácido giberélico en las variables número de nudos y número de ramas en plántulas de las leguminosas Leucaena leucoephala y Pithecellobium dulce, así como del frutal Ziziphus mauritiana.
Correlaciones entre variables
Se observó correlación entre la altura de la plántula y el número de ramas (rs = 0.50, p = 0.0006). El diámetro basal no se correlacionó con el número de ramas ni con la altura de la plántula. Lo que sugiere la necesidad de programas de fertilización en etapa de vivero para suplir los requerimientos nutricionales de la especie y obtener plántulas jóvenes vigorosas y aptas para el trasplante, dado que se ha argumentado que este proceso suele producir estrés fisiológico y que es mayor en plántulas con edades mayores (Flores et al., 2009). En este sentido, Gómez et al. (1986), sugieren que las variaciones del diámetro de tallo en arbóreas y arbustivas justifica entre el 60 y 80 % de las variaciones del peso de las ramas, lo que determina la tasa fotosintética y la sobrevivencia de las plántulas en campo.
Conclusiones
Los métodos físicos de escarificación empleados en este estudio no mejoraron significativamente la tasa de germinación de las semillas de M. oleifera con seis meses de edad. Tampoco mejoraron el diámetro de tallo ni el número de ramas de las plántulas emergidas de las semillas escarificadas. Por lo tanto, es posible asumir que a esa edad las semillas muestran alto potencial de germinación natural, pudiendo ser empleadas en condiciones de vivero. Sin embargo, es necesario evaluar el potencial de este tipo de semillas para emplearse en sistemas de siembra directa en campo. Finalmente, para plántulas provenientes de semillas con largos periodos de almacenamiento, es recomendable establecer programas de fertilización para obtener plántulas jóvenes con un desarrollo adecuado de tallo y brotes para trasplantarse en campo.
References
Ahmed, L. T., Warrag, E. I. and Abdelgadir, A. Y. (2014). Effect of shade on seed germination on early seedling growth of Moringa oleifera Lam. Journal of Forest Products and Industries 3(1): 20-26. http://researchpub.org/journal/jfpi/number/vol3-no1/vol3-no1-3.pdf [ Links ]
Asante, W. J., Nasare, I. L., Tom-Dery, D., Ochire-Boadu, K. and Kentil, K. B. (2014). Nutrient composition of Moringa oleifera leaves from two agro ecological zones in Ghana. African Journal Plant Science 8: 65-71. https://doi.org/10.5897/AJPS2012.0727 [ Links ]
Barraza, F. A. (2017). Germinación de semillas de moringa (Moringa oleifera Lam.) en diferentes tiempos de imbición en agua. Revista U.D.C.A Actualidad & Divulgación Científica, 20(1): 71-77. http://www.scielo.org.co/scielo.php?pid=S0123-42262017000100009&script=sci_abstract&tlng=es [ Links ]
Baskin, C. C. & Baskin, J. M. (2014). A geographical perspective on germination ecology: tropical and subtropical zones. In: Baskin, C.C. and Baskin, J.M. (Editors). Seed, ecology, biogeography, and evolution of dormancy and germination. 2th Edition. Academic Press of Elsevier. ISBN: 978-0-12-416677-6 [ Links ]
Gómez, C. A. G., Tovar, A. J. J., Medina, B. M. and Martínez, T. A. (1986). Relaciones entre diámetro de tallo y peso de las ramas en cuatro especies leñosas mediterraneas. Archivos de Zootecnia 35: 149-154. https://www.uco.es/organiza/servicios/publica/az/php/az.php?idioma_global=0&revista=90&codigo=1108 [ Links ]
Coppin, J. (2008). A study of the nutritional and medicinal values of Moringa oleifera leaves from Sub-Saharan Africa: Ghana, Rwanda, Senegal and Zambia, MSc thesis, Graduates School-New Brunswick Rutgers, The State University of New Jersey. 124 p. http://biblioteca.universia.net/html_bura/ficha/params/title/study-of-the-nutritional-andmedicinal-values-of-moringa-oleifera/id/49974028.html [ Links ]
Donohue, K., Rubio, C. R., Burghardt, L., Kovach, K. and Willis, C. G. (2010). Germination, postgermination, adaptation and species ecological ranges. Annual Review of Ecology, evolution and Systematics, 41: 293-319. https://doi.org/doi:10.7282/T3MG7PVN [ Links ]
Doria, J. (2010). Generalidades sobre las semillas: su producción, conservación y almacenamiento. Cultivos tropicales 31: 74-85. http://scielo.sld.cu/pdf/ctr/v31n1/ctr11110.pdf [ Links ]
Dubreucq, B., Berger, N., Vincent, E., Boisson, M., Pelletier, G., Caboche, M. and Lepiniec, L. (2000). The Arabidopsis AtEPR1 extensin-like gene is specifically expressed in endosperm during seed germination. Plant Journal 23(5): 643-652. https://www.ncbi.nlm.nih.gov/pubmed/10972890 [ Links ]
Flores, E., Moratinos, P., Ramírez, M. and García, D. E. (2009). Evaluación de la emergencia y las características morfológicas iniciales de Tamarindus indica L. con fines agroforestales. Pastos y forrajes 32(2): 1-11. http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S0864-03942009000200008 [ Links ]
Fotouo, M. H., Toit, E. S. and Robbertse, P. J. (2015). Germination ad ultraestructural studies of seed produced by a fastgrowing, drought-resistant tree: implicationsfor its domestiction and seed storage. AoB PLANTS 7: 1-12. https://doi.org/10.1093/aobpla/plv016 [ Links ]
García, D. E., Medina, M. G., Cova, L. J., Clavero, T., Torres, A., Perdomo, D. and Santos, O. (2009). Evaluación integral de recursos forrajeros para rumiantes en el estado Trujillo, Venezuela. Revista de la Facultad de Agronomía (LUZ) 4: 555-582. [ Links ]
García, D. E., Medina, M. G., Domínguez, C., Baldizán, A., Humbría, J. and Cova, L. (2006). Evaluación química de especies no leguminosas con potencial forrajero en el estado Trujillo, Venezuela. Zootecnia Tropical 24(4): 401-415. [ Links ]
García, E. (2004). Modificaciones al sistema de clasificación de Köppen para adaptarlo a las condiciones de la República Mexicana. Instituto de Geografía, Universidad Nacional Autónoma de México. Serie libros No. 6. México, DF. 98 p. https://www.academia.edu/12911044/Modificaciones_al_sistema_de_clasificaci%C3%B3n_clim%C3%A1tica_de_K%C3%B6ppen_para_adaptarlo_a_las_condiciones_de_la_Rep%C3%BAblica_Mexicana_2004_._Enriqueta_Garc%C3%ADa [ Links ]
García-Roa, M. (2003). Producción de semillas forestales de especies forrajeras enfatizados en sistemas silvopastoriles. Instituto Nacional Forestal. Managua, Nicaragua. https://s3.amazonaws.com/academia.edu.documents/41739070/Produccion_Semillas_forestales_Especies_forrrajeras_.pdf?response-content-disposition=inline%3B%20filename%3DPRODUCCION_DE_SEMILLAS_FORESTALES_DE_ESP.pdf&X-Amz-Algorithm=AWS4-HMACSHA256&X-Amz-Credential=AKIAIWOWYYGZ2Y53UL3A%2F20190703%2Fus-east-1%2Fs3%2Faws4_request&X-Amz-Date=20190703T143336Z&X-Amz-Expires=3600&X-Amz-SignedHeaders=host&X-Amz-Signature=66499f49d48c8fa230e5b5c0aed50a58318772a424b698c7ffa9212efd1557ad [ Links ]
González, Y. & Navarro, M. (2001). Efecto de tratamientos pregerminativos en la ruptura de la dormancia en las semillas de Albizia lebbeck. Pastos y Forrajes, 24(3): 225-228. https://payfo.ihatuey.cu/index.php?journal=pasto&page=article&op=view&path%5B%5D=900 [ Links ]
Gopalakrishnan, L., Doriya, K. and Kumar, S. D. (2016). Moringa oleifera: A review on nutritive importance and its medicinal application. Food Science and Human Wellness, 5(2): 49-56. https://doi.org/10.1016/j.fshw.2016.04.001 [ Links ]
Jahn, S. A. A. (1998). Using Moringa oleifera seeds as coagulant in developing countries. Journal American Water Works Association, 80(6): 43-50. https://doi.org/10.1002/j.1551-8833.1988.tb03052.x [ Links ]
Jones, R. H. & Sharitz, R. R. (1989). Potential advantages and disadvantages of germinating early for trees in flood plain forests. Oecologia, 81(4): 443-449. https://doi.org/10.1007/BF00378950 [ Links ]
Lakshmipriya, G., Doriya, K., Santos, K. D. (2016). Moringa oleífera: A review on nutritive importance and its medicinal application. Food Science and Human Wellness, 5(2): 49-56. https://doi.org/10.1016/j.fshw.2016.04.001 [ Links ]
Martín, C., Martín, G., García, A., Fernández, T., Hernández, E. and Puls, J. (2013). Potenciales aplicaciones de Moringa oleifera. Una revisión crítica. Pastos y forrajes, 36(2):137-149. http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S0864-03942013000200001 [ Links ]
Mendieta-Araica, B., Sporndly, E., Reyes-Sánchez, N., Salmerón-Miranda, F. and Halling, M. (2013). Biomass production and chemical composition of Moringa oleifera under different planting densities and levels of nitrogen fertilization. Agroforestry Systems, 87(1): 81-92. https://doi.org/10.1007/s10457-012-9525-5 [ Links ]
Parrota, J. A. (2000). Moringa oleifera Lam. En: Francis, JK, Lowe, CA, Trabanino, S (Ed). Bioecología de Arbóreas Nativos y Exóticos de Puerto Rico y las Indias Occidentales. Gen. Tech. Rep. IITF-15. Departamento de Agricultura de los Estados Unidos, Servicio Forestal, Instituto Internacional de Dasonomía Tropical. Río Piedras, Puerto Rico. pp: 366-370. https://data.fs.usda.gov/research/pubs/iitf/Bioecologia_gtr15.pdf [ Links ]
Pérez, A., Sánchez, T., Armengol, N. and Reyes, F. (2010). Características y potencialidades de Moringa oleifera Lamark. Una alternativa para la alimentación animal. Pastos y Forrajes, 36(4):1-16. http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S0864-03942010000400001 [ Links ]
Ramachandran, C., Peter, K. V. and Gopalakrishnan, P. K. (1980). Drumstick (Moringa oleifera): a multipurpose Indian vegetable. Economic Botany 34(3): 276-283. https://doi.org/10.1007/BF02858648 [ Links ]
Ramírez, M., Suárez, H., Regino, M., Caraballo, B. and García, D. (2012). Respuesta a tratamientos pregerminativos y caracterización morfológica de plántulas de Leucaena leucocephala, Pithecellobium dulce y Ziziphus mauritiana. Pastos y Forrajes 35(1): 29-42. http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S0864-03942012000100003 [ Links ]
Rashid, U., Anwar, F., Moser, B. R. and Knothe, G. (2008). Moringa oleifera Oil: A Possible Source of Biodiesel. Bioresource Technology 99(17): 8175-8179. https://doi.org/10.1016/j.biortech.2008.03.066 [ Links ]
Sanabria, D., Silva-Acuña, R., Oliveros, M. and Manrique, U. (2004). Germinación de semillas de las leguminosas arbustivas forrajeras Cratylia argentea y Cassia moschata sometidas a inmersión en ácido sulfúrico. Bioagro, 16(3): 10-25. http://www.scielo.org.ve/scielo.php?script=sci_arttext&pid=S1316-33612004000300010 [ Links ]
Sharma, G.K., Raina, V. 1982. Propagation techniques of Moringa oleífera Lam. En: Khosla, P.K., ed. Improvement of forest biomass: Proceedings of a Symposium, 20-21 November 1980, Solan, India: Indian Society of Tree Scientists: p. 175-181. [ Links ]
StatSoft, Inc. STATISTICA (data analysis software system) (2005) version 7.1. http://www.statsoft.com/Products/STATISTICA-Features [ Links ]
Teixeira, E.M., Carvalho, M.R., Neves, V.A., Silva, M.A. and Arantes-Pereira, L. 2014. Chemical characteristics and fractionation of proteins from Moringa oleífera Lam. Leaves. Food Chemistry, 15(147): 51-54. https://doi.org/10.1016/j.foodchem.2013.09.135 [ Links ]
Tesfay, S. Z., Modi, A. T. and Mohammed, F. (2016). The effect of temperature in Moringa seed phytochemical compounds and carbohydrate mobilization. South African Journal of Botany, 102(January):190-196. https://doi.org/10.1016/j.sajb.2015.07.003 [ Links ]
Thurber, M. D. & Fahey, J. W. (2010). Adoption of Moringa oleifera to combat under nutrition viewed through the lens of the diffusion of innovations theory. Ecology Food Science Nutrition, 48(3): 210-225. HTTPS://doi.org/10.1080/03670240902794598 [ Links ]
Toral, O., Cerezo, Y., Reino, J. and Santana, H. (2013). Caracterización morfológica de ocho procedencias de Moringa oleífera (Lam.) en condiciones de vivero. Pastos y Forrajes, 36(4): 409-416. http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S0864-03942013000400002 [ Links ]
Valdés-Rodríguez, O. A., Muños-Gamboa, C., Pérez-Vázquez, A. and Martínez-Pacheco, E. (2014). Análisis y ajuste de curvas de crecimiento de Moringa oleifera Lam. en diferentes sustratos. Revista Biológico-Agropecuaria Tuxpan, 2(2): 66-70. http://www.colpos.mx/wb_pdf/Veracruz/2014/20_14_19.pdf [ Links ]
Recibido: 27 de Noviembre de 2017; Aprobado: 14 de Septiembre de 2018











 text in
text in 


