Introducción
La descomposición de la materia orgánica aportada por el mantillo es la precursora y reguladora de los patrones de disponibilidad de nutrientes, es la responsable del abastecimiento, en parte, del flujo de energía en los ecosistemas forestales (Weltzin et al., 2005). Se estima que del total de nutrientes que las plantas necesitan, 80 % se libera durante este proceso de descomposición (Liu et al., 2006; Sayer et al., 2020), por lo que es clave para el funcionamiento de los ciclos biogeoquímicos, ya que favorece las condiciones físicas, químicas y biológicas del suelo (Liu et al., 2004; Castellanos y León, 2010).
La descomposición del mantillo y del suelo tiene reguladores en común que actúan de forma diferente, por ejemplo, la aireación del suelo afecta la descomposición de la materia orgánica, pero muy poco la del mantillo. Otros reguladores que inciden de manera directa sobre el proceso de descomposición son el clima, la composición de la hojarasca, la fauna edáfica y los microorganismos (Pando-Moreno et al., 2018); la estructura y composición de la vegetación son algunos de los factores más importantes, ya que determinan la variación local en los procesos de acumulación y descomposición del mantillo (Gaspar-Santos et al., 2015).
Cornelissen (1996) destaca que la composición química del mantillo es un elemento clave en la velocidad a la cual la materia orgánica se descompone. Por lo general, el proceso de descomposición de la materia orgánica aportada por el mantillo consta de dos etapas: una inicial de rápido desarrollo debido a la lixiviación de compuestos solubles y a la descomposición de azúcares, fenoles y proteínas (Arellano et al., 2004), y una segunda fase caracterizada por una descomposición más lenta debido al contenido de celulosa, lignina y hemicelulosa (sustancias recalcitrantes), lo cual resulta en una menor tasa de descomposición (Crespo, 2015).
En los ecosistemas forestales de clima templado donde predominan los géneros Pinus L. y Quercus L., el proceso de descomposición in situ ha evidenciado que ciertas variables climáticas, la composición y distribución de especies, suelen ser factores que determinan la tasa o dinámica de pérdida de masa (Moreno et al., 2018). Por lo tanto, el estudio del proceso de descomposición del mantillo en los ecosistemas templados es fundamental para lograr una comprensión, a mayor escala, sobre la liberación de nutrientes (Bohara et al., 2019). Es por ello que el objetivo del presente trabajo fue conocer el proceso de descomposición del mantillo en ecosistemas de pino, encino y pino-encino que incluyó modelos para predecir la tasa de descomposición en cada comunidad vegetal, a partir de la siguiente hipótesis: la descomposición en el ecosistema de pino es más lenta que en los ecosistemas de encino y pino-encino, donde el mantillo posee diversas características fisicoquímicas debido a las condiciones de la estructura de la vegetación.
Materiales y Métodos
Área de estudio
La presente investigación se llevó a cabo en tres diferentes ecosistemas (pino, encino y pino-encino), los cuales se localizan en el ejido Pablillo, municipio de Galeana, Nuevo León (Figura 1), cuyo clima es de tipo árido, templado, con lluvias entre verano e invierno mayores a 18 % anual (García, 2004). Las comunidades vegetales predominantes en la zona corresponden a matorrales y bosques de coníferas con presencia de Pinus pseudostrobus Lindl. y rodales mixtos con Pinus teocote Schltdl. & Cham., P. ayacahuite var. brachyptera Shaw, P. arizonica Engelm., P. cembroides Zucc., P. hartwegii Lindl., Pseudotsuga menziesii (Mirb.) Franco var. glauca (Mayr) Franco y la asociación Pinus pseudostrobus con Quercus spp. y Quercus sideroxyla Bonpl., en segundo término: Pinus culminicola Andresen & Beaman, Arbutus glandulosa M. Martens & Galeotti, Quercus crassifolia Bonpl., Alnus acuminata Kunth y Juniperus deppeana Steud. var. robusta Martínez (Tapia y Návar, 2011).
El intervalo altitudinal en el que se desarrollan los ecosistemas bajo estudio es de 2 267 msnm para pino (ubicación geográfica: 24°34'44.34" N; 99°58'30.12" O), 2 313 msnm para encino (ubicación geográfica: 24°34'28.32" N; 99°58'33.180" O) y 2 160 msnm para encino-pino (ubicación geográfica: 24°35'27.66" N; 99°58'34.50" O).
Descomposición del mantillo y frecuencia de recolecta
Con base en el método de bolsas de descomposición propuesto por Bocock y Gilbert (1957), se evaluó durante un periodo de un año en condiciones de intemperie el proceso de descomposición del mantillo en tres ecosistemas templados. El mantillo corresponde a todo aquel material que se forma una vez que la hojarasca cae al suelo formando un estrato orgánico (Pérez-Vázquez et al., 2021); se manejó en los tres ecosistemas de manera uniforme, para ello se colocaron 10 g de peso seco de una mezcla uniforme de los componentes de la hojarasca (hojas, ramas, corteza, estructuras reproductivas y otros componentes misceláneos), la cual fue recolectada en cada uno de los ecosistemas un mes antes de iniciar el experimento con la finalidad de que fuera material fresco y se colocó en bolsas de papel, posteriormente, se secó a 65 °C. La recolecta se realizó de manera aleatoria en cada sitio (López-Hernández et al., 2018).
Por tipo de ecosistema, se utilizó un total de 60 bolsas de descomposición, se distribuyeron 12 al azar en cinco parcelas experimentales de 20 m × 20 m, colindantes entre ellas a fin de cubrir el total de la superficie del sitio en cada ecosistema. Las bolsas fueron de tela nylon de 1 mm de apertura, con dimensiones de 25 cm × 20 cm (Rodríguez et al., 2019), lo que permite que los invertebrados detritívoros tengan acceso a su interior, pero minimizan las pérdidas por fragmentación (Martínez-Atencia et al., 2020). Cada bolsa se colocó en la superficie del suelo, sin alterar las condiciones del sustrato en descomposición para evitar que se modificaran las condiciones naturales en las cuales se desarrollan los microorganismos descomponedores, además de mantener el contacto con la materia orgánica del suelo (Rodríguez et al., 2019).
La evaluación se llevó a cabo durante 12 fechas de muestreo correspondientes al periodo de febrero de 2021 a enero de 2022; se recolectaron cinco bolsas por parcela y ecosistema de estudio cada 30 días. El material se transportó al Laboratorio de Química de la Facultad de Ciencias Forestales de la Universidad Autónoma de Nuevo León, donde se aplicó la metodología propuesta por López-Hernández et al. (2018) para secarlo en una estufa de aire forzado (Felisa ® modelo FE-292AD) a una temperatura constante de 65 °C hasta obtener un peso constante (g). En diversos trabajos (Rivera et al., 2013; Tapia-Coronado et al., 2022) se considera que las partículas del suelo que se adhieren al material vegetal, no alteran los resultados y pueden considerarse despreciables, sin embargo, con el fin de eliminarlas, las submuestras se limpiaron con un pincel. El peso remanente (g) del mantillo de cada repetición se obtuvo para estimar el grado de la descomposición mediante la diferencia del peso inicial y el peso final de cada fecha de muestreo, ambos se registraron con una balanza digital Sartorius ® modelo Laboratory LC 620 S con resolución de 0.001 g.
Mediante el Modelo simple exponencial negativo propuesto por Olson (1963), se estimó la tasa de descomposición de la mezcla uniforme de los componentes del mantillo (10 g) para cada ecosistema. Además del Modelo exponencial de Olson (1963), y con el fin de estimar las tasas de descomposición del mantillo, se probaron otros modelos matemáticos (lineal simple, logarítmico y de potencia) para determinar cual presentaba un mejor ajuste en la estimación de la tasa de descomposición, en comparación con el modelo de referencia:
Donde:
H = Fracción del mantillo remanente (años)
t = Tiempo (años)
ln = Logaritmo natural
β 0 = Porcentaje de peso inicial de mantillo
β 1 = Tasa de descomposición del mantillo
Análisis estadísticos
Los promedios de la fracción del mantillo remanente, por fecha de muestreo y ecosistema se sometieron a un análisis estadístico para probar los supuestos de normalidad (prueba de Kolmogorov-Smirnov con la corrección de Lilliefors) y de homogeneidad de varianzas (prueba de Levene) (Ott, 2001). Dado que ambos supuestos fueron demostrados, se realizó un análisis de varianza de acuerdo a un diseño experimental con un criterio de clasificación (Steel y Torrie, 1980) para detectar diferencias en la cantidad de la fracción del mantillo remanente entre los ecosistemas forestales para cada fecha de muestreo. La comparación de medias de la fracción del mantillo remanente por fecha se realizó mediante la prueba HDS (p=0.05) de Tukey (Ott, 2001). La evaluación de la bondad de ajuste de cada modelo utilizado para determinar la tasa de descomposición del mantillo se hizo a partir de las gráficas de los residuos, los valores de la Raíz del cuadrado medio del error, y con base en los coeficientes de determinación (R 2 ) y de correlación (r) de Pearson (Ott, 2001). Todos los análisis estadísticos se efectuaron con el paquete estadístico Statistical Package for Social Sciences (SPSS por sus siglas en inglés) versión 22.0 para Windows (IBM, 2016).
Resultados y Discusión
Descomposición del mantillo
En el Cuadro 1 se presentan los promedios de la fracción del mantillo remanente por cada ecosistema. Los estadísticos y valores de p de la prueba de Kolmogorov-Smirnov y la prueba de Levene (L), así como los valores F y p del análisis de varianza por fecha de muestreo, también se incluyen. De acuerdo con la prueba HDS de Tukey, la mayoría de las fechas de recolecta presentaron diferencias significativas (p<0.05) entre ecosistemas, a excepción de la cuarta (MAY-21), sexta (JUL-21) y última fecha (ENE-22) de muestreo.
Cuadro 1 Promedios de la fracción del mantillo remanente por fecha de recolecta y ecosistema.
| Fecha de colecta | Fracción del mantillo remanente | K-S | Valor p | L | Valor p | F | Valor p | EEEM | ||
|---|---|---|---|---|---|---|---|---|---|---|
| Encino | Pino | Pino-Encino | ||||||||
| 1. FEB-21 | 0.944a | 0.935a | 0.913b | 0.193 | 0.139 | 5.54 | 0.020 | 14.26 | 0.001 | 0.0042 |
| 2. MAR-21 | 0.947a | 0.928b | 0.914c | 0.218 | 0.052 | 1.69 | 0.225 | 25.95 | 0.001 | 0.0033 |
| 3. ABR-21 | 0.958a | 0.944a | 0.920b | 0.142 | 0.200 | 1.86 | 0.198 | 21.14 | 0.001 | 0.0042 |
| 4. MAY-21 | 0.924a | 0.920a | 0.905a | 0.156 | 0.200 | 0.03 | 0.975 | 1.46 | 0.270 | 0.0085 |
| 5. JUN-21 | 0.907a | 0.918a | 0.871b | 0.118 | 0.200 | 1.01 | 0.392 | 9.58 | 0.003 | 0.0078 |
| 6. JUL-21 | 0.897a | 0.928a | 0.896a | 0.200 | 0.111 | 0.05 | 0.951 | 0.82 | 0.462 | 0.0201 |
| 7. AGO-21 | 0.812b | 0.891a | 0.820b | 0.206 | 0.085 | 1.63 | 0.237 | 30.50 | 0.001 | 0.0079 |
| 8. SEP-21 | 0.819b | 0.904a | 0.866ab | 0.120 | 0.200 | 0.32 | 0.731 | 10.58 | 0.002 | 0.0130 |
| 9. OCT-21 | 0.792b | 0.880a | 0.806ab | 0.171 | 0.200 | 1.24 | 0.330 | 5.18 | 0.029 | 0.0213 |
| 10. NOV-21 | 0.704b | 0.848a | 0.838a | 0.196 | 0.148 | 1.45 | 0.276 | 7.61 | 0.008 | 0.0322 |
| 11. DIC-21 | 0.692b | 0.826a | 0.776a | 0.161 | 0.200 | 1.45 | 0.281 | 12.79 | 0.002 | 0.0198 |
| 12. ENE-22 | 0.765a | 0.857a | 0.788a | 0.230 | 0.187 | 7.36 | 0.024 | 1.18 | 0.369 | 0.0441 |
EEEM = Error Estándar Estimado de la Media. ** Medias de la fracción del mantillo remanente con la misma letra no son estadísticamente diferentes (p>0.05) de acuerdo a la prueba HDS de Tukey.
En la Figura 2 se presenta la dinámica de la fracción del mantillo remanente para los tres ecosistemas durante el periodo de estudio. En las primeras tres fechas (FEB-21 a ABR-21), la fracción remanente del mantillo fluctuó de 0.913 (ecosistema de pino-encino) a 0.958 (ecosistema de encino). Entre ABR-21 y DIC-21, la fracción del mantillo remanente en el ecosistema de pino disminuyó gradualmente hasta 0.83 %, mientras que en los ecosistemas pino-encino y encino dicha fracción fue de 0.78 % y 0.69 %, respectivamente; la descomposición fue más notoria en el ecosistema de encino. Con respecto a la última fecha de recolecta (ENE-22), se observó un ligero aumento en la fracción remanente del mantillo en los tres ecosistemas, que de acuerdo con Pinos et al. (2017), este fenómeno sucede debido a las condiciones climáticas particulares que se desarrollan durante el proceso de descomposición, las cuales actúan de manera directa retardando o aumentando el proceso. En este mismo sentido, von Arx et al. (2012) aseguran que el proceso de descomposición es fuertemente influenciado por características del clima como humedad, temperatura y precipitación que inciden de manera activa retardando la descomposición durante periodos de tiempo específicos, e incluso lo detienen.
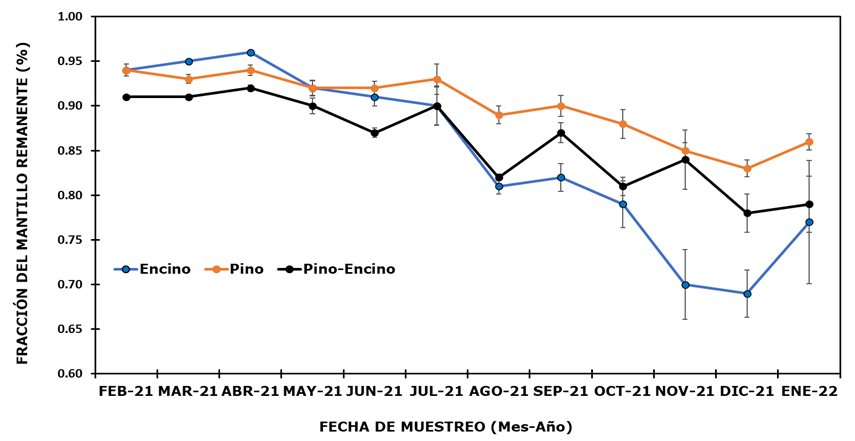
Cada valor graficado representa la media de n ij observaciones del ecosistema i en la fecha de muestreo j, con i = 1, 2, 3; j = 1, … , 12 ± Error típico de la media.
Figura 2 Fracción del mantillo remanente de los tres tipos de ecosistemas.
Los resultados del presente estudio son congruentes con la investigación realizada por Xuluc-Tolosa et al. (2003), pero difieren de lo documentado por Torres et al. (2018), quienes indican que la tasa de descomposición en los primeros meses es mayor y después la pendiente se vuelve más lenta y se reduce significativamente, lo cual responde en gran medida al tipo de ecosistema estudiado; la rápida pérdida de masa en el primer periodo se asocia a la baja presencia de taninos y nitrógeno que se liberan durante el proceso de descomposición de especies asociadas a manglares. Por el contrario, los ecosistemas forestales templados pueden presentar un proceso de descomposición lento en la primera fase debido a la composición química de las acículas de los pinos (Moreno et al., 2018).
Rivera et al. (2013) señalan que la primera etapa es controlada por la fragmentación que realiza la fauna edáfica y se relaciona con los compuestos solubles en agua, mientras que la segunda etapa tiene una relación más directa con el contenido de lignina presente en el mantillo, lo cual provoca que la descomposición sea más lenta. Lo anterior puede explicar las diferencias en la descomposición del mantillo en el ecosistema de pino, que fue más lenta, con respecto a la degradación de la hojarasca del ecosistema de encino (Figura 2).
Estos razonamientos permiten suponer diferencias en la composición química entre los mantillos de los ecosistemas estudiados. Al respecto, Bruno-Eutimio et al. (2022) documentan que la composición química del mantillo es un factor determinante que se refleja durante el proceso de descomposición. En ese mismo sentido, Avendaño-Yáñez et al. (2020) y Berg y McClaugherty (2020) concluyen que las diferencias observadas durante el proceso de descomposición se asocian al tipo de hojarasca y su composición química, lo que puede pausar o impulsar el proceso en diferentes ecosistemas. El porcentaje de descomposición del mantillo al final del estudio fue de 14 % para el ecosistema de pino, 22 % para el de pino-encino y 23 % para el de encino.
De acuerdo con los resultados de Rodríguez et al. (2019), la pérdida de la fracción del mantillo remanente para los ecosistemas de pino, encino y pino-encino fue de 17, 27 y 23 %, respectivamente, los cuales coinciden con los intervalos observados en el presente estudio, por lo que el proceso de descomposición en ecosistemas de pino, encino y pino-encino sigue una tendencia, aun cuando dichos ecosistemas se sitúen en diferentes zonas, con distintos tipos de suelo y características particulares, además estas similitudes pueden explicarse a escala local por la composición química del mantillo típica de los bosques mixtos, los cuales generalmente tienen baja fertilidad (Reed et al., 2012).
De acuerdo con la investigación desarrollada por Soong et al. (2015) bajo condiciones de laboratorio en la Universidad Estatal de Colorado, las pérdidas de la fracción del mantillo para pino (Pinus ponderosa P. Lawson & C. Lawson) es de 28 % y para encino (Quercus macrocarpa Michx.) de 58 %, con una mayor descomposición en comparación con los resultados de la presente investigación para el encino, resultados que se asocian a diversos factores que actúan pasivamente en el proceso de descomposición, por ejemplo: factores químicos y bióticos que tienen un papel fundamental en el comportamiento de la pérdida de masa del mantillo, aun cuando se trate de especies del mismo género (Bangroo et al., 2017).
Un factor importante que se debe considerar en los estudios de descomposición del mantillo es el tiempo para evaluar el proceso de pérdida de masa, asociado principalmente a los ecosistemas forestales, tal como lo sugiere Prescott (2005) quien indica que los patrones de descomposición pueden modificarse en experimentos de larga duración, ya que el porcentaje de descomposición del mantillo a largo plazo alcanza una desintegración mayor y con ello se logra una mejor comprensión del proceso. En este sentido, Horodecki y Jagodziński (2019) documentan que para comprender procesos como la mineralización y humificación es necesario analizar por completo el proceso, lo que deriva en una comprensión más precisa de la liberación de nutrientes.
El periodo de estudio de la presente investigación fue de un año, considerado como el conveniente para especies de climas templados asociadas a ecosistemas forestales (Edwards, 1977; Rocha-Loredo y Ramírez-Marcial, 2009; López-Hernández et al., 2018), el cual comparado con otros estudios en ecosistemas de climas tropicales es suficiente para estabilizar el proceso de descomposición. Por ejemplo, Oliveira et al. (2019) solo analizaron la descomposición de la hojarasca en un periodo de 136 días para Urochloa brizantha (Hochst. ex A. Rich.) R. D. Webster, y concluyen que la masa residual del mantillo después de un día de descomposición se suma a la masa del mantillo recién depositada que sigue descomponiéndose día tras día, por lo que es un proceso continuo que requiere estudiarse en intervalos de tiempo continuos. Rivera et al. (2013) estudiaron el proceso de desintegración de la materia orgánica en un ecosistema templado en la Reserva de la Biosfera Selva El Ocote durante 223 días, en el cual incluyeron varias especies, entre ellas: Enterolobium cyclocarpum (Jacq.) Griseb., Salix bonplandiana Kunth, Cecropia peltata L., Heliocarpus appendiculatus Turcz. y Mastichodendron capiri (A. DC.) Cronquist. El factor más determinante en el proceso de descomposición fue la edad de los individuos. Tapia-Coronado et al. (2022) en 210 días analizaron el comportamiento de la descomposición de hojarasca de especies forestales [Gmelina arborea Roxb. ex Sm., Tabebuia rosea (Bertol.) DC. y Acacia mangium Willd.] en sistemas silvopastoriles de clima seco tropical, cuyo proceso de descomposición es similar al del presente trabajo, con una pérdida de material inicial rápida que favorece la liberación activa de nutrientes, para después volverse un proceso más lento. Zhang et al. (2008) observaron que las variaciones en las tasas de descomposición del mantillo se deben, principalmente, a las diferencias en la calidad de la hojarasca, los diversos microclimas, el tipo y la composición de la comunidad microbiana y las propiedades del suelo, entre los cuales destaca la calidad del mantillo como el principal factor en el proceso de descomposición.
En general, los bosques latifoliados en donde las precipitaciones y temperaturas son altas, el proceso de descomposición suele ser más acelerado que aquellos ecosistemas en los que la temperatura y precipitación son menores, por ejemplo, los bosques de coníferas. Asimismo, otro factor determinante es la acidez de los suelos en los bosques de coníferas, que al ser más ácidos respecto a otros ecosistemas, por ejemplo los pastizales, limita las actividades microbianas y por tanto disminuyen el proceso de descomposición del mantillo (Gholz et al., 2000).
Modelos de descomposición del mantillo
En lo que respecta a los valores de los estadísticos de ajuste de los cuatro modelos de descomposición evaluados, se describen en el Cuadro 2; se observa que el Coeficiente de determinación presentó una fluctuación de 0.455 a 0.719, valores relativamente más bajos en relación con los documentados por Moreno et al. (2018) en ecosistemas mixtos (0.965 a 0.069), y Rodríguez et al. (2019) quienes refieren para este estadístico un intervalo entre 0.577 y 0.899 en ecosistemas forestales del norte del país.
Cuadro 2 Modelos de regresión ajustados para la estimación de la fracción del mantillo remanente durante el periodo de estudio para los tres tipos de ecosistemas.
| Modelo | Ecosistema | Coeficiente estimado | Intervalos del 95 % de confianza | Coeficiente estimado | Intervalos del 95 % de confianza | Estadísticos | ||||
|---|---|---|---|---|---|---|---|---|---|---|
|
|
|
|
|
|
|
R 2 | RCME |
Coeficiente de Pearson |
||
| Exponencial | Encino | 1.017 | 0.983 | 1.051 | 0.352 | 0.290 | 0.414 | 0.71 | 0.054 | 0.843 |
| Pino | 0.961 | 0.946 | 0.976 | 0.128 | 0.101 | 0.156 | 0.621 | 0.026 | 0.788 | |
| Pino-Encino | 0.946 | 0.926 | 0.967 | 0.180 | 0.141 | 0.220 | 0.617 | 0.034 | 0.785 | |
| Línea simple | Encino | 1.009 | 0.979 | 1.039 | -0.303 | -0.354 | -0.252 | 0.719 | 0.053 | 0.848 |
| Pino | 0.960 | 0.946 | 0.975 | -0.116 | -0.141 | -0.092 | 0.626 | 0.025 | 0.791 | |
| Pino-Encino | 0.944 | 0.924 | 0.963 | -0.156 | -0.190 | -0.123 | 0.62 | 0.034 | 0.788 | |
| Logarítmico | Encino | -0.276 | -0.312 | -0.24 | -0.126 | -0.157 | -0.094 | 0.537 | 0.085 | 0.733 |
| Pino | -0.144 | -0.158 | -0.13 | -0.044 | -0.056 | -0.031 | 0.462 | 0.034 | 0.680 | |
| Pino-Encino | -0.203 | -0.224 | -0.183 | -0.063 | -0.081 | -0.045 | 0.489 | 0.047 | 0.699 | |
| Potencia | Encino | 0.770 | 0.744 | 0.797 | -0.112 | -0.140 | -0.084 | 0.543 | 0.068 | 0.737 |
| Pino | 0.867 | 0.854 | 0.880 | -0.042 | -0.054 | -0.029 | 0.455 | 0.031 | 0.675 | |
| Pino-Encino | 0.819 | 0.802 | 0.836 | -0.059 | -0.076 | -0.042 | 0.485 | 0.04 | 0.696 | |
β 0 y β 1 = Coeficientes del modelo; LI y LS = Límite inferior y superior de los coeficientes del modelo, respectivamente; R 2 = Coeficiente de determinación; RCME = Raíz del cuadrado medio del error.
Los valores obtenidos del ajuste de los modelos en los tres ecosistemas bajo estudio para el Coeficiente de correlación variaron de 0.675 a 0.848, los cuales son bajos en comparación con los citados por Del Valle-Arango (2003) con 0.966, e Ibarra et al. (2011) con 0.946. El Modelo exponencial negativo simple (Olson, 1963) presentó un buen ajuste de acuerdo con el Coeficiente de determinación, el cual fluctuó de 0.617 (ecosistema de pino-encino) a 0.710 (ecosistema de encino). El Coeficiente de correlación de Pearson se distribuyó entre 0.785 y 0.843. Este modelo es el más usado para describir la tasa de descomposición del mantillo (Swift et al., 1981; Burghouts et al., 1998; Gama-Rodrigues et al., 2003; Tapia-Coronado et al., 2022).
Al Modelo lineal simple correspondió un Coeficiente de determinación (R 2 ) de 0.620 (ecosistema de pino-encino) a 0.719 (ecosistema de encino). Respecto a los modelos logarítmico y potencia, presentaron coeficientes de determinación bajos (0.462 a 0.543), con respecto a los modelos exponencial y lineal simple.
Tasa de descomposición
La velocidad de descomposición (constante k) del mantillo dada por los modelos exponencial y lineal simple, los cuales se consideraron como referencia con base en los valores más altos de los coeficientes de determinación, se presentan en el Cuadro 2; se observa que dicha constante para los tres ecosistemas fue de 0.352, 0.180 y 0.128, respectivamente, a partir de los cuales se estimó el tiempo teórico requerido para que se degrade 25, 50 y 75 % del mantillo. Los valores estimados, de acuerdo con el modelo propuesto por Olson (1963) fueron de 0.866 (ecosistema de encino) hasta 10.455 años (ecosistema de pino) (Cuadro 3).
Cuadro 3 Tiempo estimado (años) para desintegrar el 25 % (t 0.25), 50 % (t 0.5) y 75 % (t 0.75) del mantillo en los tres tipos de ecosistemas.
| Modelo | PD | Ecosistemas | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Encino | Pino | Pino-Encino | ||||||||
| Estimación | LI | LS | Estimación | LI | LS | Estimación | LI | LS | ||
| Exponencial | 25 | 0.866 | 0.656 | 0.934 | 1.929 | 1.690 | 2.294 | 1.289 | 1.156 | 1.494 |
| 50 | 2.018 | 1.635 | 2.330 | 5.076 | 4.285 | 6.291 | 3.534 | 2.997 | 4.368 | |
| 75 | 3.985 | 3.309 | 4.717 | 10.455 | 8.721 | 13.123 | 7.370 | 6.144 | 9.281 | |
| Lineal Simple | 25 | 0.854 | 0.646 | 1.147 | 1.803 | 1.389 | 2.434 | 1.240 | 0.918 | 1.739 |
| 50 | 1.678 | 1.351 | 2.138 | 3.942 | 3.159 | 5.137 | 2.835 | 2.230 | 3.772 | |
| 75 | 2.503 | 2.056 | 3.130 | 6.080 | 4.928 | 7.840 | 4.430 | 3.542 | 5.805 | |
PD = Porcentaje de descomposición; LI = Límite Inferior; LS = Límite Superior. Ambos límites con un intervalo de 95 % de confianza.
En relación a los valores de la constante de descomposición (k) del Modelo lineal simple, variaron de -0.116 (ecosistema de pino-encino) hasta -0.303 (ecosistema de encino) (Cuadro 2). En lo referente a las estimaciones del tiempo necesario para degradar el mantillo 25, 50 y 75 %, fluctuó de 0.854 (ecosistema de encino) hasta 6.080 años (ecosistema de pino) (Cuadro 3). Estos resultados indican, de manera general, que la estimación de la descomposición del mantillo es mayor con el modelo de Olson respecto a cuando se utiliza el Modelo lineal simple, ya que los tiempos promedios de descomposición son más altos. Cabe puntualizar que los tiempos de descomposición del mantillo a 25, 50 y 75 % en ambos modelos, deben de considerarse con reserva, ya que las condiciones ambientales, tanto bióticas como abióticas y químicas, no se mantienen constantes.
En este sentido, Tresch et al. (2019) señalan que el proceso está influenciado por las condiciones ambientales de cada sitio, las cuales modifican las tasas de descomposición; Correa-Araneda et al. (2020) hacen referencia a que las condiciones ambientales que predominan en intervalos de tiempo específicos, controlan la descomposición a través de diversos procesos directos e indirectos que rara vez son constantes, por ejemplo, Bölscher et al. (2020) mencionan que las altas temperaturas y las precipitaciones facilitan la acidificación del suelo, lo que probablemente aumente la presencia de agentes descomponedores, y por ende las actividades microbianas, las que pueden ser alteradas por fenómenos climáticos extraordinarios, y en consecuencia se modifican las tasas de descomposición.
En la Figura 3, se ilustra la dispersión de los datos (observados y predichos) de la fracción remanente del mantillo considerando el Modelo exponencial y el Modelo lineal simple durante el periodo de estudio en los tres ecosistemas forestales de clima templado.
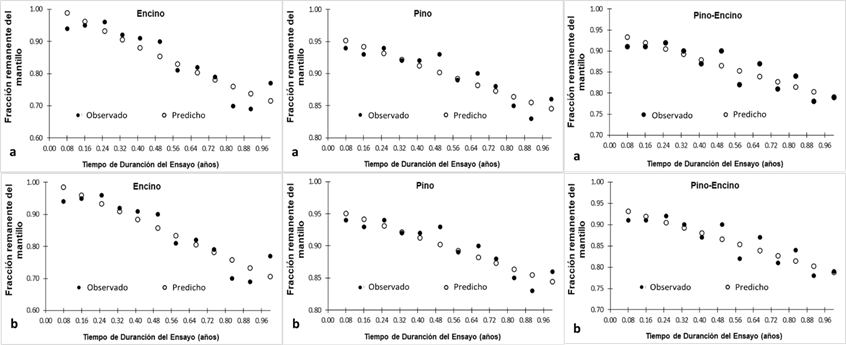
a = Valores predichos obtenidos con referencia al Modelo exponencial para cada ecosistema bajo estudio; b= Valores predichos obtenidos con referencia al Modelo lineal simple para cada ecosistema bajo estudio.
Figura 3 Valores observados y predichos de la descomposición del mantillo durante el tiempo (año) del ensayo en cada ecosistema.
Los valores de k en comparación con los obtenidos para otros ecosistemas parecen bajos. Rocha-Loredo y Ramírez-Marcial (2009) registraron en bosques de pino-encino, pino y encino una constante k de 1.40, 1.44 y 1.74, respectivamente, en tanto que Rivera et al. (2013) estimaron que para degradar 50 y 99 % del mantillo en selva baja caducifolia, el tiempo requerido es de 75.9 y 504.3 días, respectivamente. Tapia-Coronado et al. (2022) documentaron que la tasa de descomposición para especies forestales es más acelerada en comparación con la de gramíneas, con valores de k de 1.77, lo cual permite inferir que la velocidad de descomposición del mantillo está influenciada por la composición de especies vegetales y su distribución (Peña-Peña e Irmler, 2016; Djukic et al., 2018). En el presente estudio no se consideró el análisis químico de los componentes del mantillo, por lo que es posible asumir que las diferencias en los valores de la Constante de descomposición (k) entre los ecosistemas estudiados dependa directamente de la composición de especies y la etapa sucesional de los ecosistemas, como lo indican Rocha-Loredo y Ramírez-Marcial (2009). Por otra parte, los componentes nutricionales y estructurales del mantillo son factores que actúan de manera directa en las tasas de descomposición y explican sus diferencias, aun cuando estas no suelen estudiarse (Berg y McClaugherty, 2020).
Conclusiones
El proceso de descomposición del mantillo en los tres ecosistemas fue diferente durante el periodo experimental. El ecosistema de pino presenta el menor porcentaje (14 %) de descomposición con respecto al de encino (23 %) y pino-encino (22 %), lo cual sugiere que la calidad del material orgánico tiene una relación directa en el proceso. En el ecosistema de encino la descomposición más acelerada implica una liberación más rápida de nutrientes, por consiguiente, una mejor calidad. Además, la composición de especies tiene un papel fundamental, aunque la composición química de la hojarasca y los factores ambientales son los principales reguladores. La distribución y composición de especies son factores que inciden en el aporte del material orgánico.
Dadas las condiciones de los ecosistemas estudiados, los modelos con mejor ajuste para predecir la descomposición del mantillo son el exponencial y lineal simple.
En cuanto a la tasa de descomposiciones estimada para los tres ecosistemas, el tiempo requerido presenta una diferencia para todos los porcentajes de descomposición de acuerdo con los modelos de referencia. Con base en el Modelo exponencial, al ecosistema de encino corresponde el menor tiempo (0.866 años), seguido de pino-encino (1.156 años) y pino (1.929 años), estos resultados se deben, en parte, a la composición química del material recalcitrante. Respecto a las tasas de descomposición estimadas con el Modelo lineal simple, en el ecosistema de pino se necesita mayor tiempo debido a la presencia de sustancias químicas en las acículas de pino.











 text in
text in