Introducción
Los híbridos de Pinus elliottii var. elliotti × Pinus caribaea var. hondurensis desarrollados en Australia superan a sus especies parentales en crecimiento, forma y resistencia al viento (Nikles, 2000). En México, se han plantado miles de hectáreas con este híbrido para producción de resina y madera (Conafor, 2016). Genotipos superiores del híbrido deben ser clonados para acelerar la producción de planta requerida por la industria.
La clonación vegetal permite maximizar la producción, calidad y uniformidad en las plantaciones. En árboles, el proceso de clonación se dificulta debido a que su estado de maduración fisiológica afecta la producción de estacas o esquejes y su capacidad de enraizamiento (Majada et al., 2011). La técnica de enraizamiento de estacas incluye el rejuvenecimiento, a través de podas programadas para la obtención de estacas juveniles de varias especies de Pinus con buena respuesta al enraizamiento (Riov et al., 2020).
El rebrote es una característica de algunas especies forestales para recuperar su biomasa aérea después de presentar algún daño; respuesta que depende, en gran medida, de las reservas de carbono existentes en los tejidos del árbol para producir la cantidad de rebrotes necesarios (Smith et al., 2018). Esta capacidad de rebrote se aprovecha, a través de podas de la planta madre para obtener estacas y clonar genotipos de Pinus thunbergii Parl., Picea abies L. Karst. y Pinus patula Schltdl. et Cham. (Tikkinen et al., 2018; Matsunaga and Ohira, 2019; Escamilla-Hernández et al., 2020).
Estacas vigorosas más aptas para enraizar se forman en plantas donadoras bien fertilizadas (Hernández y Rubilar, 2012). Plantas Madre de Pinus taeda L. tratadas con fertilizantes incrementaron sus niveles de reservas de carbono (carbohidratos), lo cual mejoró la producción y enraizamiento de estacas (Rowe et al., 2002). En otras investigaciones, también se cita que la fertilización de plantas Madre con cantidades adecuadas de nitrógeno y fósforo influye en la producción de brotes y en su rápido enraizamiento adventicio (Moe y Andersen, 1988).
La mayoría de las estacas de las especies del género Pinus son de difícil enraizamiento, por lo que se ha recurrido al uso de auxinas sintéticas (Coimbra et al., 2016). La auxina más utilizada es el Ácido Indolbutírico (AIB), debido a su estabilidad y solubilidad (Tilahun et al., 2019). En pinos mexicanos, el AIB mejora los porcentajes de enraizamiento de estacas en más de 45 %, para Pinus leiophylla Schiede ex Schltdl. & Cham. (Cuevas et al., 2015) y en 90 % para P. jaliscana Pérez de la Rosa (Aparicio-Rentería et al., 2008).
En este trabajo, se probó la clonación mediante uno de los métodos más prácticos y de bajo costo, como es el enraizamiento de estacas de algunos genotipos superiores del híbrido de P. elliottii var. elliotti × P. caribaea var. hondurensis que han evidenciado crecimiento superior y rectitud de fuste. Dado que los árboles donadores presentan cierta madurez fisiológica, la capacidad de rebrote para producción de estacas y su facilidad para enraizar son limitadas. Por lo tanto, el objetivo del trabajo fue evaluar el efecto del manejo nutrimental de los árboles donadores de cuatro años de edad del híbrido P. elliottii var. elliotti × P. caribaea var. hondurensis, y del uso de AIB sobre el enraizamiento de estacas, con la finalidad de propagar vegetativamente los mejores genotipos de una plantación y establecer, en el futuro, plantaciones clonales de la especie.
Materiales y Métodos
Localización del experimento
El experimento se estableció en el invernadero de la Jefatura de Ingeniería Forestal del Instituto Tecnológico Superior de Venustiano Carranza (ITSVC), ubicado entre las coordenadas geográficas 20°28´19.6" latitud N y 97°41´56.4" longitud O; a una altitud de 333 m, en Lázaro Cárdenas, Puebla.
Material vegetal y análisis nutrimental
En julio del 2019, en una plantación de cuatro años de edad del híbrido P. elliottii var. elliottii × P. caribaea var. hondurensis, localizada dentro de las instalaciones del ITSVC, se seleccionaron 25 árboles con mejor crecimiento, libres de plagas y rectitud de fuste. Se obtuvo una muestra del follaje (aproximadamente 200 g de material verde) de cada árbol seleccionado para el análisis del estado nutricional, Las muestras se colocaron en bolsas de papel para su traslado al Laboratorio del Posgrado en Ciencias Forestales del Colegio de Postgraduados, donde se lavaron con agua corriente y agua destilada, se secaron en estufa (modelo Shel lab, 1675-S) por 48 horas a 70 °C. Posteriormente, se hicieron tres muestras compuestas de 60 g de materia seca cada una; las cuales se molieron y procesaron para su análisis químico en el Laboratorio Salvador Alcalde Blanco del Posgrado en Edafología en el Colegio de Postgraduados. En cada muestra se determinaron las concentraciones de nitrógeno, fósforo, potasio, calcio, magnesio, hierro, cobre, zinc, manganeso y boro; para ello, se utilizó el extracto por digestión húmeda del follaje con ácido sulfúrico Merck ®, ácido perclórico Merck ® y peróxido de hidrógeno Merck ® (1.3:0.7:1, v:v:v), excepto para el N (Alcántar y Sandoval, 1999). Los extractos se leyeron en un equipo de espectrometría de emisión e inducción por plasma (Agilent 725 Series ICP-OES). La concentración de N se determinó en una alícuota de 10 mL del extracto antes descrito, mediante destilación de la muestra y valoración a través de titulación con ácido sulfúrico (Alcántar y Sandoval, 1999).
Los análisis foliares se interpretaron mediante las concentraciones críticas citadas por Dickens et al. (2016) para Pinus elliottii Engelm. ex Parl. y las sugeridas por Xu et al. (2000) para Pinus elliottii × Pinus caribaea.
Aplicación de tratamientos de fertilización
De acuerdo con el análisis nutrimental (Cuadro 1), se prescribió la aplicación de cinco tratamientos de fertilización, basados en soluciones preparadas con agua corriente: T1 testigo (solo agua), T2 Nitrógeno (80 g de urea por árbol), T3 Fósforo (20 g de ácido fosfórico por árbol), T4 Magnesio (10 g de sulfato de magnesio por árbol) y T5 Nitrógeno + Fósforo (80 y 20 g de urea y ácido fosfórico por árbol, respectivamente).
Cuadro 1 Concentraciones nutrimentales foliares en los árboles seleccionados de Pinus elliottii var. elliottii × Pinus caribaea var. hondurensis y concentraciones críticas foliares citadas para Pinus elliottii Engelm. ex Parl. (Dickens et al., 2016) y para el híbrido (Xu et al., 2000).
| Elementos | N % | P | K | Ca | Mg | Fe | Cu | Zn | Mn | B |
|---|---|---|---|---|---|---|---|---|---|---|
| ppm | ||||||||||
| CF SE | 0.82* | 0.14 | 0.44 | 0.25 | 0.10* | 59.6 | 2.50 | 18.2 | 88.3 | 6.4 |
| CC PE * | 1.00 | 0.09 | 0.25 | 0.08 | 0.06 | 15.0 | 1.50 | 10.0 | 20.0 | 4.0 |
| CC PE × PC** | 0.96 | 0.06 | 0.06 | 0.10 | 0.11 | - | 2.24 | 16.1 | 55.0 | - |
* Deficiencias; CF = Concentración foliar; SE = Sitio experimental; CC = Concentración crítica; PE = Pinus elliottii; PC = Pinus caribaea.
En noviembre del 2019, se realizó el experimento con los tratamientos bajo un diseño completamente al azar; cada tratamiento fue aplicado aleatoriamente a cinco árboles. En el experimento se consideró un total de 25 árboles. La aplicación de las soluciones se hizo dentro de un cajete de aproximadamente 1 m de diámetro alrededor de cada árbol.
Después de un mes de la fertilización, todos los individuos fueron podados. La poda se llevó a cabo en la punta de ocho ramas ubicadas en el segundo tercio de la copa de cada árbol, para ello se usaron tijeras con mango telescópico. Esta acción tuvo la finalidad de inducir la producción de brotes adventicios. Durante el experimento se realizaron deshierbes continuos, para evitar una competencia por nutrimentos.
Recolecta y preparación de estacas
En febrero del 2020, los rebrotes (estacas) alcanzaron una longitud superior a 5 cm, por lo que se recolectaron. En la base de cada estaca, se hizo un corte en bisel con un bisturí desinfectado con alcohol (70 %). Enseguida, las estacas se colocaron en una solución de Captan (Adama México) (2 mL L-1), donde permanecieron sumergidas por 5 minutos.
Plantación y aplicación de AIB
La sección basal (2 cm) de cada estaca se sumergió en la solución del AIB en forma líquida (Radix® 3 000) por un lapso de 20 segundos; para el testigo, solo se utilizó agua corriente en el mismo lapso de tiempo; a continuación, se plantaron en un sustrato compuesto por una mezcla de peat most, agrolita y vermiculita (3:1:1). Previo a la plantación, el sustrato se llevó a capacidad de campo, con agua corriente. El ensayo se estableció en cámaras de enraizamiento de 120 cm de largo por 60 cm de ancho y 15 cm de altura, las cuales se construyeron con tablas de madera y láminas de policarbonato. Durante el experimento, en las cámaras se registró una humedad relativa de 80 % y una temperatura promedio de 20 °C.
Diseño experimental y variables evaluadas
El experimento se estableció bajo un diseño experimental de bloques completos al azar con arreglo factorial; cada cámara de enraizamiento representó un bloque. Como factor A se consideró al AIB con dos niveles (0 y 3 000 ppm); mientras que, el factor F fue la fertilización (realizada a los árboles Madre o donadores) con cinco niveles (testigo, nitrógeno, fósforo, magnesio, y la combinación nitrógeno y fósforo), para un total de 10 tratamientos en cada bloque. El experimento se replicó cuatro veces, cada unidad experimental estuvo constituida por ocho estacas: 320 estacas.
En abril del 2020, a las 11 semanas de realizada la plantación, se registró el número de estacas vivas, número de estacas con raíces, número de raíces primarias y secundarias, longitud de raíces primarias y número de estacas con formación de callo. Con esto, se determinó el porcentaje de supervivencia de estacas, porcentaje de estacas enraizadas, número de raíces primarias y longitud de la raíz principal, número de raíces secundarias y porcentaje de estacas con formación de callo. Las estacas se consideraron muertas cuando más de la mitad de su tejido, a partir de la base, fue necrótico en el momento de la evaluación. Las enraizadas, cuando presentaron al menos una raíz con 0.5 cm de longitud.
Análisis de datos
Con los valores promedio de las variables respuesta se llevó a cabo el análisis estadístico, mediante el procedimiento Mixed en el paquete de análisis estadístico SAS (Statistical Analysis System ©) versión 9.4 (SAS, 2013). Para verificar los supuestos del análisis de varianza paramétrico, se emplearon la prueba de Shapiro Wilk para normalidad y la de Levene y Barlett para homogeneidad. Entonces, las variables expresadas en porcentaje (enraizamiento, callo y supervivencia) se transformaron con la función arco seno de la raíz cuadrada del valor original expresado en fracción decimal, ya que los datos en la escala original no cumplían con los criterios de normalidad y homogeneidad de varianza. Un procedimiento similar se efectuó para las variables número de estacas con raíces, número de raíces primarias y secundarias y longitud de raíces primarias que mostraron distribución tipo Poisson; en este caso se usó la raíz cuadrada del valor original. Después del análisis, los valores promedio por tratamiento se retransformaron a las unidades originales. El modelo de análisis de varianza empleado fue el siguiente:
Donde:
Y ijk = ijk-ésima observación en i-ésimo bloque que contiene el j-ésimo nivel del factor A y el k-ésimo nivel del factor F
μ = Media general
B i = Efecto del i-ésimo bloque
A j = Efecto del i-ésimo nivel del factor A (auxina)
F k = Efecto del i-ésimo nivel del factor F (fertilización)
AF jk = Interacción entre i-ésimo nivel del factor A y del factor F
ε ijk = Error experimental
En las variables que presentaron diferencias significativas, se aplicó la prueba de comparación de medias de Tukey (α= 0.05) para determinar diferencias estadísticas entre los niveles de los factores en estudio.
Resultados y Discusión
Efectos del AIB y fertilización de la planta madre
Los tratamientos de AIB y fertilización tuvieron efectos significativos en la supervivencia, estacas enraizadas, longitud de raíz principal, número de raíces primarias (excepto para AIB) y número de raíces secundarias; mientras que, la interacción entre los tratamientos solo se presentó en las estacas enraizadas (Cuadro 1). Por otro lado, ambos tratamientos no influyeron en el desarrollo del callo observado en las estacas vivas sin raíces (Cuadro 2).
Cuadro 2 Valores de P del análisis de varianza para las variables de enraizamiento de las estacas del híbrido de Pinus elliottii var. elliottii × Pinus caribaea var. hondurensis.
| Fuente de variación |
%SE | %Callo | %EE | LRP | NRP | NRS |
|---|---|---|---|---|---|---|
| AIB | 0.0091 | 0.2369 | 0.0001 | 0.002 | 0.0512 | 0.0055 |
| F | 0.0001 | 0.8170 | 0.0001 | 0.001 | 0.0001 | 0.0001 |
| AIB × F | 0.0511 | 0.7549 | 0.0085 | 0.110 | 0.0920 | 0.0599 |
AIB = Ácido indolbutírico; F = Fertilización; %SE = Porcentaje de supervivencia de estacas; % Callo = Porcentaje de estacas con formación de callo; %EE = Porcentaje de estacas enraizadas; LRP = Longitud de raíz principal; NRP = Número de raíces primarias; NRS = Número de raíces secundarias.
En general, las estacas mantuvieron una supervivencia por arriba de 50 %, lo cual es un porcentaje aceptable para la propagación por estacas (Cuadro 3). El porcentaje de supervivencia de estacas tratadas con AIB resultó 25 % mayor comparado con los testigos y también incrementó el porcentaje de enraizamiento en poco más de 35 % (Cuadro 3). De acuerdo con estos resultados, se puede deducir que la auxina influye de manera directa en la promoción de raíces, de manera particular, en aquellas estacas que probablemente requerían del estimulo del regulador hormonal externo para desarrollarlas. La presencia de raíces en las estacas les permite reactivar sus funciones fisiológicas y conformarse como una plántula. De otra manera, las estacas sin raíces pueden sobrevivir hasta que las reservas en sus tejidos se agotan, y entonces mueren. Lo anterior coincide con lo señalado por Fachinello et al. (2005), quienes indican que la supervivencia de la estaca no solo depende de su calidad (estado nutricional, vigor y juvenilidad), sino también de la rápida formación de raíces adventicias, encargadas de proveer agua y nutrimentos.
Cuadro 3 Valores medios (± error estándar), por dosis de Ácido Indolbutírico (AIB) y fertilizante, de porcentajes de supervivencia de estacas, de estacas enraizadas y de estacas con formación de callo en el experimento de enraizamiento de estacas del híbrido de Pinus elliottii var. elliotti × Pinus caribaea var. caribaea.
| Tratamientos | Supervivencia de estacas (%) |
Estacas enraizadas (%) |
Estacas con callo (%) |
|---|---|---|---|
| AIB | |||
| 0 | 52.5±4.3b | 32.8±5.1b | 15.0±3.6a |
| 3000 | 70.0±8.1a | 53.6±6.3a | 21.2±5.5a |
| Fertilizante | |||
| T | 34.5±4.8d | 12.5±9.6d | 18.7±3.6a |
| N | 54.7±8.8bc | 42.2±9.3bc | 12.5±2.9a |
| P | 76.6±8.7ab | 62.6±3.1ab | 17.2±2.6a |
| Mg | 51.6±9.8bc | 31.5±6.8dc | 20.3±4.7a |
| N+P | 89.1±7.3a | 67.2±2.4a | 21.8±5.1a |
*Letras diferentes indican diferencias significativas (P ≤ 0.05).
El uso de AIB en la promoción de raíces adventicias en estacas está bien documentado; esta hormona acelera los procesos de desarrollo y formación de raíces en el menor tiempo posible, con lo cual se asegura la supervivencia de la estaca (Endres et al., 2007; Gratieri-Sossella et al., 2008; Latsague-Vidal et al., 2010).
Un mínimo porcentaje de estacas presentó formación de callo, efecto que en el presente estudio resultó indeseable, ya que las estacas con callo no lograron formar raíces adventicias; sin embargo, su generación no se debió a los tratamientos (Cuadro 3). Las células del callo tienen pérdida de conexión con el tejido conductor, fragilidad y sin definición a estructura radicular (Heaman y Owens, 2011). Para algunas especies, como la sequoia, la formación de callo se considera como una fase inicial indispensable para la posterior formación de raíces (Navroski et al., 2014). En este trabajo no se determinó ningún factor que promoviera la producción de callo en las estacas, pero el ambiente pudo ser relevante en ese proceso.
El AIB no tuvo efecto significativo sobre el número de raíces primarias, pero sí influyó en la producción de raíces secundarias y en la longitud de la raíz primaria (Figura 1). Las estacas tratadas con AIB incrementaron la producción de raíces secundarias en más de 30 %; mientras que, la longitud de la raíz principal lo hizo en 35 %, ambos casos respecto al testigo (Figura 1).

A) Longitud de raíces primarias, B) Número de raíces primarias y secundarias. Dentro de un tipo de raíces, letras diferentes en las barras de error indican diferencias significativas entre tratamientos (α=0.05).
Figura 1 Efecto de la dosis de Ácido Indolbutírico (AIB) en la producción de raíces en las estacas del híbrido de Pinus elliottii var. elliottii × Pinus caribaea var. hondurensis.
En coníferas de difícil enraizamiento, el AIB es un excelente promotor de raíces adventicias. En estacas de Pinus leiophylla Schiede ex Schltdl. et Cham. se señaló que el AIB no solo induce el enraizamiento de las estacas, sino también alarga las raíces primarias e incrementa el número de las primarias y secundarias (Cuevas et al., 2015); un efecto similar se comprobó en el presente estudio. Sin embargo, también se ha documentado poco o nulo efecto del AIB en la morfología de raíces; por lo que, se considera que la variación en las respuestas al AIB depende tanto de la dosis, como de la menor o mayor predisposición de la estaca al enraizamiento (De Oliveira et al., 2020).
Las auxinas facilitan el enraizamiento, ya que estimulan la actividad del cambium y la movilización de reservas hacia el sitio de iniciación de raíces, donde las células se dividen y diferencian para generar los primordios (Dhillon et al., 2011; Brondani et al., 2012). En consecuencia, la aplicación del AIB en las estacas es deseable para mejorar la morfología y calidad de las raíces, lo que a su vez es importante para el desarrollo y crecimiento de la planta, puesto que incrementa el área de absorción de nutrimentos y del agua (Davis y Jacobs, 2005).
Los tratamientos de fertilización favorecieron la supervivencia de las estacas de manera diferenciada, pero siempre por arriba de 50 % (Cuadro 3). Las plantas donadoras tratadas con N+P generaron estacas con una supervivencia superior a 85 %; mientras que, las de plantas testigo no alcanzaron 40 %. Los resultados demuestran la importancia de tener una planta donadora en buena condición nutricional para producir estacas de calidad. Y son acordes con lo señalado por otros autores, en el sentido que la fertilización adecuada de la planta donadora influye en el nivel de carbohidratos, auxinas y otros compuestos en los tejidos de las estacas, los cuales la mantienen viva mientras inicia el proceso de rizogénesis (Kanmegne et al., 2017).
Los tratamientos de fertilización promovieron la formación de raíces. El mayor número de estacas enraizadas se registró con los tratamientos de N+P y solo P, los cuales incrementaron en más de 80 % el enraizamiento, respecto al testigo (Cuadro 3).
En Pinus radiata D. Don, la fertilización basada en N, de los setos donadores tuvo un efecto positivo en la inducción de raíces adventicias en las estacas (Hernández y Rubilar, 2012). Dado que el N es un constituyente de las proteínas y ácidos nucleicos; además, su participación en el crecimiento de las plantas es esencial; cuando este es absorbido por la planta en forma de nitrato (NO3 -) y amonio (NH4 +), se incorpora a los meristemos para el crecimiento y desarrollo de las plantas. En el cambium de las estacas, el N se requiere para la formación de raíces adventicias (Emer et al., 2019).
El P es un elemento que potencia el metabolismo de la planta y favorece la absorción, combinado con el N y una dosis óptima de auxina favorece una mejor absorción de nutrimentos y desarrollo de raíces en las estacas (Henry y Blazich, 1992). Además, se ha observado una relación significativa entre la concentración de P y el potencial de enraizamiento, lo que refuerza la hipótesis de que el P es importante en la supervivencia postrasplante, vía la promoción de la extensión radical en campo (Planelles, 2004; Oliet et al., 2005). En general, el estado nutricional de la planta incide en los procesos de producción de nuevas raíces (Villar et al., 2004; Oliet et al., 2006).
La longitud de raíces primarias y el número de raíces primarias y secundarias también se afectaron significativamente por los tratamientos de fertilización (Figura 2). En particular, el tratamiento con N+P mejoró en más de 80 % el número de raíces primarias y secundarias de las estacas, con respecto al testigo sin fertilización; los otros tratamientos de fertilización superaron al testigo por más de 35 % (Figura 2A). Incrementos similares con los tratamientos de fertilización se obtuvieron en la longitud de la raíz primaria de las estacas (Figura 2B).

A) Número de raíces primarias y secundarias presentes en las estacas, B) Longitud de raíces primarias de las estacas.
Figura 2 Efecto del fertilizante en la producción de raíces en estacas del híbrido de Pinus elliottii var. elliottii × Pinus caribaea var. hondurensis.
La longitud de la raíz principal y el número de raíces primarias y secundarias conforman la arquitectura del sistema radicular de la planta. Por lo tanto, son parámetros importantes para la planta producida por estaca. La fertilización de la planta Madre contribuye en el contenido de carbohidratos de las estacas, las cuales tienen alta demanda durante la formación de raíces adventicias (Otiende et al., 2017). En este trabajo, la fertilización mejoró, considerablemente, esos parámetros. En las estacas no tratadas, es probable que los carbohidratos presentes no cubrieron la demanda de la planta para la generación de nuevas raíces, aunado a que la fotosíntesis en ellas no genera la suficiente cantidad de carbohidratos para los procesos involucrados en la rizogénesis de la estaca (Kanmegne et al., 2017).
De las interacciones de dosis de AIB por el tipo de fertilizante, únicamente se obtuvieron diferencias significativas (P˂0.05) para el porcentaje de estacas enraizadas (Cuadro 1). El porcentaje de estacas enraizadas procedente de los árboles tratados con fertilizante se incrementó con el tratamiento de auxina; mientras que, las procedentes de árboles no fertilizados (testigo) disminuyeron con el AIB (Figura 3).
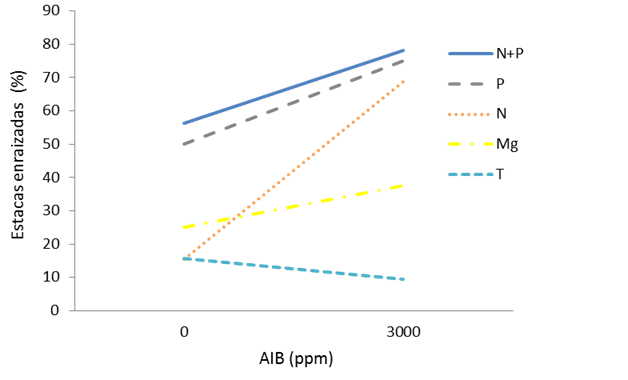
Figura 3 Interacción entre los tratamientos de fertilización de la planta madre y la dosis de AIB en estacas enraizadas del híbrido Pinus elliottii var. elliottii × Pinus caribaea var. hondurensis.
Esta interacción implica que la capacidad de enraizar no solamente depende de la aplicación exógena de AIB, sino también de la calidad y vigor de la estaca; por ello, el estatus nutricional de la estaca es de primordial importancia en el proceso de rizogénesis para el híbrido en cuestión. Se sabe que la movilización de nutrimentos dentro de la estaca es limitada durante la fase de iniciación de raíces, no así en su crecimiento y desarrollo.
En este caso, las estacas no fertilizadas no se potencializaron con la auxina, como sucedió con las fertilizadas. Probablemente, en estacas no fertilizadas el bajo nivel de carbohidratos u otros compuestos metabólicos en el tejido limitó el proceso de rizogénesis y disminuyó la capacidad de enraizamiento. Así, desde el punto de vista nutricional, la iniciación de raíces depende, en gran medida, de los niveles iniciales de nutrimentos que se encuentran en la porción de la estaca, donde se formarán las raíces. De ahí el papel fundamental de la nutrición de las plantas Madre sobre el enraizamiento subsecuente de estacas (Mesén et al., 2001; Leakey, 2014).
La formación de raíces adventicias es un proceso dirigido por reguladores de crecimiento, pero es afectado por múltiples factores que incluyen entre otros el estado nutricional de la estaca, por lo que la nutrición mineral es importante en la conformación de estructuras orgánicas, activación de reacciones enzimáticas y de osmorregulación, entre otras (Geiss et al., 2018).
Conclusiones
El manejo de la nutrición de los árboles Madre y la aplicación de AIB a las estacas mejora el proceso de enraizamiento, y con ello se incrementa la probabilidad de supervivencia. En particular, en el sitio de estudio se recomienda la fertilización de los árboles Madre o donadores con N+P, ya que este tratamiento genera estacas con mejores características de enraizamiento. La clonación de árboles jóvenes del híbrido Pinus elliottii var. elliottii × Pinus caribaea var. hondurensis, por la técnica de enraizamiento de estacas es posible con el apoyo de un programa de fertilización y el uso de AIB.











 text in
text in 


