Introducción
Los escarabajos descortezadores del género Dendroctonus se distribuyen en los bosques de pino de Norte América (Islas-Salas, 1980), y se extienden hasta Nicaragua. Destaca su presencia en Chihuahua, en el centro de México y, en particular, en los estados de Michoacán y el Estado de México (Islas-Salas, 1980). Se le ha consignado también en Honduras y Belice (Payne, 1980; Wood, 1982; Monser et al., 2005; Clarke y Nowak, 2009; Armendáriz-Toledano et al., 2014).
Se estima la reproducción de dos a cinco generaciones por año de Dendroctonus mexicanus Hopkins, 1905, ya que es una especie dependiente de la temperatura; por ello, es considerado uno de los taxones con mayor agresividad en sus ataques (Cibrián et al., 1995; Salinas-Moreno et al., 2004; Trân et al., 2007; Armendáriz-Toledano et al., 2014). Por ejemplo, se ha registrado la pérdida de árboles de Pinus patula Schiede ex Schltdl. et Cham. asociada, en numerosas ocasiones, a D. mexicanus (Fonseca-Gonzáles et al., 2014). En los bosques de pino de Aguascalientes, se han detectado infestaciones de este insecto y la muerte del arbolado (Sánchez-Martínez et al., 2016).
Los escarabajos descortezadores son especies ectotérmicas que están relacionados con el balance hídrico y el equilibrio térmico; por consecuencia, los factores abióticos más importantes que influyen en su distribución y abundancia son la disponibilidad de agua y la temperatura (Chown y Nicolson, 2004; De la Vega y Schilman, 2015; Clark, 2019). Existe evidencia que demuestra la importante relación que los descortezadores guardan entre sus características fisiológicas y la temperatura, específicamente, la tolerancia y la preferencia térmica (De la Vega y Schilman, 2015).
En México, se ha estudiado la relación de la abundancia de los descortezadores y la temperatura en los bosque de pino (Hernández-Muñoz et al., 2017; Morales-Rangel et al., 2018). Sin embargo, es necesario enriquecer el conocimiento sobre la respuesta poblacional de los descortezadores a diversas variables climáticas en un solo sitio.
Son pocas las investigaciones en el país que relacionen la abundancia de los ejemplares con la humedad, a pesar de que en el extranjero se ha comprobado una fuerte dependencia de diversas especies de escarabajos con este factor (Johansson et al., 2017; Härkönen y Sorvari, 2018). Además, en muchas ocasiones la humedad influye en la expresión fenotípica de la coloración de dichos insectos. Se ha observado que en presencia de una elevada humedad relativa en el ambiente, los escarabajos tienden a presentar en el exoesqueleto tonos obscuros, cercanos al negro (Rassart et al., 2008; Noh et al., 2016; Carrascal et al., 2017; Sun et al., 2017). Lo anterior es causado por una estructura porosa en forma de esponja tridimensional ubicada a unos 3 µm por debajo de la superficie cuticular, la cual contiene aire en los poros, y cuando el insecto está en condiciones de alta humedad, el aire se sustituye por agua y provoca un cambio de coloración hacia tonos oscuros (Noh et al., 2016).
La variabilidad climática tiene efectos en los insectos a lo largo de su historia de vida, en términos fisiológicos como la etapa de desarrollo y la diapausa (De la Vega y Schilman, 2015). Las temperaturas extremas pueden ser críticas al provocar que no respondan de forma adaptativa a ningún cambio adicional de temperatura y por lo tanto, serán vulnerables a la depredación, a las catástrofes ambientales (Byrne et al., 2004). Las temperaturas críticas para muchas especies son desconocidas, sin embargo son de gran interés en los estudios ecológicos y evolutivos (Mitchell et al., 1993; Lighton y Turner, 2004).
Por lo anterior, en el presente estudio se analizó la relación entre la variación de la intensidad en coloración del exoesqueleto de Dendroctonus mexicanus y la abundancia asociada a variables climáticas como la humedad, la temperatura y el índice de aridez que ocurren en cuatro regiones en las que el taxón habita.
Materiales y Métodos
Localización de sitios de muestreo
Para cubrir el intervalo de distribución natural del bosque de pino-encino de México, se realizó un muestreo de D. mexicanus en cuatro regiones dentro de los estados de Nuevo León (1 950 - 2 650 msnm), Hidalgo (1 342 - 2 611 msnm), Jalisco (1 999 - 2 306 msnm) y Oaxaca (2 113 - 2 889 msnm) (Figura 1). En cada región, se colocaron ocho trampas de recolección de insectos de Lindgren Synergy Semiochemicals Corps ®, compuestas de ocho embudos, siguiendo un transecto altitudinal entre 1 300 y 2 900 m, que corresponden con áreas adecuadas para la presencia de descortezadores del género Dendroctonus.

Figura 1 Localización de sitios de colecta de Dendroctonus mexicanus Hopkins, 1905 dentro de boques de pino y pino-encino en cuatro estados de la república mexicana.
Las ocho trampas se colocaron con una separación en altitud de 100 m entre cada una de ellas (Macías et al., 2004); se instalaron en árboles no hospederos, suspendidas a 1.5 m del suelo (Rodríguez, 2009). En la parte superior, la trampa cuenta con un atrayente que contiene una fórmula feromonal diseñada para atraer individuos de Dendroctonus, como D. mexicanus, el cual es una combinación de semioquímicos (SQ) de Synergy Semiochemical Corps ® (Macías-Sámano y Niño, 2016), que comprende las feromonas Frontalina y Endo-brevicomina, más alfa/beta-pineno como kairomona; el atrayente se sustituyó bimestralmente. En la parte inferior se acomoda el vaso colector de cada trampa, en el cual se colocó anticongelante para sacrificar y facilitar la conservación de los insectos (Zylstra et al., 2010). Se realizó la recolecta de los escarabjos en periodos de 15 días; posteriormente, se depositaron en bolsas tipo Ziploc ®. Para la preservación de los individuos recolectados se utilizó una mezcla de anticongelante al 50 % y alcohol al 70 % (Macías et al., 2004).
La temperatura (°C) y la humedad relativa (%) se evaluaron a partir de colectores de datos climáticos tipo Hobos (EL-USB-2 RH/Data Logger de Micro DAQ ®); los datos climáticos se registraron cada 30 minutos por un periodo de un año (enero-diciembre del 2015); con los valores obtenidos se calculó el índice de aridez (Sáenz-Romero et al., 2010; Soto-Correa et al., 2012). Este se ajustó mediante el cociente de la temperatura promedio sobre la humedad relativa promedio (temperatura/humedad), en el cual los valores más elevados son sitios más calientes y con menor humedad, mientras que los valores inferiores corresponden a sitios más fríos y húmedos.
Identificación taxonómica de insectos
La colecta de los insectos se llevó a cabo durante el periodo abril-diciembre del 2015. El material se trasladó al Laboratorio de Ecología de la Facultad de Ciencias Naturales de la Universidad Autónoma de Querétaro. Posteriormente, se procedió con la limpieza y separación de los descortezadores de otros grupos de insectos. La identificación de individuos de Dendroctonus mexicanus y el sexado, se hizo con base en los criterios propuestos por Wood (1982) y Cibrián et al. (1995).
Intensidad colorimétrica
Se seleccionó, de las recolectas por sitio, una muestra al azar de D. mexicanus dentro de los gradientes de cada región; se montaron en alfileres entomológicos que se insertaron en una plataforma de unicel (10 × 5 cm diseñada de acuerdo al espacio del microscopio) forrado de papel milimétrico, siempre en la misma posición, a 20 aumentos y bajo la misma iluminación; enseguida, se observaron a través de un microscopio estereoscopio Carl Zeiss ®, y mediante el software Z en 2 Blue edition (2018) se obtuvieron las lecturas de intensidad de la iluminación decorrespondiente a cada banda de color (nm) (rojo, azul y verde), en el modelo RGB18 (Zeiss, 2018). La medición de la coloración se efectuó en vista dorsal, desde la cabeza hasta la mitad de los élitros.
Diseño estadístico
Para determinar las posibles diferencias significativas en la abundancia y coloración entre las cuatro regiones seleccionadas y entre sexos de los descortezadores recolectados, se utilizó un análisis de varianza para lo cual se usó el procedimiento GLM y la prueba de Tukey (α=0.05) con el paquete estadístico SAS (versión 9.3 de SAS) (SAS, 2014), mediante la siguiente fórmula:
Donde:
Y ijk = Observación
µ= Efecto de la media general
R i = Efecto del i-ésima región de estado
S j = Efecto de la i-ésima sexo
R i *S j = Efecto de la ij-ésima interacción Región de estado*Sexo
e ij = Error
Para determinar la posible relación entre la humedad y la intensidad de coloración, se llevó a cabo un análisis de regresión, mediante el siguiente modelo:
Donde:
Y ij = Media de intensidad de coloración (intensidad de coloración por estado)
( 0 = Intercepto
( 1 = Pendiente
X i = Humedad (%)2 u otra variable climática estimada de la i-ésima procedencia
e ij = Error
Resultados
Existen diferencias significativas en la intensidad de coloración del exoesqueleto de D. mexicanus entre los estados (rojo P≤ 0.0004; verde P ≤ 0.000, azul P ≤ 0.0014), contrario a la intensidad de coloración asociada al sexo de la especie, en la que no se verificaron diferencias significativas, así como para la interacción Región*Sexo (Cuadro 1).
Cuadro 1 Análisis de varianza de la intensidad de coloración del exoesqueleto de Dendroctonus mexicanus Hopkins, 1905 procedentes de cuatro regiones de México.
| F. V. | g. l. | Rojo | Verde | Azul |
|---|---|---|---|---|
| p≤0.05 | p≤0.05 | p≤0.05 | ||
| Región | 3 | 0.0004 | 0.0003 | 0.0014 |
| Sexo | 1 | 0.6561 | 0.9467 | 0.1094 |
| Estado*Sexo | 3 | 0.9461 | 0.1449 | 0.6514 |
F.V. = Factor de variación; g.l. = Grados de libertad.
Las diferencias en la intensidad de las bandas de coloración del rojo, verde y azul del exoesqueleto de D. mexicanus mostraron valores altos en individuos recolectados en el estado de Oaxaca (rojo=138; verde=92; azul=76), que los hace más oscuros al resto de los sitios; cabe señalar que se determinó una elevada similitud en la coloración con individuos procedentes de Jalisco, los cuales presentan valores semejantes en las bandas de color verde y azul (Figura 2). Para Hidalgo se observó que la banda de color azul es semejante a las localidades de los estados de Jalisco y Oaxaca; sin embargo, fue relativamente diferente a los individuos procedentes de Nuevo León, que registraron valores inferiores de intensidad para las tres bandas de color del exoesqueleto, con individuos más claros y rojizos (rojo=120; verde=77; azul=66) (Figura 2).
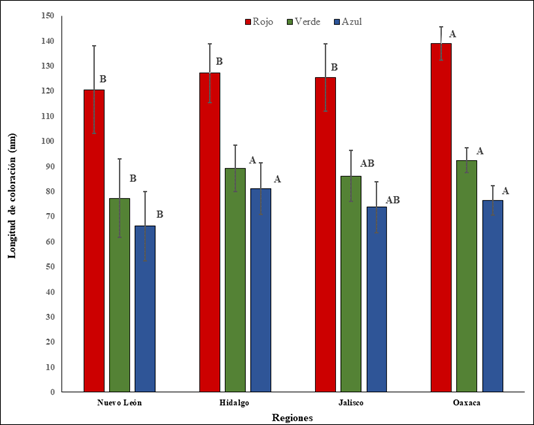
Figura 2 Prueba de medias de Tukey (α=0.5) para longitud de coloración (rojo, verde y azul) entre los estados de la república mexicana estudiados.
Los valores altos en los pixeles para los tres colores básicos significan individuos más obscuros, como los observados en Oaxaca y los más bajos, una coloración más clara, como los ejemplares del estado de Nuevo León.
Por otro lado, se observó que existe una relación no significativa entre el porcentaje de humedad y la intensidad de color de D. mexicanus (r2=0.7826; p=0.11); se estimó que en el estado de Nuevo León la humedad relativa ambiental promedio fue de 66 %, porcentaje inferior al de Hidalgo, Jalisco y Oaxaca por lo que los insectos son más claros. En Hidalgo y Oaxaca los individuos recolectados tuvieron mayor intensidad, y la humedad relativa promedio fue superior a 80 %; por lo tanto, a mayor humedad relativa, los ejemplares de D. mexicanus fueron más obscuros (Figura 3, A).

A) Porcentaje de humedad relativa; B) Índice de aridez.
Figura 3 Relación entre intensidad de coloración del exoesqueleto de Dendroctonus mexicanus Hopkins, 1905 y las variables climáticas de los cuatro sitios de muestreo en México.
Las correlaciones entre la humedad y la intensidad de coloración respaldan el hecho de que la humedad es un factor ambiental importante que influye en los cambios de patrones de coloración de los individuos de descortezadores. Sin embargo, existe una relación de mayor precisión cuando se integran variables como la humedad relativa y la temperatura en un índice de aridez (r2=0.9861; p=0.007). En este contexto, los insectos más obscuros correspondieron a los de Oaxaca, cuyo índice fue inferior al de Nuevo León (Figura 3, B).
Si la humedad influye en la intensidad de coloración, también es determinante como un factor que regula la abundancia de D. mexicanus. Bajo ese razonamiento, se puede afirmar que las regiones del norte de México, como Nuevo León, tienden a presentar menor humedad relativa; por lo cual, la repuesta en la abundancia de D. mexicanus es menor, en comparación con las regiones del sur como Oaxaca, donde se esperan valores elevados de humedad relativa y, por consiguiente, de la abundancia de los descortezadores.
Las regiones con humedad relativa alta fueron Hidalgo y Oaxaca, mientras que lo opuesto se registró en Nuevo León. En la primera, se obtuvo una mayor abundancia de D. mexicanus (8 190 individuos), en comparación con los otros tres estados cuya población promedio fue de 2 000 individuos totales durante el periodo de muestreo (Cuadro 2). El número más grande en la región de Hidalgo puede ser el resultado de la combinación de las diferentes variables climáticas favorables para D. mexicanus: temperaturas promedio, máxima y mínima, así como humedades relativa promedio, máxima y mínima (Cuadro 2).
Cuadro 2 Prueba múltiple de medias de Tukey (α=0.05) de las variables climáticas y abundancia total de Dendroctonus mexicanus Hopkins, 1905 en cuatro estados de México.
| Estado |
TMA °C |
Tukey |
HMA % |
Tukey |
TMIN °C |
Tukey |
HMIN % |
Tukey |
TMX °C |
Tukey |
HMX % |
Tukey | Abundancia D. mexicanus |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Nuevo León | 15.7 | C | 66.3 | C | 10.0 | B | 39.6 | C | 26.0 | A | 86.4 | C | 2 134 |
| Hidalgo | 16.3 | B | 82.5 | A | 12.6 | A | 66.1 | A | 22.3 | C | 92.7 | B | 8 190 |
| Jalisco | 16.7 | A | 77.8 | B | 12.3 | A | 53.1 | B | 24.0 | B | 94.1 | A | 1 731 |
| Oaxaca | 13.9 | D | 81.1 | A | 10.0 | B | 63.7 | A | 20.3 | D | 91.6 | B | 1 783 |
TMA = Temperatura media anual; HMA = Humedad media anual; TMIN = Temperatura promedio mínima; HMIN = Humedad mínima anual; TMX = Temperatura media máxima; HMX = Humedad media máxima.
En el caso particular del presente estudio, la humedad relativa y la temperatura promedio explicaron el comportamiento de la abundancia de D. mexicanus en las cuatro regiones; por ejemplo, en la de Hidalgo se registró una temperatura promedio de 16.3 °C y humedad promedio de 82.5 %, datos similares a los obtenidos en los sitios de muestreo de Jalisco y Nuevo León, pero difierieron de los correspondientes a Oaxaca (13.9 °C); por el contrario, la humedad relativa promedio de Hidalgo, que fue cercana a la de Oaxaca, pero distinta para las regiones de Nuevo León y Jalisco: 66.3 y 77.8 %, respectivamente (Cuadro 2).
Los extremos de la temperatura tuvieron diferencias significativas entre los sitios de muestreo (P≤0.05) (Cuadro 2). Si bien, en la región de Nuevo León ocurrieron temperaturas medias máximas idóneas para la presencia de grandes poblaciones de descortezadores, la humedad media mínima resultó muy baja para ellos (10 °C y 39.6 %), lo cual fue una limitante. Al comparar Oaxaca con Hidalgo, se advirtió una discrepancia de 2 °C menos en Oaxaca en las temperaturas medias y una diferencia de 2.6 °C en la temperatura media mínima, lo cual puede explicar la abundancia de D. mexicanus. Lo anterior sugiere que la existencia de este escarabajo posiblemente se asocia con temperaturas extremas muy altas, y, en combinación con las temperaturas extremas bajas, constituyen factores limitantes para su abundancia.
En lo que se refiere a la humedad relativa, esta solo incide en una dirección; pues la menor abundancia de descortezadores se asoció con una baja humedad en el ambiente. Las condiciones que propiciaron un aumento en las poblaciones de D. mexicanus fueron las temperaturas medias cercanas 16 °C, con humedad relativa alrededor de 80 %, con variabilidad baja en los extremos máximos y mínimos de la temperatura respecto a la media.
El análisis de la temperatura y la humedad en conjunto con el índice de aridez facilita la interpretación de la interacción entre dichas variables, respecto a su influencia en la abundancia de los descortezadores por sitio. Los promedios de aridez dentro de la región de Hidalgo registraron un índice de 0.20, similar al estimado para los sitios de Jalisco y Oaxaca, pero diferente al del Nuevo León cuyo valor fue mayor (0.24).
Por otra parte, se observó que los índices de aridez medios máximos para las regiones de Nuevo León, Jalisco y Oaxaca fueron superiores a 0.36, mientras que para la del estado de Hidalgo fue de 0.30; esto es indicativo de una elevada probabilidad de que los índices de aridez máximos o mayores a 0.30 pueden limitar la abundancia de D. mexicanus. Desafortunadamente, no hubo una relación entre su abundancia y el índice de aridez promedio máximo (r2=0.39), abundancia - índice de aridez promedio mínimo (r2=0.45) y abundancia - índice de aridez medio (r2=0.37) (Figura 4, A, B, C). Se determinó una relación entre la abundancia y la variación entre los índices de aridez máximo y mínimo; de tal manera que resultó menor la abundancia de descortezadores, cuando la diferencia entre los extremos fue más pronunciada, y si la diferencia entre los extremos del índice de aridez fue menor, la abundancia promedio fue superior en los sitios de muestreo (Figura 4, D).
Discusión
La variación en la coloración del exoesqueleto de individuos de D. mexicanus procedentes de cuatro diferentes regiones de México es una respuesta a variables climáticas como la humedad, lo cual se ha observado en otras especies de escarabajos, en las que se relaciona la humedad relativa del ambiente con la coloración de su exoesqueleto (Rassart et al., 2008). Esto se explica por su estructura, la cual es porosa, cuyos poros contienen agua que es factible de sustituirse por aire, lo que, a su vez, influye en la variación de la coloración de los escarabajos (Carrascal et al., 2017; Noh et al., 2016). Existen evidencias sobre cómo la humedad ambiental influye en la coloración; tal es el caso de Dynastes tityus Linnaeus, 1763, insecto que exhibe colores oscuros en presencia de porcentajes de humedad altos (≥ 80 %) (Rassart et al., 2008; Sun et al., 2017). Con base en lo anterior, es posible explicar lo estimado en los sitios de Hidalgo y Oaxaca, donde se presentaron los valores de humedad relativa más elevados (≥80 %) y los individuos de D. mexicanus tienden a ser más oscuros en comparación con la región de Nuevo León, en la que se observaron individuos más claros ante porcentajes de humedad relativa inferiores a los de otros sitios muestreados en el presente estudio (66.3 %).
De la misma forma que la humedad relativa, la temperatura también supone una relación directa con la intensidad de coloración del exoesqueleto del descortezador (Carrascal et al., 2017; Noh et al., 2016; Sun et al., 2017), como se ha reconocido en Chrysomela lapponica Linnaeus, 1758 en el que fue evidente que tonalidades más oscuras se asocian a bajas temperaturas y los escarabajos de colores claros a temperaturas elevadas; dichas diferencias implican una capacidad adaptativa de los insectos oscuros, debida a su mayor capacidad térmica ante bajas temperaturas (Zverev et al., 2018).
Se identificó una relación directa entre la intensidad de coloración del exoesqueleto y la humedad relativa; al integrar la temperatura y la humedad en el índice de aridez, la relación se ajusta aún más a una relación inversamente proporcional, en la que al aumentar la intensidad del color, el índice de aridez es menor. Las regiones con más humedad fueron Hidalgo y Oaxaca, donde los tonos de los escarabajos fueron más obscuros.
Se verificó un patrón de mayor abundancia de D. mexicanus en sitios con alta humedad relativa; bajo dicho patrón, se observó que las regiones de Oaxaca, Jalisco e Hidalgo registraron poblaciones más numerosas del descortezador estudiado, en comparación con lo sucedido en el estado de Nuevo León, cuyos valores fueron inferiores; lo que coincide con otros estudios de escarabajos que también consumen madera y que son favorecidos por una mayor humedad (Johansson et al., 2017; Härkönen y Sorvari, 2018). Cabe destacar que en las regiones de Oaxaca y Jalisco se registró una menor abundancia con altos porcentajes de humedad, lo cual contradice el supuesto anterior; sin embargo, se explica por las temperaturas extremas, lo cual es evidente en especies ectodérmicas ya que estas variables inciden en muchos de sus procesos fisiológicos (Fields et al., 1992; Chown y Nicolson, 2004; Fields et al., 2012; De la Vega et al., 2015).
La temperatura promedio registrada en la región de Hidalgo (16.3 °C), se asocia con una mayor abundancia de insectos; en otros estudios, se corrobora que una gran abundancia de D. mexicanus se presenta en sitios cuyas temperaturas promedio son cercanas a 16 °C (Hernández-Muñoz et al., 2017; Morales-Rangel et al., 2018), lo que también se ha consignado para D. frontalis Zimmerman, 1868 (Soto-Correa et al., 2019). También se destaca la complejidad de las respuestas de los insectos a la variabilidad térmica (Chidawanyika et al., 2017). Por ejemplo, los eventos extremos en las temperaturas mínimas son las variables limitantes (Fields, 1992; De la Vega et al., 2015) y su variabilidad puede ser la respuesta de lo sucedido en regiones como Hidalgo y Oaxaca, donde se presentó una mayor abundancia de descortezadores con una elevada humedad relativa en el ambiente y temperaturas promedio estables. En trabajos previos, se ha estimado la vinculiación de una menor abundancia de algunos escarabajos cuando las temperaturas extremas son fluctuantes (Jian et al., 2018).
Oaxaca presentó una temperatura promedio mínima de 13.9 °C, con una diferencia inferior de 2.6 °C comparada con el sitio de Hidalgo; dicha diferencia en la temperatura mínima puede explicar la discrepancia en la abundancia del descortezador entre ambos sitios, como se ha observado en otros estudios de insectos en los que la temperatura letal es igual o menor a 13 °C (Fields et al., 2012). En los Estados Unidos de América, se considera a las temperaturas mínimas como el factor ambiental determinante para la presencia exponencial de los descortezadores (Buotte et al., 2017).
En la región de Nuevo León, las condiciones ambientales prevalecientes pueden ser desfavorables para una mayor población de D. mexicanus, con una humedad promedio baja y una amplia variación en las temperaturas extremas (39.6 °C máxima en promedio y 10 °C mínima en promedio). Respecto a la variación de temperaturas extremas en el sitio de Nuevo León, la diferencia fue de hasta 4 °C entre las temperaturas máximas y mínimas promedio, en relación al sitio de la región de Hidalgo, en donde se obtuvo la mayor abundancia de insectos descortezadores. La temperatura máxima promedio es un factor determinante en el control de la abundancia de D. mexicanus, lo que es una consecuencia de que las temperaturas promedio máximas en extremo provocan la desecación de los tejidos y la eventual muerte de los insectos (De la Vega y Schilman, 2015). Los extremos en las temperaturas limitan la abundancia de los insectos por ser organismos ectotermos (Chown y Nicolson, 2004; De la Vega y Schilman, 2015).
La proliferación de D. mexicanus está asociada a una humedad alta, lo cual se ha observado en diversos estudios de laboratorio con otros escarabajos, en los cuales se ha registrado que una alta humedad relativa evita la mortalidad por deshidratación (Noh et al., 2015).
Por otra parte, en la región de Hidalgo las variables climáticas favorecieron una mayor abundancia de los escarabajos de interés; por ejemplo, las temperaturas medias alrededor de 16 °C (Hernández-Muñoz et al., 2017; Morales-Rangel et al., 2018; Soto-Correa et al., 2019) y una humedad de 80 %, con poca variación en las temperaturas medias mínimas y máximas.
El índice de aridez resulta útil para observar e interpretar cómo interactúan las variables temperatura y humedad con respecto a la abundancia de D. mexicanus. Las especies ectotérmicas, como los escarabajos, suelen relacionarse con el balance hídrico y el equilibrio térmico, factores que influyen en una mayor o menor abundancia de los insectos (Chown y Nicolson, 2004). Asimismo, fue posible estimar una relación entre la abundancia de D. mexicanus y la diferencia entre los índices de aridez mínimo y máximo promedio, en la que existe una mayor abundancia de D. mexicanus, cuando la diferencia entre ambos índices es menor, como se cita en estudios con diferencias de temperatura (Jian et al., 2018). La presente investigación es importante, ya que genera evidencia sobre los factores climáticos que determinan la abundancia de poblaciones de descortezadores dentro del tipo de bosques evaluados, y no solo que las condiciones secas en el sitio pueden aumentar la abundancia de las poblaciones, como se ha indicado en estudios de dinámica poblacional en D. mexicanus; además de, la gran influencia que tiene la humedad en la coloración de su exoesqueleto.
Conclusiones
Existe variación en la intensidad de la coloración en el exoesqueleto de D. mexicanus entre los individuos de las regiones de Nuevo León y Oaxaca, donde se observa la presencia de individuos con una coloración más obscura en regiones con mayor humedad, como en Oaxaca, y una coloración menos obscura en la región con menor humedad, como Nuevo León.
La abundancia de D. mexicanus está limitada por las variables climáticas: ocurrencia de una baja humedad, las temperaturas extremas mínimas y máximas, así como la diferencia entre los índices de aridez máximo y mínimo.











 text in
text in 



