Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista mexicana de ciencias pecuarias
On-line version ISSN 2448-6698Print version ISSN 2007-1124
Rev. mex. de cienc. pecuarias vol.14 n.4 Mérida Oct./Dec. 2023 Epub Nov 17, 2023
https://doi.org/10.22319/rmcp.v14i4.6419
Notas de investigación
Adenocarcinoma pulmonar ovino en México
aUniversidad de Colima. Facultad de Medicina Veterinaria y Zootecnia. Colima, México. Carretera Colima-Manzanillo Km 40, Col. La Estación. 2810 Tecomán, Colima, México.
bUniversidad de Colima. Facultad de Medicina. Colima, México. Programa de Doctorado en Ciencias Médicas
cUniversidad de Zaragoza. Facultad de Veterinaria. Zaragoza, España. Departamento de Patología Animal
dUniversity of Prince Edward Island. Department of Pathology and Microbiology, Atlantic Veterinary College. Charlottetown, PEI. Canada.
El adenocarcinoma pulmonar ovino es una neoplasia pulmonar transmisible del ganado ovino causada por un beta retrovirus actualmente denominado retrovirus Jaagsiekte de las ovejas (JSRV). Las células Club (anteriormente llamadas células de Clara) de los bronquiolos y los neumocitos de tipo II de los alvéolos son las células oncogénicas que constituyen el objetivo de este virus. Se caracteriza clínicamente por tos intermitente, secreción nasal abundante y pérdida de peso progresiva, los tumores afectan aleatoriamente a todos los lóbulos pulmonares o tienen una distribución cráneo-ventral que simula una bronconeumonía. El diagnóstico definitivo del adenocarcinoma pulmonar ovino requiere que se identifique el retrovirus Jaagsiekte de las ovejas RVJO-Env, o bien, la presencia de proteínas específicas asociadas en las células neoplásicas, tales como la proteína oncogénica JSRV-Env. Un ovino Pelibuey macho de dos años con un historial de tos crónica y pérdida de peso progresiva fue tratado sin éxito con antibióticos y murió unos días más tarde. El examen post mortem reveló edema pulmonar y varias masas nodulares localmente extensas en los pulmones. A nivel microscópico, los tejidos tumorales estaban compuestos por grupos de células epiteliales neoplásicas que mostraban un patrón de crecimiento lepídico típico del carcinoma pulmonar. Las células tumorales fueron inmunopositivas para la proteína oncogénica Env del retrovirus Jaagsiekte de la oveja. Con base en estos hallazgos, se hizo el diagnóstico final de adenocarcinoma pulmonar ovino.
Palabras clave Adenocarcinoma pulmonar ovino; Adenomatosis pulmonar ovina; Retrovirus Jaagsiekte; RVJO; Inmunohistoquímica; Pelibuey
Ovine pulmonary adenocarcinoma is a transmissible pulmonary malignancy of sheep caused by a beta-retrovirus currently named Jaagsiekte sheep retrovirus (JSRV). Club cells (formerly Clara cells) in the bronchiole and type II pneumonocytes in the alveoli are the target oncogenic cells for this virus. Characterized clinically by intermittent cough, abundant nasal discharge, and progressive weight loss, the tumors randomly involve all lung lobes or have a cranioventral distribution mimicking bronchopneumonia. The definitive diagnosis of ovine pulmonary adenocarcinoma requires identifying Jaagsiekte sheep retrovirus or associated specific proteins in neoplastic cells such as JSRV-Env oncogenic protein. A two-year-old Male Pelibuey sheep with a history of chronic cough and progressive weight loss was treated unsuccessfully with antibiotics and died a few days later. Postmortem examination revealed lung edema and several nodular to locally extensive masses in the lungs. Microscopically the tumoral tissues were composed of clusters of neoplastic epithelial cells exhibiting a lepidic growth pattern typical of pulmonary carcinoma. Tumoral cells were immunopositive for Jaagsiekte sheep retrovirus-Env oncogenic protein. Based on these findings, the final diagnosis of ovine pulmonary adenocarcinoma was made.
Keywords Ovine pulmonary adenocarcinoma; Ovine pulmonary adenomatosis; Jaagsiekte; retrovirus; JSRV; Immunohistochemistry; Pelibuey
El adenocarcinoma pulmonar ovino (APO), también llamado Jaagsiekte en Sudáfrica, y carcinoma pulmonar ovino (CPO) o adenomatosis pulmonar, es un tumor pulmonar maligno transmisible de las ovejas1,2. El APO, del cual se informó por primera vez en Sudáfrica en 1855, se da en muchas partes del mundo y algunos investigadores lo consideran la neoplasia pulmonar más común en las ovejas3. En las Américas, se ha reportado desde Argentina4, Perú5, Brasil6 y México7. En algunos países, el APO es endémico y ocasiona un importante impacto económico en la producción ovina; en algunas regiones geográficas la tasa de mortalidad anual por esta enfermedad puede llegar a ser del 2 %3.
El APO es causado por un retrovirus perteneciente al género Betaretrovirus, de la familia Retroviridae1,2, y se le conoce como retrovirus Jaagsiekte de las ovejas (RVJO). Su ARN genómico está formado aproximadamente por 7,460 nucleótidos8,9, y el genoma viral posee los genes gag, pro, pol y env característicos de los retrovirus. El RVJO también contiene una glicoproteína de envoltura que desempeña un papel fundamental en la transformación oncogénica de las células10,11. Al igual que otras infecciones retrovirales, el RVJO tiene un largo periodo de incubación de hasta dos años, y la neoplasia puede reproducirse experimentalmente inoculándolo a ovejas susceptibles10,12.
Se han registrado casos de infección por RVJO en varias razas de ovejas domésticas (Ovis aries), con escasa frecuencia en cabras y muflones (ovejas salvajes Ovis gmelini), y nunca en ninguna otra especie animal2,6. Las principales células blanco del RVJO en el pulmón son las células Club bronquiolares (antiguamente llamadas células de Clara) y los neumonocitos tipo II de la pared alveolar1,9,13. Este virus también infecta a los linfocitos B, los linfocitos T (CD4+ y CD8+) y a los macrófagos, y se ha detectado en los monocitos de la sangre periférica 9,11,14.
Las ovejas con APO suelen mostrar una pérdida de peso progresiva, intolerancia al ejercicio, tos y escurrimiento nasal líquido. Sus pulmones son notablemente pesados en la necropsia debido a un edema pulmonar grave, y el parénquima pulmonar presenta múltiples nódulos tumorales grises de textura firme. Las características histológicas son las de un carcinoma lepídico o papilar bien diferenciado3,12,15. El APO requiere confirmación de laboratorio mediante la identificación del RVJO o de las proteínas asociadas en los tejidos afectados por inmunomarcación o PCR4,14,16. Se describen los cambios macroscópicos, microscópicos e inmunohistoquímicos en los pulmones de una oveja infectada con RVJO que evolucionó a APO en Colima, México.
Se presentó al veterinario local un carnero Pelibuey (Ovis aries) de dos años de edad, con una historia de dos meses de escurrimiento nasal, tos crónica, dificultad respiratoria y pérdida progresiva de peso. El animal fue separado del rebaño y tratado durante siete días con antibióticos de amplio espectro y expectorantes. El carnero se deterioró, se postró y finalmente murió. El cadáver fue remitido para su examen post mortem al Laboratorio de Patología de la Facultad de Medicina Veterinaria de la Universidad de Colima.
En el examen post mortem, el ovino estaba hemaciado y presentaba una marcada opacidad corneal en el ojo derecho debida a una lesión traumática en el tejido periorbitario. Internamente, había algunas adherencias fibrosas en los lóbulos caudales derechos entre la pleura visceral y la parietal. En general, los pulmones parecían pálidos y distendidos con márgenes redondeados, estaban pesados y edematosos (Figura 1A). Había dos tipos distintos de infiltraciones tumorales en el pulmón: las primeras consistían en masas tumorales firmes bien delimitadas (1-7 cm) que sobresalían de la superficie pleural (Figuras 1A y 1B); el segundo tipo consistía en una infiltración neoplásica localmente extensa que se asemejaba mucho a una consolidación bronconeumónica (Figura 1B). La tráquea y los bronquios contenían grandes cantidades de líquido espumoso (Figura 1C), el corazón mostraba una marcada dilatación del lado derecho, y el hígado estaba congestionado. No se observaron otras lesiones significativas en la autopsia. Los tejidos se fijaron en formol tamponado al 10 % y se procesaron de forma rutinaria para su examen histopatológico.
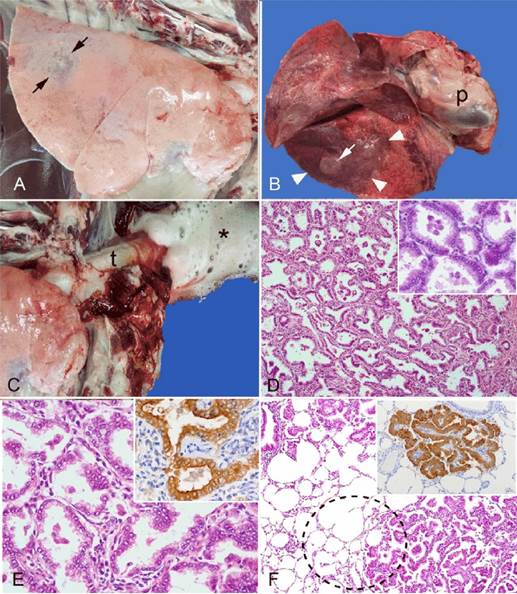
A. Vista lateral del pulmón derecho en la que se percibe el parénquima pulmonar parcialmente distendido y pálido. El lóbulo caudal dorsal muestra una decoloración focal gris oscura (flechas) con una textura firme a la palpación. B. Vista ventral de los pulmones y del saco pericárdico (p). Se observa un área localmente extensa de consolidación oscura en el lóbulo caudal izquierdo que se asemeja a una bronconeumonía (puntas de flecha), así como un nódulo tumoral prominente y elevado (flecha). C. Abundante líquido espumoso (asterisco) que rezuma de la tráquea (t). D. Vista microscópica del tumor que muestra estructuras de aspecto alveolar compuestas por finas bandas de tejido estromal revestidas por células neoplásicas cuboidales y columnares. Hematoxilina-eosina. E. Las estructuras de tipo alveolar están formadas por una fina capa de tejido conjuntivo revestido por células cuboidales o columnares. Hematoxilina-eosina. Recuadro: Las células neoplásicas muestran una fuerte inmunomarcación para la proteína oncogénica RVJO-Env en el citoplasma y en la membrana celular. IHQ Anticuerpo monoclonal. F. Vista microscópica de la unión entre el tumor y el pulmón normal (círculo punteado). Obsérvese la ausencia de encapsulación o fibrosis de unión entre el tumor y el tejido pulmonar adyacente. Hematoxilina-eosina. Recuadro: Grupo de células neoplásicas que muestran una fuerte inmunomarcación para la proteína oncogénica RVJO-Env. IHQ Anticuerpo monoclonal.
Figura 1 Adenocarcinoma pulmonar ovino; pulmón
A nivel microscópico, las masas tumorales estaban mal delimitadas, no encapsuladas y compuestas por grupos de células epiteliales que crecían en patrones lepídicos y papilares sobre finas bandas de tejido conectivo, y formaban estructuras similares a alvéolos (Figura 1D). Las células neoplásicas eran cuboidales o columnares, tenían abundante citoplasma eosinofílico con núcleos redondos y sutiles patrones de cromatina que contenían uno o dos nucléolos (Figuras 1D y 1E). Había anisocariosis leve y 1-2 figuras mitóticas por campo de alta potencia (40x). Los alvéolos circundantes eran normales excepto por la presencia de cierto grado de edema y de macrófagos alveolares dispersos pero sin evidencia de encapsulamiento (Figura 1F). Basándose en los hallazgos macroscópicos y microscópicos, se hizo un diagnóstico provisional de APO. Se enviaron muestras embebidas en parafina del pulmón afectado para la detección inmunológica de la proteína oncogénica RVJO-Env mediante anticuerpos monoclonales11,16, y los resultados fueron positivos (Figuras 1E y 1F).
La infección por RVJO se distribuye por todos los continentes, con la notable excepción de Australia y Nueva Zelanda9,13,14. En algunos países, la infección por RVJO es endémica y afecta al 80 % de la población ovina, aunque sólo entre el 4 y el 30 % de las ovejas infectadas desarrollan APO8,17. El primer caso confirmado de APO reportado en México se presentó en 2019 en un rebaño de ovejas en el estado de Tabasco, en el sur de México7. Hasta 2016 el APO era una enfermedad exótica de notificación oficial en México; sin embargo, a partir de 2018, la Norma Oficial Mexicana de Sanidad ya no reconoce al APO como enfermedad de notificación obligatoria18,19, tal vez en conformidad con las recomendaciones revisadas de la OIE. Se desconoce la verdadera prevalencia de la infección por el virus RVJO y la incidencia del APO en México, principalmente porque en este país rara vez se realizan investigaciones post mortem y de laboratorio en los animales de granja.
El historial clínico y los hallazgos macroscópicos, microscópicos e inmunohistoquímicos del carnero de 2 años aquí descritos eran los clásicos del APO. Según la literatura veterinaria, los signos respiratorios y la pérdida de peso suelen manifestarse entre los 2 y los 4 años de edad, pero las infecciones iniciales se producen probablemente durante la ingestión de calostro y en los primeros años de vida2,5. La abundante secreción líquida de las fosas nasales en una oveja con tos crónica y pérdida de peso es un dato relevante que indica la necesidad de que el veterinario practicante realice pruebas de detección del APO. El sujetar a la oveja afectada por las extremidades traseras (prueba de la "carretilla") provoca que salga un líquido blanquecino claro por las fosas nasales8,12,17. Desgraciadamente, este signo distintivo no fue investigado adecuadamente por el veterinario local. Cabe señalar que el escurrimiento nasal líquido por APO no es un edema o exudado en sentido estricto, sino más bien un exceso de líquido secretado por las células Club neoplásicas bronquiolares y por los neumonocitos alveolares tipo II2,15. Las infecciones bacterianas secundarias son frecuentes en los pulmones con APO, pero no lo fue en el caso presente.
Los signos clínicos del APO son inespecíficos y pueden observarse en otras infecciones respiratorias crónicas del ganado ovino12,15. También causada por un retrovirus (género lentivirus), la enfermedad de Maedi induce una grave neumonía intersticial linfocítica progresiva en ovejas, y los signos clínicos son indistinguibles de los del APO3,15. Desgraciadamente, en la actualidad no se dispone de pruebas de laboratorio de rutina para distinguir estas dos enfermedades retrovirales en la práctica ovina diaria. La microscopía electrónica sería un método poco práctico y costoso para detectar el RVJO en las células neoplásicas de APO8,13. Por lo tanto, la necropsia, la histopatología y la detección del virus mediante inmunomarcación o PCR son indispensables para el diagnóstico convencional. Además del APO y de la enfermedad de Maedi, otros padecimientos ovinos no virales, como la bronconeumonía bacteriana crónica, la neumonía verminosa, la linfadenitis caseosa y otras neoplasias pulmonares también se manifiestan clínicamente con tos crónica y pérdida de peso2,3,12. No hubo evidencia de ninguna de estas enfermedades pulmonares en la autopsia ni en el examen microscópico del ovino.
Una característica única del APO es que los tumores suelen tener una distribución pulmonar cráneo-ventral que imita la distribución clásica de la bronconeumonía. En otros casos como el reseñado en este trabajo, los tumores afectan a todos los lóbulos pulmonares indistintamente, como ocurre con la mayoría de las neoplasias pulmonares en animales domésticos2,3,15. La distribución del tumor fue dorsal, no cráneo-ventral, como se indica en la literatura. Las alteraciones pulmonares en el APO pueden agruparse en dos patrones morfológicos, a saber, "clásico" y "atípico"20. El APO clásico tiende a ser localmente extenso, tiene una distribución cráneo-ventral y en la superficie de corte rezuma un líquido claro. Por el contrario, el APO atípico tiende a ser focal y a veces solitario, sin evidencia de líquido en la superficie de corte. Parece que en el presente caso, se desvió ligeramente de la presentación clásica, mostrando también el patrón atípico. Independientemente del tipo de presentación, los hallazgos microscópicos son los mismos12.
No hubo evidencia de metástasis a los linfonodos mediastínicos o bronquiales ni a tejidos distantes, lo que no es de sorprender, ya que sólo el 10 % de los APOs metastatizan a estos linfonodos3,17, y la metástasis a otros órganos distantes es extremadamente rara8. Las características microscópicas del APO son las clásicas de un carcinoma bronquioloalveolar; sin embargo, este mismo tipo de neoplasia pulmonar también puede desarrollarse espontáneamente en los pulmones de las ovejas en ausencia de infección por RVJO3,12. La clasificación de los carcinomas de pulmón en patología humana y veterinaria ha cambiado continuamente en las tres últimas décadas. La clasificación actual distingue microscópicamente cinco tipos principales de adenocarcinomas de pulmón con base en el patrón de crecimiento predominante de las células neoplásicas: lepídico, papilar, acinar, escamoso y adenoescamoso3. El crecimiento lepídico se refiere a la proliferación de células neoplásicas a lo largo de la superficie intacta de las paredes alveolares sin invasión vascular o del estroma12,15. En este caso, los patrones de crecimiento predominantes fueron de tipo lepídico y papilar, que son los más comúnmente observados en el APO3,20. Las neoplasias de rumiantes pequeños inducidas por retrovirus, como el APO y el carcinoma nasal enzoótico (etmoidal), son de gran interés para los investigadores de medicina humana de todo el mundo. El APO se ha utilizado ampliamente como modelo animal para estudios de carcinogénesis humana9,10,16. Aún queda mucho por aprender sobre la oncogénesis retroviral ovina, y es probable que los actuales avances científicos en materia de patología molecular conduzcan pronto a descubrimientos importantes.
Literature cited
1. Palmarini M, Sharp JM, De las Heras M, Fan H. Jaagsiekte sheep retrovirus is necessary and sufficient to induce a contagious lung cancer in sheep. J Virol 1999;73(8):6964-6972. [ Links ]
2. De las Heras M, González L, Sharp JM. Pathology of ovine pulmonary adenocarcinoma. Curr Top Microbiol Immunol 2002;275:25-54. [ Links ]
3. Wilson DW. Tumors of the respiratory tract: tumors of the lung. In: Meuten DJ, editor. Tumors in domestic animals, 5th ed. Ames, Iowa, USA: John Wiley & Sons Inc; 2017:467-498. [ Links ]
4. Uzal FA, Delhon G, Murcia PR, De las Heras M, Luján L, Fernández Miyakawa ME, et al. Ovine pulmonary adenomatosis in Patagonia, Argentina. Vet Res Commun 2004;28(2):159-170. [ Links ]
5. Londoñe P, Maturrano HL, Rosadio AR. Report of an ovine pulmonary adenocarcinoma in a lamb of five months old in Puno, Peru. Rev Investig Vet Peru 2014;25(4):545-550. [ Links ]
6. Rama Devi V, Manasa BB, Samatha V, Mahesh M, Srikanth KV, Yathiraja-Rao T, et al. Pathology of natural cases of ovine pulmonary adenocarcinoma (Jaagsiekte) in goats. Brazilian J Vet Pathol 2016;9(3):108-112. [ Links ]
7. Caraveo RK, Moreno PL, Sánchez GI, Berumen AA, Cerón TF, González MA, Garrido FG, Ramírez AH, Tórtora PJ. Diagnóstico de adenocarcinoma pulmonar ovino (virus del Jaagsiekte) en un rebaño de México. Rev Acad Ciênc Anim 2019;(1):404-407. [ Links ]
8. Griffiths DJ, Martineau HM, Cousens C. Pathology and pathogenesis of ovine pulmonary adenocarcinoma. J Comp Pathol 2010;2(4):260-283. [ Links ]
9. Youssef G, Wallace WAH, Dagleish MP, Cousens C, Griffiths DJ. Ovine pulmonary adenocarcinoma: A large animal model for human lung cancer. ILAR J 2015;56(1):99-115. [ Links ]
10. Wootton SK, Halbert CL, Miller AD. Sheep retrovirus structural protein induces lung tumours. Nature 2005;434(7035):904-907. [ Links ]
11. De las Heras M, De Martino A, Borobia M, Ortín A, Álvarez R, Borderías L, Giménez-Más JA. Solitary tumours associated with Jaagsiekte retrovirus in sheep are heterogeneous and contain cells expressing markers identifying progenitor cells in lung repair. J Comp Pathol 2014;(2-3):138-147. [ Links ]
12. Caswell JL, Williams KJ. Respiratory system: infectious respiratory diseases of sheep and goats. In: Maxie MG, editor. Jubb, Kennedy & Palmer’s Pathology of Domestic Animals, 5th ed. St. Louis, Missouri, USA: Saunders Elsevier; 2016:557-567. [ Links ]
13. Naik HS, Srilatha C, Sujatha K, Kumar RVS, Ramnamurthy RV. Histopathological and ultra structural studies of ovine pulmonary adenocarcinoma (Jaagsiekte). Indian J Vet Pathol 2015;39(1):81-83. [ Links ]
14. De las Heras M, Reséndiz RA, González-Sáinz JM, Ortín A. Exogenous small ruminant Betaretrovirus envelope protein is detected in draining lymph nodes in contagious respiratory tumors of sheep and goats. Vet Pathol 2021;58(2):361-368. [ Links ]
15. López A, Martinson SA. Respiratory system, mediastinum, and pleurae: neoplasms of the lungs. In: Zachary JF, editor. Pathologic basis of veterinary diseases, 6th ed. St. Louis, Missouri, USA: Mosby Elsevier; 2017:552-555. [ Links ]
16. Miller AD, De Las Heras M, Yu J, Zhang F, Liu SL, Vaughan AE, et al. Evidence against a role for Jaagsiekte sheep retrovirus in human lung cancer. Retrovirology 2017;14(1):3. [ Links ]
17. Ortín A, De las Heras M, Borobia M, Ramo MA, Ortega M, Ruíz de Arcaute M. Ovine pulmonary adenocarcinoma: A transmissible lung cancer of sheep, difficult to control. Small Ruminant Res 2019;176:37-41. [ Links ]
18. DOF. Diario Oficial de la Federación. Acuerdo mediante el cual se dan a conocer en los Estados Unidos Mexicanos las enfermedades y plagas exóticas y endémicas de notificación obligatoria de los animales terrestres y acuáticos. Ciudad de México, México, 2016. [ Links ]
19. DOF. Diario Oficial de la Federación. Acuerdo mediante el cual se dan a conocer en los Estados Unidos Mexicanos las enfermedades y plagas exóticas y endémicas de notificación obligatoria de los animales terrestres y acuáticos. Ciudad de México, México, 2018. [ Links ]
20. García-Goti M, González L, Cousens C, Cortabarría N, Extramiana AB, Minguijón E, et al. Sheep pulmonary adenomatosis: characterization of two pathological forms associated with Jaagsiekte retrovirus. J Comp Pathol 2000;122(1):55-65. [ Links ]
Recibido: 25 de Febrero de 2023; Aprobado: 12 de Junio de 2023











 text in
text in 


