Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista mexicana de ciencias pecuarias
On-line version ISSN 2448-6698Print version ISSN 2007-1124
Rev. mex. de cienc. pecuarias vol.14 n.2 Mérida Apr./Jun. 2023 Epub June 26, 2023
https://doi.org/10.22319/rmcp.v14i2.6245
Artículos
Acción ixodicida de productos naturales de plantas nativas mexicanas
a Universidad Veracruzana. Facultad de Medicina Veterinaria y Zootecnia. Miguel Ángel de Quevedo s/n, 91710, Veracruz, Veracruz, México.
b Universidad Veracruzana. Facultad de Bioanálisis. Iturbide s/n, 91700, Veracruz, Veracruz, México.
c Universidad Veracruzana. Centro de Estudios y Servicios en Salud, Veracruz, México.
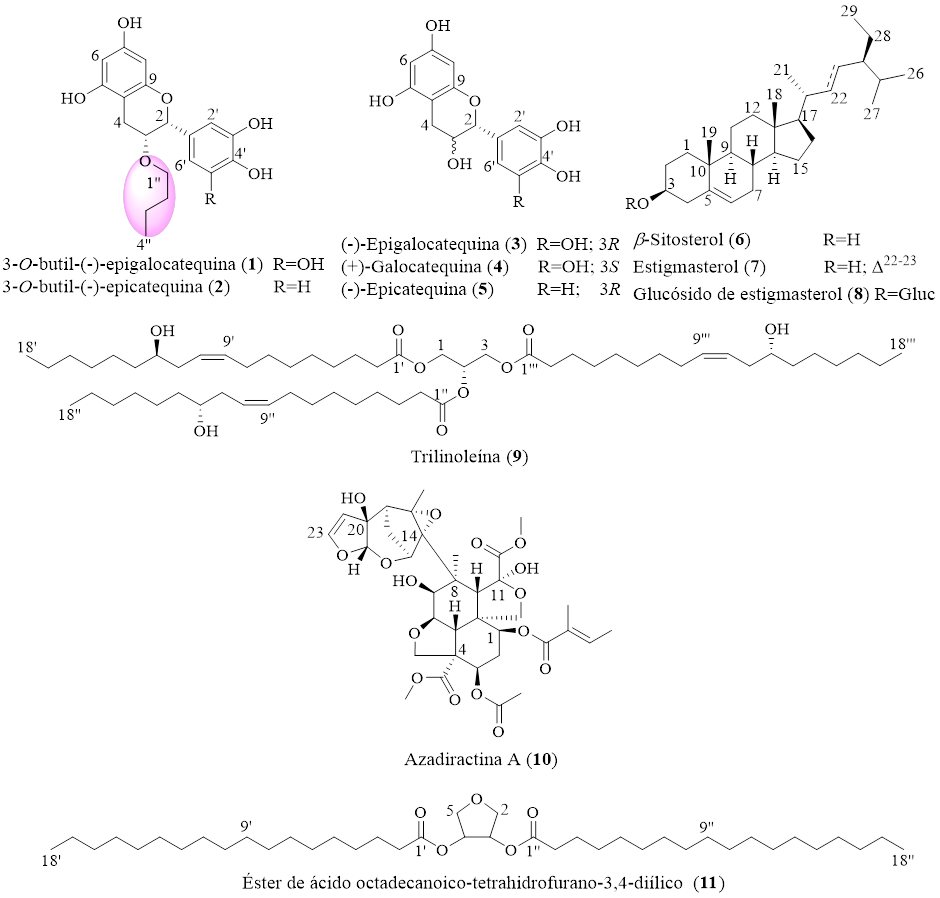
Se determinó el efecto acaricida de 18 plantas mexicanas contra Rhipicephalus microplus. Los resultados del ensayo larvicida revelaron que 5 extractos metanólicos produjeron una actividad alta (86-100 % de mortalidad), 3 extractos mostraron una actividad relativamente alta (71-85 % de mortalidad), 2 extractos mostraron una actividad moderada (56-70 % de mortalidad), 2 extractos presentaron baja actividad (31-55 % mortalidad) y 6 extractos mostraron actividad acaricida no significativa (0-30 % mortalidad). Los extractos que inducían >56 % de mortalidad se analizaron posteriormente contra garrapatas ingurgitadas de R. microplus mediante una prueba de inmersión de adultos a una concentración de 5.0% p/v. En términos generales, los resultados en larvas y garrapatas adultas indicaron que los extractos metanólicos de Annona globiflora, Annona scleroderma, Litchi chinensis y Azadirachta indica mostraron las mayores actividades. El extracto crudo de A. indica fue sometido a una purificación cromatográfica, lo que llevó al aislamiento de 3-O-butil-(-)-epigalocatequina (1), 3-O-butil-(-)-epicatequina (2), (-)-epigalocatequina (3), (+)-galocatequina (4), (-)-epicatequina (5), β-sitosterol (6), estigmasterol (7), glucósido de estigmasterol (8), trilinoleína (9), azadiractina A (10) y el éster de ácido octadecanoico-tetrahidrofurano-3,4-diílico (11). Las estructuras químicas de los compuestos aislados fueron identificadas mediante la interpretación de los datos espectroscópicos de RMN y HRESI-MS. Los compuestos aislados se ensayaron frente a garrapatas ingurgitadas de R. microplus a una concentración de 6 mM. Sobre la base de los resultados obtenidos, se concluyó que el 3-O-butil-(-)-epigalocatequina (1), el 3-O-butil-(-)-epicatequina (2), la azadiractina A (10) y el ácido octadecanoico-tetrahidrofurano-3,4-diil éster (11) muestran la mayor eficacia.
Palabras clave Plantas mexicanas; Cribado acaricida; Azadirachta indica; Metabolitos ixodicidas
This work determined the acaricidal effect of 18 Mexican plants against Rhipicephalus microplus. The results of the larvicidal assay revealed that 5 methanolic extracts produced high activity (86-100 % mortality), 3 extracts exhibited relatively high activity (71-85 % mortality), 2 extracts displayed moderate activity (56-70 % mortality), 2 extracts presented low activity (31-55 % mortality) and 6 extracts showed non-significant acaricidal activity (0-30 % mortality). Extracts inducing >56 % mortality were subsequently assayed against engorged ticks of R. microplus by adult immersion test at a concentration of 5.0% w/v. In general terms, the results on larvae and adult ticks indicated that the methanolic extracts of Annona globiflora, Annona scleroderma, Litchi chinensis and Azadirachta indica showed the greatest activities. The crude extract of A. indica was subjected to chromatographic purification, which has led to the isolation of 3-O-butyl-(-)-epigallocatechin (1), 3-O-butyl-(-)-epicatechin (2), (-)-epigallocatechin (3), (+)-gallocatechin (4), (-)-epicatechin (5), β-sitosterol (6), stigmasterol (7), stigmasterol glucoside (8), triolein (9), azadirachtin A (10), and the octadecanoic acid-tetrahydrofuran-3,4-vinyl ester (11). The isolated compounds' chemical structures were identified by the interpretation of NMR and HRESI-MS spectroscopic data. The isolated compounds were assayed against engorged ticks of R. microplus at a concentration of 6 mM. Based on the results obtained, it was concluded that 3-O-butyl-(-)-epigallocatechin (1), 3-O-butyl-(-)-epicatechin (2), azadirachtin A (10), and octadecanoic acid-tetrahydrofuran-3,4-vinyl ester (11) show the highest effectiveness.
Keywords Mexican plants; Acaricidal screening; Azadirachta indica; Ixodicide metabolites
Introducción
Rhipicephalus (Boophilus) microplus (R. microplus), se distribuye en latitudes tropicales y subtropicales a nivel mundial y es responsable de severas pérdidas económicas en la ganadería en países de América, África, Asia y Australia1. En México, R. microplus se encuentra ampliamente distribuida, infestando varias especies hospederas2. Este ectoparásito produce menor aumento de peso y reducción de la producción de leche, anemia, daños en la piel e incluso mortalidad en el ganado. También es un importante vector de patógenos como Babesia bovis, B. bigemina y Anaplasma marginale3. Actualmente, el control de las garrapatas consiste principalmente en el uso de acaricidas, animales resistentes a las garrapatas, vacunas antigarrapatas y control biológico4. Entre ellos, los acaricidas son el método de control más común, ya que ofrecen una supresión rápida y rentable de las poblaciones de garrapatas. Sin embargo, el uso indiscriminado de sustancias químicas (piretroides sintéticos, organofosforados, lactonas macrocíclicas y amidinas) para el control de plagas de garrapatas ha promovido la multirresistencia en este ectoparásito5-7. Además, la acumulación de plaguicidas en los tejidos animales provoca la exposición humana a través del consumo de productos animales derivados8. Por tanto, es necesario el desarrollo de nuevas sustancias con mecanismos de acción novedosos y menos tóxicos que los utilizados actualmente. En este sentido, los productos naturales emergen como una alternativa eco-biológica para el control de garrapatas por su bajo costo y toxicidad9-12.
La química de los productos naturales ha sido una de las fuentes de inspiración para el desarrollo de nuevos fármacos durante muchas décadas, ya sea directamente como fármacos o como estructuras líderes que fueron optimizadas aún más por los químicos y médicos13,14. Dentro de la amplia gama de fuentes naturales, la medicina tradicional a base de hierbas ha sido una de las más prolíficas productoras de metabolitos bioactivos. De hecho, los estudios fitoquímicos de las plantas medicinales han llevado al desarrollo de más del 50 % de los principios activos farmacéuticos que se comercializan actualmente15-17. Azadirachta indica A. Juss., comúnmente conocida como el árbol “neem” en América Latina, es una planta curativa con una amplia gama de actividades farmacológicas y propiedades beneficiosas para la salud18-20. Del árbol del neem se han aislado una variedad de metabolitos con alta diversidad estructural, algunos de los cuales han mostrado importantes bioactividades, como efectos antioxidantes, citotóxicos, bactericidas o larvicidas21-24. Este estudio evaluó la actividad acaricida de 18 extractos de plantas mexicanas, contra larvas y garrapatas ingurgitadas de R. microplus. Además, un estudio fitoquímico de la corteza de A. indica, recolectada en la primavera de 2018 en el estado de Veracruz (México), permitió aislar 11 metabolitos naturales del árbol del neem. Sus estructuras se determinaron con base a estudios espectroscópicos detallados. Los compuestos aislados se evaluaron frente a garrapatas hembra ingurgitadas.
Material y métodos
Material vegetal
Dieciocho especies de plantas se recolectaron en la primavera de 2018 en la región de Sotavento del Estado de Veracruz, México. Taxónomos del Instituto de Investigaciones Biológicas (CIB) de la Universidad Veracruzana identificaron las plantas (Cuadro 1). Después de la recolección, el material vegetal se secó a temperatura ambiente durante dos semanas y luego se trituró.
Cuadro 1 Especies de plantas estudiadas
| Plantas | Parte usada | Voucher | Coordenadas geográficas |
|---|---|---|---|
| Annona globiflora | Semillas | 10750UV | 19º 42’ 42.6’’ N, 96º 28’ 7.2’’ W |
| Annona scleroderma | Semillas | 23839UV | 19º 9’ 39.4’’ N, 96º 13’ 5.7’’ W |
| Litchi chinensis | Semillas | 23764UV | 19º 10’ 26.8’’ N, 96º, 13’ 27.3’’ O |
| Inga jinicuil | Semillas | 11859UV | 19º 29’ 15.8’’ N, 96º 5’ 26.5’’ O |
| Ensete ventricosum | Semillas | 11244UV | 18º 17’ 15.1’’ N, 95º 18’ 51.3’’ O |
| Azadirachta indica | Corteza | 23765UV | 19º 10’ 26.4’’ N, 96º 13’ 22.8’’ O |
| Salvia hispanica | Semillas | 11164UV | 18º 38’ 3’’ N, 97º 0’ 45’’ O |
| Sterculia apetala | Semillas | 11165UV | 18º 17’ 15.1’’ N, 95º 18’ 51.3’’ O |
| Citrus sinensis | Cascara | 10500UV | 18º 39’ 39’’ N, 96º 56’ 18’’ O |
| Citrus paradisi | Cascara | 23762UV | 19º, 10’, 26.6’’ N, 96º 13’ 27.3’’ O |
| Citrus latifolia | Cascara | 23766UV | 19º, 10’ 30.5’’ N, 96º 13’ 28.8’’ O |
| Citrus medica | Cascara | 23768UV | 19º 33’ 50.4’’ N, 96º 56’ 27.6’’ O |
| Mimosa pudica | Planta entera | 12879UV | 18º 3’ 50.5’’ N, 94º 22’ 13.4’’ O |
| Heliotropium indicum | Planta entera | 21157UV | 18º 34’ N, 95º 4’ O |
| Momordica charantia | Planta entera | 12161UV | 19º 52’ 47’’ N, 96º 67’ 86’’ O |
| Tagetes erecta | Planta entera | 20090UV | 19º 43’ 50.3’’ N, 96º 43’ 40.7’’ O |
| Tridax procumbens L. | Planta entera | 21537UV | 19º 18’ 29’’ N, 96º 22’ 14’’ O |
| Randia aculeata | Raíces | 20326UV | 19.3º 41’ 10.1’’ N, 96.3º 8’ 36.9’’ O |
Extracción de las plantas
El material vegetal se extrajo cuatro veces por maceración frío durante 3 h a temperatura ambiente usando 1 L de metanol para 300 g de material vegetal, cada vez. Posteriormente, el disolvente se eliminó al vacío en un evaporador rotatorio (Buchi Rotavapor R-3, Suiza).
Proceso de aislamiento de los compuestos
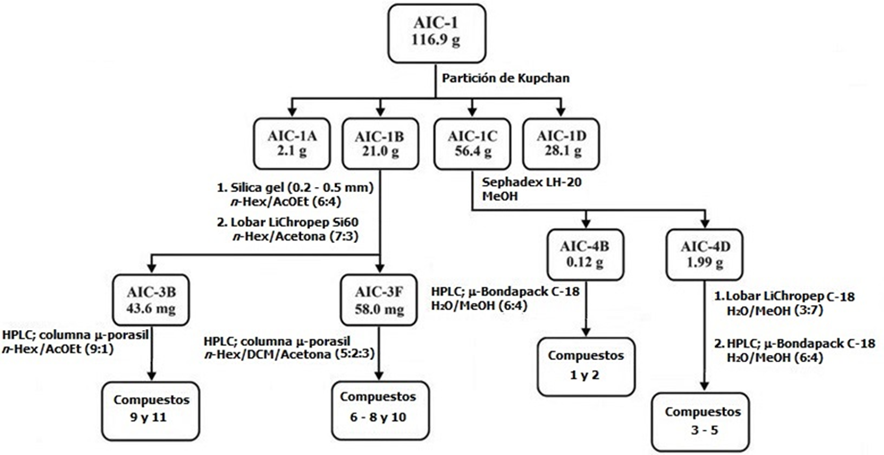
El extracto metanólico de A. indica (117 g, 2.8 % peso seco) se fraccionó por extracción líquido-líquido siguiendo el método de Kupchan. Brevemente, el extracto se disolvió en una mezcla de metanol/agua (MeOH/H2O; 1 L, 1:1) y se separó sucesivamente con hexano (Hex; 3 × 1 L), diclorometano (DCM; 3 × 1 L) y acetato de etilo (AcOEt; 3 × 1 L) (Sigma-Aldrich, St. Louis Mo., EE. UU.) para obtener cuatro fracciones de polaridad creciente25-27. La fracción de diclorometano (21.0 g) se sometió a una cromatografía en columna de gel de sílice 60 (5 cm de diámetro interno y 35 cm de longitud) (Merck, Darmstadt, Alemania) con Hex:AcOEt (6:4), y, posteriormente, en una columna Lobar LiChroprep-Si60 de media presión (Merck, Darmstadt, Alemania) con Hex:Acetona (7:3) como eluyente. Las fracciones recogidas entre 6-11 min y 108-175 min se agruparon (3B y 3F, 44 y 58 mg, respectivamente). La purificación final se realizó en HPLC con una columna de µ-Porasil (Waters, Wexford, Irlanda), usando Hex/DCM/Acetona (5:2:3) como eluyente para obtener β-sitosterol (6) (32.9 mg) estigmasterol (7) (39.7 mg), glucósido de estigmasterol (8) (9.9 mg) y azadiractina A (10) (28.4 mg) de la fracción 3F. Por otra parte, para la fracción 3B, se utilizó Hex/AcOEt (9:1) para producir trilinoleína (9) (9.3 mg) y el éster de ácido octadecanoico-tetrahidrofurano-3,4-diílico (11) (21.7 mg). La fracción de acetato de etilo (56.4 g) se cromatografió utilizando una columna Sephadex LH-20 (5 x 35 cm; eluyente: MeOH) (Merck, Darmstadt, Alemania). La segunda fracción (4B 120 mg) se purificó en HPLC con una columna µ-BondapakTM C-18 (1.9 × 15 cm) (Waters, Wexford, Irlanda) usando MeOH/H2O (2:3) para producir 3-O-butil-(-)-epigalocatequina (1) (23.3 mg) y 3-O-butil-(-)-epicatequina (2) (24.7 mg). La fracción 4D (2.0 g) se procesó mediante cromatografía de media presión, utilizando Lobar LiChroprep-RP18 (eluyente: MeOH/H2O (7:3)). Finalmente, se realizó HPLC en una columna µ-BondapakTM C-18 utilizando MeOH/H2O (2:3) para obtener tres compuestos puros (-)-epigalocatequina (3) (34.8 mg), (+)-galocatequina (4) ( 27.9 mg) y (-)-epicatequina (5) (25.7 mg) (Figuras 1 y 2).
Procedimientos químicos experimentales generales
La espectroscopia de RMN se realizó en instrumentos Bruker AVANCE de 600 MHz usando CDCl3 y CD3OD a 298 K. Los datos de RMN se adquirieron usando secuencias de pulso estándar. Los datos de RMN se procesaron utilizando el software MestReNova (v 11.01, Santiago de Compostela, España). Las separaciones por HPLC se llevaron a cabo con el sistema HPLC Breeze 2 (Waters, Wexford, Irlanda) equipado con un detector UV. Todos los disolventes utilizados fueron de grado HPLC. El HPLC se controló por cromatografía de capa delgada (CCD), realizada en AL Si gel Merck 60 F254 (Kenilworth, NJ, EE. UU.). Las placas de CCD se visualizaron mediante luz ultravioleta (365 nm) y solución de ácido fosfomolíbdico al 10% en peso en etanol.
Recolección de garrapatas
Se recolectaron 1,000 hembras ingurgitadas de R. microplus de seis bovinos naturalmente infestados en una finca ubicada en el municipio de Puente Nacional, Veracruz, México (19°19’N, 96°28’O). Estos bovinos no habían sido tratados con acaricidas durante 45 días antes de la recolección de garrapatas. Se utilizaron 700 hembras ingurgitadas en la prueba de inmersión de adultos, y 300 se colocaron en cajas de Petri y se incubaron a 28 °C y 80 % de humedad relativa durante dos semanas para proporcionar condiciones óptimas para la oviposición. Luego, los huevos fueron mezclados y transferidos a 20 viales de vidrio de 10 ml cerrados con una torunda de algodón por aproximadamente 30 días, a 28 °C y 80 % de humedad relativa28.
Preparación de las soluciones de control
Para el testigo positivo se utilizó el compuesto comercial Taktic® (12.5%; Intervet, México) para preparar una dosis discriminatoria de amitraz al 0.0002%. Para el testigo negativo se preparó una solución acuosa con etanol al 1.0% y Triton X-100 al 0.02%29. En ambos casos, el volumen final utilizado fue de 750 μl.
Concentración de las muestras analizadas
Los extractos metanólicos de las 18 plantas se ensayaron a una concentración de 5.0% p/v (37.5 mg en 750 μl para el ensayo de larvas y 250 mg en 5 ml para el ensayo de adultas). Para la purificación bioguiada de A. indica se utilizaron diferentes concentraciones ≤5.0% p/v, dependiendo del grado de pureza de la fracción a ensayar. Por otro lado, los compuestos 1-11 se ensayaron a una concentración de 6 mM. El volumen final utilizado en la prueba de inmersión de larvas fue de 750 μl, mientras que en la prueba de inmersión de adultos fue de 5 ml24.
Prueba de inmersión de larvas
Aproximadamente 100 larvas de R. microplus se sumergieron con pinceles durante 10 min en 750 μl de cada dilución a ensayar. Luego, se colocaron en sobres de papel filtro y se mantuvieron a 28 °C y 80 % de humedad relativa durante 24 h. El grupo testigo se trató con una solución acuosa de etanol al 1.0% y de Triton X-100 al 0.02%. A las 24 h se registraron las larvas vivas y muertas y se calcularon los porcentajes de mortalidad30. Para cada ensayo se utilizó un experimento con tres réplicas.
Prueba de inmersión para adultas
Diez (10) garrapatas hembra ingurgitadas con pesos homogéneos (aproximadamente 200 ± 20 mg cada una) se sumergieron durante 10 min en 5 ml de volumen final de cada solución a ensayar y luego se secaron en papel filtro Whatman nº 1. Las garrapatas se colocaron en cajas Petri y se mantuvieron a 28 °C y 80 % de humedad relativa durante 24 h. Después de una semana, se registró el número de hembras ingurgitadas vivas o muertas y se calcularon los porcentajes de mortalidad. Se utilizó un experimento con tres repeticiones para cada prueba, así como para el testigo negativo (1,0% de etanol y 0,02% de solución de Triton X-100)30,31.
Determinación de la actividad acaricida
La mortalidad larvaria se corrigió utilizando la fórmula de Abbott según lo recomendado por la FAO32. Así, la mortalidad corregida (MC) se calculó de la siguiente manera: MC = [(% de mortalidad de la prueba − % de mortalidad del control)/100 − % de mortalidad del control] × 100, si la mortalidad del control era superior al 7 %, se anulaba la prueba de bioensayo y se repetía.
En este estudio, la actividad acaricida de los extractos se clasificó de la siguiente manera: Alta: (86-100 % de mortalidad); relativamente alta: (71-85 % de mortalidad); moderada: (56-70 % mortalidad); baja: (31-55% de mortalidad); y no significativa: (0-30% mortalidad)33-35.
Resultados
Para explorar el potencial acaricida de 18 plantas mexicanas, inicialmente, se evaluó la actividad larvicida de sus extractos metanólicos a una concentración de corte de 5.0% p/v. Los resultados revelaron que 5 extractos produjeron alta actividad (86-100 % de mortalidad), 3 extractos exhibieron actividad relativamente alta (71-85 % de mortalidad), 2 extractos mostraron actividad moderada (56-70 % de mortalidad), 2 extractos presentaron baja actividad (31-55 % de mortalidad) y 6 extractos mostraron actividad acaricida no significativa (0-30 % de mortalidad). Los extractos que inducían >56 % de mortalidad se analizaron posteriormente contra garrapatas ingurgitadas de R. microplus mediante una prueba de inmersión de adultos a una concentración de 5.0% p/v. Estos resultados mostraron que Annona globiflora, Annona scleroderma, Litchi chinensis y Azadirachta indica tienen las mejores actividades tanto en larvas como en garrapatas adultas (Cuadro 2). Se realizó una purificación biodirigida para identificar los principios activos responsables de la actividad acaricida en el extracto metanólico de A. indica. Inicialmente, los resultados del ensayo larvicida de las fracciones de Kupchan, Hex, DCM, EtOAc y MeOH/H2O, mostraron que la actividad se encontraba predominantemente en las fracciones de DCM y AcOEt. De este modo, se les realizó un estudio cromatográfico para identificar los compuestos activos. De la fracción de diclorometano se encontraron seis metabolitos: β-sitosterol (6), estigmasterol (7), glucósido de estigmasterol (8), trilinoleína (9), azadiractina A (10) y el éster diílico del ácido octadecanoico-tetrahidrofurano-3,4. (11). Además, 3-O-butil-(-)-epigalocatequina (1), 3-O-butil-(-)-epicatequina (2), (-)-epigalocatequina (3), (+)-galocatequina (4) , (-)-epicatequina (5) se aislaron de la fracción de acetato de etilo (Figura 2).
Cuadro 2 Efecto acaricida de los extractos de plantas mexicanas a una concentración de corte de 5.0% p/v
| Planta | Clave | Mortalidad de larvas (%) |
Mortalidad de adultas (%) |
|---|---|---|---|
| Annona globiflora | AGS | 100 | 100 |
| Annona scleroderma | ASS | 100 | 100 |
| Litchi chinensis | LCS | 91.6 ± 2.2 | 66.7 ± 5.8 |
| Inga jinicuil | IJS | 89.3 ± 4.8 | 26.7 ± 15.3 |
| Ensete ventricosum | EVS | 41.5 ± 13.7 | NP |
| Azadirachta indica | AIC | 84.9 ± 4.3 | 53.3 ± 11.5 |
| Salvia hispanica | SHS | 32.7 ± 12.4 | NP |
| Sterculia apetala | SAS | 1.4 ± 2.5 | NP |
| Citrus sinensis | CSR | 74.3 ± 7.9 | 10 ± 10 |
| Citrus paradisi | CPR | 84.4 ± 7.1 | 3.3 ± 5.8 |
| Citrus latifolia | CLR | 89.3 ± 4.2 | 16.7 ± 11.5 |
| Citrus medica | CMR | 56.7 ± 9.2 | 6.7 ± 5.8 |
| Mimosa pudica | MPW | 58.5 ± 9.1 | 0 |
| Heliotropium indicum | HIW | 0 | NP |
| Momordica charantia | MCW | 3.5 ± 6.1 | NP |
| Tagetes erecta | TEW | 0.3 ± 0.4 | NP |
| Tridax procumbens L. | TPW | 0 | NP |
| Randia aculeata | RAR | 1.1 ± 1.0 | NP |
| Amitraz1 | - | 63.2 ± 5.5 | 56.7 ± 5.8 |
± Desviación estándar. 1Probada a la concentración de 0.0002%. NP= no probado.
Con respecto al ensayo acaricida de los compuestos aislados sobre garrapatas hembra ingurgitadas, los resultados indicaron que los flavonoides 3-O-butil-(-)-epigalocatequina (1) y 3-O-butil-(-)-epicatequina (2) causaron mortalidad (36.7 y 43.3 %, respectivamente), mientras que los otros flavonoides evaluados, 3-5, no mostraron actividad a la concentración de 6 mM. De igual forma, los compuestos azadiractina A (10) (66.7 %) y el éster de ácido octadecanoico-tetrahidrofurano-3,4-diílico (11) (46.7%) muestran buena eficacia (Cuadro 3). Finalmente, se observó que los compuestos 3-7 no inducían actividad adulticida. Los compuestos 8 y 9 no pudieron probarse debido a la falta de material de muestra.
Cuadro 3 Actividad acaricida de los compuestos 1-11
| Compuesto | Mortalidad de adultas (%) |
Compuesto | Mortalidad de adultas (%) |
|---|---|---|---|
| 1 | 36.7 ± 5.8 | 7 | 0 |
| 2 | 43.3 ± 5.8 | 8 | NP |
| 3 | 0 | 9 | NP |
| 4 | 0 | 10 | 66.7 ± 5.8 |
| 5 | 0 | 11 | 46.7 ± 5.8 |
| 6 | 0 | Amitraz1 | 56.7 ± 5.8 |
± Desviación estándar. Los compuestos se ensayaron a una concentración de 6 mM.
1Probado a la concentración de 0.0002%. NP= no probada.
Discusión
Identificar el rango confiable del ensayo es esencial para las conclusiones de la presente investigación, especialmente cuando la resistencia de las garrapatas no depende solo de factores intrínsecos como su genética y fisiología, sino también de los factores bióticos y abióticos en el momento de la recolección. Es por ello por lo que se realizó el análisis de error estándar (EE) (material suplementario), en el cual se observó una variación ≤2.8 % en los cinco extractos que generan una alta mortalidad (86-100 %). Sin embargo, el EE se vuelve inversamente proporcional respecto a la mortalidad, es decir, a menor actividad aumenta el error estándar. El análisis del EE sugiere que la variación en evaluaciones futuras de los extractos de las 18 plantas examinadas será inferior al 5 % a una concentración con mortalidad alta (Figura 3).
En términos generales, los resultados combinados de actividad adulticida y larvicida indicaron que los extractos metanólicos de Annona globiflora, Annona scleroderma, Litchi chinensis y Azadirachta indica tienen la mejor efectividad. El género Annona se ha convertido en un prolífico productor de interesantes compuestos con gran actividad biológica36,37. Las actividades acaricidas de los extractos de A. globiflora y A. scleroderma posiblemente estén relacionadas con la presencia de acetogeninas, los principales constituyentes químicos de la familia Annonaceae, que se ha encontrado que tienen una potente actividad plaguicida contra una variedad de artrópodos38. Estos resultados concuerdan con la actividad larvicida reportada para extractos etanólicos de semillas de A. squamosa contra R. microplus39. En el caso de las semillas de L. chinensis, estudios previos han demostrado que esta planta presenta importantes actividades antimicrobianas, antioxidantes y anticancerígenas40, aunque este es el primer reporte de su actividad acaricida. Se ha identificado una gran cantidad de compuestos con una diversidad estructural y farmacológica significativa de A. indica. Sin embargo, la actividad acaricida del árbol del neem ha sido atribuida a la presencia de azadiractina A (10), aunque existen algunos reportes que contradicen lo anterior41,42. De la corteza del tallo de Azadirachta indica se aislaron once compuestos mayoritarios, entre los que se encuentra la azadirachtina A (10). El ensayo acaricida por inmersión de adultos de estos compuestos reveló que, además de la azadiractina A (10), algunos otros compuestos mostraron un efecto acaricida, como 3-O-butil-(-)-epigalocatequina (1), 3-O-butil-(-)-epicatequina (2) y éster de ácido octadecanoico-tetrahidrofurano-3,4-diílico (11).
En relación con los flavonoides 1-5, los resultados indicaron que solo los flavonoides 3-O-butil-(-)-epigalocatequina (1) y 3-O-butil-(-)-epicatequina (2) causaron mortalidad (36.7 y 43.3 %, respectivamente) a una concentración de 6 mM. Con base a estos resultados, parece claro que el fragmento de éter butílico es esencial para la actividad de 1 y 2. Dichos fragmentos de éter butílico conducen a un aumento en las propiedades de liposolubilidad de estos metabolitos con respecto a los compuestos 3-5, estructuralmente relacionados. En efecto, la lipofilia es una de las propiedades físicas más importantes en el descubrimiento de fármacos, ya que interviene en la farmacodinámica, farmacocinética y toxicidad de muchos compuestos43. Por ejemplo, Echeverría et al44 y Cen-Pacheco et al24 reportaron que la actividad bactericida y acaricida de los flavonoides está asociada con un rango estrecho de valores de lipofilicidad (LogP entre 1.5 y 3.0).
Conclusiones e implicaciones
La evaluación de 18 plantas mexicanas contra larvas y garrapatas adultas de R. microplus indicó que los extractos metanólicos de A. globiflora, A. scleroderma, L. chinensis y A. indica o sus mezclas tienen gran potencial para ser utilizados como alternativa en el control de R. microplus. En general, las actividades plaguicidas de A. indica están asociadas con la azadiractina A (10), que es el compuesto insecticida más conocido de esta planta. Sin embargo, aquí se reportaron tres nuevos compuestos adulticidas del árbol neem identificados como 3-O-butil-(-)-epigalocatequina (1), 3-O-butil-(-)-epicatequina (2) y ácido octadecanoico-tetrahidrofurano-3,4-diil éster (11); lo anterior indica que la corteza de A. indica es una gran fuente de compuestos acaricidas con gran diversidad estructural. El uso de estos compuestos puede representar una nueva estrategia para el control de las zoonosis por R. microplus. Desde el punto de vista químico, también es importante destacar que 1 y 2 tienen un grupo butil éter que, además de ser poco común en la naturaleza, aumenta la liposolubilidad y su actividad acaricida.
Agradecimientos
Este trabajo fue apoyado por el Gobierno del estado de Veracruz de Ignacio de la Llave y por el Consejo Veracruzano de Investigación Científica y Desarrollo Tecnológico ‒ [COVEICyDET, número de concesión 14 1953/2021]. J.S.R. agradece a la fundación CONACyT por una beca (1075240). Al Dr. Fernando Nicolalde-Morejón por la identificación de las plantas.
REFERENCIAS
1. Nunes de Santana CR, Nascimento LCB, Passos OA, Albano AAP, Fitzgerald BA, Barreto AP, et al. Acaricidal properties of vetiver essential oil from Chrysopogon zizanioides (Poaceae) against the tick species Amblyomma cajennense and Rhipicephalus (Boophilus) microplus (Acari: Ixodidae). Vet Parasitol 2015;212(3-4):324-330. http://dx.doi.org/10.1016/j.vetpar.2015.08.022. [ Links ]
2. Rodríguez-Vivas RI, Apanaskevich DA, Ojeda-Chi MM, Trinidad-Martínez I, Reyes-Novelo E, Esteve-Gassent MD, Pérez de León AA. Ticks collected from humans, domestic animals, and wildlife in Yucatan, Mexico. Vet Parasitol 2016;15(215):106-113. http://dx.doi.org/10.1016/j.vetpar.2015.11.010. [ Links ]
3. Fouche G, Ramafuthula M, Maselela V, Mokoena M, Senabe J, Leboho T, et al. Acaricidal activity of the organic extracts of thirteen South African plants against Rhipicephalus (Boophilus) decoloratus (Acari: Ixodidae). Vet Parasitol 2016;224:324-330. http://dx.doi.org/10.1016/j.vetpar.2016.05.011. [ Links ]
4. Rodriguez-Vivas RI, Jonsson NN, Bhushan C. Strategies for the control of Rhipicephalus microplus ticks in a world of conventional acaricide and macrocyclic lactone resistance. Parasitol Res 2018;117(1):3-29. http://dx.doi.org/10.1007/s00436-017-5677-6. [ Links ]
5. Perez-Cogollo LC, Rodriguez-Vivas RI, Ramirez-Cruz GT, Rosado-Aguilar JA. Survey of Rhipicephalus microplus resistance to ivermectin at cattle farms with history of macrocyclic lactones use in Yucatan, Mexico. Vet Parasitol 2010;172:109-113. http://dx.doi.org/10.1016/j.vetpar.2010.04.030. [ Links ]
6. Fernández-Salas A, Rodríguez-Vivas RI, Alonso-Díaz MA. First report of a Rhipicephalus microplus tick population multi-resistant to acaricides and ivermectin in the Mexican tropic. Vet Parasitol 2012;183(3-4):336-342. http://dx.doi.org/10.1016/j.vetpar.2011.07.028. [ Links ]
7. Rodríguez-Vivas RI, Miller RJ, Ojeda-Chi MM, Rosado-Aguilar JA, Trinidad-Martínez IC, Pérez de León AA. Acaricide and ivermectin resistance in a field population of Rhipicephalus microplus (Acari: Ixodidae) collected from red deer (Cervus elaphus) in the Mexican tropics. Vet Parasitol 2014;200(1-2):179-188. http://dx.doi.org/10.1016/j.vetpar.2013.11.025. [ Links ]
8. Magadum S, Mondal DB, Ghosh S. Comparative efficacy of Annona squamosa and Azadirachta indica extracts against Boophilus microplus Izatnagar isolate. Parasitol Res 2009;105:1085-1091. http:// dx.doi.org/10.1007/s00436-009-1529-3. [ Links ]
9. Borges LMF, Sousa LAD, Barbosa CS. Perspectives for the use of plant extracts to control the cattle tick Rhipicephalus (Boophilus) microplus. Rev Bras Parasitol Vet 2011;20:89-96. http://dx.doi.org/10.1590/S1984-29612011000200001. [ Links ]
10. Benelli G, Pavela R, Canale A, Mehlhorn H. Tick repellents and acaricides of botanical origin: a green roadmap to control tick-borne diseases? Parasitol Res 2016;115:2545-2560. http:// dx.doi.org/10.1007/s00436-016-5095-1. [ Links ]
11. Adenubi OT, Fasina FO, McGaw LJ, Eloff JN, Naidoo V. Plant extracts to control ticks of veterinary and medical importance: A review. S African J Bot 2016;105:178-193. http://dx.doi.org/10.1016/j.sajb.2016.03.010. [ Links ]
12. Pavela R, Canale A, Mehlhorn H, Benelli G. Application of ethnobotanical repellents and acaricides in prevention, control and management of livestock ticks: A review. Res Vet Sci 2016;109:1-9. http://dx.doi.org/10.1016/j.rvsc.2016.09.001. [ Links ]
13. Newman DJ, Cragg GM. Natural products as sources of new drugs from 1981 to 2014. J Nat Prod 2016;79(3):629-661. https://doi.org/10.1021/acs.jnatprod.5b01055. [ Links ]
14. Carroll AR, Copp BR, Davis RA, Keyzers RA, Prinsep MR. Marine natural products. Nat Prod Rep 2021;38(2):362-413 and previous articles in the same series. https://doi.org/10.1039/D0NP00089B. [ Links ]
15. Misra R. Modern drug development from traditional medicinal plants using radioligand receptor-binding assays. Med Res Rev 1998;6(18):383-402. https://doi.org/10.1002/(SICI)1098-1128(199811)18:6%3C383::AID-MED3%3E3.0.CO;2-A. [ Links ]
16. Phillipson JD. Phytochemistry and medicinal plants. Phytochemistry 2001;56(3):237-43. https://doi.org/10.1016/s0031-9422(00)00456-8 . [ Links ]
17. Anand U, Jacobo-Herrera N, Altemimi A, Lakhssassi N. A Comprehensive review on medicinal plants as antimicrobial therapeutics: potential avenues of biocompatible drug discovery. Metabolites 2019;9(11):258. https://doi.org/10.3390/metabo9110258 . [ Links ]
18. Atawodi SE, Atawodi JC. Azadirachta indica (neem): a plant of multiple biological and pharmacological activities. Phytochem Rev 2009;8:601-620. https://doi.org/10.1007/s11101-009-9144-6. [ Links ]
19. Van der Nat JM. Van der Sluis W G, Silva KT, Labadie RP. Ethnopharmacognostical survey of Azadirachta indica A. Juss (Meliaceae). J Ethnopharmacol 1991;35(1):1-24. https://doi.org/10.1016/0378-8741(91)90131-v . [ Links ]
20. Patil SM, Shirahatti PS, Chandana KVB, Ramu R, Nagendra PMN. Azadirachta indica A. Juss (neem) as a contraceptive: an evidence-based review on its pharmacological efficiency. Phytomedicine 2021;15(88):153596. https://doi.org/10.1016/j.phymed.2021.153596. [ Links ]
21. Sultana B, Anwar F, Przybylsky R. Antioxidant activity of phenolic components present in barks of Azadirachta indica, Terminalia arjuna, Acacia nilotica, and Eugenia jambolana Lam. Trees. Food Chem 2007;104:1106-1114. https://doi.org/10.1016/j.foodchem.2007.01.019 . [ Links ]
22. Kitdamrongtham W, Ishii K, Ebinab K, Zhang J, Ukiya M, Koike K, Akazawaa H, Manosroia A, Manosroi J, Akihisa T. Limonoids and flavonoids from the flowers of Azadirachta indica var. siamensis, and their melanogenesis-inhibitory and cytotoxic activities. Chem & Biodiversity 2014;11:73-84. https://doi.org/10.1002/cbdv.201300266 [ Links ]
23. Kanwal Q, Hussain I, Siddiqui HL, Javaid A. Antimicrobial activity screening of isolated flavonoids from Azadirachta indica leaves J Serbian Chem Soc 2011;76(3):375-384. https://doi.org/10.2298/JSC100406027K. [ Links ]
24. Cen-Pacheco F, Ortiz-Celiseo A, Peniche-Cardeña A, Bravo-Ruiz O, López-Fentanes FC, Valerio-Alfaro G, Fernández JJ. Studies on the bioactive flavonoids isolated from Azadirachta indica. Nat Prod Res 2020;5:1-9. https://doi.org/10.1080/14786419.2019.1579808. [ Links ]
25. Kupchan SM, Tsou G, Sigel CW. Datiscacin, a novel cytotoxic cucurbitacin 20-acetate from Datisca glomerata. J Org Chem 1973;38(7):1420-1421. https://doi.org/10.1021/jo00947a041. [ Links ]
26. Ortiz-Celiseo A, Valerio-Alfaro G, Sosa-Rueda J, López-Fentanes FC, Domínguez-Melendez V, Cen-Pacheco F. Ectyoplasin, a novel cytotoxic cyclic peptide from Ectyoplasia ferox sponge. Nat Prod Res 2021; Published online. https://doi.org/10.1080/14786419.2021.1902326 . [ Links ]
27. Cen-Pacheco F, Valerio-Alfaro G, Santos-Luna D, Fernández JJ. Sclerin, a new cytotoxic cyclononapeptide from Annona scleroderma. Molecules 2019;24(3):554. https://doi.org/10.3390/molecules24030554. [ Links ]
28. Shaw RD, Cook M, Carson RE. Developments in the resistance status of the southern cattle tick to organophosphorus and carbamate insecticides. J Econ Entomol 1968;61:1590-1594. https://doi.org/10.1093/jee/61.6.1590. [ Links ]
29. Fernández-Salas A, Rodríguez-Vivas I, Alonso-Díaz MA. Resistance of Rhipicephalus microplus to amitraz and cypermethrin in tropical cattle farms in Veracruz, Mexico. J Parasitol 2012;98(5):1010-1014. https://doi.org/10.1645/GE-3074.1. [ Links ]
30. FAO. Food Agriculture Organization of the United Nation. Module 1. Ticks: Acaricides resistance: Diagnosis management and prevention in: Guidelines resistance management and integrated parasite control in ruminants. FAO Animal Production and Health Division, Rome. 2004. https://www.fao.org/3/ag014e/ag014e.pdf. [ Links ]
31. Drummond RO, Ernst SE, Trevino JL, Gladney WJ, Graham OH. Boophilus annulatus and Boophilus microplus: laboratory tests for insecticides. J Econ Entomol 1973;66(1):130-133. https://doi.org/10.1093/jee/66.1.130. [ Links ]
32. Abbott WS. A method of computing the effectiveness of an insecticides. J Econ Entomol 1925;18(2):265-267. https://doi.org/10.1093/jee/18.2.265a. [ Links ]
33. Chungsamarnyart N, Jiwajinda S, Jansawan W. Larvicidal effect of plant crude-extracts on the tropical cattle tick (B. microplus). Thailand. Kasetsart J Nat Sci 1991;25(5):80-89. [ Links ]
34. Rosado-Aguilar JA, Aguilar-Caballero A, Rodríguez-Vivas RI, Borges-Argaez R, García-Vázquez Z, Méndez-González M. Screening of the acaricidal efficacy of phytochemical extracts on the cattle tick Rhipicephalus (Boophilus) microplus (acari: ixodidae) by larval immersion test. Trop Subtrop Agroecosyst 2010;12(2):417-422. https://www.revista.ccba.uady.mx/ojs/index.php/TSA/article/download/358/362. [ Links ]
35. Arceo-Medina GN, Rosado-Aguilar JA, Rodríguez-Vivas RI, Borges-Argaez R. Synergistic action of fatty acids, sulfides, and stilbene against acaricide-resistant Rhipicephalus microplus ticks. Vet Parasitol 2016;228:121-125. http://dx.doi.org/10.1016/j.vetpar.2016.08.023. [ Links ]
36. Sosa-Rueda J, Domínguez-Meléndez V, Ortiz-Celiseo A, López-Fentanes FC, Cuadrado C, Fernández JJ, Hernández Daranas A, Cen-Pacheco F. Squamins C-F, four cyclopeptides from the seeds of Annona globiflora. Phytochemistry 2022;194:112839. https://doi.org/10.1016/j.phytochem.2021.112839. [ Links ]
37. Rodríguez-Expósito RL, Sosa-Rueda J, Reyes-Batlle M, Sifaoui I, Cen-Pacheco F, Hernández Daranas A, Díaz-Marrero AR, Piñero JE, Fernández JJ, Lorenzo-Morales J. Antiamoeboid activity of squamins C-F, cyclooctapeptides from Annona globifora. Int J Parasitol Drugs Drug Resist 2021;17:67-79. [ Links ]
38. Bhavani Shankaram AV, Marthanda Murthy M, Manohar Akkewar D, Subramanyam M, Narasimha Rao A. Compound iso-squamocin obtained from seeds of Annona squamosa and composition containing the same. Patent US6991818B2 2006. [ Links ]
39. Chungsamarnyart N, Jiwajinda S, Jansawan W, Kaewsuwan U, Burnasilpin P. Effective plant crude-extracts on the tick (Boophilus microplus) larvicidal action. Kasetsart J Nat Sci 1988;22:37-41. https://li01.tci-thaijo.org/index.php/anres/article/view/242564/165442. [ Links ]
40. Emanuele S, Lauricella M, Calvaruso G, D’Anneo A, Giuliano M. Litchi chinensis as a functional food and a source of antitumor compounds: an overview and a description of biochemical pathways. Nutrients 2017;8;9(9):pii-E992. https://doi.org/10.3390/nu9090992. [ Links ]
41. Isman MB, Koul O, Luczynski A, Kaminskis J. Insecticidal and antifeedant bioactivities of neem oils and their relationship to azadirachtin content. J Agric Food Chem 1990;38:1406-1411. https://doi.org/10.1021/jf00096a024. [ Links ]
42. Walton SF, Myerscough MR, Currie BJ. Studies in vitro on the relative efficacy of current acaricides for Sarcoptes scabiei var. hominis. Trans R Soc Trop Med Hyg 2000;94: 9296. https://doi.org/10.1016/S0035-9203(00)90454-1. [ Links ]
43. Kadela-Tomanek M, Jastrzębska M, Chrobak E, Bębenek E, Boryczka S. Chromatographic and computational screening of lipophilicity and pharmacokinetics of newly synthesized betulin-1,4-quinone hybrids. Processes 2021;9(2):376. https://doi.org/10.3390/pr9020376. [ Links ]
44. Echeverría J, Opazo J, Mendoza L, Urzúa A, Wilkens, M. Structure-activity and lipophilicity relationships of selected antibacterial natural flavones and flavanones of chilean flora. Molecules 2017;2(4):608. https://doi.org/10.3390/molecules22040608. [ Links ]
Recibido: 24 de Mayo de 2022; Aprobado: 29 de Noviembre de 2022











 text in
text in