Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista mexicana de ciencias pecuarias
On-line version ISSN 2448-6698Print version ISSN 2007-1124
Rev. mex. de cienc. pecuarias vol.14 n.2 Mérida Apr./Jun. 2023 Epub June 26, 2023
https://doi.org/10.22319/rmcp.v14i2.6277
Artículos
Caracterización del suero bovino fetal proveniente de la industria cárnica mexicana en el cultivo celular
a Universidad Autónoma de Aguascalientes. Centro de Ciencias de la Salud. Maestría en Investigación Biomédica. Aguascalientes, México.
b Universidad Autónoma de Aguascalientes. Centro de Ciencias de la Salud. Unidad Médico-Didáctica, Departmento de Estomatología. Aguascalientes, México.
c Universidad Autónoma de Aguascalientes. Centro de Ciencias de la Salud. Departamento de Nurición. Aguascalientes, México.
El suero bovino fetal (FBS por sus siglas en inglés) es el suplemento más utilizado para el cultivo celular, ya que su compleja composición aporta los nutrientes necesarios para el crecimiento de la mayoría de las células. Es un subproducto de la industria cárnica, y su disponibilidad y producción dependen principalmente de dos factores externos incontrolables: las condiciones climáticas y los cambios en el consumo de carne vacuna. Se hizo una caracterización de un FBS que se obtuvo de la industria cárnica para su uso en el cultivo celular. Se realizaron pruebas de proteínas totales, osmolaridad, presencia o ausencia de agentes biológicos patógenos, pH, concentración de ADN, contaminantes biológicos, resultados negativos y viabilidad celular, siguiendo los estrictos lineamientos de calidad de la International Serum Industry Association (ISIA). Se compararon el FBS y el plasma derivados de la sangre de la industria cárnica con un FBS comercial. Se observaron diferencias entre los FBS en cuanto a las concentraciones de ADN y de proteína total, pero no para la osmolaridad y el pH. A pesar de las diferencias, la prueba de viabilidad no arrojó complicación para el crecimiento celular con cualquier de los sueros y el plasma. El suero obtenido de la industria cárnica podría mantener cultivos celulares y permitir la proliferación celular de manera indistinta del suero comercial. Además, si no se dispone de FBS, el plasma puede funcionar como sustituto para el mantenimiento de los cultivos celulares.
Palabras clave Suero bovino fetal; Suplemento; Producción; Estéril; International Serum Industry Association
The present work aims to characterize a fetal bovine serum (FBS) obtained from the meat industry for use in cell culture. FBS is the most widely used supplement for cell culture since its complex composition provides the necessary nutrients for the growth of most cells. It is a by-product of the meat industry, and its availability and production depend mainly on two uncontrollable external factors, climatic conditions and changes in beef consumption. According to the strict quality features of the International Serum Industry Association (ISIA), tests for total proteins, osmolarity, presence or absence of pathogenic biological agents, pH, DNA concentration, biological contaminants, negative results, and cell viability were performed. The characterization of the serum in the DNA and total protein concentration tests showed significant differences. Additionally, osmolarity and pH did not present significant differences between groups. Regarding the viability test, no complication for cell growth was observed despite the differences found in the characterization. The results showed that the serum obtained from the meat industry could maintain cell cultures and allow cell proliferation compared to commercial serum. Furthermore, if FBS is not available, some kinds of plasma can be used as a surrogate to maintain cell cultures.
Key words Fetal bovine serum; Supplement; Production; Sterile; International Serum Industry Association
Introducción
El cultivo celular comenzó a principios del siglo XX como un método para estudiar el comportamiento de las células animales, aislado de las variaciones sistémicas que pueden ocurrir in vivo. Se puede definir el cultivo celular como la adquisición de células animales y su propagación in vitro1. La preservación de la mayor parte de las propiedades fisiológicas, bioquímicas y genéticas de células de órganos específicos en un ambiente artificial requiere de técnicas de congelación, descongelación, siembra y tripsinización que permitan su mantenimiento, supervivencia y multiplicación2,3.
Se utilizan los cultivos celulares en la investigación básica y aplicada, y se pueden clasificar en tres tipos: monocapa, suspensión y tridimensional4,5. Para evitar su contaminación, es común que se trabajen los cultivos celulares en un ambiente completamente estéril6. Se deben mantener las mismas condiciones estériles con todos los reactivos que intervienen con el medio de cultivo (por ejemplo, el suero fetal bovino, antimicóticos, entre otros)7,8.
El suero fetal bovino (FBS por sus siglas en inglés) es el principal suplemento usado en los medios de cultivo, ya que aporta más de mil componentes nutricionales para las células. Estos incluyen aminoácidos, proteínas, vitaminas (particularmente vitaminas liposolubles como las A, D, E y K), carbohidratos, lípidos, hormonas, factores de crecimiento, minerales y oligoelementos9. Los tampones de suero inactivan las enzimas proteolíticas del medio de cultivo, aumentan la viscosidad promedio y mantienen las condiciones adecuadas sobre la superficie de crecimiento en el recipiente de cultivo10,11.
El uso del FBS para la investigación, diagnóstico y manufactura farmacéutica ha hecho que su producción sea un negocio internacional que representa un impacto económico significativo (por. ej.: en el año 2022 una unidad de 500 ml FBS marca SIGMA® cuesta 17,724.63 pesos mexicanos). La creciente demanda global crea oportunidades para la producción del FBS para mercados tantos nacionales como internacionales12. México cuenta con 35 millones de cabezas de ganado, de las cuales aproximadamente 13 millones se crían en pastoreo libre, resaltando la posibilidad de que hasta una de cada ocho vacas procesadas en los mataderos llegue preñada13-15. Considerando la potencial materia prima disponible, la producción de FBS en México es una opción factible16,17. Esto es importante para los usuarios en México, ya que se puede disminuir el suministro en el país por el cierre de fronteras o problemas de regulación sanitaria que impidan la importación de reactivos potencialmente contaminados. El objetivo del presente estudio fue caracterizar un FBS producido de suero proveniente de la industria cárnica en México, compararlo con un suero comercial de acuerdo con las pruebas solicitadas por la International Serum Industry Association (ISIA) y evaluar su aptitud de uso en el cultivo celular.
Material y métodos
Este estudio consistió en la obtención de FBS para cultivo celular, su caracterización y su comparación in vitro con los parámetros de un FBS comercial. La caracterización incluyó la microfiltración, el pH, la osmolaridad, la concentración de proteína total, la presencia/ausencia de Mycoplasma sp., la proliferación celular y la concentración de ADN. Se usó un FBS comercial como control (F2442, suero bovino fetal, cultivo de células de insectos y mamíferos probado, 17L436 de SIGMA®). Se respetaron en todo momento los lineamientos del reglamento de ética para el uso de animales en la docencia e investigación de la Universidad Autónoma de Aguascalientes (CEADI-UAA) y la Norma Oficial Mexicana NOM-024-ZOO-1995, “Especificaciones y características zoosanitarias para el transporte de animales, sus productos y subproductos, productos químicos, farmacéuticos, biológicos y alimenticios para uso en animales o consumo por estos”.
Recolección de sangre fetal bovino y separación del suero
Se recibió un lote de suero de una empresa cárnica (Frigorífico y Empacadora de Aguascalientes S.A. de C.V. - FREASA) lo cual se recolectó por personal capacitado. Se trasladó al laboratorio en condiciones de congelación (-20 °C) para su posterior procesamiento. La sangre se obtuvo mediante la técnica de punción cardíaca18. Se recolectó en tubos Falcon® estériles de 30 ml y una bolsa de contención de sangre de 500 ml con anticoagulante (bolsa ACD BLORECEP de 500 ml con 2.20 g de citrato trisódico, 0.80 g de ácido cítrico, 2.45 g de dextrosa y H2O libre de pirógenos). Se centrifugó la sangre a 3,000 rpm durante 5 min19,20, se extrajo el suero y se colocó en tubos Falcon® de 30 ml. Se tomaron alícuotas del suero en tubos y se almacenaron a -20 °C hasta su uso. Al realizar el proceso de la separación de hemocomponentes se obtuvieron dos muestras: el suero (centrifugación de muestra de sangre sin anticoagulante) y el plasma (centrifugación de muestra de sangre con anticoagulante). La diferencia entre las muestras es la presencia/ausencia de las proteínas responsables de los procesos de coagulación21,22. Con base en las muestras recolectadas, se definieron tres grupos experimentales: el grupo control, FBS comercial (C-FBS); un grupo experimental del suero obtenido de la industria cárnica (E-FBS); y uno del plasma obtenido de la industria cárnica (E-Plasma).
Filtración del FBS para la eliminación de los componentes celulares
Se eliminaron los componentes celulares del suero por medio de la microfiltración con el uso de filtros de jeringas de 0.2 µm. Se aplicó el mismo proceso de filtración a todos los grupos [C-FBS (F1), E-FBS (F1), and E-Plasma (F1)], y se guardaron las muestras procesadas en nuevos tubos de 2 ml.
Evaluación de la esterilidad por medio de pruebas microbiológicas
Se utilizó caldo de soya (BD Bioxon®, Becton Dickinson de México) en el ensayo de esterilidad, siguiendo las instrucciones del fabricante. Se prepararon seis tubos con caldo de soya a los que se añadieron 200 µl de C-FBS, E-FBS o E-Plasma sin filtrar, además de un tubo de control positivo (saliva humana). Se colocaron los tubos en una estufa bacteriológica a 37 °C durante 24 h.
Presencia/ausencia de Mycoplasma sp.
Se realizó una prueba de la presencia/ausencia de Mycoplasma sp. sobre medio de crecimiento selectivo con Mycoplasma sp. agar (MO660-500G de SIGMA). Se prepararon 100 ml del medio para 15 cajas de Petri pequeñas. Según las instrucciones del fabricante, se sembraron siete cajas con hisopos estériles, y luego se sembró un control positivo (un raspado de la epidermis facial) y las muestras. Una vez preparadas las cajas, se colocaron en una estufa bacteriológica a 37 °C durante 24 h.
Evaluación del pH
Se cuantificó el pH por medio de tiras reactivas (Hydrion® 9400, Plastic pH Indicator Strips, pH rango 5.0-9.0) y basado en una escala colorimétrica. Se evaluaron los mismos grupos descritos anteriormente; los grupos de FBS se evaluaron con la dilución del medio de cultivo.
Preparación de las muestras de dilución para la medición de la concentración de proteína total y la concentración de ADN
Para llevar a cabo la medición de la concentración de proteína total y la concentración de ADN, se diluyeron las muestras hasta una concentración final de 1,030 µg/ml; esto es un factor de dilución (FD) de 32, es decir, se diluyó 32 veces la concentración del FBS. Se calculó el FD con la formula siguiente: FD= CI / CF, donde: FD= factor de dilución; CI= concentración inicial; CF= concentración final.
Concentración total de proteína
Se hizo la medición de las proteínas totales basado en el método colorimétrico de Pierce y usando un kit comercial de proteínas (PierceTM BCA Protein Assay Kit, ref. 23227, Thermoscientific®). Siguiendo el protocolo propuesto por el fabricante, se prepararon el reactivo de trabajo, las muestras y la curva de calibración. Brevemente, se pipetearon 25 µl de cada estándar o desconocido por réplica (tres réplicas) en cada pocillo de la placa. Se agregaron 200 µl del reactivo de trabajo y se incubó a 37 °C por 2 h. Las lecturas se realizaron a 620 nm, en un lector de placas de 96 pozos (Multiskan FC, SN 357-914771, Thermoscientific®).
Concentración de ADN
La cuantificación de la concentración de ADN se hizo con un equipo Nanodrop siguiendo el método de extracción Fenol-Cloroformo, el cual se divide en tres pasos:
1. Lisis celular. La muestra se centrifugó durante 5 min a 270 xg, y se descartó el sobrenadante. El sedimento se resuspendió en 100 µl de PBS. La muestra se incubó a -80 °C durante 30 min, se transfirió a un sonicador y se aplicó a 20 kilohertzio en dos tiempos de 10 s para romper las células. Después de la lisis, se centrifugaron las muestras a 10,000 xg durante 20 min, y se trasladó el sobrenadante a un nuevo tubo Eppendorf® estéril para continuar con la segunda fase.
2. Separación de fases. Al sobrenadante se añadieron 250 µl de fenol-cloroformo y se pasó por un proceso de vórtice continuo. Se centrifugó esta mezcla a 10,000 xg durante 5 min hasta observar una separación de dos fases. La fase superior se usó en el siguiente paso.
3. Purificación del ADN. Se añadieron 200 µl de cloroformo a las muestras y se centrifugaron a 10,000 xg durante 10 min. Se transfirió el sobrenadante a un tubo nuevo. A los sobrenadantes se añadió 1/10 de volumen de acetato de sodio 3 M y dos volúmenes de etanol al 100 %. Se dejaron precipitar durante la noche a -80 °C. Una vez finalizadas, se centrifugaron las muestras a 10,000 xg durante 30 min a 4 °C, y se extrajo el sobrenadante. Al resto del contenido del tubo se añadieron 100 µl de etanol al 70% y se centrifugó durante 10 min a 10,000 xg. Para limpiar el material genético se repitieron los pasos de la adición de etanol al 70 % y el centrifugado de 2 a 3 veces. Se eliminó la mayor cantidad de sobrenadante posible y se dejó evaporar el etanol restante. Se resuspendió el material genético en 100 µl de agua de grado Milli-Q y se realizaron lecturas de ácido nucleico en un espectrofotómetro (Nanodrop 2000, Thermoscientific).
Osmolaridad
La osmolaridad se midió con un osmómetro (Modelo 5004 Automatic Osmometer, Precision Systems). Después de calibrar el equipo y seleccionar el rango, se midió 100 µl de muestra en un tubo Eppendorf®.
Proliferación celular
Se medió la proliferación celular utilizando un medio de cultivo DMEM bajo en glucosa con L-glutamina y piruvato de sodio (Biowest®). Se añadió a este medio una solución antibiótica/antifúngica (A5955, Sigma®) así como FBS comercial (el suero de control; F2442, Sigma®). Se prepararon tres tipos de medios: suero comercial (C-FBS), suero de la industria cárnica (E-FBS), y plasma de la industria cárnica (E-Plasma).
La prueba de viabilidad celular se llevó a cabo con un kit comercial (MTT Assay Kit, Abcam®) y placas de 96 pocillos. Se utilizó la línea hFOB 1.19 ATCC de osteoblastos con una siembra inicial de 1,000 células. Los osteoblastos son un tipo de célula sin requerimientos específicos para el crecimiento y proliferación, aunque para los fines del presente estudio se aplicaron las condiciones estándar para el cultivo celular: 37 °C, atmósfera de 5 % CO2, 95 % aire9. Se realizaron mediciones a los 3, 7, 14 y 21 días para cuantificar el crecimiento celular. Se leyeron las placas en un lector de placas de 96 pocillos (Multiskan FC, SN 357-914771, Thermoscientific®) a 620 nm.
Análisis estadísticos
Se calcularon las medias, medianas y la desviación estándar de los resultados. La distribución de normalidad de los datos se evaluó con una gráfica Q-Q, y la homogeneidad de la varianza con la prueba de Levene. Si los datos cumplieron con el supuesto estadístico, se aplicó una prueba ANOVA de dos colas o de una vía. Para evaluar la cinética de proliferación celular se utilizó una prueba de razón de verosimilitud (RV) para comparar las curvas cinéticas. Se llevaron a cabo los análisis estadísticos con el programa estadístico R versión 4.0.3, considerando un nivel de confianza del 95%.
Resultados
Se verificó la condición del suero por medio de una caracterización general del E-FBS. Se tomó la muestra de un feto, desde luego algunos de los parámetros pueden estar fuera de los límites establecidos para un organismo adulto (Cuadro 1).
Cuadro 1 Características del E-FBS de la industria cárnica
| Características | Valor | Valor de referencia |
|---|---|---|
| Color | Ámbar | Ámbar |
| Glucosa, mg. dl | 37 | 80-120 mg. dl |
| Creatinina, mg. dl | 2.73 | 1.2-1.9 mg. dl |
| Ácido úrico, mg. dl | 2.0 | 1.21-3.47 mg. dl |
| Fósforo, mg. dl | 10.5 | 2.5-5.0 mg. dl |
| Calcio, mg. dl | 16 | 12.0-14.0 mg. dl |
| Bilirrubina, mg. dl | 0.8 | 0.2-0.5 mg. dl |
| ALT, U/L | 8 | 11-40 U/L |
| ALP, U/L | 280 | 86-285 U/L |
| Proteínas totales, g. dl | 3.81 | 6.0-8.0 g. dl |
| Albumina, g. dl | 2.63 | 2.5-3.5 g. dl |
| Hierro en suero, Ug. dl | 169 | 37-170 Ug. dl |
| Amilasa en suero, U/L | 49 | 30-110 U/L |
| Globulina, g. dl | 1.18 | 2.5-4.5 g. dl |
| Índice aterogénico | 3.6 | 0-5 |
Este resumen de las características del FBS de la industria cárnica se llevó a cabo por una empresa externo y funciona como apoyo para los resultados obtenidos. ALT= alanina-aminotransferasa; ALP= fosfatasa alcalina.
Evaluación de la esterilidad por pruebas microbiológicas
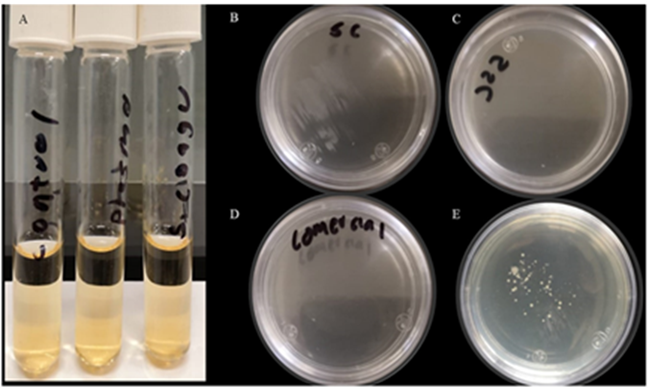
Se hicieron dos pruebas microbiológicas para confirmar la esterilidad de las muestras, una en el momento de la colecta de las muestras y otra después de un mes de almacenamiento a - 20 °C. En la primera, no se observó crecimiento microbiológico en las muestras después de una incubación a 37 °C por 24 h (Figure 1A). Tampoco a un mes las muestras evidenciaron crecimiento, aunque, como es de esperar, la muestra de saliva mostró la turbidez característica del crecimiento microbiológico. Ninguna de los sueros o el plasma mostraron la presencia de Mycoplasma sp. en el agar (Figuras 1B, C y D). Este coincide con las pruebas microbiológicas, pero la muestra de la piel si mostró el crecimiento de este microorganismo (Figura 1E).
Concentración de ADN
Hubo diferencias en la concentración de ADN entre los grupos y entre las muestras filtradas y no filtradas (P<0.05, Cuadro 2). De las muestras no filtradas, no hubo diferencia entre la E-Plasma and el C-FBS, pero si hubo entre el E-Plasma y el E-FBS y entre el E-FBS y el C-FBS.
Cuadro 2 Resumen de los datos estadísticos
| Variable | Grupos Exp. | Medio ± DE | ANOVA valor de P | 1 vs 1 | Cohen d | Tukey valor de P |
|---|---|---|---|---|---|---|
| Concentración ADN (ng/µl) | C-FBS | 9.46 ± 0.358 | <0.00001 | C-FBS vs E-FBS |
1.3400 | 0.21777 |
| E-FBS | 2.88 ± 0.303 | |||||
| E-Plasma | 9.60 ± 0.860 | E- FBS vs E-Plasma |
3.0400 | 0.00434 | ||
| C-FBS (F1) | 6.16 ± 0.167 | |||||
| E-FBS (F1) | 7.50 ± 2.04 | E-Plasma vs C-FBS |
-1.7000 | 0.10154 | ||
| E-Plasma (F1) | 4.46 ± 0.288 | |||||
| Concentración de proteína total (g/dl) |
C-FBS | 0.744 ± 0.0322 |
<0.001 | C-FBS vs E-FBS |
-0.06688 | 0.00172 |
| E-FBS | 0.677 ± 0.0238 |
E-FBS vs E-Plasma |
-0.00390 | 0.96217 | ||
| E-Plasma | 0.674 ± 0.00494 |
E-Plasma vs C-FBS |
-0.07078 | 0.00108 | ||
| C-FBS (F1) | 0.666 ± 0.0324 |
<0.001 | C-FBS (F1) vs E-FBS (F1) |
-0.06418 | 0.00414 | |
| E-FBS (F1) | 0.602 ± 0.0278 |
E-FBS (F1) vs E-Plasma (F1) |
0.06956 | 0.00244 | ||
| E-Plasma (F1) | 0.671 ± 0.00729 |
E-Plasma (F1) vs C-FBS (F1) |
0.00538 | 0.93867 | ||
| Osmolaridad (mOsm/kg H2O) |
C-FBS | 253 ± 14.7 | 0.48 | C-FBS vs E-FBS |
N/A | N/A |
| E-FBS | 242 ± 6.88 | |||||
| E-Plasma | 252 ± 9.92 | E-FBS vs E-Plasma |
N/A | N/A | ||
| C-FBS (F1) | 245 ± 2.07 | |||||
| E-FBS (F1) | 246 ± 3.91 | E-Plasma vs C-FBS |
N/A | N/A | ||
| E-Plasma (F1) | 257 ± 26.5 | |||||
| Viabilidad celular (%) |
C-FBS | 0.131 ± 0.00829 |
0.08 | C-FBS vs E-FBS |
N/A | N/A |
| E-FBS | 0.124 ± 0.00593 |
E-FBS vs E-Plasma |
N/A | N/A | ||
| E-Plasma | 0.121 ± 0.00439 |
E-Plasma vs C-FBS |
N/A | N/A |
Todas las comparaciones se hicieron por medio de métodos independientes. Los ANOVAs de una y dos vías se aplicaron de manera independiente a cada variable según las relaciones entre los factores: filtrado, no filtrado y grupo experimental. Las comparaciones de 1 vs 1 se hicieron aplicando una prueba post hoc de Tukey. C-FBS= control-FBS; E-FBS= experimental-FBS; E-Plasma= experimental-plasma; DE= desviación estándar. Nivel de significancia: P<0.05.
Concentración de proteína total
En este parámetro se observaron diferencias entre los C-FBS y E-FBS y entre el E-Plasma y el C-FBS, todos filtrados (P<0.05). No hubo diferencias entre el E-Plasma y el E-FBS no filtrados, pero si hubo diferencias entre los no filtrados del E-Plasma y el C-FBS y entre los E-FBS y C-FBS (Cuadro 2).
pH
Antes de la filtración, el C-FBS y el E-FBS tuvieron un pH de 7.0, pero la muestra de E-Plasma tuvo un pH de 6.0. Después de la filtración, los tres tuvieron un valor de pH de 7.0.
Osmolaridad
La osmolaridad no difirió entre grupos experimentales ni antes ni después de la filtración (P>0.05, Cuadro 2).
Viabilidad celular
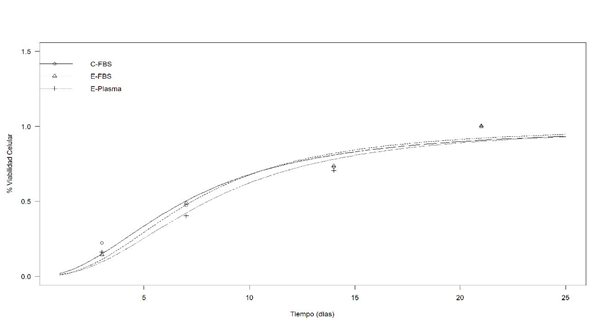
Se evaluó el crecimiento celular entre los grupos experimentales por medio de la viabilidad celular a través del tiempo (Figura 2). Se hizo la comparación usando una prueba de la razón de verisimilitud con un valor de RV= 0.031124 y un P= 0.999. No se observaron diferencias entre los grupos.
Discusión
Los resultados confirman que el FBS proveniente de la industria cárnica en México es viable en el cultivo celular y comparable con el FBS comercial. Investigaciones previas han comprobado que las materias primas provenientes de la ganadería mexicana son aptas para la obtención y producción del FBS ya que el ganado en México se encuentra libre de las principales enfermedades cuarentenarias desde el 2016 hasta la fecha17,23.
Para obtener el FBS, la sangre que se utiliza se debe obtener de fetos. Para evitar riesgos de contaminación la sangre se obtiene por punción cardíaca y debe ser tomada por personal altamente capacitado18. La principal razón para obtener la sangre a partir de esa etapa gestacional es que el feto está protegido por la “barrera placentaria”, una protección natural que defiende al organismo en desarrollo de cualquier infección24. Otro aspecto que hace que el suero de feto sea la mejor opción para el cultivo celular es que desde el momento de la fecundación y hasta que el óvulo se implanta en el útero, la mayoría de los procesos de señalización son de inflamación. Esto significa, que siempre hay células del sistema inmune presentes en todo momento, incrementando las defensas contra los contaminantes. Por este motivo, para el cultivo celular el suero proveniente de fetos es, en efecto, la mejor opción (25.
Una de las limitaciones del presente estudio fue que, en las pruebas elegidas para esta etapa inicial de caracterización sérica, basados en la Guía del Certificado de Análisis (CoA)26, no se incluyeron las pruebas de virus (virus citopático, hemadsorbente y la diarrea viral bovina) y de IgG y GGT porque el objetivo principal eran las pruebas de rendimiento.
La prueba de osmolaridad mide la concentración de nutrientes solutos en un reactivo. Es de vital importancia mantener los niveles de osmolaridad dentro de los estándares, ya que esto permite que las células en cultivo crezcan rápidamente y se evita las malformaciones morfológicas por falta de nutrientes. Por ello es pertinente disponer de un suero con una concentración de FBS dentro del rango de 260-340 mOsm/Kg H2O) puesto que una suplementación baja o nula de FBS no permitirá a las células desarrollarse adecuadamente. Este se ha confirmado en un estudio para verificar la vida útil de células de pollo cultivadas en diferentes concentraciones de FBS (5, 10, 20 y 30 %)27, y otro para evaluar el efecto de la concentración de FBS (5, 10, 20 y 30) sobre la eficiencia de la reprogramación celular para la generación de células madre pluripotentes28.
La prueba de viabilidad celular mostró que a los 21 días de crecimiento los tres grupos experimentales mantienen el mismo porcentaje de viabilidad. Esto sugiere que el plasma podría usarse para complementar los medios de cultivo de la misma manera que el FBS. Sin embargo, la presencia de fibrinógeno en el plasma puede disminuir la eficacia de ello en el cultivo celular. El fibrinógeno es un zimógeno, un precursor enzimático inactivo que participa principalmente en la cascada de la coagulación. Su función principal es la formación de fibrina para la creación del coágulo que cubre una lesión. Además, se conoce como una proenzima que no requiere de un activador proteico, sino que se puede activar simplemente con un cambio bioquímico en el ambiente29,30. El fibrinógeno también está involucrado en procesos como la distribución, la adhesión y la señalización plaquetaria, la proliferación de fibroblastos y células endoteliales, la cicatrización y la respuesta inflamatoria. Es una proenzima con amplio campo de acción ya que es capaz de unirse a proteínas como la fibronectina (facilitando su incorporación a la matriz extracelular), y a factores de crecimiento para fibroblastos (FDF-2, β-FGF) y endotelio vascular (VEDF), que estimulan la angiogénesis, y a la interleucina-1β, que interviene en la inflamación24,25. Desde luego, frente al plasma, el suero sigue siendo la mejor opción para complementar los medios de cultivo.
Aunque se encontraron diferencias entre los sueros y el plasma en algunas de las pruebas de caracterización, no se observó ninguna en la prueba de viabilidad. Ninguno de estos datos tiene un efecto significativo sobre el uso del suero obtenido de la industria cárnica (E-FBS) para complementar el medio de cultivo y desde luego podría utilizarse para tal fin. El presente estudio es una caracterización inicial y la intención es llevar a cabo las pruebas de caracterización faltantes, por ejemplo, la medición de endotoxinas, hemoglobina, hormonas y vitaminas. Además, es necesario evaluar el desempeño del E-FBS en diferentes líneas celulares.
Conclusiones e implicaciones
Comparado con el suero comercial, el suero obtenido de la industria cárnica no presentó diferencias en cuanto al mantenimiento y la proliferación celular. El plasma no es un complemento comúnmente utilizado para cultivos celulares, pero, si el FBS no está disponible, el plasma evaluado aquí se puede usar como sustituto para mantener ciertos cultivos celulares. Esta primera etapa de caracterización del suero bovino fetal producido por la industria cárnica en México sugiere que se puede utilizar para complementar cultivos celulares, aunque faltarán las pruebas estándar para confirmar tal suposición.
Agradecimientos
La investigación recibió apoyo del Consejo Nacional de Ciencia y Tecnología (CONACYT). Se agradece el acceso a las instalaciones del Laboratorio de Investigación y Desarrollo en la Diagnosis Molecular y de Biomateriales de la Universidad Autónoma de Aguascalientes.
REFERENCIAS
1. Hudu SA, Alshrari AS, Syahida A, Sekawi Z. Cell culture, technology: Enhancing the culture of diagnosing human diseases. J Clin Diagnostic Res 2016;10(3):DE01-05. doi:10.7860/JCDR/2016/15837.7460. [ Links ]
2. Rodríguez HCO, Torres GSE, Olvera SC, Ramírez CFY, Loera MA, Avelar GFJ, et al. Cell culture: History, development and prospects. Int J Curr Res Acad Rev 2014;2(12):188-200. ISSN: 2347-3215. [ Links ]
3. Coecke S, Balls M, Bowe G, Davis J, Gstraunthaler G, Hartung T, et al. Guidance on good cell culture practice: A report of the second ECVAM task force on good cell culture practice. ATLA. 2005;33(3):261-287 doi: 10.1177/026119290503300313. [ Links ]
4. Segeritz CP, Vallier L. Cell culture: Growing cells as model systems in vitro. In: Jalali M, et al, editors. Basic science methods for clinical researchers. Unided Kindom: Elsevier 2017: 151-172. doi: 10.1016/B978-0-12-803077-6.00009-6. [ Links ]
5. WHO. World Health Organization. Laboratory Biosafety Manual. 4th ed. Unites States of America; 2020. [ Links ]
6. Pamies D, Bal-Price A, Chesné C, Coecke S, Dinnyes A, Eskes C, et al. Advanced good cell culture practice for human primary, stem cell-derived and organoid models as well as microphysiological systems. ALTEX. 2018;35(3):353-78. doi: 10.14573/altex.1710081. [ Links ]
7. Nikfarjam L, Farzaneh P. Prevention and detection of mycoplasma contamination in cell culture. Cell J 2012;13(4):203-212. [ Links ]
8. Eskes C, Boström AC, Bowe G, Coecke S, Hartung T, Hendriks G, et al. Good cell culture practices & in vitro toxicology. Toxicol Vitr 2017;45(3):272-277. doi: 10.1016/j.tiv.2017.04.022. [ Links ]
9. Freshney RI. Animal cell culture guide. Atcc. 2014;39(6):1-33. ISSN: 1464-3553. [ Links ]
10. Van Der Valk J, Mellor D, Brands R, Fischer R, Gruber F, Gstraunthaler G, et al. The humane collection of fetal bovine serum and possibilities for serum-free cell and tissue culture. Toxicol Vitr 2004;18(1):1-12. doi: 10.1016/j.tiv.2003.08.009. [ Links ]
11. Nielsen OB, Hawkes P. Fetal bovine serum and the slaughter of pregnant cows: Animal welfare and ethics. Bioprocess J 2019;18:1-4. doi:10.12665/j18oa.hawkes. [ Links ]
12. Van Der Valk J, Bieback K, Buta C, Cochrane B, Dirks WG, Fu J, et al. Fetal bovine serum (FBS): Past - Present - Future. ALTEX 2018;35(1):99-118. doi: 10.14573/altex.1705101. [ Links ]
13. Anon. “Total grausames Geschehen.” Der Spiegel. 1993;4:190-193. [ Links ]
14. SEMARNAT. Secretaría de Medio Ambiente y Recursos Naturales. Unidades de producción y existencias de ganado bovino según sistema de producción. Gob Mex website. 2007. http://dgeiawf.semarnat.gob.mx:8080/ibi_apps/WFServlet?IBIF_ex=D2_AGRIGAN01_15&IBIC_user=dgeia_mce&IBIC_pass=dgeia_mce&NOMBREENTIDAD=* Consultado Sep 7, 2022. [ Links ]
15. SIAP. Servicio de Información Agroalimentaria y Pesquera. Bovinos carne y leche: Población ganadera 2012 - 2021 “Cabezas”. Gob Mex website 2007. https://www.gob.mx/siap/documentos/poblacion-ganadera-136762 . Consultado Sep 7, 2022. [ Links ]
16. Versteegen RJ. Serum: What, When, and Where? BioProssesing 2016;15(1):18-21. doi: 10.12665/J151.Versteegen. [ Links ]
17. OIE. World Organization for Animal Health. Official Disease Status. OIE website 1998. https://www.oie.int/en/what-we-do/animal-health-and-welfare/official-disease-status/ . Accessed Dec 6, 2021. [ Links ]
18. Jochems CEA, Van Der Valk JBF, Stafleu FR, Baumans V. The use of fetal bovine serum: Ethical or scientific problem? ATLA 2002;30(2):219-227. doi: 10.1177/026119290203000208. [ Links ]
19. Elliott P, Peakman TC. The UK Biobank sample handling and storage protocol for the collection, processing and archiving of human blood and urine. Int J Epidemiol 2008;37(2):234-244. doi:10.1093/ije/dym276. [ Links ]
20. Fontél KS, Bøtner A, Belsham GJ, Lohse L. Diagnostic comparison of serum and EDTA-stabilized blood samples for the detection of foot-and-mouth disease virus RNA by RT-qPCR. J Virol Methods 2019;270(3):120-125. doi: 10.1016/j.jviromet.2019.05.003. [ Links ]
21. Yu Z, Kastenmüller G, He Y, Belcredi P, Möller G, Prehn C, et al. Differences between human plasma and serum metabolite profiles. PLoS One 2011;6(7):1-6. doi: 10.1371/journal.pone.0021230. [ Links ]
22. Gejl AK, Enevold C, Bugge A, Andersen MS, Nielsen CH, Andersen LB. Associations between serum and plasma brain-derived neurotrophic factor and influence of storage time and centrifugation strategy. Sci Rep 2019;9(1):1-9. doi: 10.1038/s41598-019-45976-5. [ Links ]
23. World Organisation for Animal Health. Report of the meeting of the OIE Scientific Commission for Animal Diseases. OIE. 2022;33:1-137. ISBN: 1291701506161. [ Links ]
24. Yong HEJ, Chan SY, Chakraborty A, Rajaraman G, Ricardo S, Benharouga M, et al. Significance of the placental barrier in antenatal viral infections. BBA - Mol Basis Dis 2021;1867(12):166-244. doi: 10.1016/j.bbadis.2021.166244. [ Links ]
25. Pazos M, Sperling RS, Moran TM, Kraus TA. The influence of pregnancy on systemic immunity. Immunol Res 2012;54(1-3):254-61. doi:10.1007/s12026-012-8303-9. [ Links ]
26. ISIA. International Serum Industry Association. Certificate of Analysis (CofA) Vol. 16. ISIA website 2017. https://www.serumindustry.org/standardization/certificate-of-analysis-cofa/ Accessed Sep 10, 2022. [ Links ]
27. Ryan JM. Effect of different fetal bovine serum concentrations on the replicative life span of cultured chick cells. Soc Vitr Biol 2016;15(11):895-899. doi: 10.1007/BF02618046. [ Links ]
28. Kwon D, Kim JS, Cha BH, Park KS, Han I, Park KS, et al. The effect of fetal bovine serum (FBS) on efficacy of cellular reprogramming for induced pluripotent stem cell (iPSC) generation. Cell Transplant 2016;25(6):1025-1042. doi: 10.3727/096368915X689703. [ Links ]
29. Litvinov RI, Pieters M, de Lange-Loots Z, Weisel JW. Fibrinogen and fibrin. Subcell Biochem 2021;96(4):471-501. doi: 10.1007/978-3-030-58971-4_15. [ Links ]
30. Malagón D, Cardozo C, Godoy R. Uso de fibrinógeno humano en la generación de soportes para la obtención de equivalentes tisulares. Rev Colomb Biotecnol 2011;13(2):243-253. ISSN: 1909-8758. [ Links ]
Recibido: 07 de Julio de 2022; Aprobado: 10 de Octubre de 2022











 text in
text in