Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista mexicana de ciencias pecuarias
On-line version ISSN 2448-6698Print version ISSN 2007-1124
Rev. mex. de cienc. pecuarias vol.10 n.4 Mérida Oct./Dec. 2019 Epub Apr 30, 2020
https://doi.org/10.22319/rmcp.v10i4.4703
Revisiones bibliográficas
Suplementación con ácido ascórbico para mejorar la fertilidad del ganado lechero. Revisión
a Universidad Autónoma Chapingo. Departamento de Zootecnia. Estado de México, 56230, México.
b Colegio de Postgraduados. Departamento de Estadística. Estado de México, México.
c Colegio de Postgraduados. Departamento de Ganadería. Estado de México, México.
El ácido ascórbico (vitamina C: VC) es un antioxidante que participa en los procesos reguladores que intervienen en el desarrollo de las estructuras ováricas y en la fertilidad. No obstante, la suplementación del ganado lechero con VC para mejorar la fertilidad ha recibido poca atención. Sin embargo, la reducción de la fertilidad del ganado lechero asociada al elevado mérito genético para la producción de leche y al estrés por calor, que igualmente reducen las concentraciones de la VC en la sangre, sugiere que la VC desempeña un papel benéfico potencial. Los objetivos de esta revisión son contribuir al conocimiento actual sobre la relación entre la VC y la fertilidad y compartir aquellas experiencias que apoyan la relevancia de la suplementación con VC para mejorar el rendimiento reproductivo del ganado lechero.
Palabras clave Antioxidantes; Ácido ascórbico; Reproducción
Ascorbic acid (vitamin C: VC) is an antioxidant that participates in the regulatory processes involved in the development of ovarian structures and fertility. However, supplementation of VC to dairy cattle to improve fertility has received little attention. However, reduced fertility in dairy cattle associated with high genetic merit for milk production and heat stress, which also diminish blood VC concentrations, suggest a potentially beneficial role for VC supplementation. The objectives of this review are to contribute to the current knowledge regarding the relationship between VC and fertility and to share many experiences that support the relevance of VC supplementation to improve dairy cattle reproductive performance.
Key words Antioxidants; Ascorbic acid; Reproduction
Introducción
Los beneficios económicos de una explotación lechera se incrementan en la medida en que mejora la eficiencia reproductiva del ganado. Sin embargo, la disminución histórica de la fertilidad de las vacas lecheras Holstein es un obstáculo para la rentabilidad; pero al mismo tiempo ofrece un desafío para desarrollar estrategias para mejorar el rendimiento reproductivo. La causa de la baja fertilidad en el ganado lechero Holstein moderno comprende múltiples factores. Los principales están asociados con el mejoramiento del mérito genético para la producción lechera, la incapacidad de satisfacer las necesidades nutricionales, las condiciones ambientales adversas y la susceptibilidad a enfermedades que ponen en riesgo la viabilidad de los ovocitos y del embrión1.
Se desconoce la causa exacta de la baja fertilidad, pero podría estar relacionada con el estrés oxidativo. Éste surge cuando los radicales libres exceden la capacidad antioxidante del organismo2. Los radicales libres son moléculas con un electrón desapareado, altamente reactivas y que se producen normalmente en los organismos aeróbicos vivos3. A un ritmo de producción controlado, sirven como señales moleculares, pero la sobreproducción puede dar como resultado un proceso patológico4. Los radicales libres que pueden superar la capacidad antioxidante de la vaca son resultado del rendimiento de la producción lechera y del estrés por calor, entre otros factores. Las vacas cuya producción de leche es elevada tienen mayores concentraciones de marcadores de estrés oxidativo que aquellas que producen menos leche5, y también son más susceptibles al estrés por calor6. Esto es relevante porque el estrés debido al calor produce estrés oxidativo en el ganado lechero7, y el estrés oxidativo crea condiciones desfavorables dentro del oviducto8 que conducen a la muerte del embrión9.
El estrés oxidativo se contrarresta mediante los antioxidantes, que suprimen el efecto nocivo de los radicales al proporcionarles un electrón. Un antioxidante relevante para la reproducción de los mamíferos es el ácido ascórbico soluble en el agua (vitamina C, a la que en lo sucesivo se referirá como VC)10. Las funciones químicas y biológicas de la VC en el ganado han sido analizadas por otros11, y por lo tanto no se abordarán aquí. Sin embargo, el impacto de la suplementación con VC en la fertilidad del ganado lechero ha sido escasamente estudiado, quizá porque los bovinos pueden sintetizar su propia VC en el hígado a partir de la glucosa11, y por lo tanto no requieren suplementación externa12. No obstante, los mismos factores que se considera afectan la fertilidad (el alto rendimiento lechero y el estrés debido al calor) redujeron la concentración de VC en la sangre del ganado lechero13,14. Podría sospecharse que, si la VC es necesaria para la reproducción, una reducción del suministro de la misma podría afectar la fertilidad. Investigaciones anteriores han demostrado que la suplementación con VC es ventajosa para mejorar el rendimiento reproductivo de las vacas repetidoras15 y del ganado lechero en condiciones de estrés16. Se considera que la suplementación con VC y sus impactos en la fertilidad del ganado lechero merecen más atención.
El objetivo de esta revisión es contribuir al conocimiento actual sobre la relación entre la VC y la fertilidad y compartir las experiencias sobre la pertinencia de la suplementación con VC para mejorar el rendimiento reproductivo del ganado lechero.
Desarrollo del folículo ovárico y del cuerpo lúteo
La deficiencia de vitamina C incrementa el número de folículos atrésicos17. Sin embargo, la suplementación atenúa la apoptosis de las células foliculares18, promueve la activación primordial de los folículos19, incrementa la población de los folículos en crecimiento20 y reduce los que se encuentran en estado atrésico21. Estos hallazgos sugieren que la VC apoya el desarrollo de folículos ováricos saludables.
El folículo ovárico está en constante remodelación estructural. Su diámetro aumenta hasta 475 veces desde su etapa primordial hasta que alcanza el tamaño ovulatorio22,23. Este incremento de tamaño implica una constante remodelación de la lámina folicular basal24 y un cambio de concentraciones intrafoliculares de VC, que son mayores en los folículos más pequeños25. La lámina folicular basal da estabilidad al folículo y sirve como un filtro molecular24, pero requiere cantidades mayores de colágeno a medida que el tamaño de éste aumenta26. Dado que la VC es uno de los factores que intervienen en la síntesis de colágeno27, es lógico suponer que se requerirá VC en cantidades mayores para los folículos en desarrollo. De hecho, la suplementación con VC mejora la supervivencia folicular e incrementa las probabilidades de que un folículo alcance un tamaño preovulatorio28. Esto podría explicarse por el efecto de la VC de prevenir la muerte de las células foliculares y mantener la integridad de la membrana a medida que crece el folículo18,29.
Bajo un ambiente con un cuerpo lúteo en regresión, el folículo dominante alcanzará el estado preovulatorio. En esta etapa se requiere de VC para una esteroidogénesis folicular normal30, lo cual se logra promoviendo la expresión de las enzimas clave que intervienen en la esteroidogénesis, como la aromatasa y la enzima de escisión de la cadena lateral de colesterol P45031. Sin embargo, a medida que crece el folículo hay una reducción en la concentración de VC. El folículo preovulatorio tiene menores concentraciones intrafoliculares de VC que los folículos grandes de otras etapas del ciclo del estro32. Esta reducción puede dar como resultado una mayor concentración intrafolicular del IGF-1, que induce la absorción de VC por las células33. El incremento de la hormona luteinizante (LH) también causa una reducción de las concentraciones de VC34, probablemente aumentando las concentraciones intrafoliculares de especies reactivas de oxígeno (ERO)35.
La reducción de las concentraciones intrafoliculares de VC en la etapa preovulatoria puede ser parte del mecanismo para controlar la ovulación. El colágeno de la lámina basal folicular se reduce a medida que crece el folículo, lo cual lo vuelve más expandible y más fácil de remodelar36. La reducción de las concentraciones intrafoliculares de VC, aunada a la degradación del colágeno en los folículos preovulatorios, da como resultado el debilitamiento y la ruptura de la lámina basal, eventos cruciales que pueden conducir a la ruptura de los folículos preovulatorios37,38.
El número de mujeres embarazadas con defectos de la fase luteal crece después de suplementarlas con VC, lo cual probablemente obedezca a que se produce un incremento de la progesterona del cuerpo lúteo39. Se ha relacionado el diámetro del cuerpo lúteo32, así como la concentración de progesterona, con la concentración de VC40. Además, el contenido de VC es superior durante las etapas tempranas del desarrollo del cuerpo lúteo41, que alcanza su máxima concentración, al menos en los bovinos, en el día 12 del ciclo estral42. Es más, un elemento clave de la relación entre la VC y el cuerpo lúteo es que se necesita esta vitamina, como se mencionó, para la síntesis del colágeno, el cual es esencial para el desarrollo del cuerpo lúteo43.
Vitamina C y fertilidad
La vitamina C mejoró la fertilidad44. Esto puede deberse al mayor desarrollo de los ovocitos y del embrión45,46. Desgraciadamente, la limitada información disponible sobre este tema se ha obtenido sobre todo en condiciones in vitro. Por el contrario, en dosis elevadas la VC podría dañar el desarrollo de los ovocitos (750 µM ml-1) y del embrión (˃200 󠅾µM en medio de cultivo)47,48, lo cual podría ser consecuencia de un efecto pro-oxidante de la VC. La VC en concentraciones bajas pueden actuar como antioxidante, mientras que en concentraciones elevadas ocurre lo contrario; esto puede depender de la concentración de iones de metal (hierro)49. Cabría esperar un efecto pro-oxidante de la VC a medida que se incremente la concentración de iones de metal50. Esto último puede ocurrir en condiciones in vitro, pero es improbable que ocurra en organismos vivos51.
Relación entre la vitamina C y la vitamina E
La vitamina C puede controlar el desarrollo folicular al interactuar con otros elementos que se sabe afectan la fertilidad. Es una verdad aceptada que después de que la vitamina E desempeña su actividad antioxidante, puede ser reactivada por la VC52, lo cual incrementa su disponibilidad53. La deficiencia de vitamina E afecta al desarrollo folicular, produciendo anomalías en el ciclo estral y pérdida de gestaciones54. No se sabe con exactitud qué concentración de vitamina E en la sangre se puede considerar adecuada o deficiente en el ganado. Una concentración de vitamina E en la sangre de ˃1 µg ml-1 puede ser considerada adecuada, pero no hay un acuerdo a este respecto55. Además, no se conoce de ninguna recomendación de vitamina E para un rendimiento reproductivo óptimo en el ganado. Sin embargo, estudios anteriores (véanse la siguiente sección de este artículo y la referencia 16) han demostrado que la suplementación con 3,000 UI de vitamina E durante un estro sincronizado favorece el mejoramiento de la fertilidad del ganado lechero.
La relación entre las vitaminas C y E en cuestiones reproductivas ha recibido poca atención. Un sistema antioxidante, que incluye las vitaminas C y E, se activa durante la esteroidogénesis42. En las ratas, la suplementación con vitamina C (125 mg kg-1 día-1) y E (75 mg kg-1 día-1) incrementa las concentraciones de la testosterona, FSH y LH en la sangre56. Estas concentraciones superiores de gonadotropinas coinciden con el hecho de que la vitamina C estimula su secreción desde la pituitaria57. Estudios in vitro han demostrado un efecto positivo de las vitaminas C y E en la calidad de los ovocitos y el desarrollo embrionario cuando se las suministran por separado, pero no cuando se las suministran juntas53,58,59. La adición de vitamina C y E al medio de maduración reduce la tasa de formación de blastocistos, previniendo que se produzca la cantidad de ERO necesaria para el desarrollo competente del ovocito53. Esto es aceptable porque se ha demostrado que un suministro intermitente de ERO interrumpe el arresto meiótico de los ovocitos60. Sin embargo, es poco probable que la situación descrita por Dalvit et al.53 ocurra también in vitro porque la suplementación con ambas vitaminas ha dado como resultado más gestaciones en el ganado lechero (véanse la siguiente sección de este artículo y la referencia 16). Además, se ha reportado una mejora de la calidad del embrión después de inyectar dos antioxidantes ―β-caroteno y vitamina E― a donantes bovinas superovuladas antes del estro61.
Los estudios in vitro simulan las condiciones fisiológicas. Sin embargo, al contrario de lo que ocurre en los organismos vivos, los sistemas in vitro son estáticos, y en estos la actividad metabólica, la absorción y almacenamiento de nutrientes y la excreción de los desechos están limitados por el tiempo y por las condiciones del medio de cultivo. Además, la adaptación a las condiciones cambiantes es más rápida en los sistemas in vivo. Y cuando se suplementa a un organismo vivo simultáneamente con vitamina C y vitamina E, éste elige entre almacenarlas, excretarlas o distribuirlas donde se requieren. Esto evita posibles efectos dañinos en los procesos biológicos de las células, como los que afectan la calidad de los ovocitos y el desarrollo embrionario.
Experiencias de suplementación del ganado lechero con vitamina C
La evidencia presentada aquí apoya la hipótesis de que la VC desempeña un papel preponderante en la fertilidad. El primer acercamiento a una evaluación del efecto de la VC en la fertilidad del ganado lechero se llevó a cabo en vacas en condiciones de estrés por calor16. Los resultados de este estudio revelaron que el inyectar vitamina C y E tiene como resultado un mayor número de vacas preñadas que cuando se suministra cualquiera de estas vitaminas por separado. Además, no se encontró ningún efecto de la suplementación con vitaminas en el tamaño del folículo preovulatorio ni en el del cuerpo lúteo. Estos hallazgos llevan a suponer que el incremento en el número de vacas gestantes, obtenido después de suplementarlas con ambas vitaminas a la vez, fue el resultado de que las vacas tuvieran un folículo más sano, el cual a la larga se transforma en un cuerpo lúteo que produce más progesterona que el de las vacas que no reciben la suplementación. Se realizó un segundo ensayo para probar este supuesto (T2).
El procedimiento general, así como la justificación de las dosis y el momento en que se aplican las inyecciones de la vitaminas utilizadas en el T2 se explica en detalle en otro artículo16. En pocas palabras, la onda folicular de las vacas se sincronizó con un dispositivo que contenía 1.0 g de progesterona (Sincrogest ®, Ourofino Agronegocio), insertado intravaginalmente durante 8 días, y una inyección intramuscular (i.m.) de 250 µg de análogo de GnRH (GnRH, Sanfer). Se indujo el comportamiento de celo mediante la aplicación de una inyección i.m. de 500 µg de cloprostenol (Celosil, MSD, Salud Animal) al retirar el dispositivo intravaginal. Una vez que se retiró éste, se dio un seguimiento constante a los animales mediante observación directa para detectar señales de estro. Las vacas se inseminaron artificialmente 12 h después del estro, con una dosis única (de aproximadamente 20 x 106 espermatozoides) de semen de un solo toro de fertilidad probada. A las vacas que recibieron vitaminas (n=32; grupo testigo, n=28) se les aplicó una inyección i.m. única de 3,000 UI de vitamina E ((±) α-tocoferol, Sigma-Aldrich)) en el día 5 (el día 0 es el día en el que se retiró el dispositivo intravaginal) e inyecciones subcutáneas (s.c.) de una dosis total de 3,000 mg de VC (ácido ascórbico, Q.P. Reasol) en el día 5, inmediatamente después de que se detectó el estro y 2 días después de la inseminación artificial.
Como se muestra en el Cuadro 1, la suplementación con vitaminas no afectó el tamaño del folículo preovulatorio ni el del cuerpo lúteo. Además, no se observó ningún efecto en el nivel de estradiol en la sangre ni en la producción de progesterona. Sin embargo, en concordancia con los hallazgos anteriores16, la tasa de gestación fue más alta (P=0.06) en las vacas inyectadas con vitaminas 45 días después de la inseminación artificial (Figura 1).
Cuadro 1 Cuadrados medios mínimos (±SE) del efecto de las inyecciones de vitamina C y E en el tamaño de las estructuras ováricas, la presentación del celo y las concentraciones de hormonas
| Tratamiento | Valor P | ||
|---|---|---|---|
| Variable | Testigo (n=28) |
Vitamina C y E (n=32) |
|
| Horas al celo | 57.1±4.89 | 58.4±4.57 | 0.67 |
| Diámetro del folículo preovulatorio, mm | 18.3±0.57 | 17.2±0.60 | 0.21 |
| Concentración de estradiol, pg ml-1 | 45.1±3.12 | 46.8±3.26 | 0.71 |
| Área del cuerpo lúteo, cm2 | 6.9±0.39 | 6.7±0.37 | 0.74 |
| Concentración de progesterona, ng ml-1 | 10.8±1.60 | 12.5±1.60 | 0.26 |
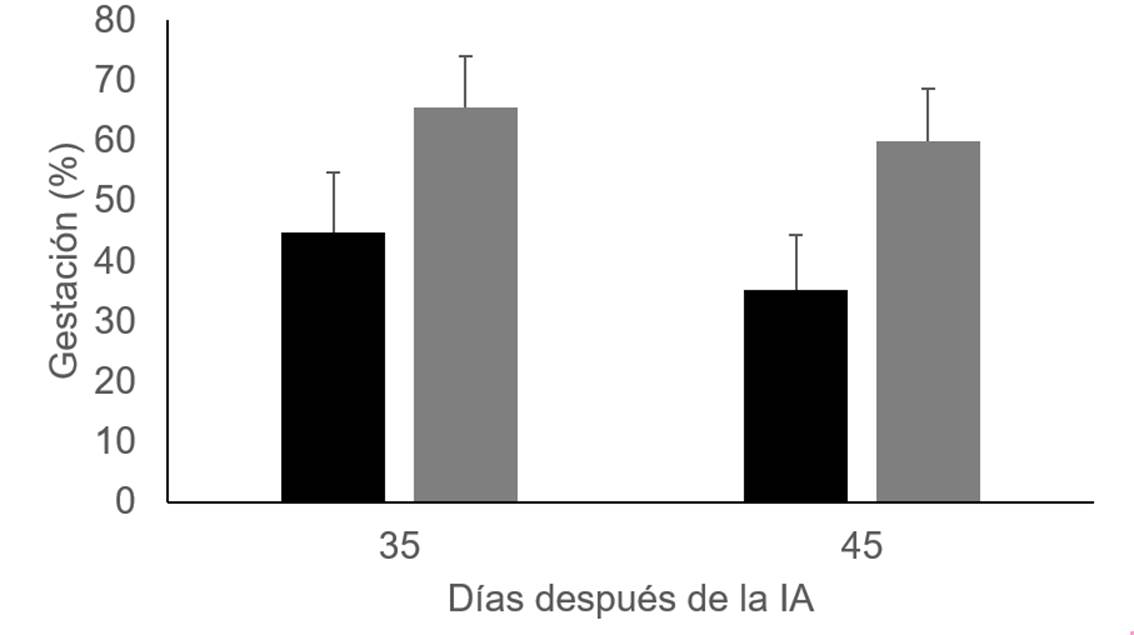
Figura 1 Tasa de gestaciones a 35 y 45 días después de la IA en el grupo testigo (barras negras, n=28) y en las vacas lecheras Holstein inyectadas con vitamina C y E (barras grises, n=32)
La sincronización estral es una herramienta reproductiva utilizada en el ganado lechero para mejorar la fertilidad porque hace posible controlar el inicio del estro. Sin embargo, la mayoría de los técnicos prefieren utilizar la inseminación artificial a tiempo fijo porque evita la necesidad de detectar el celo. Además, es muy conveniente porque se programa la inseminación simultánea de todas las vacas. Con base en los hallazgos anteriores, se decidió incorporar inyecciones de vitaminas C y E a un protocolo de inseminación artificial a tiempo fijo (T3) para incrementar el número de vacas preñadas. A las vacas se les aplicó una inyección i.m. de 250 µg de análogo de GnRH en el día 0, siete días después de que fueron inyectadas con 500 µg de cloprostenol. 48 h después de administrarles la inyección de cloprostenol se les administró una segunda dosis de GnRH. La inseminación se llevó a cabo 14 a 16 h después de la segunda inyección de GnRH. Las inyecciones de vitamina C y E se aplicaron tal como se mencionó en el T2, pero la primera de éstas se administró 3 días después de que se aplicó la primera inyección de GnRH. Las inyecciones segunda y tercera de VC se aplicaron justo después de la segunda inyección de GnRH y 2 días después de la inseminación artificial.
El efecto de las inyecciones de vitamina C y E en el diámetro del folículo preovulatorio (16.8 ± 0.70 mm en el grupo testigo y 16.2 ± 0.77 mm en las vacas inyectadas con vitaminas) y en el área del cuerpo lúteo (5.4 ± 0.48 cm2 y 6.1 ± 0.50 cm2, respectivamente) no fue significativo. Como en los resultados previos20 y con el T2, hubo un porcentaje mayor de vacas preñadas 30 y 45 días después de la inseminación artificial en el grupo de vacas suplementadas con vitaminas que en el grupo testigo. Sin embargo, las diferencias no son significativas, probablemente debido al pequeño tamaño de la muestra utilizada en el T3 (vacas inyectadas con vitaminas, n=16; grupo testigo, n=17), Figura 2.
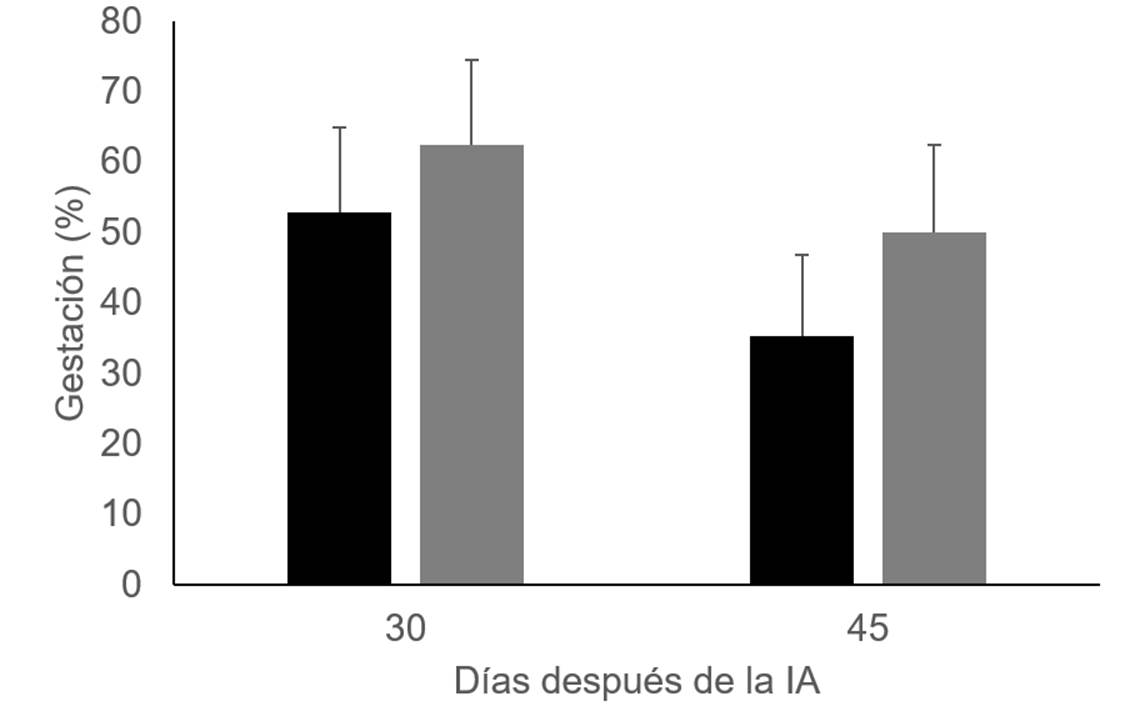
Figura 2 Porcentajes de gestación 30 y 45 días después de la IA en el grupo testigo (barras negras, n=17) y en las vacas lecheras Holstein inyectadas con vitaminas C y E (barras grises, n=16)
Los resultados obtenidos demuestran que las inyecciones de VC en combinación con la vitamina E pueden mejorar la fertilidad del ganado lechero. Este efecto no está mediado por cambios en el tamaño del folículo preovulatorio o del cuerpo lúteo ni por una afectación en la producción de estradiol o progesterona. Una probable explicación del incremento en la tasa de gestaciones del ganado lechero inyectado con vitaminas C y E es que las vacas suplementadas con estas vitaminas producen ovocitos y embriones de mejor calidad que las vacas a las que no se suministran los suplementos.
Conclusiones
Al contrario de lo que se piensa en la actualidad, la evidencia sugiere que la suplementación del ganado lechero con vitamina C mejora la fertilidad. Sin embargo, es necesario investigar la dosis y el periodo de suplementación con vitamina C óptimos para mejorar el rendimiento reproductivo del ganado lechero.
Literature cited
1. Dobson H, Walker SL, Morris MJ, Routly JE, Smith RF. Why is it getting more difficult to successfully artificially inseminate dairy cows? Animal 2008;2:1104-1111. [ Links ]
2. Halliwell B, Whiteman M. Measuring reactive species and oxidative damage in vivo and in cell culture: how should you do it and what do the results mean? Brit J Pharmacol 2004;142:231-255. [ Links ]
3. Valko M, Leibfritz D, Moncol J, Cronin MT, Mazur M, Telser J. Free radicals and antioxidants in normal physiological functions and human disease. Int J Biochem Cell Biol 2007;39:44-84. [ Links ]
4. Rizzo A, Roscino MT, Binetti F, Sciorsci RL. Roles of reactive oxygen species in female reproduction. Reprod Domest Anim 2012;47:344-352. [ Links ]
5. Castillo C, Hernández J, López-Alonso M, Miranda M, Benedito JL. Values of plasma lipid hydroperoxides and total antioxidant status in healthy dairy cows: preliminary observations. Arch Tierz 2003;46: 227-233. [ Links ]
6. Gantner V, Bobic T, Gantner R, Gregic M, Kuterovac K, Novakovic J, Potocnik K. Differences in response to heat stress due to production level and breed of dairy cows. Int J Biometeorol 2017;1-11. [ Links ]
7. Bernabucci U, Ronchi B, Lacetera N, Nardone A. Markers of oxidative status in plasma and erythrocytes of transition dairy cows during hot season. J Dairy Sci 2002;85:2173-2179. [ Links ]
8. Takahashi M. Heat stress on reproductive function and fertility in mammals. Reprod Med Biol 2012;11:37-47. [ Links ]
9. Celi P, Merlo M, Da Dalt L, Stefani A, Barbato O, Gabai G. Relationship between late embryonic mortality and the increase in plasma advanced oxidized protein products (AOPP) in dairy cows. Reprod Fert Develop 2011; 23:527-533. [ Links ]
10. Luck MR, Jeyaseelan I, Scholes RA. Ascorbic acid and fertility. Biol Reprod 1995;52:262-266. [ Links ]
11. Ranjan R, Ranjan A, Dhaliwal GS, Patra RC. l-Ascorbic acid (vitamin C) supplementation to optimize health and reproduction in cattle. Vet Quart 2012;32:145-150. [ Links ]
12. NRC. National Research Council. Nutrient requirements of dairy cattle. 7th ed. Washington, DC, USA: National Academic Press; 2001. [ Links ]
13. Padilla L, Matsui T, Kamiya Y, Kamiya M, Tanaka M, Yano H. Heat stress decreases plasma vitamin C concentration in lactating cows. Livest 2006;101:300-304. [ Links ]
14. Joźwik A, Strzałkowska N, Bagnicka E, Grzybek W, Krzyżewski J, Poławska E, Kołataj A, Horbańczuk JO. 2012. Relationship between milk yield, stage of lactation, and some blood serum metabolic parameters of dairy cows. Czech J Anim Sci 2012;57:353-360. [ Links ]
15. Phillips PH, Lardy HA, Boyer PD, Werner GM. The relationship of ascorbic acid to reproduction in the cow. J Dairy Sci 1941;24:153-158. [ Links ]
16. González Maldonado J, Santos RR, De Lara RR, Ramírez GV. Impacts of vitamin C and E injections on ovarian structures and fertility in Holstein cows under heat stress conditions. Turk J Vet Anim Sci 2017;41:345-350. [ Links ]
17. Kramer MM, Harman MT, Brill AK. Disturbances of reproduction and ovarian changes in the guinea-pig in relation to vitamin C deficiency. Am J Physiol 1933 106:611-622. [ Links ]
18. Thomas FH, Leask R, Srsen V, Riley SC, Spears N, Telfer EE. Effect of ascorbic acid on health and morphology of bovine preantral follicles during long-term culture. Reproduction 2001;122:487-495. [ Links ]
19. Andrade ER, van den Hurk R, Lisboa LA, Hertel MF, Melo-Sterza FA, Moreno K, et al. Effects of ascorbic acid on in vitro culture of bovine preantral follicles. Zygote 2012;20:379-388. [ Links ]
20. Al-Katib SR, Al-Azam AHA, Habeab SA. The effect of vitamin C on ovary of female white rats treated with kmno4. Histological & physiological study. Kufa J Vet Med Sci 2012;3:1-16. [ Links ]
21. Gürgen SG, Erdoğan D, Elmas C, Kaplanoğlu GT, Ozer C. Chemoprotective effect of ascorbic acid, α-tocopherol, and selenium on cyclophosphamide-induced toxicity in the rat ovarium. Nutrition 2013;29:777-784. [ Links ]
22. Braw-Tal R, Yossefi S. Studies in vivo and in vitro on the initiation of follicle growth in the bovine ovary. J Reprod Fert 1997;109:165-171. [ Links ]
23. Machado-Pfeifer LF, de Souza-Leal SCB, Schneider A, Schmitt E, Nunes-Corrêa M. Effect of the ovulatory follicle diameter and progesterone concentration on the pregnancy rate of fixed-time inseminated lactating beef cows. Rev Bras Zootec 2012;41:1004-1008. [ Links ]
24. Rodgers RJ, Irving-Rodgers HF, van Wezel IL. Extracellular matrix in ovarian follicles. Mol Cell Endocrinol 2000;163:73-79. [ Links ]
25. Meur SK, Sanwal PC, Yadav MC. Acorbic acid in buffalo ovary in relation to oestrus cycle. Indian J Biochem Bio 1999;36:134-135. [ Links ]
26. Haliloglu S, Erdem H, Serpek B, Tekeli T, Bulut Z. The relationship among vitamin C, beta-carotene, vitamin A, progesterone and oestradiol 17-beta concentrations in plasma and cyst fluid of Holstein cows with ovarian cyst. Reprod Domest Anim 2008;43:573-577. [ Links ]
27. Pinnell SR. Regulation of collagen biosynthesis by ascorbic acid: a review. Yale J Biol Med 1985;58:553-559. [ Links ]
28. Rose UM, Hanssen RGJM, Kloosterboer HJ. Development and characterization of an in vitro ovulation model using mouse ovarian follicles. Biol Reprod 1999;61:503-511. [ Links ]
29. Murray AA, Molinek MD, Baker SJ, Kojima FN, Smith MF, Hillier SG, Spears N. Role of ascorbic acid in promoting follicle integrity and survival in intact mouse ovarian follicles in vitro. Reproduction 2001;121:89-96. [ Links ]
30. Paszkowski T, Clarke RN. The Graafian follicle is a site of L-ascorbate accumulation. J Assist Reprod Gen 1999;16:41-45. [ Links ]
31. Wu X, Iguchi T, Itoh N, Okamoto K, Takagi T, Tanaka K, NakanishI T. Ascorbic acid transported by sodium-dependent vitamin C transporter 2 stimulates steroidogenesis in human choriocarcinoma cells. Endocrinology 2008;149:73-83. [ Links ]
32. Serpek B, Baspinar N, Haliloglu S, Erdem H. The relationship between ascorbic acid, oestradiol 17β and progesterone in plasma and in ovaries during the sexual cycle in cattle. Rev Med Vet 2001;152:253-260. [ Links ]
33. Behrman HR, Preston SL, Aten RF, Rinaudo P, Zreik TG. Hormone induction of ascorbic acid transport in immature granulosa cells. Endocrinology 1996;137:4316-4321. [ Links ]
34. Guarnaccia MM, Takami M, Jones EE, Preston SL, Behrman HR. Luteinizing hormone depletes ascorbic acid in preovulatory follicles. Fertil Steril 2000;74:969-963. [ Links ]
35. Yacobi K, Tsafriri A, Gross A. Luteinizing hormone-induced caspase activation in rat preovulatory follicles is coupled to mitochondrial steroidogenesis. Endocrinology 2007;148:1717-1726. [ Links ]
36. Rodgers RJ, Irving-Rodgers HF, Russell DL. Extracellular matrix of the developing ovarian follicle. Reproduction 2003;126:415-424. [ Links ]
37. Murdoch WJ. Regulation of collagenolysis and cell death by plasmin within the formative stigma of preovulatory ovine follicles. J. Reprod Fertil 1998;113:331-336. [ Links ]
38. Khan FA, Das GK. Follicular fluid nitric oxide and ascorbic acid concentrations in relation to follicle size, functional status and stage of estrous cycle in buffalo. Anim Reprod Sci 2011;125:62-68. [ Links ]
39. Henmi H, Endo T, Kitajima Y, Manase K, Hata H, Kudo R. Effects of ascorbic acid supplementation on serum progesterone levels in patients with a luteal phase defect. Fertil Steril 2003;80:459-461. [ Links ]
40. Miszkiel G, Skarzynski D, Bogacki M, Kotwica J. Concentrations of catecholamines, ascorbic acid, progesterone and oxytocin in the corpora lutea of cyclic and pregnant cattle. Reprod Nutr Dev 1999;39:509-516. [ Links ]
41. Luck MR, Zhao Y. Identification and measurement of collagen in the bovine corpus luteum and its relationship with ascorbic acid and tissue development. J Reprod Fertil 1993;99:647-652. [ Links ]
42. Rapoport R, Sklan D, Wolfenson D, Shaham-Albalancy A, Hanukoglu I. Antioxidant capacity is correlated with steroidogenic status of the corpus luteum during the bovine estrous cycle. Biochim Biophys Acta 1998;1380:133-140. [ Links ]
43. Jaglan P, Das GK, Kumar BV, Kumar R, Khan FA, Meur SK. Cyclical changes in collagen concentration in relation to growth and development of buffalo corpus luteum. Vet Res Commun 2010;34:511-518. [ Links ]
44. Yassein SK, Mahmoud M, Maghraby N, Ezzo O. Hot climate effects and their amelioration on some productive and reproductive traits in rabbit does. World Rabbit Sci 2008;16:173-181. [ Links ]
45. Ullah I, Jalali S, Khan H, Shami SA, Kiyani MM. Effect of L-ascorbic acid on Nili Ravi buffalo oocytes during in vitro maturation. Pak J Biol Sci 2006;9:2369-2374. [ Links ]
46. Hossein MS, Kim YW, Park SM, Koo OJ, Hashem MA, Bhandari DP, et al. Antioxidant favors the developmental competence of porcine parthenogenotes by reducing reactive oxygen species. Asian Austal J Anim Sci 2007;20:334-339. [ Links ]
47. Wang X, Falcone T, Attaran M, Goldberg JM, Agarwal A, Sharma RK. Vitamin C and vitamin E supplementation reduce oxidative stress-induced embryo toxicity and improve the blastocyst development rate. Fertil Steril 2002;78:1272-1277. [ Links ]
48. Nadri B, Zeinoaldini S, Kohram H. Ascorbic acid effects on in vitro maturation of mouse oocyte with or without cumulus cell. Afr J Biotechnol 2009;8:5627-5631. [ Links ]
49. Seo MY, Lee SM. Protective effect of low dose of ascorbic acid on hepatobiliary function in hepatic ischemia/reperfusion in rats. J Hepatol 2002;36:72-77. [ Links ]
50. Buettner GR, Jurkiewicz BA. Catalytic metals, ascorbate and free radicals: combinations to avoid. Radiat Res 1996;45:532-541. [ Links ]
51. Carr A, Frei B. Does vitamin C act as a pro-oxidant under physiological conditions?. FASEB J 1999;13:1007-1024. [ Links ]
52. Chauhan SS, Celi P, Ponnampalam EN, Leury BJ, Liu F, Dunshea FR. Antioxidant dynamics in the live animal and implications for ruminant health and product (meat/milk) quality: role of vitamin E and selenium. Anim Reprod Sci 2015;54: 1525-1536. [ Links ]
53. Dalvit G, Llanes SP, Descalzo A, Insani M, Beconi M, Cetica P. Effect of alpha-tocopherol and ascorbic acid on bovine oocyte in vitro maturation. Reprod Domest Anim 2005;40:93-97. [ Links ]
54. Martin AJP, Moore T. Some effects of prolonged vitamin-E deficiency in the rat. J Hyg 1939;39:643-650. [ Links ]
55. Sivertsen T, Øvernes G, Østerås O, Nymoen U, Lunder T. Plasma vitamin E and blood selenium concentrations in Norwegian dairy cows: regional differences and relations to feeding and health. Acta Vet Scand 2005;46:177-191. [ Links ]
56. Saki G, Jasemi M, Sarkaki AR, Fathollahi A. Effect of administration of vitamins C and E on fertilization capacity of rats exposed to noise stress. Noise Health 2013;15:194-198. [ Links ]
57. Karanth S, Yu WH, Walczewska A, Mastronardi CA, McCann SM. Ascorbic acid stimulates gonadotropin release by autocrine action by means of NO. Proc Natl Acad Sci USA 2001;98:11783-11788. [ Links ]
58. Olson SE, Seidel GE Jr. Culture of in vitro-produced bovine embryos with vitamin e improves development in vitro and after transfer to recipients. Biol Reprod 2000;62:248-252. [ Links ]
59. Miclea I, Păcală N, Zăhan M, Hettig A, Roman I, Miclea V. Influence of alpha-tocopherol and ascorbic acid on swine oocyte viability and maturation. B. UASVM Anim Sci Biotechol 2011;68:338-345. [ Links ]
60. Tripathi A, Khatun S, Pandey AN, Mishra SK, Chaube R, Shrivastav TG, Chaube SK. Intracellular levels of hydrogen peroxide and nitric oxide in oocytes at various stages of meiotic cell cycle and apoptosis. Free Radical Res 2009;43:287-294. [ Links ]
61. Sales JN, Dias LM, Viveiros AT, Pereira MN, Souza JC. Embryo production and quality of Holstein heifers and cows with beta-carotene and tocopherol. Anim Reprod Sci 2008;106:77-89. [ Links ]
Recibido: 18 de Octubre de 2017; Aprobado: 11 de Julio de 2018











 text in
text in 


