Introducción
Las enfermedades fúngicas representan una de las principales causas de pérdidas en cultivos anualmente, causando 60% de ellas durante la producción y post-cosecha (Sommer et al., 2002). Rhizoctonia solani es un agente causal patógeno de distribución mundial asociado a enfermedades de raíces y tubérculos de diferentes cultivos que ocasiona pérdidas económicas importantes. A continuación, se menciona las familias y cultivos en donde se ha encontrado este fitopatógeno. Poaceae o Gramínea: arroz, trigo, cebada, avena; Fabaceae: soja, maní, frijol seco, alfalfa, garbanzos, lentejas, guisantes; Solanaceae: tabaco y papa; Amaranthaceae: remolacha azucarera; Brassicaceae: canola; Rubiaceae: café; Malvaceae: algodón y Asteraceae: lechuga (Ajayi y Bradley, 2018).
Este patógeno necrotrófico (requiere primero matar las células de su hospedante y después tomar los nutrientes) es uno de los más destructivos que se encuentran en el suelo (Khaledi et al., 2015), dentro de las enfermedades que comúnmente ocasionan se encuentra el llamado ahogamiento de las plántulas y la pudrición de las raíces (Arcos y Zúñiga, 2015). Los síntomas ocasionados por el complejo patológico de R. solani son observados en las partes subterráneas y aéreas de las plantas en dos fases: 1) cancro del tallo que es la infección de las plantas en crecimiento; y 2) costra negra o infección de tubérculos con la formación de esclerosios. La ‘costra negra’ es el signo más evidente de enfermedad causada por R. solani y se caracteriza por esclerosios negros de tamaños irregulares en el tubérculo que en un estado de severidad puede llegar a deformarlo y agrietarlo (Hide et al., 1973; Frank y Leach, 1980; Tsror, 2010).
Para contrarrestar los efectos de este fitopatógeno se ha hecho uso de fungicidas pertenecientes a diferentes grupos químicos con diversos principios activos. Se han reportado cuatro grupos principalmente: 1) inhibidores externos de quinona (Qol) y principios activos como azoxistrobina, piraclostrobina y trifloxistrobina; 2) inhibidores del succinato deshidrogenasa (SDHI) y principios activos como carboxina, penflufeno y sedaxano; 3) inhibidores de la desmetilación (DMI) y principios activos como penconazol y protioconazol; y 4) inhibidores de los fenilpirroles (PP) con el principio activo fludioxonil (Ajayi y Bradley, 2018).
Sin embargo, el comité de acción de resistencia a fungicidas (FRAC) por sus siglas en inglés declaró que el riesgo de desarrollo de resistencia a los fungicidas es alto ya que estos actúan en un solo sitio dentro de una ruta metabólica del fitopatógeno, por lo que la dependencia de estos fungicidas químicos para su control aumenta el riesgo de que estos organismos sean resistentes a estas sustancias (FRAC, 2017). Si bien el uso de fungicidas de amplio espectro ayuda en el control de las enfermedades generadas por R. solani, estas sustancias son altamente tóxicas y han ocasionado graves problemas ambientales y de salud (asociadas a carcinogenicidad) (Patiño et al., 2020).
Las estrategias para el control de este fitopatógeno son limitadas debido a las altas tasas de supervivencia por la formación de esclerocios, se han buscado otras alternativas naturales y menos tóxicas. Tal es el caso de extractos de plantas con actividad antifúngica, un ejemplo es el trabajo de Al-Askar y Rashad (2010) quienes prueban extractos hidroalcohólicos de cuatro plantas medicinales: canela (Cinnamomum verum Presl.), anís (Pimpinella anisum L.), semilla negra (Nigella sativa L.) y clavo (Syzygium aromaticum L. Merr. y Perry) contra R. Solani en guisantes (Pisum sativum L.).
Encontrando que el extracto de clavo al 1% inhibió por completo el crecimiento radial del hongo; mientras que para los otros extractos hidroalcohólicos (4%) de plantas se observó una inhibición del 90.5 al 100%. Los autores mencionan que el efecto antifúngico del extracto hidroalcohólico de clavo se pude atribuir al eugenol, principal compuesto activo del aceite esencial de esta planta, el cual puede formar enlaces en los sitios activos de las enzimas desactivándolas. En otra investigación Rafiq et al. (2021), evaluaron el potencial antifúngico de extractos metanólicos de hojas de cártamo (Carthamus oxycantha) contra R. solani, encontrando de 27 al 37% de inhibición en el crecimiento del hongo fitopatógeno. Los efectos observados se les atribuyeron a 95 compuestos encontrados en los extractos metanólicos, entre los que destacan un derivado de la D-ribofuranosa, ftalato y en menor proporción algunos ácidos grasos.
Mientras que en el caso de hongos macromicetos se ha reportado (Patiño et al., 2020) que estos organismos poseen una fuente potencial de compuestos antifúngicos que podrían usarse para controlar patógenos en plantas y humanos. Tal es el caso de los metabolitos provenientes de extractos etanólicos de Amanita rubescens que presentaron actividad antibacteriana y actividad antioxidante contra Candida albicans, Streptococcus agalactiae y Staphylococcus aureus (Martínez et al., 2021). Otro ejemplo, son los glucolípidos (biosurfactantes) obtenidos de Ustilago maydis que han presentado actividad antimicrobiana contra Salmonella entérica y S. aureus (Cortes et al., 2011).
En el caso de los extractos metanólicos de Lactarius sp. Se ha reportado su actividad antitumoral y antimicrobiana en contra de S. aureus, atribuida a metabolitos como sesquiterpenos, esteroides, compuestos nitrogenados y otros metabolitos secundarios (Feussi et al., 2017). Doğan y Akbaş (2013) reportan la actividad antimicrobiana de extractos de cloroformo, acetona y metanol de Amanita caesarea contra cuatro bacterias grampositivas (Bacillus subtilis, Staphylococcus aureus, Listeria monocytogenes y Streptococcus pyogenes), cinco gramnegativas (Escherichia coli, Klebsiella pneumoniae, Pseudomonas aeruginosa, Proteus vulgaris y Salmonella enteritidis) y una levadura (Candida albicans) mediante el método de microdilución, encontrando un efecto inhibitorio alto para C. albicans a una concentración de 4.8 µg mL del extracto de acetona, siguiendo la escala de Craig (1998).
Además, Doğan y Akbaş (2013) reportan que el extracto metanólico presentó el máximo efecto antimicrobiano contra Staphylococcus pyogenes y E. coli (valores MIC, 78 y 156 mg mL, según escala de Craig) atribuyéndole este efecto a diterpenos, triterpenos y polisacáridos. Los solventes más utilizados para realizar la extracción de metabolitos en hongos son el agua, etanol, metanol, acetona y acetato de etilo (Elbatrawy et al., 2015) lo cual fue un punto a considerar al realizar los extractos; de igual manera se buscó que los solventes elegidos fueran de fácil acceso y manejo para los productores del sector agrícola, con la finalidad de buscar su aplicabilidad en el futuro.
Cabe mencionar que los reportes sobre el uso de extractos de hongos macromicetos para el control de fitopatógenos son escasos, Patiño et al., 2020; Volcão et al., 2021). Reinoro et al. (2013) probaron que los extractos de hongos macromicetos nativos de Chile por medio de la técnica de difusión en disco poseen actividad biológica activa contra hongos fitopatógenos.
El extracto de Mycena hialinotricha presentó mayor actividad antifúngica en el crecimiento de Penicillium notatum, Ceratocistys pilífera y Rhizoctonia solani al formar halos de inhibición. Los autores concluyeron que los extractos de hongos comestibles son buenas fuentes de compuestos activos antifúngicos y sugieren la necesidad de seguir investigando el potencial de estos metabolitos en la industria agroforestal como control de agentes fitopatógenos. Otro estudio que explora el efecto de los metabolitos activos de hongos comestibles contra fitopatógenos es lo reportado por Priya et al. (2019), quienes estudiaron ocho especies de hongos de los cuales Lentinus edodes u hongo shitake, Schizophyllum commune, Coprinus comatus y Volvariella volvaceae son comestibles, contra el crecimiento del hongo fitopatógeno Colletotrichum capsici.
Encontraron que L.edodes mostró la máxima actividad antifúngica al inhibir el crecimiento micelial de C.capsici en 45.55% con una zona de inhibición máxima de 4.86 mm. La identificación y el estudio de los compuestos bioactivos secretados por los macromicetos comestibles, son necesaria para poder desarrollar fungicidas de amplio espectro contra patógenos de plantas. Por lo cual la presente investigación tuvo como objetivo probar el efecto antifúngico de extractos alcohólicos (metanol y etanol) de cuatro hongos comestibles (Lactarius deliciosus, Ustilago maydis, Amanita jacksonii y Amanita rubescens) contra el fitopatógeno R. solani mediante tres metodologías.
Materiales y métodos
Obtención de los hongos comestibles
Los hongos comestibles se consiguieron en los mercados locales de la ciudad de Xalapa, Veracruz en el periodo de julio-agosto de 2021. Posteriormente los ejemplares se llevaron al laboratorio de Biotecnología Microbiana del Instituto de Química Aplicada para ser limpiados y cortados.
Obtención de los extractos hidroalcohólicos
Se pesaron 330 g del material fúngico de cada respectivo hongo, luego se cortaron en fragmentos de aproximadamente de 4 cm x 4 cm, después los fragmentos se colocaron en un frasco de vidrio hermético de 3 L de capacidad. Se establecieron seis recipientes con material fúngico de los cuales a tres de estos se les adicionaron 350 mL de metanol y a los otros tres recipientes se les agregaron 350 mL de etanol. Los recipientes con material fúngico y disolventes se dejaron macerar por cinco días a temperatura ambiente y transcurrido este tiempo se filtraron a gravedad con papel filtro de filtración media poro de 8 µm, posteriormente el sobrenadante obtenido de cada respectivo hongo y disolvente se colocó en un matraz Erlenmeyer de 500 mL.
El líquido obtenido en cada tratamiento se llevó a evaporación en un rotavapor para conseguir el extracto concentrado que regularmente presenta consistencia pastosa-oleosa. Los tres extractos metanólicos y los tres extractos etanólicos se establecieron como soluciones madre y a partir de estos se prepararon los extractos hidroalcohólicos (tratamientos) con las siguientes proporciones: etanol-agua 1:1, metanol-agua 1:1, etanol-agua 3:7 y metanol-agua 3:7 (todo por triplicado).
Actividad antifúngica de los extractos alcohólicos
Difusión en discos
Se prepararon cajas de Petri con medio papa dextrosa agar (PDA), luego se cortaron discos de papel filtro (filtración media 8 µm de poro) con 0.5 mm de diámetro y se esterilizaron en autoclave a 120 lb de presión por 20 min. Posteriormente en condiciones asépticas los discos de papel filtro (cuatro discos para cada extracto alcohólico) se impregnaron con 150 µL de cada extracto alcohólico y se dejaron reposar hasta que el disco absorbió por completo el extracto. Después las cajas de Petri con PDA se inocularon con un disco del hongo R. solani, el cual se colocó en el centro de la caja con medio de cultivo.
Se colocaron cuatro discos impregnados de cada extracto de forma equidistante al disco con micelio de R. solani. R. solani fue aislado de la rizósfera de chile poblano (Capsicum annuum L.) y forma parte del cepario del departamento de Fitopatología del Colegio de Posgraduados Campus Montecillo, Edo de México. Dentro de los tratamientos se incluyeron un control de agua destilada estéril, un control de metanol y un control de etanol. Las cajas se incubaron a 28 °C por tres días, transcurrido el tiempo de incubación se observó si había inhibición sobre el crecimiento de R. solani y se midió con una regla el diámetro de inhibición en milímetros alrededor del disco impregnado con el extracto, todos los tratamientos se realizaron por triplicado.
Difusión en pozos
Se prepararon cajas de Petri con medio PDA y se realizaron tres perforaciones en el agar con ayuda de un sacabocados de 0.5 mm de diámetro. A cada pozo se le colocó 100 µL de cada extracto alcohólico (etanol-agua 1:1, metanol-agua 1:1, etanol-agua 3:7 y metanol-agua 3:7), luego en el centro de cada caja se colocó un disco de R. solani con micelio fresco (Cruz et al., 2010). Dentro de los tratamientos se incluyeron un control de agua destilada estéril, un control de metanol y un control de etanol (todo por triplicado). Posteriormente las cajas se incubaron a 28 °C durante tres días, transcurrido el tiempo de incubación se observó si había inhibición sobre el crecimiento de R. solani cercana al pozo, para medir el halo de inhibición se midió en milímetros.
Dilución en placa
Determinación de la concentración de una solución de fragmentos de micelio de R. solani
Se prepararon 100 mL de caldo papa dextrosa, luego el medio de cultivo se inoculó con un disco de 7 mm de diámetro de micelio fresco de R. solani. Se incubó durante cuatro días a 28 °C, transcurrido este tiempo se filtró la solución fúngica a través de un sistema filtrante estéril (columna de plástico empacada con algodón), para permitir el paso de los fragmentos más pequeños de micelio. La concentración de los fragmentos de micelio del líquido filtrado se estimó utilizando una cámara de Neubauer.
Una vez conocida la concentración de la solución de fragmentos de micelio fúngico (2 x 107 fragmentos de micelio / mL, 1X104 UFC) se determinó la actividad antifúngica por el método de microdilución en placa utilizando el método descrito por Casaril et al. (2011); Ren et al. (2014) con modificaciones. En cada pozo de una placa de 96 pozos se colocó, 100 μL de caldo papa dextrosa, 50 μL del respectivo extracto alcohólico de los hongos comestibles (etanol-agua 1:1, metanol-agua 1:1, etanol-agua 3:7 y metanol-agua 3:7) y 50 μL de la solución de fragmentos de micelio de R. solani. Dentro de los tratamientos se incluyeron un control de agua destilada estéril, un control de metanol, un control de etanol, un control de caldo de papa dextrosa y un control de papa dextrosa todos con solución de fragmentos de micelio de R. solani (todo por triplicado).
Posteriormente las cajas se incubaron a temperatura ambiente en un agitador horizontal a 400 rpm por cuatro días, transcurrido este tiempo se leyó la absorbancia a 595 nm con un lector de microplacas. La actividad antifúngica se midió comparando las densidades ópticas de los pozos que contienen los mismos extractos y controles. El porcentaje de inhibición del crecimiento fúngico se calculó usando la siguiente ecuación:
Donde: AF es la absorbancia del control fúngico sin la adición del extracto; AFE es la absorbancia de la mezcla (extracto alcohólico y suspensión de fragmentos de micelio) y AE es la absorbancia del extracto correspondiente.
Análisis estadístico
Para la técnica de dilución en placa el bioensayo se estableció bajo un diseño experimental completamente al azar con tres repeticiones. A los datos obtenidos se les realizó un análisis de varianza Anova y la prueba de comparación de medias (Tukey, α= 0.05) con el programa estadístico SAS Institute, 2020
Resultados y discusión
Actividad antifúngica de los extractos hidroalcohólicos por las técnicas de difusión en pozos, difusión en discos y dilución en placa
Difusión en disco
En los resultados obtenidos con el método de difusión en disco se observó que el hongo en algunos tratamientos como el extracto etanólico de A. jacksonii en su dilución 1:1 de metanol-agua, aunque también el extracto de A. rubescens en la dilución 3:7 de etanol-agua y 1:1 metanol-agua; extracto de U. maydis dilución 3:7 metanol-agua y L. deliciosus dilución 3:7 etanol-agua; creció de manera más lenta y menos abundante en comparación con los controles (Figura 1).
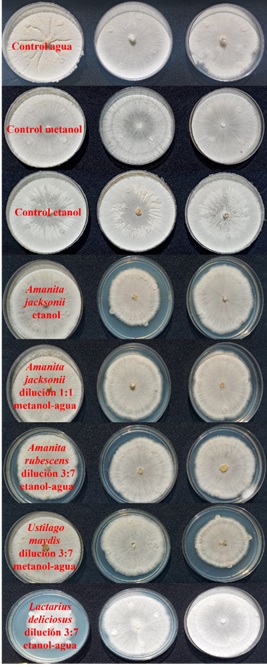
Figura 1 Extracto alcohólicos y diluciones de Amanita jacksonii contra Rhizoctonia solani a 28 °C por tres días de incubación.
Se observó de manera cualitativa que R. solani creció de manera más lenta en el extracto de A. rubescens en la dilución 3:7 de etanol-agua, donde el hongo no creció de manera homogénea y en la totalidad de la superficie del PDA como en el caso de los controles. Si bien el perfil metabólico de cada hongo es único (Shen et al., 2017), la observación de la afectación en el crecimiento y desarrollo de R. solani podría deberse a los metabolitos reportados en extractos alcohólicos de hongos comestibles, como los compuestos fenólicos de bajo peso molecular que tienen actividad antimicrobiana (Alves et al., 2013).
Otra posibilidad es que un mínimo porcentaje de los metabolitos polares de naturaleza fenólica quedaron libres en los extractos alcohólicos de algunos macromicetos y pudieron difundirse sobre el agar mostrando un crecimiento más lento en R. solani con respecto a los controles (Naczk y Shahidi, 2006). Además, la difusión en disco depende directamente de la capacidad de difusión de las sustancias activas presentes en los extractos, lo que puede provocar poca movilidad de los metabolitos en el agar si estos presentan baja solubilidad o alta masa molecular.
Difusión en pozo
No se observó ningún efecto sobre el crecimiento de R. solani con los extractos alcohólicos y sus diluciones, Figura 2, ya que R. solani creció dentro y fuera de los pozos con extractos. Estos resultados podrían relacionarse con el peso molecular de los compuestos presentes en el extracto, ya que si es muy alto el peso molecular de los compuestos o si presentan baja solubilidad se dificultará su movilidad por el agar (no difusibles), está podría ser una razón por la cual no se observó ningún efecto inhibitorio por parte de los extractos alcohólicos y sus diluciones (Ren et al., 2014; Martínez et al., 2021).

Figura 2 Diluciones de extractos alcohólicos de Lactarius deliciosus, Ustilago maydis, Amanita jacksonii y Amanita rubescens contra Rhizoctonia solani a 28 °C por tres días de incubación.
Si bien no se conoce que tipo de metabolitos están presentes en los extractos de los hongos comestibles probados, se debe destacar que el material fúngico fue utilizado en fresco y por el tipo de disolventes utilizados (metanol, etanol y agua) se buscaba arrastrar en los extractos, metabolitos polares como polifenoles, azúcares, alcaloides, saponinas, glucósidos y algunas proteínas provenientes de hongos macromicetos (Naczk y Shahidi, 2006; Akpi et al., 2017). La presencia o ausencia de estos metabolitos en los extractos dependerá del entorno en donde se desarrolla el hongo y las diferentes fuentes de nutrientes disponibles durante su crecimiento (Shen et al., 2017).
También puede existir la posibilidad que los compuestos polares presentes en los extractos alcohólicos de los hongos comestibles no tuvieran actividad inhibitoria contra R. solani en la técnica de difusión de pozo. Por otro lado, se ha reportado que para el género Amanita los péptidos son los principales constituyentes de los extractos polares, dichos metabolitos presentan mayor actividad antimicrobiana en medio líquido o caldo que en medios sólidos como el agar, debido a que tienen baja solubilidad (Li y Oberlies, 2005).
Dilución en placa
Los resultados indican que la mayor actividad inhibitoria la presentó la dilución etanol-agua 1:1 de L. deliciosus (88%), mientras que la menor actividad inhibitoria la tuvo el extracto etanólico de A. rubescens (0.5%), Figura 3. Estos resultados difieren con los encontrados en las técnicas de difusión de pozos y discos. Este comportamiento, se puede explicar con lo que se reporta en la literatura (Ren et al., 2014; Balouiri et al., 2016), pues nos mencionan que, en la técnica de dilución en placa, los metabolitos presentes en los extractos tienden a difundirse mejor en medios líquidos que en sólidos, tal es el caso del caldo de papa dextrosa que se utilizó en esta técnica.

Figura 3 Extractos alcohólicos y diluciones de hongos comestibles con actividad inhibitoria sobre el crecimiento de Rhizoctonia solani. Media ± error estándar, n= 3.
Una de las ventajas de utilizar esta técnica es su capacidad para identificar la actividad antimicrobiana y cuantificarla de manera precisa, ya que los resultados no se ven afectados por la tasa de crecimiento de los diferentes microorganismos (Morales et al., 2013). La cual es una posible razón de que se presentan inhibiciones más fuertes con mayor efectividad. La actividad inhibitoria presentada por el extracto etanólico y la dilución etanol-agua 1:1 de L. deliciosus en el crecimiento de R. solani, se puede atribuir a la presencia de compuestos fenólicos contenidos en el extracto etanólico de este hongo comestible (Zavastin et al., 2015).
L. deliciosus posee actividad antifúngica probada como lo reporta Volcão et al. (2021) que evaluaron la actividad antifúngica del extracto hidroalcoholico obtenido de L. deliciosus contra el fiopatógeno Monilinia fructicola (Wint.), reportan que el extracto inhibió el crecimiento fúngico y redujo el desarrollo micelial del fitopatógeno a una concentración de 1.25 mg L-1. Por otra parte, también se debe considerar el procesamiento del material fúngico (fresco o secó), el tiempo de extracción y el tipo de solvente, lo cual influirá en la actividad antimicrobiana de los extractos (Adhikari et al., 2018).
Dentro de los solventes más utilizados para realizar la extracción de metabolitos en hongos se encuentra el agua, etanol, metanol, acetona y acetato de etilo (Elbatrawy et al., 2015). En los resultados encontrados en este estudio fue una dilución etanol-agua 1:1 de L. deliciosus quien presentó mayor actividad antifúngica, aun mayor que aquellos extractos que no tenían ninguna dilución y solo era el solvente, una posible explicación de este comportamiento es lo reportado por Yim et al. (2012) quienes señalan que el mejor solvente para la extracción de compuestos fenólicos de hongos es el agua ya que esta no rompe los enlaces glucosídicos, lo que indica la presencia de fenoles libres. En la dilución 1:1 la presencia del agua favoreció la extracción de los fenoles libres y por ello se pudo cuantificar la mayor actividad antifúngica de este extracto.
Conclusiones
En cuanto a la difusión en disco se observó en algunos tratamientos que el hongo no crecía de manera homogénea como en los controles, lo que sugiere de manera cualitativa crecimiento lento de R. solani; sin embargo, hacen falta más evidencias y estudios para afirmar que con esta metodología hay algún efecto inhibitorio cuantificable. Mientras que en el método de difusión por discos no se encontró inhibición del crecimiento de R. solani. No obstante, los resultados obtenidos por la técnica de dilución en placa se consideran confiables, ya que los extractos alcohólicos (y diluciones) tuvieron un contacto directo en medio líquido con R. solani en los pozos de la microplaca.
Por lo cual, la dilución etanol-agua 1:1 de L. deliciosus, extracto de etanol de L. deliciosus, extracto de metanol de U. maydis y extracto de metanol de L. deliciosus deben de ser estudiados con mayor profundidad, al probarlos en un sistema in vivo e identificar los metabolitos presentes.











 text in
text in 


