Introducción
El mango (Mangifera indica L.) es uno de los frutos tropicales más importantes en el mundo, debido a su característico sabor dulce, aroma, textura cremosa y a sus propiedades nutricionales; además México ocupa el primer lugar en exportación a nivel mundial (Altendorf, 2019). Los principales productores de mango en el país son Sinaloa (19.04%), Guerrero (18.7%), Nayarit (15.42%) y Chiapas (12.85%), donde el mango cv Ataulfo es uno de los cultivares más importantes a nivel nacional con más del 31% de la superficie cultivada (63 971 ha) y es uno de los mayormente exportados a EE. UU. y Canadá (Ariza-Flores et al., 2018; SIAP, 2021).
Durante el proceso de maduración del fruto de mango, se llevan a cabo reacciones bioquímicas como la pérdida de firmeza causado por enzimas que degradan polisacáridos complejos de la pared celular y el incremento en el contenido de azúcares en la pulpa (Tharanathan et al., 2006; Litz, 2009). Estos cambios facilitan que los frutos sean más susceptibles al ataque de fitopatógenos o al desarrollo de hongos presentes en estado latente como Colletotrichum spp., lo que reduce la calidad pre y postcosecha (Tovar-Pedraza et al., 2020; Fuentes‐Aragón et al., 2020).
La mayoría de las pérdidas postcosecha del fruto de mango son generadas por la antracnosis causada por el hongo Colletotrichum gloeosporioides, con pérdidas entre 30 y 60% de la producción, el cual además afecta a hojas e inflorescencias (Benítez-Camilo et al., 2003; Carrillo-Fasio et al., 2005; Huerta-Palacios et al., 2009). En condiciones inadecuadas de manejo agronómico del cultivo de mango, la antracnosis puede estar presente en cualquier estado de desarrollo de los frutos. En frutos tiernos, el hongo puede prevalecer en su forma latente, manifestándose después de su madurez fisiológica con lesiones irregulares hundidas de color café oscuro o negro en la cáscara, así como también pequeñas lesiones circulares oscuras en el pedicelo y pedúnculo (Carrillo-Fasio et al., 2005; Tovar-Pedraza et al., 2020; Fuentes‐Aragón et al., 2020).
En México, al menos siete especies crípticas pertenecientes al complejo C. gloeosporioides (C. siamense C. asianum, C. tropicale C. alienum C. fructicola, C. chrysophilum y C. queenslandicum) se han identificado con base en análisis filogenéticos multilocus como las especies causantes de los síntomas de antracnosis en tejidos de mango. Sin embargo, C. siamense y C. asianum son las especies más comunes y ampliamente distribuidas (Tovar-Pedraza et al., 2020; Fuentes‐Aragón et al., 2020; Mora-Aguilera et al., 2021). Lo anterior, genera nuevas interrogantes acerca de la respuesta fisiológica del fruto frente a estas especies fúngicas.
Se ha reportado que la patogenicidad de las especies de Colletotrichum en frutos puede variar por efecto de las condiciones ambientales y de los hospedantes (Sharma et al., 2013). Por lo que es importante conocer la respuesta fisiológica y la calidad postcosecha de los frutos de mango expuestos a diferentes especies de Colletotrichum. El objetivo de este trabajo fue determinar la virulencia de C. siamense y C. asianum en frutos de mango cv Ataulfo, además de estimar su efecto en los parámetros de calidad y actividad respiratoria durante almacenamiento.
Materiales y métodos
Material vegetal
Se utilizaron frutos de mango cv Ataulfo con madurez fisiológica cosechados de una huerta comercial ubicada en Los Mochis, Sinaloa, México. Los frutos se seleccionaron de acuerdo con el color, tamaño uniforme y sin daños visuales; se lavaron con hipoclorito de sodio al 1% durante 2 min, se enjuagaron con agua destilada, se asperjaron con alcohol al 70% y se dejaron secar (Tovar-Pedraza et al., 2020).
Inoculación de frutos de mango
Por duplicado, los frutos se dividieron en tres lotes; los lotes 1 y 2 se inocularon con las cepas de C. siamense (UACH 334) y C. asianum (UACH 310) (Tovar-Pedraza et al., 2020) y el tercero se utilizó como el testigo sin inoculación. Previamente, los aislados de Colletotrichum spp. Se dejaron 10 días en crecimiento en medio de cultivo papa dextrosa agar (PDA, BD Bioxon, México) a 28 °C. Se cortaron discos de 5 mm de diámetro de agar con el hongo y se colocaron en una herida inducida de 1 mm de diámetro por 1 mm de profundidad en la superficie del epicarpio de los frutos según Álvarez et al. (2020). Posteriormente, todos los frutos se almacenaron a 28 °C a 85-90% de humedad relativa (HR).
Análisis de virulencia
La prueba de virulencia en los mangos inoculados se midió con un vernier, se consideró el diámetro de las lesiones de forma perpendicular y se promediaron los valores en cada uno de los frutos a los 0, 2, 4, 6, 8 y 10 días de almacenamiento. Los resultados se expresaron en milímetros (mm).
Color
El color externo e interno de los frutos se determinó con un espectrofotómetro Konica modelo CM-700 (Minolta Inc., Japón) y las coordenadas de color L*, a*, b*, así como cromaticidad (C) y ángulo de matiz (h) se calcularon con el programa OnColor QC versión 5 (Siller-Cepeda et al., 1994).
Respiración
La respiración se midió en tres frutos por tratamiento a los 1, 2, 4, 6, 8 y 10 días posteriores a la inoculación (DPI), se colocaron frutos individuales en un sistema cerrado (3.8 L) por una hora, se tomó la muestra del gas acumulado y se evaluó la producción de CO2. El análisis se determinó en un cromatógrafo de gases modelo Agilent Technologies 7820 adaptado con un detector de conductividad térmica para el analizar CO2, equipado con una columna HayeSep Q de 1.83 m x 3.175 mm. Se utilizó helio como gas acarreador con un flujo de 25 ml min-1. Como estándar se utilizó CO2 al 0.52% en mezcla con nitrógeno (Praxir, México). Los resultados se expresaron en ml CO2 kg-1 h-1.
Parámetros de calidad
Para la calidad de los frutos se evaluó la pérdida de peso, firmeza, pH, acidez titulable y sólidos solubles totales a los 0, 2, 4, 6, 8 y 10 DPI. El porcentaje de pérdida de peso se evaluó con la diferencia de peso inicial y final de los frutos de mango (Muy-Rangel et al., 2004). La firmeza reportada en Newtons (N) se determinó como el esfuerzo para penetrar la pulpa del fruto utilizando un penetrómetro modelo DFGS-100 (Chatillon Digital Force, EE. UU.) Con un punzón cilíndrico de 8 mm de diámetro (Bourne, 1980). Para los sólidos solubles totales (SST) se utilizó un refractómetro modelo RM-40 (Mettler Toledo, México), los resultados se expresaron en sólidos solubles totales (Brix) (AOAC, 1998). La acidez titulable (AT) reportada en (%) de ácido cítrico y el pH se determinaron en un titulador automático modelo T-50 (Mettler Toledo, México) (AOAC, 1998).
Análisis estadístico
Para la prueba de virulencia en los frutos de mango con las dos especies de Colletotrichum (C. siamense y C. asianum), se realizó un diseño de medidas repetidas. La variable de respuesta fue diámetro de la lesión. Para el análisis de firmeza, pH, acidez titulable, sólidos solubles totales y color interno se realizó un diseño completamente al azar con arreglo factorial A x B. El factor A fueron los tratamientos mango-C. siamense, mango-C. asianum y testigo, y el factor B los días de muestreo (0, 2, 4, 6, 8 y 10 DPI). Para las variables de pérdida de peso, color externo y respiración en los frutos se utilizó un diseño de medidas repetidas en el tiempo. Las diferencias de los parámetros evaluados fueron determinadas por un Anova con significancia de 5% y una prueba de Tukey en el paquete estadístico NCSS (2020).
Resultados y discusión
Análisis de virulencia
El aislado de C. siamense presentó un crecimiento algodonoso, de forma circular, de coloración blanco y ligeramente gris, mientras que C. asianum mostró un crecimiento micelial algodonoso e irregular, de coloración blanco-grisáceo; ambas características fueron similares a lo reportado por Tovar-Pedraza et al. (2020), lo que avala la reproducibilidad del hongo. Los síntomas de la enfermedad se caracterizaron por presentar lesiones negras, irregulares y hundidas, así como crecimiento micelial gris y producción de cuerpos fructíferos asexuales (acérvulos) del hongo en la cutícula del fruto.
Las especies C. asianum y C. siamense se han asociado con más frecuencia a la antracnosis con una alta patogenicidad en diferentes cultivares de mango y distribución en todo el mundo (Lima et al., 2013; Sharma et al., 2013; Pardo‐De la Hoz et al., 2016; Liu et al., 2017; Fuentes‐Aragón et al., 2020; Tovar-Pedraza et al., 2020; Mora-Aguilera et al., 2021). En el análisis de virulencia, se observó mayor tamaño de lesión en los frutos inoculados con C. siamense con valores máximos de 33 mm a los 10 días de almacenamiento (Figura 1), similar a lo reportados por Li et al. (2019), para frutos de mango inoculados con C. gloeosporioides almacenados a ocho días 25 °C a HR de 85-90%.

Figura 1 Diámetro de lesión en frutos de mango cv Ataulfo inoculados con Colletotrichum siamense y C. asianum, almacenados 10 días a 28 °C con 85-90% HR. Las barras indican desviación estándar. Mismas letras en superíndices son estadísticamente iguales (Tukey p> 0.05).
Tovar-Pedraza et al. (2020), observaron en mango Manila un menor tiempo de propagación de Colletotrichum spp. (5 DPI) contra 8 DPI. El mango Ataulfo presenta mayores cantidades de fenoles, flavonoides y betacarotenos tanto en pulpa como en cáscara (Manthey y Perkins-Veazie, 2009; Sulaiman y Ooi, 2012), los cuales podrían actuar como componentes de inhibición del crecimiento del hongo. Además, en la cáscara de los frutos de mango inmaduros se encuentran algunos compuestos antifúngicos como quitinasas, galotaninos y resorcinoles (5-12-cisheptadecenyl resorcinol y 5-pentadecenyl resorcinol) que van disminuyendo con la maduración y están implicados en la resistencia a patógenos como Alternaria alternata y C. gloeosporioides (Droby et al., 1987; Karunanayake et al., 2011; Sinniah et al., 2012).
La concentración de estos compuestos antifúngicos puede variar entre los cultivares de mango, lo que genera una resistencia diferencial frente a la infección por Colletotrichum pero también ésta respuesta puede ser distinta en un mismo cultuvar frente a diferentes especies de Colletotrichum (Karunanayake et al., 2011; Sinniah et al., 2012; Fuentes‐Aragón et al., 2020).
El crecimiento micelial y los síntomas de la enfermedad en los mangos inoculados con Colletotrichum spp. Mostraron diferencias significativas al día 10 de almacenamiento con respecto al testigo; pero no entre especies (Figura 1). Sin embargo, en la Figura 2 se muestra de manera subjetiva que C. siamense provocó lesiones irregulares hundidas de coloración negra más grandes en comparación con las producidas por C. asianum. Por lo que, para deducir el efecto del estrés biótico que causa Colletotrichum spp. En mango es importante analizar los cambios fisiológicos y la respuesta de defensa a nivel bioquímico y molecular en los frutos.
Color
Las variables del color externo e interno de los frutos (Figura 2) no fueron estadísticamente diferentes entre los mangos, pero si durante el tiempo de almacenamiento (p< 0.05). Para el color externo al día cero, los frutos fueron menos luminosos, de menor saturación y con valores 90 °h, que corresponden a mangos en madurez fisiológica de color amarillo-verdoso; variables que cambiaron significativamente los primeros cuatro días de almacenamiento. Posteriormente, los frutos mostraron una tendencia de cambio con valores finales de L= 62, mayor saturación de color= 60 y un tono= 65 °h que corresponde a frutos en madurez de consumo de color amarillos-naranjas, según el círculo de color de Minolta (1994).
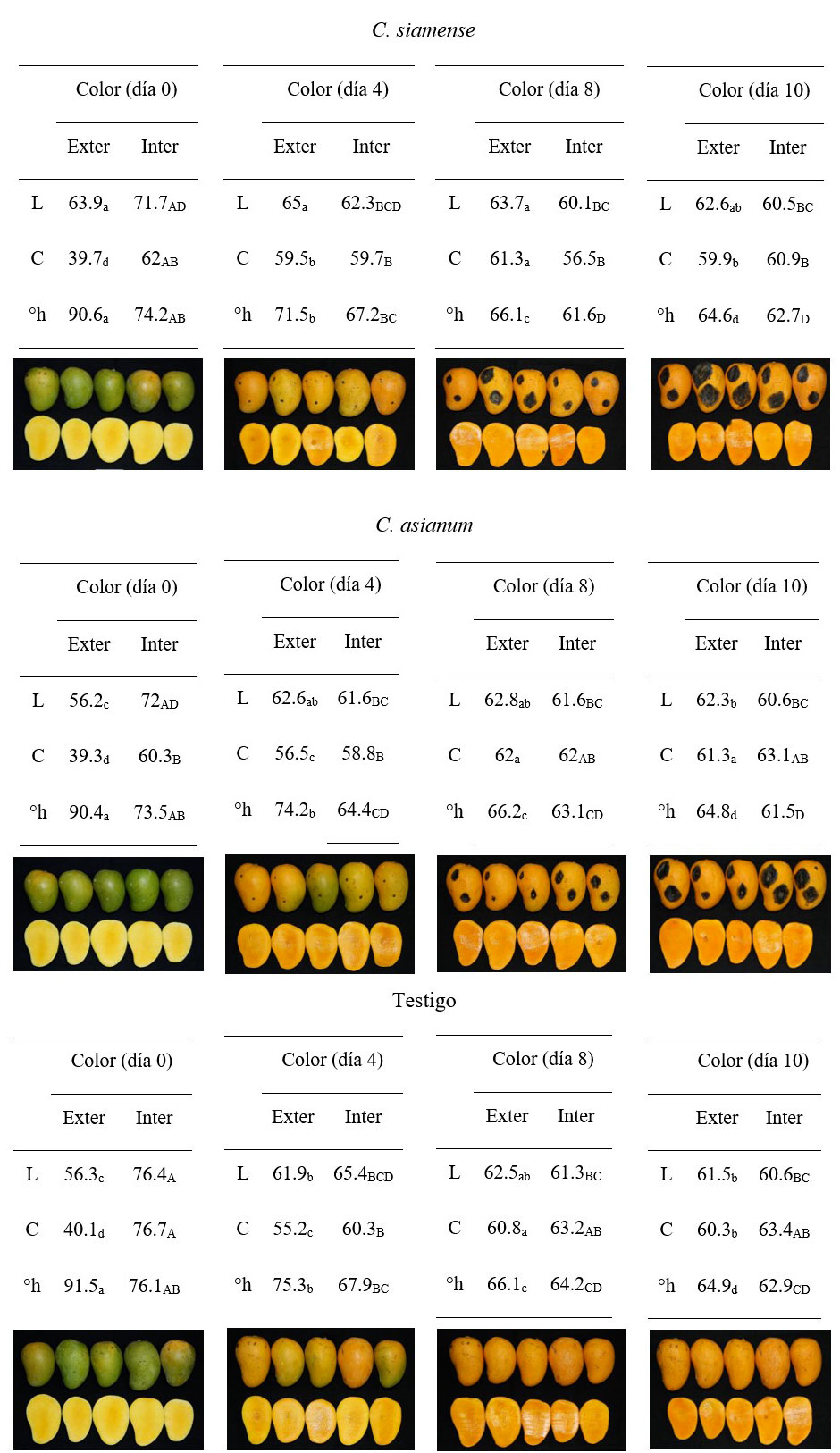
Figura 2 Efecto de los síntomas de antracnosis inducidos por Colletotrichum siamense y C. asianum en la apariencia del mango cv Ataulfo y datos del color externo (exter) e interno (inter) en luminosidad (L); cromaticidad (C); y ángulo de matiz (°h) almacenados 10 días a 28 °C con 85-90% de HR. Valores con letras iguales por variable de respuesta entre color externo (minúsculas) y color interno (mayúsculas) son estadísticamente iguales (Tukey p> 0.05).
El color de la pulpa de los mangos mostró un cambio de amarillo claro (h= 74) a amarillo a ligeramente anaranjado (h= 63). Los valores de luminosidad y tono presentaron en promedio una tendencia de cambio lineal de -2.4 unidades por cada dos días de almacenamiento, mientras que la saturación de color fue polinómica de orden 2 con un incremento durante la maduración de los frutos. Huerta-Palacios et al. (2009) reportaron oscurecimiento, pudrición y desarrollo de acérvulos entre la pulpa y la superficie de la cáscara en zonas dañadas por Colletotrichum.
De igual manera, se reporta cambio de color de la cáscara del mango por efecto del hongo, por la presencia de hifas que pueden penetrar las células epidérmicas y degradar las paredes celulares mediante enzimas hidrolíticas, ocasionando la muerte del tejido del hospedante (Sandoval-Chávez et al. 2015). El cambio en el color del mango durante la maduración ocurre por la degradación de la clorofila y la acumulación de carotenoides y pigmentos fenólicos (Tharanathan et al., 2006). Cultivares de mango como Ataulfo y Manila Súper pierden su color verde y aparecen tonalidades amarillas y anaranjadas en frutos en madurez de consumo, lo que es proporcionado por los carotenoides (Ortiz et al., 2002; Singh et al., 2013), como se observó en los frutos del experimento.
Respiración
Los frutos de mango presentaron su máxima actividad respiratoria a los dos días de almacenamiento, sin diferencia significativa entre los frutos inoculados (153.6 para C. siamense y 168.7 ml CO2 kg-1 h-1 para C. asianum), pero si con los frutos testigo (132.2 ml CO2 kg-1 h-1) (Figura 3). El incremento en la actividad respiratoria a los pocos días de almacenamiento se puede relacionar con frutos de madurez avanzada al inicio del experimento, lo cual se corrobora con valores de menor acidez y mayores sólidos solubles totales al corte; lo que coincide con lo citado por Osuna-García et al. (2002).
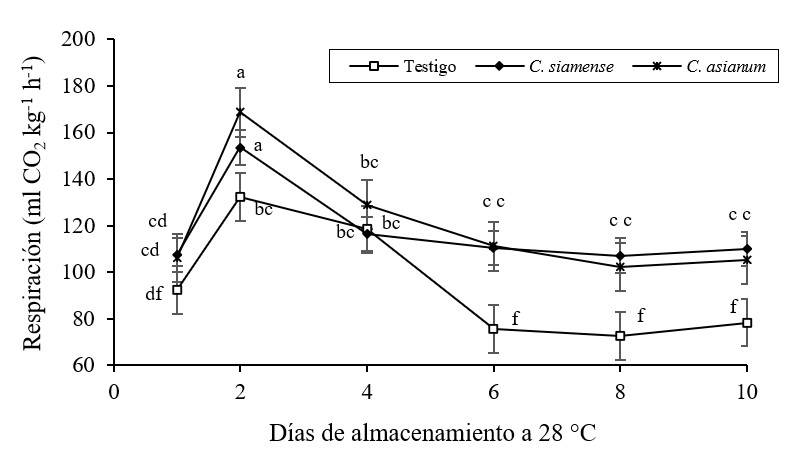
Figura 3 Comportamiento respiratorio en frutos de mango cv Ataulfo inoculados con Colletotrichum siamense y C. asianum, almacenados 10 días a 28 °C con 85-90% HR. Las barras indican error estándar (n= 3). Mismas letras por tratamiento y día son estadísticamente iguales (Tukey p> 0.05).
Por su parte, Cienfuegos et al. (2004) reportaron para frutos de mango cv Kent en madurez fisiológica, la máxima actividad respiratoria a los seis días de almacenamiento a 27 °C (62.7 ml CO2 kg-1 h-1), mientras que Dautt-Castro et al. (2019) la observaron a los 13 días a 20 °C (62.29 ml CO2 kg-1 h-1) para mango cv Kent. Similar a este trabajo, Palafox-Carlos et al. (2012) reportaron una actividad respiratoria de 122.2 ml CO2 kg-1 h-1 en mango cv Ataulfo que lo relacionó con una etapa de madurez avanzada.
De manera general, la actividad respiratoria de los frutos de mango depende de la variedad, el estado de madurez y temperatura de almacenamiento, con un comportamiento climatérico y una actividad respiratoria decreciente hasta la senescencia de los frutos (Martínez-González et al., 2017; Palafox-Carlos et al., 2012), la cual se acelera en presencia de fitopatógenos, como se observó en este estudio. La producción de etileno y CO2 durante la maduración climatérica desencadena la transducción de señales para la activación de varios factores de transcripción que a su vez activan la expresión de genes que codifican enzimas que catalizan cambios en la maduración como color, sabor, textura, aroma, entre otros (Grierson, 2013; Martínez-González et al., 2017; Dautt-Castro et al., 2019).
Firmeza
La pérdida de firmeza fue similar entre los frutos inoculados y testigos durante el almacenamiento, 85% de pérdida se presentó en los primeros cuatro días, sin cambios significativos durante los días posteriores de almacenamiento, con valores promedios de 7 N (Figura 4). Es importante citar que el hongo afectó un área localizada del fruto (Figura 2) y los valores de la textura de la fruta no se tomaron exactamente en la zona dañada. Quintero et al. (2013); Dautt-Castro et al. (2019) reportaron una pérdida de firmeza por debajo de los 20 N a los 10 días en frutos de mango de distintos cultivares y diferentes condiciones de almacenamiento.
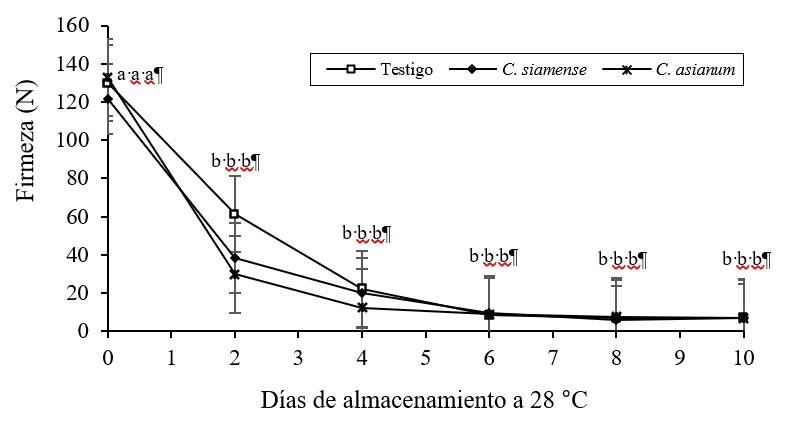
Figura 4 Firmeza en frutos de mango cv Ataulfo inoculados con Colletotrichum siamense y C. asianum, almacenados 10 días a 28 °C con 85-90% HR. Las barras indican error estándar (n= 5). Mismas letras por tratamiento y día son estadísticamente iguales (Tukey p> 0.05).
Por su parte, Carrillo-Fasio et al. (2005) observaron una firmeza de 20 N a los 12 días en mango cv Kent con antracnosis. Sin embargo, Kader (2008) señaló que la firmeza del mango para consumo debe estar entre 13 y 26 N, lo cual se presentó a los cuatro días para los mangos de este estudio, posiblemente debido al estado de madurez y a la temperatura de almacenamiento. De manera natural, el cambio de la firmeza del mango se debe a la ruptura de las paredes celulares, causada por la degradación enzimática de polisacáridos como celulosas, hemicelulosas y pectinas y a la generación de azúcares de bajo peso molecular solubles en agua y cuantificados como sólidos solubles (Islas-Osuna et al., 2010; Quintero et al., 2013; Singh et al., 2013).
Los mangos inoculados de este estudio mostraron de manera subjetiva una mayor ruptura de la cáscara, posiblemente inducida por las enzimas hidrolíticas del patógeno, en comparación con los frutos testigo (Figura 2). Se ha sugerido que una firmeza menor a 20 N en frutos de mango puede provocar daños mecánicos durante su manipulación y almacenaje, además que se considera de mala calidad para su comercialización (Quintero et al., 2013).
Pérdida de peso
Todos los frutos de mango mostraron en promedio 1% de pérdida de peso por día, con un comportamiento lineal creciente, dependiente de los días de almacenamiento y sin diferencia significativa entre los mangos inoculados y los testigos. La pérdida de peso (PP) de los frutos se expresa: inoculados con C. simanese (%PP= 1.159*día-0.01, R2= 0.9998), C. asianum (%PP= 1.047*día-0.05, R2= 0.99) y el testigo (%PP= 1.039*día-0.09, R2= 0.9983), con diferencia significativa entre el tiempo de almacenamiento por efecto de la actividad fisiológica.
Para mango cv Ataulfo almacenando por 12 días a 20 °C se reporta una pérdida de peso de 9% y para las mismas condiciones, valores entre 2.5 y 5.4% para mangos cv Haden, Manila Rosa, Tommy Atkins y Kent (Siller-Cepeda et al., 2009), donde la PP está claramente relacionada con la variedad. Por otro lado, Carrillo-Fasio et al. (2005) encontraron una pérdida de peso de 4.6% en mango cv Kent almacenado nueve días a 20 °C con presencia de C. gloeosporioides. La mayor pérdida de peso en los frutos de mango de este estudio se puede deber a la mayor temperatura de almacenamiento utilizada (28 °C).
pH, acidez titulable y sólidos solubles totales (SST)
Durante el proceso de maduración de los frutos, el pH y los sólidos solubles incrementaron y la acidez disminuyó de manera significativa durante el tiempo de almacenamiento, mientras que la inoculación de los frutos con las dos especies de Colletotrichum no tuvo efecto significativo en comparación con el testigo. Al día cero y a los 10 días a 28 °C los mangos presentaron valores de pH 2.9 a 5, acidez de 3.2 a 0.12% de ácido cítrico y SST de 10 a 18 °Brix, los cuales corresponden a un comportamiento normal de madurez del fruto con buena calidad química.
Quintero et al. (2013) reportaron para mango un rango de pH de 3.3 a 5.3, acidez de 1.5 a 0.35% de ácido cítrico y de SST de 10.5 a 20 °Brix durante 10 días de almacenamiento a 25 °C. Los resultados citados son similares a los del mango cv Ataulfo maduro, ya que el mango Ataulfo verde es más acido que la mayoría de los mangos, lo que se refleja en el pH y la acidez. Siller-Cepeda et al. (2009) estudiaron mangos Haden, Manila Rosa, Tommy Atkins y Kent almacenados 12 días a 20 °C y observaron un pH inicial de 2.9 a 4.7 y un pH final de 3.9 a 4.9. Los °Brix encontrados en estos mismos cultivares en la maduración máxima fueron menores a los 18°Brix encontrados en mango Ataulfo, lo que indica que los mangos cv Ataulfo pueden desarrollar mayor dulzor.
Los cambios bioquímicos que ocurren durante la maduración de los frutos incluyen la degradación de polisacáridos que se reducen a carbohidratos de bajo peso molecular y la disminución de los ácidos orgánicos (Tharanathan et al., 2006; Siller-Cepeda et al., 2009; Quintero et al., 2013). Con la presencia de monosacáridos como la sacarosa, fructosa y glucosa durante los días de almacenamiento, incrementan los SST (°Brix) y el dulzor del mango (Tharanathan et al., 2006; Siller-Cepeda et al., 2009). Mientras que, la disminución de la acidez en frutos enfermos se debe a que los patógenos utilizan los ácidos orgánicos para llevar a cabo la actividad respiratoria (Ruiz y Guadarrama, 1992). Por el contrario, en los resultados de este estudio, todos los frutos mostraron un comportamiento similar en las variables de calidad química, esto pudo haber ocurrido debido a que la enfermedad no fue lo suficientemente severa y se encontraba localizada como para provocar cambios en la calidad del resto del fruto.
Los patógenos rompen las barreras preexistentes en las plantas y en los frutos (cutícula, pared celular y compuestos antifúngicos preformados) e inmediatamente se inicia el reconocimiento y la activación de defensas inducidas estructurales y bioquímicas a nivel local o sistémico que evitan que la infección y el patógeno se propaguen (Sinniah et al., 2012). La inducción de estas defensas provoca la acumulación de fitoalexinas, la síntesis de proteínas de fortalecimiento de la pared celular y de proteínas relacionadas a la patogénesis. Sinniah et al. (2012) reportaron la activación transcripcional de genes de defensa en la cáscara de frutos de mango (cv Karutha Colomban y Willard) como respuesta a la infección por C. gloeosporioides. Por lo que, es importante conocer el rol que tienen las defensas inducidas a nivel bioquímico y molecular de los frutos mango en la resistencia a patógenos como Colletotrichum spp.
Conclusiones
La infección inducida por Colletotrichum siamense y C. asianum en los frutos de mango cv Ataulfo en estado de madurez fisiológico, no generó diferencias significativas en la mayoría de los parámetros de calidad con respecto al testigo, a excepción del color interno y la respiración. Colletotrichum siamense presentó mayor virulencia en comparación con C. asianum en frutos de mango cv Ataulfo inoculados y ambas especies afectaron la apariencia visual en el área inoculada con respecto a los frutos testigo. Por lo que, es importante estudiar la respuesta bioquímica y molecular en áreas cercanas al tejido enfermo para entender la respuesta de defensa de los frutos a las distintas especies de Colletotrichum para generar datos que ayuden a establecer diferentes estrategias de control.











 text in
text in 


