Introducción
La ganadería, intensiva y extensiva, ha sido uno de los factores que ha incidido de manera negativa en la degradación de los suelos y también en el medio ambiente. Lo anterior es debido, entre otras causas, a la cantidad de desechos que se originan en la ganadería intensiva (Pinos-Rodríguez et al., 2012) y a la desforestación provocada por la tala de los bosques para establecer pastizales en grandes extensiones de tierras (Budowski, 1984), así como el mal manejo de la carga animal o sobrepastoreo en el caso de la ganadería extensiva (SEMARNAT, 2015). Algunas medidas que apoyan la recuperación de los suelos degradados son incrementar y mantener la diversidad de especies vegetales e incluir leguminosas herbáceas y arbustivas en el sistema (Crespo, 2009).
Prosopis laevigata (Humb. & Bonpl. ex Willd.) M. C. Johnst, más conocido en México como mezquite, es una leguminosa que se desarrolla en las regiones áridas y semiáridas del centro y norte de México. El mezquite tiene múltiples usos, ya que su madera es usada como combustible, para construcción de cercas; sus vainas se utilizan como forraje y como alimento incluso para el hombre; produce resina que tiene uso en la fabricación de pegamentos, barnices; en tanto, sus flores son importantes en la producción de miel (Rodríguez et al., 2014). Desde el punto de vista ambiental se conoce que previene los procesos de desertificación y erosión por su alta capacidad de retención del suelo, mejora la fertilidad, entre otros atributos (Palacios et al., 2016).
Las leguminosas, además de presentar gran importancia como forraje, debido a sus cualidades nutricionales, su alto contenido proteico y digestibilidad respecto a otros grupos de plantas, son capaces de mejorar la estructura y la fertilidad del suelo mediante la fijación biológica del nitrógeno, esta capacidad la realizan a través de la simbiosis que establecen con bacterias conocidas como rizobios (Bianco y Cenzano, 2018). Esta cualidad facilita una adecuada nutrición nitrogenada a este grupo de plantas, lo que, a su vez, disminuye la necesidad de aplicar fertilizantes nitrogenados para garantizar su productividad (Cantaro-Segura et al., 2019).
Los hongos micorrízicos arbusculares (HMA) son microorganismos del suelo que forman simbiosis con 80% de las plantas terrestres (Vierheilig, 2004). Estos hongos colonizan las raíces de estas plantas, produciendo estructuras especializadas en la rizosfera mediante las cuales ayudan al hospedero a incrementar la adquisición de nutrientes y agua (Posada et al., 2008; Leigh et al., 2009).
También está comprobado que entre rizobio-planta-HMA se establece una simbiosis tripartita, la cual, conjuntamente con otros microorganismos del suelo, contribuye a mejorar el estado nutricional y los rendimientos de las plantas, además de conservar la fertilidad de los suelos (Toro et al., 2008).
Aunque se ha comprobado el beneficio experimentado por plántulas de P. laevigata con la inoculación con HMA (Gardezi et al., 2020), la efectividad de la simbiosis dependerá, en cierta medida, de la infectividad de las cepas (Tapia et al., 2010) y de las condiciones del suelo donde se pretende su establecimiento (Gryndler et al., 2009). En el caso de la inoculación con rizobios en P. laevigata la información es muy escasa para ser una leguminosa con potencial para establecer la simbiosis con estas bacterias; por esta razón, se hace necesario estudiar los efectos de la inoculación y coinoculación rizobios-HMA en esta especie.
A través de algunos estudios, se ha comprobado que ciertas especies de HMA presentan afinidad por uno u otro tipo de suelo, más que entre hospedero y simbionte (González et al., 2016). Por ejemplo, Glomus cubense suele ser más efectiva en suelos de mediana a alta fertilidad. En contraste, Funneliformis mosseae presenta mayor efectividad en suelos de baja fertilidad con tendencia a la acidez (Rivera y Fernández, 2003).
En el caso de los rizobios se conoce de la especificidad entre la especie y planta hospedera, aunque algunas especies de plantas se consideran promiscuas por mostrar alta compatibilidad con una gran variedad de especies de estas bacterias. Pero también, el suelo puede ser determinante para el buen funcionamiento de la simbiosis debido a que existen ciertos factores que la inhiben, como la salinidad, el pH, la deficiencia o toxicidad de ciertos elementos químicos (P, Ca, Mo y Al), presencia de nitrógeno combinado (NO3 -) y el exceso o déficit de agua, etc. (De Souza et al., 2003).
La información generada de dichos estudios contribuirá a garantizar que el manejo de la inoculación de estos microorganismos sea efectivo en función de la productividad de las plantas en distintas condiciones.
Teniendo en cuenta los beneficios que resultan de la ya mencionada simbiosis tripartita, utilizar aislados locales provenientes de distintas leguminosas arbustivas, inoculados de manera simple o coinoculados con HMA, pudiera contribuir a mejorar la nutrición, así como el incremento del crecimiento y producción de biomasa de las plántulas de P. laevigata. A partir de esta hipótesis, se realizó este trabajo para evaluar el efecto de la inoculación simple y combinada de dos cepas de HMA y tres aislados locales de bacterias fijadoras de nitrógeno (rizobios) provenientes de la rizosfera de Leucanena leucocephala y Vachellia schaffneri para determinar el comportamiento de las estructuras micorrízicas, la nodulación y el crecimiento de P. laevigata.
Materiales y métodos
Condiciones del experimento
El experimento se realizó bajo invernadero en la Facultad de Agronomía y Veterinaria de la UASLP. Como sustrato para el crecimiento de las plantas, se preparó una mezcla de suelo y arena de río en una proporción 1:1. El suelo utilizado procede de un área experimental de la Facultad; la arena fue extraída del cauce de un río. Se agregó 1 kg de sustrato a cada bolsa para vivero cuyas dimensiones fueron 20 x 12.5 cm de altura y ancho respectivamente. El sustrato preparado presentó 35, 66.3, 3 300 y 540 mg kg-1 de P, K, Ca y Mg respectivamente y 34.5 mg kg-1 (0.7% de las bases) de Na, 1.92% de materia orgánica (MO) así como un pH= 6.9.
Los métodos utilizados para determinar estos valores fueron los siguientes: pH (H2O) por potenciómetro (1:2.5, relación suelo: agua) (NC ISO 10390, 1999), materia orgánica por el método de Walkley y Black (NC 51, 1999), fósforo (P) asimilable por el método de extracción con H2SO4 0.05 mol L-1, Ca y Mg por complejometría y Na y K por fotometría de llama (NC 52, 1999).
Según los valores del análisis químico, el sustrato presentó concentraciones bajas de K y MO, altos valores de P asimilable, Ca y Mg, un porcentaje de Na aceptable y pH cercano a la neutralidad (Paneque y Calaña, 2011). El sustrato presentó un número de esporas de HMA promedio de 140 esporas 50 g-1.
Diseño experimental
El experimento se diseñó con 13 tratamientos, que consistieron en la inoculación de dos cepas de HMA (HMA1 y HMA2) y tres aislados de rizobios (R1, R2 y R3) inoculados de manera individual y en combinaciones, más un testigo sin inocular y un tratamiento de fertilización como referencia. Los tratamientos se conformaron de la manera siguiente: testigo sin inocular; tratamientos de inoculación simple (HMA1, HMA2, R1, R2, R3); tratamientos de inoculación combinada o coinoculación (HMA1+R1, HMA1+R2, HMA1+R3, HMA2+R1, HMA2+R2, HMA2+R3), testigo sin inocular con fertilización (Fert). Los tratamientos se distribuyeron en un diseño completamente aleatorizado con cinco repeticiones. La unidad experimental la conformó cada bolsa con una planta de P. laevigata.
Inoculantes empleados
El inóculo HMA1 [IMCAM 4 Glomus cubense (Rodríguez & Dalpé)] es procedente de la colección de hongos micorrízicos arbusculares del Instituto Nacional de Ciencias Agrícolas (INCA) en San José de las Lajas, Mayabeque, Cuba. El inóculo HMA2 [Claroideoglomus claroideum (Schenck & Sm.) Walker & Schüßler] fue aislado de una parcela en la zona cacahuatera de Ciudad Fernández, SLP, México (22° 00’ 47.36” latitud norte 100° 21’ 14.66” longitud oeste), de un suelo cuyas caracterizas texturales son de tipo arenosa y bajo contenido de arcilla. Ambos se prepararon a partir de esporas extraídas de inóculos previamente multiplicados en un sustrato arcilloso y esterilizado en autoclave a 120 °C por una hora durante tres días consecutivos; como cultivo trampa se utilizó Sorghum vulgare L.
El cultivo de células de rizobios fue preparado en medio Levadura-Manitol-Agar (LMA) líquido a 28 °C y en condiciones de agitación, durante 24-30 h (Vincent, 1970). Los rizobios se aislaron de plantas de Vachellia schaffneri (R1 y R2) y Leucaena leucocephala (R3). Las muestras de raíces de estas plantas fueron recolectadas en su hábitat natural ubicadas en sitios cercanos a la carretera Venustiano Carranza-Pajacuaran, Michoacán (20º 07’ 09.8’’ latitud norte 102º 36’ 52.5’’ longitud oeste) y en la localidad Tocoy en el municipio San Antonio, San Luis Potosí (21º 38’ 19.0’’ longitud oeste 98º 52’ 15.0’’ longitud oeste), respectivamente.
Propagación de P. laevigata
Las plantas de P. laevigata (mezquite) se propagaron desde semilla. Las semillas fueron sometidas a escarificación para facilitar su germinación, que consistió en sumergirlas en agua a 80 °C durante dos minutos, seguidamente fueron sumergidas en una solución de hipoclorito de sodio al 5% durante tres minutos, luego se pusieron a germinar en bandejas germinadoras de 200 cavidades con peat moss como sustrato. Cuando las plántulas alcanzaron entre 5-6 cm de altura, se trasplantaron a las bolsas que contenían la mezcla de suelo y arena y se inocularon. En el tratamiento de fertilización, a partir de los 21 días después del trasplante (ddt), se aplicó a cada bolsa 0.125 g de fertilizante 17-17-17 soluble en agua (vigoro excelso) cada 15 días, hasta los 210 ddt. El mezquite se mantuvo creciendo en las bolsas durante 12 meses, en todo el período se mantuvo la aplicación de 200 ml de agua a cada unidad experimental en días alternos o según las necesidades de las plantas.
Aplicación de los inoculantes
La inoculación de las cepas de HMA (HMA1 y HMA2) se realizó aplicando 0.5 ml de solución ringer (la solución ringer contenía NaCl 7.5 g, KCl 0.75 g, CaCl2 0.1 g y NaHCO3 0.1 g en 1 L de H2O) que contenía 60 esporas en cada caso, directamente alrededor de las raíces de las plántulas. En el caso de los rizobios (R1, R2 y R3), 1 ml del inóculo se aplicó en el sustrato, en una región muy próxima a la corona radical. Cada 1 ml de inóculo contenía 108 unidades formadoras de colonias (UFC).
Evaluación de las variables de crecimiento
El crecimiento de las plantas se evaluó a partir de la altura de planta, el diámetro de tallo y el número de foliolos por cada planta. La altura de planta se midió desde la superficie del sustrato hasta la yema terminal (cm planta) empleando una regla graduada de 40 cm de longitud y 1 mm de precisión. El diámetro del tallo (mm planta) se midió con un pie de rey digital a 1 cm de altura a partir de la superficie del sustrato. Al final del experimento (365 ddt), se procedió a separar la raíz de la parte aérea de cada planta. Seguidamente se colocaron las muestras en la estufa a 65°C durante aproximadamente 72 h hasta alcanzar valores de peso constante. El peso de MS se registró en una balanza Precisa LS320M SCS.
Evaluación de la nodulación
El número de nódulos totales y su efectividad se evaluaron según lo indicado en FAO (1985). Para esto, las raíces fueron extraídas de la bolsa separándolas del sustrato y lavadas cuidadosamente con agua corriente. Una vez limpias las raíces, se cuantificaron los nódulos totales y su efectividad se determinó observando la coloración interna mediante un corte transversal del nódulo, aquellos que presentaron coloración roja a rosada se consideraron como nódulos efectivos por evidenciar presencia de leghemoglobina, mientras que a los de color blanco se les consideró como nódulo joven (nódulo no efectivo).
Evaluación de las variables fúngicas de la micorriza
La colonización micorrízica se determinó en raíces previamente lavadas con agua corriente y después fueron secadas al aire. Para las determinaciones se pesaron aproximadamente 200 mg de raicillas que fueron secadas a 70 °C y se tiñeron según la metodología descrita por Phillips y Hayman en 1970. Se evaluó la frecuencia de colonización micorrízica, que expresa el grado de ocupación de las raicillas por los HMA, mediante el método de los interceptos (Giovannetti y Mosse, 1980) y la densidad visual o intensidad de la colonización, según Trouvelot et al. (1986). La cuantificación del número de esporas (esporas 50 g) se realizó a partir de muestras de 50 g de sustrato de las macetas, extrayendo dichas estructuras mediante el tamizado y decantado por vía húmeda y su observación en microscopio (Herrera et al., 1995).
Análisis estadístico
Los datos se evaluaron mediante el análisis de varianza de clasificación simple. Se empleó la prueba de comparación múltiple de Duncan en los casos en que hubo efecto significativo de los tratamientos, para establecer las diferencias entre las medias.
Para el cumplimiento de los supuestos de normalidad, los datos a la variable número de nódulos se transformaron mediante la función raíz cuadrada y logaritmo natural para la densidad visual. Para el caso del (%) de colonización y (%) de nódulos efectivos, que no cumplieron los supuestos de normalidad aún después de una transformación de los datos, se les realizó la prueba de Kruskal-Wallis para determinar la existencia de diferencia entre las medias, seguidamente se les realizó la prueba de Games-Howell para establecer las diferencias entre las medias. Se utilizó el programa estadístico IBM SPSS Statistics para Windows versión 23 (Armonk, Nueva York, Estados Unidos).
Resultados y discusión
Variables fúngicas y de nodulación
Los tratamientos estudiados generaron efectos significativos (p< 0.001) sobre las variables que caracterizan las estructuras micorrízicas asociadas a P. laevigata. Los tratamientos inoculados con ambos HMA y coinoculados presentaron mayor número de esporas que el testigo sin inocular y que el tratamiento con fertilización, excepto cuando se combinaron con el aislado R2 (Figura 1A). La colonización micorrízica se vio favorecida cuando se combinaron las cepas de HMA con los aislados de rizobios R1 y R3 (R1+HMA1, R3+HMA1, R1+HMA2 y R3+HMA2), destacándose de manera significativa (p< 0.001) por encima del resto de los tratamientos.
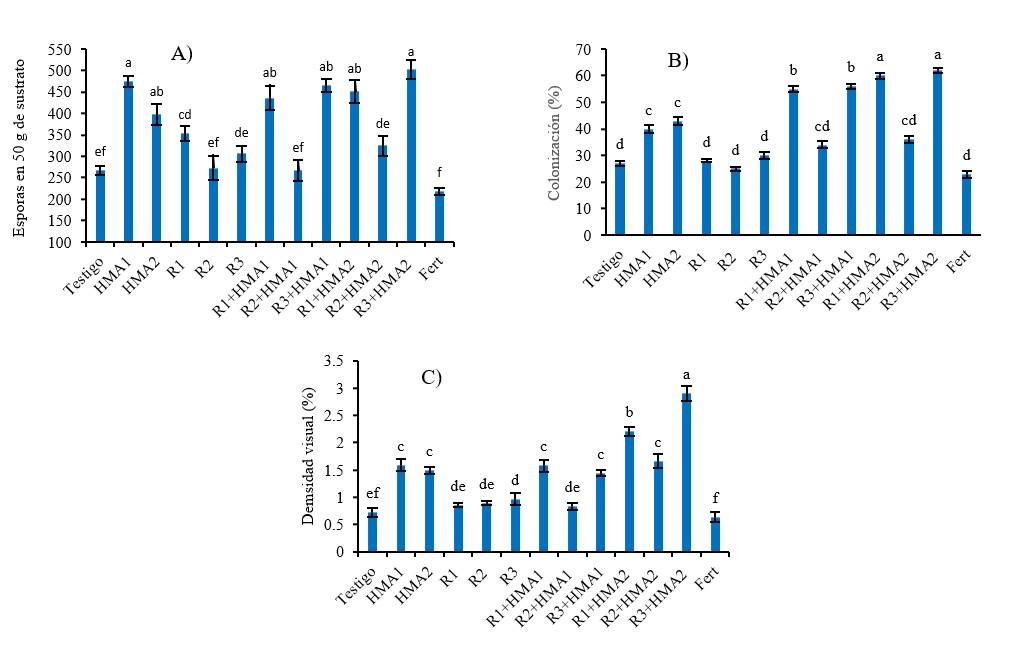
Figura 1 Efecto de diversos tratamientos de inoculación y coinoculación en el número de esporas (A), la colonización micorrízica (B); y la densidad visual (C) en raíces de P. laevigata. abcdef= valores con letras no comunes en cada variable difieren significativamente de acuerdo con la prueba de Duncan (p< 0.05) para las variables de número de esporas y (%) de densidad visual, y de acuerdo con la prueba de Games-Howell (p< 0.05) para la variable (%) de colonización. Las barras muestran el error estándar ± de las medias. R1, R2 y R3 (aislados de rizobios). HMA1 (Glomus cubense) y HMA2 (Claroideoglomus claroideum). Fert (0.125 g de fertilizante 17-17-17 soluble en agua).
También, ambos rizobios, R1 y R3, combinados con HMA2 alcanzaron mayores porcentajes de colonización que cuando se combinaron con HMA1 (Figura 1B). En el caso de la densidad visual (%) fue R3+HMA2 seguido de R1+HMA2 los tratamientos con mayores valores en esta variable y los demás tratamientos inoculados con los HMA, excepto R2+HMA1, superaron a los que no se inocularon con los HMA (Figura 1C). El testigo sin inocular y el tratamiento con fertilizante presentaron menores valores de número de esporas, colonización y densidad visual (Figura 1).
La nodulación de P. laevigata fue superior (p< 0.001) con la inoculación de los aislados R1 y R3 y sus combinaciones con los HMA (R1+HMA1, R3+HMA1, R1+HMA2 y R3+HMA2), con respecto al resto de los tratamientos y al testigo. A su vez, la nodulación de R3 fue mayor cuando se combinó con ambas cepas de HMA (R3+HMA1 y R3+HMA2) que con su inoculación de manera simple (Figura 2A). El porcentaje de nódulos efectivos se comportó de manera similar al número de nódulos, con la diferencia que R1, R3 y sus combinaciones con HMA1 y HMA2, no tuvieron diferencias entre ellas, pero sí con el resto de los tratamientos (Figura 2B).
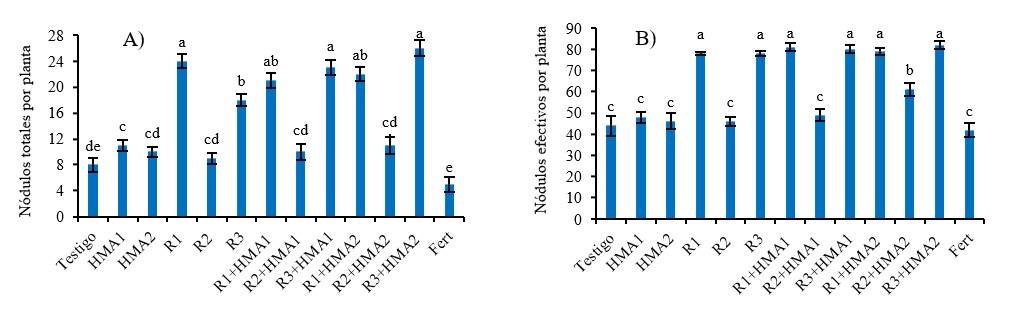
Figura 2 Efecto de diversos tratamientos de inoculación y coinoculación en el número de nódulos totales (A) y el número de nódulos efectivos (B) de P. laevigata. abcde= valores con letras no comunes en cada variable difieren significativamente de acuerdo con la prueba de Duncan (p< 0.05) para la variable de número de nódulos totales por planta, y de acuerdo con la prueba de Games-Howell (p< 0.05) para la variable de nódulos efectivos por planta (%). Las barras muestran el error estándar ± de las medias. R1, R2 y R3 (aislados de rizobios). HMA1 (Glomus cubense) y HMA2 (Claroideoglomus claroideum). Fert (0.125 g de fertilizante 17-17-17 soluble en agua).
En esta investigación se encontró que la inoculación, de los HMA, solos o de manera combinada con aislados de rizobios, favorece la generación de estructuras micorrízicas y la mayor colonización en P. laevigata (Figura 1). De igual manera, la inoculación y coinoculación de los rizobios, de manera simple y combinados con los HMA, produjeron el mayor número de nódulos totales y efectivos en la especie estudiada (Figura 2). Resultados similares, pero sólo con inoculación de HMA, fueron encontrados por Monroy-Ata et al. (2007), quien al inocular plántulas de P. laevigata con un inóculo reproducido a partir de HMA de la rizosfera de Bouteloa gracilis, el porcentaje de colonización alcanzó valores mayores al 50%.
En Prosopis juliflora, se han encontrado resultados que sugieren que la inoculación combinada con aislados de rizobios y HMA favorece, tanto la colonización y formación de estructuras micorrízicas, así como la nodulación de los rizobios con respecto a la inoculación del rizobio de manera individual en suelos con enmiendas de cloruro de sodio (NaCl) (Dixon et al., 1993). Nuestra investigación es pionera en demostrar que la inoculación de HMA y rizobios en P. laevigata favorece la formación de estructuras micorrízicas y la nodulación.
El tratamiento testigo también presentó esporas a nivel similar que otros tratamientos inoculados (Figura 1A), lo que es debido a la presencia de los HMA residentes en el sustrato. Otros tratamientos inoculados presentaron hasta el doble de esporas que el testigo. La colonización de raíces con HMA residentes del suelo es un proceso cuya magnitud esta influenciada por la efectividad de la cepa según las condiciones edáficas y climáticas y la afinidad entre simbionte y hospedero (Rivera y Fernández, 2003; João et al., 2016).
Es posible considerar que las esporas registradas en los tratamientos inoculados correspondían en mayor proporción al inóculo que a los residentes del suelo. Lo anterior, debido a la homogeneidad observada en las características morfológicas de las esporas al hacer su cuantificación. Sin embargo, en este estudio no se registró el número de esporas por cada tipo presente en la muestra. Lo anterior sugiere que las cepas de HMA inoculadas fueron más efectivas en promover el desarrollo de las estructuras micorrízicas que las presentes originalmente en el sustrato (Figura 1). No obstante, esta aseveración requiere de mayor rigor metodológico para su confirmación.
Está demostrado que, al inocular las raíces de plantas con cepas efectivas, tanto de HMA como de rizobios, se incrementa la producción de estructuras fúngicas y la nodulación respectivamente. No obstante, existen factores que influyen en la efectividad de las cepas. En el caso de los HMA, distintas especies se comportan de manera diferente de acuerdo con ciertos rangos de fertilidad y pH del suelo, lo cual indica una cierta especificidad entre especie o cepa-tipo de suelo (Rivera y Fernández, 2003; João et al., 2016).
Por otro lado, aunque los rizobios son habitantes comunes en los suelos agrícolas, normalmente su población es insuficiente para alcanzar una relación benéfica con la leguminosa, lo cual hace necesario la aplicación de inoculantes a la semilla o a las raíces jóvenes para garantizar la simbiosis y con ello la fijación biológica del nitrógeno (Das y Varma, 2009).
Variables de crecimiento del mezquite
La inoculación favoreció el crecimiento de P. laevigata, no obstante, el número de foliolos fue superior (p< 0.001) al testigo solamente cuando se coinoculó el aislado R3 con ambas cepas de micorrizas (R3+HMA1 y R3+HMA2) (Figura 3A). Por otro lado, tanto las cepas de HMA y los rizobios R1 y R3 inoculados de manera simple, como en sus combinaciones, produjeron plantas con mayor altura, similar al tratamiento fertilizado, con diferencia significativa sobre los tratamientos con R2 solo y coinoculado con los HMA (R2+HMA1 y R2+HMA2), que se comportaron de manera similar al testigo sin inocular (Figura 3B).
El diámetro del tallo también fue influenciado de manera positiva por la inoculación, siendo todos los tratamientos superiores al testigo, excepto el aislado R2 inoculado de manera individual. Los tratamientos, R1, R3, R1+HMA1, R3+HMA1, R1+HMA2 y R3+HMA2, sobresalieron por generar plantas con mayor (p< 0.001) diámetro de tallo que el resto de los tratamientos (p< 0.001) (Figura 3C).
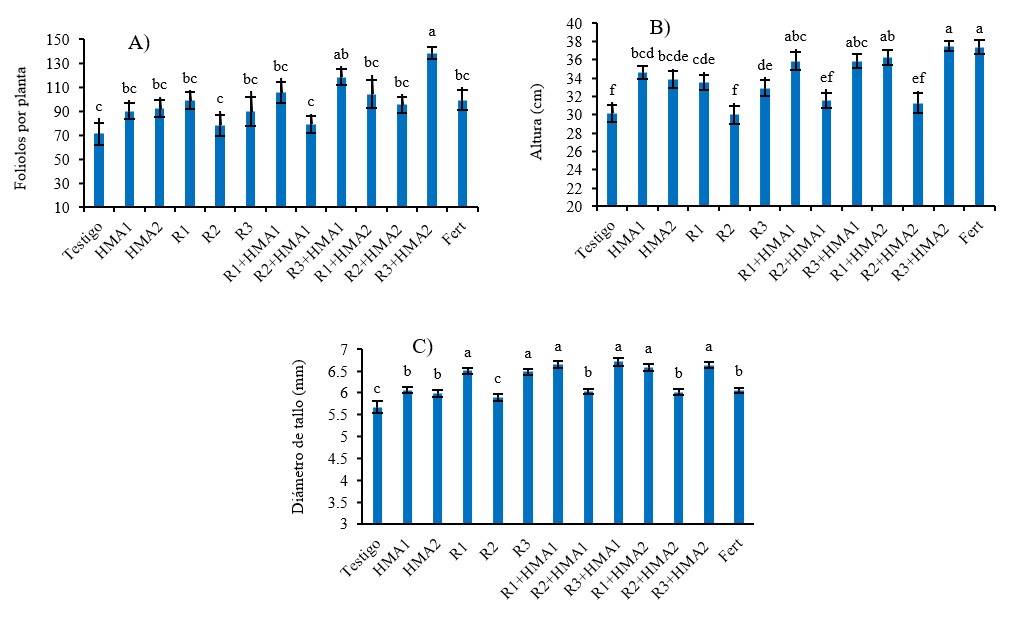
Figura 3 Efecto de diversos tratamientos de inoculación y coinoculación en el número de foliolos (A) la altura; (B) y el diámetro del tallo; y (C) de P. laevigata. abcdef= valores con letras no comunes en cada variable difieren significativamente de acuerdo con la prueba de Duncan (p< 0.05). Las barras muestran el error estándar ± de las medias. R1, R2 y R3 (Aislados de rizobios). HMA1 (Glomus cubense) y HMA2 (Claroideoglomus claroideum). Fert (0.125 g de fertilizante 17-17-17 soluble en agua).
La producción de biomasa también recibió la influencia de la inoculación, pero en el caso de la parte aérea fueron el aislado R1 y la combinación R3+HMA2 los que alcanzaron valores más altos de MS. También, todos los tratamientos inoculados y el tratamiento fertilizado produjeron mayor biomasa que el testigo sin inocular (p< 0.001), excepto cuando estuvo presente el aislado R2, tanto inoculado de manera simple como combinado con los HMA (Figura 4A). La cepa HMA1, los aislados R1 y R3 y las combinaciones R1+HMA1, R3+HMA1, R1+HMA2 y R3+HMA2, produjeron mayor biomasa de raíz (p< 0.001) que los tratamientos con presencia del aislado R2, y que el testigo sin inocular y el tratamiento fertilizado (Figura 4B).
El aumento en el crecimiento proporcionado por la inoculación que se registró en esta investigación coincide parcialmente con los resultados encontrados por Gardezi et al. (2020), quien encontró que, en suelos del tipo Xerosol y Litosol, con pH alcalino y neutro respectivamente, la inoculación con Glomus sp., conjuntamente con la aplicación de materia orgánica favoreció el crecimiento de brotes y raíces en plántulas de P. laevigata en condiciones de invernadero. Los HMA inoculados en nuestro estudio produjeron mayor colonización y densidad de esporas, mayor altura y producción de biomasa que el testigo al inocularse aún de manera individual (Figuras 1, 3 y 4), lo cual demuestra la efectividad de estas cepas en suelos con características similares a las del sustrato empleado.
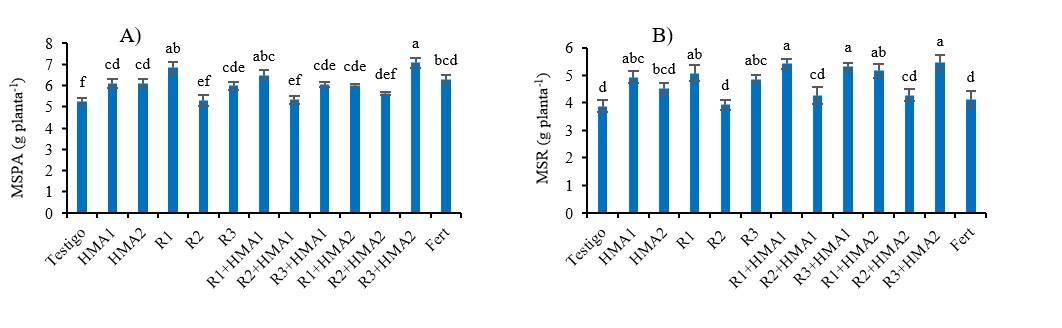
Figura 4 Efecto de diversos tratamientos de inoculación y coinoculación en la producción de masa seca de la parte aérea y raíz de la P. laevigata a los 180 ddt. Valores con letras no comunes en cada variable difieren significativamente de acuerdo con la prueba de Duncan (p< 0.05). Las barras muestran el error estándar ± de las medias. MS PA (masa seca de la parte aérea). MS R (masa seca de la raíz). R1, R2 y R3 (Aislados de rizobios). HMA1 (Glomus cubense) y HMA2 (Claroideoglomus claroideum). Fert (0.125 g de fertilizante 17-17-17 soluble en agua.
En otra especie leguminosa arbórea como Leucaena leucocephala, Quintana et al. (2014) al emplear la inoculación de hongos micorrícicos y rizobios de manera aislada y combinada obtuvieron mayores valores en las variables de crecimiento y biomasa del cultivo con relación al testigo sin inocular, y las inoculaciones combinadas fueron más efectivas que las inoculaciones simples.
En esta investigación se puede observar que, principalmente para las variables de altura de plantas y MS, los tratamientos inoculados con ambos microorganismos de manera simple y combinada fueron superiores al testigo, excepto cuando se inoculó con el aislado R2, de manera simple y también en sus combinaciones con los HMA (R2+HMA1 y R2+HMA2) (Figuras 3 y 4).
En este sentido se conoce que la mayoría de las especies de rizobios, experimentan una especificidad cepa-especie de leguminosa (Balatti, 1996). Cabe destacar que, hay que tener en cuenta la interacción entre el hospedero y simbiontes inoculados con los microorganismos presentes en el sustrato, el cual no fue esterilizado. A pesar de esto, se observa el efecto en las plantas con los tratamientos de inoculación y coinoculación, lo que demuestra que las cepas empleadas son efectivas, excepto R2.
La mayor altura y producción de biomasa experimentada por las plántulas de mezquite inoculadas con HMA1, HMA2, R1, R3, R1+HMA1, R1+HMA2, R3+HMA1 y R3+HMA2, coincide con los valores de colonización, número de esporas y la nodulación de los rizobios. A su vez, los mayores valores en estas variables se alcanzaron cuando se combinaron ambos simbiontes (Figuras 1, 2, 3 y 4). Esta relación entre el incremento de las estructuras fúngicas, la nodulación y el crecimiento de las plantas de P. laevigata demuestra el beneficio de la interacción simbiótica tripartita (rizobio-leguminosa-HMA), mencionada anteriormente por varios autores como Rabie et al. (2005) y Lara et al. (2019). La simbiosis tripartita favorece el desarrollo de cada organismo de manera individual y en conjunto, lo que representa oportunidades de mejor crecimiento de las plantas asociadas, y, en consecuencia, mayor productividad (Toro et al., 2008).
La sinergia entre los HMA y los rizobios en favor de la productividad de las plantas ha sido también corroborada por autores como González et al. (2012), quien al evaluar el efecto de la coinoculación de aislados de rizobios y una cepa de HMA (G. cubense), en plantas de Kudzú (Pueraria phaseoloides), obtuvo incrementos en los rendimientos y el contenido nutricional del pasto en los tratamientos donde se combinaron ambos microorganismos.
El tratamiento testigo establecido en esta investigación resultó con presencia de nódulos de rizobios en sus raíces. Evidentemente, tales nódulos fueron producidos por los rizobios nativos o residentes del suelo presente en el sustrato. Como toda leguminosa, la nodulación de P. laevigata ocurre de manera natural en varios tipos de suelos.
Aunque no hay información relacionada con la nodulación por rizobios nativos en P. laevigata, si se ha reportado el aislamiento de estos microorganismos en otras especies del género como Prosopis juliflora y Prosopis alba por Kulkarni y Nautiyal (1999) y Velázquez et al. (2001) respectivamente.
No obstante, esta investigación es la primera que documenta el efecto benéfico de la asociación simbiótica dual en P. laevigata en suelos con pH neutro. Lo anterior, evidencia la efectividad de los aislados y cepas probadas en este estudio.
Resulta interesante que dichos aislados presentaran compatibilidad con P. laevigata, incluso, en el caso de R1 y R3, demostraron ser casi tan eficientes en algunas de las variables medidas como sus combinaciones con los HMA (R1+HMA1, R1+HMA2, R3+HMA1 y R3+HMA2). Nuestros resultados aportan nuevos aislados de rizobio compatibles con P. laevigata y que son buenos promotores de crecimiento, lo que aumenta la posibilidad de generar inoculantes que puedan promover buenos resultados en otras especies, incluso en cultivos.
Conclusiones
La combinación de aislados de rizobios y cepas de HMA en suelos con pH cercano a la neutralidad favorece el desarrollo de las estructuras micorrízicas, la nodulación, el crecimiento y producción de biomasa de Prosopis laevigata. Los aislados R1 y R3 (procedentes de rizósfera de Vachelia. schaffneri y Leucaena leucocephala respectivamente), las cepas HMA1 y HMA2 (Glomus cubense y Claroideuglomus claroideum) y las combinaciones R1+HMA1, R3+HMA1, R1+HMA2 y R3+HMA2 son inoculantes efectivos para aumentar el crecimiento de P. laevigata.











 text in
text in 


