Introducción
La capacidad de intercambio catiónico (CIC) estima los sitios de carga de las arcillas, tanto las cargas permanentes, como las cargas dependientes de pH. Estos sitios de intercambio retienen por fuerzas electrostáticas a los cationes. La CIC es un indicador indirecto de la capacidad amortiguadora de los suelos y que es función de la cantidad y tipo de arcilla (Yong et al., 1990). Los métodos empleados para estimar la CIC se clasifican en, CIC por suma de cationes intercambiables, CIC a pH del suelo, CIC a pH amortiguado y CIC a punto cero de carga, todos estos se basan en la saturación del suelo con un catión índice. (Jaremko y Kalembasa, 2014) estiman tanto las cargas positivas como negativas simultáneamente; sin embargo, los múltiples lavados y centrifugados, implican tiempo, trabajo y pérdida de la muestra.
Por lo que el método de la AgTU+ n es una técnica eficiente para la estimación de la CIC, puesto que no se realizan lavados sucesivos y el AgTU+ n no se encuentra de forma natural en el suelo. La TU forma complejos estables con la plata (AgTU, AgTU+ 2, AgTU+ 3) debido a la coordinación entre la plata y los puentes de azufre. Este método se basa en la afinidad del complejo AgTU+ n sobre la matriz arcillosa. La CIC se determina por diferencia entre la concentración inicial y el remanente de la solución saturante de AgTU+ n, mediante espectrometría de adsorción atómica (Cremers y Pleysier, 1973; Xing-Cun, 1998; Ahmad et al., 2002; Oorts et al., 2004).
Como alternativa al uso de la espectrometría de adsorción atómica, se ha propuesto el uso de una suspensión de bentonita, que por sus características hidrofílicas le permite permanecer estable indefinidamente. Se clasifica en bentonita sódica y bentonita cálcica de acuerdo a los iones intercambiables dominantes. En la adosorción del complejo de AgTU+ n en la fracción fina (<0.5 µm) de una suspensión de bentonita, se ha observado la formación de floculos, seguida de una fase de separación y sedimentación causada por la neutralización de la cargas negativas de la arcilla. Este principo es utilizado para la estimación de la CIC, dado que, la adosorción de AgTUn + sobre la bentonita presenta un comportamiento lineal (200 ml de suspensión al 1%, adsorbe aproximadamente un mmol de AgTU+ n) (Cremers y Pleysier, 1973; Pleysier et al., 1986, Ladoo, 1992; Pinzon, 2006 y Fu y Chung, 2011).
Conradie y Kotze (1989), evaluaron el método de la tiourea AgTU+ n, donde los resultados con el Na22, son similares, mientras que los obtenidos con cloruro de amonio a pH del suelo son mayores, concluyen que el uso de AgTU+ n es más práctico con valores de CIC aceptables.
La plata es fotosensible al espectro visible (Prauss et al, 2008), siendo la luz blanca o azul, las que inician la fotorreducción del Ag+ a Ag0 (Oster y Oster 1959), esto debido la fotolisis del agua donde se producen radicales e- aq, OHaq y Haq (Janata et al., 1994; Abid et al., 2002). En pH alcalino se forman precipitados de Ag2O (Kan-Sen et al., 2005), de manera similar el AgTU+ n es inestable a pH>8 (Cornell y Aksoyoglu, 1991). Algunos autores han modificado esta técnica para prolongar la estabilidad de AgTU+ n, como: Oorts et al. (2004) que incrementaron el pH del suelo antes de la adición de AgTU+ n, con una solución de NaOH 0.001 M, hasta llegar a un pH de 8 y 9, esta modificación tuvo resultados similares al AgTU+ n amortiguado con acetato de amonio. Dhorman (2006) propone que la solución AgNO3 sea adicionada lentamente, durante 2 min, mientras se agita la solución de TU, después se agrega la solución de acetato de amonio. Esta versión es más estable con una duración de 48 a 72 h. Dada la sensibilidad a la fotorreducción del Ag+, aún como AgTU+ n, y el uso de una suspensión de bentonita como alternativa al espectrofotómetro de adsorción atómica para estimar la CIC de los suelos, el objetivo de este trabajo fue describir la fase metodológica y los puntos críticos de la estimación de la CIC con la tiourea de plata.
Se utilizaron 204 suelos secados al aire y tamizados a dos mm, a los que se le estimó pH en agua (2:1), conductividad eléctrica (CE) relación 5:1 y CIC. Para determinar la CIC se utilizó la metodología propuesta por Pleysier y Jou (1980) y Pleysier et al. (1986), con las siguientes modificaciones: Se pesó de 0.8 a 1 g de suelo. Durante la preparación de la solución extractante de AgTU+ n, los matraces donde se prepara la TU y el AgNO3 se protegen de la luz con papel aluminio. La mezcla de la TU y el AgNO3 se realizó con un agitador magnético y se adiciona lenta y gradualmente el AgNO3 mediante una bureta de 100 ml, la cual también es protegida. La mezcla final se coloca en un recipiente ámbar.
Posterior al proceso de centrifugado, el sobrenadante es filtrado con papel Alstrhom núm 90 o similar, y el extracto es depositado en recipientes protegidos de la luz. Se utiliza un blanco para determinar la concentración inicial de AgTU+ n que se adiciona. Se toma una alícuota de cinco ml del sobrenadante y cinco ml de EDTA, se agita la alícuota y el EDTA en tubos de ensayo con Vortex por cinco segundos. Se titula gota a gota con una suspensión de bentonita comercial, obtenida de minerales industriales no metálicos, la cual es denominada bentonita cálcica. El tamaño de partícula empleado fue <37µm.
Para la solución de calibración de AgTU+ n, se preparan 100 ml de solución AgTU+ n (0.01M), los materiales se protegen y se almacenan de la misma forma que en la preparación de la solución extractante. El punto final de la titulación se aprecia cuando en el sobrenadante al agregar unas gotas de bentonita, pasa de claro a ligeramente turbio, en este punto la adsorción disminuye, esté es un estado indicador de que la arcilla está próxima a saturación, por lo que, es necesario continuar agregando unas gotas de la suspensión de bentonita hasta que esa ligera turbidez cambie a una tonalidad más intensa, en este punto la reacción de adsorción finaliza (Figura 1).
El volumen gastado de la suspensión de bentonita en la curva de calibración y las concentraciones empleadas se encuentran en el Cuadro 1. En la Figura 2, se muestra el gradiente de formación y sedimentación de flóculos de la solución de calibración de AgTU+ n.
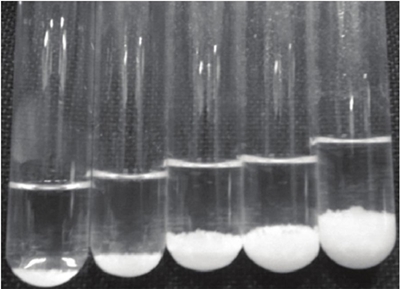
Figura 2 Estado visual de los puntos de calibración de la suspensión de bentonita y las soluciones de AgTU+ n.
Para cuantificar la cantidad de AgTU+ n adsorbida en la suspensión de bentonita en la titulación, se emplea la ecuación de regresión obtenida en la curva de calibración. Se determinaron las ecuaciones de regresión con (CI) y sin intercepción (SI), Y= 0.0049X , Y= 0.0049X-3*10-5, cuyos coeficientes de correlación son: R²= 0.9961 y R²= 0.9962, respectivamente (Figura 3).
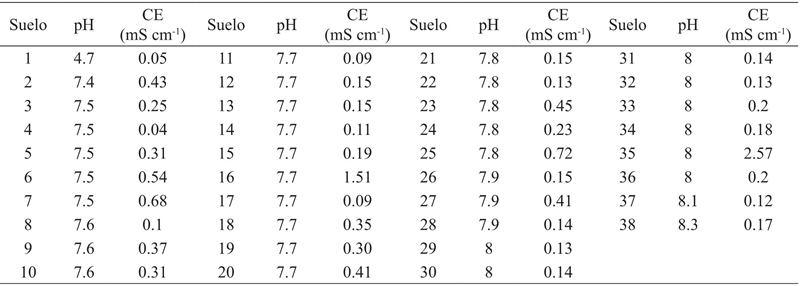
Treinta y ocho suelos de 204 tienen la capacidad de adsorber una concentración mayor a 0.3 mmol de AgTU+ n; es decir, presentan una CIC>28 meq100 g-1 de suelo, que es la concentración máxima que se determina en estos suelos con la técnica propuesta por Pleysier y Jou (1980) (Cuadro 2). Dado que al titular con las primeras gotas de la suspensión de bentonita no se aprecia la formación de flóculos y la mezcla se torna inmediatamente turbia, para estimar la CIC de suelo con esta característica debe ser 0.8 g. Con la versión original del método se produce la reducción del Ag+, por la exposición prolongada a la luz y la falta de homogenización de la mezcla de la TU y el AgNO3, esta reacción se evita utilizando un agitador magnético y adicionando lenta y gradualmente el AgNO3 mediante una bureta de 100 ml, aunado a esto, la cristalería empleada se protegió de la luz con papel aluminio. Cuando no se realiza este procedimiento se aprecia en el matraz manchas en los bordes y una mezcla no homogénea.
Sí el extracto de AgTU+ n permanece más de 12 h expuesto a la luz, la adsorción del catión en la suspensión de bentonita disminuye, por que la radiación UV produce electrones hidratados que reducen la plata (Janata et al., 1994; Kan-Sen et al., 2005), induciendo una sobrestimación del valor real de la CIC.
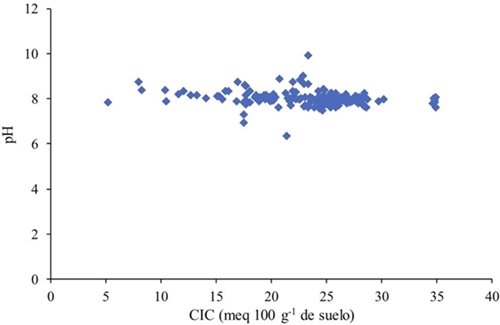
La capacidad de amortiguamiento del suelo es función del tipo y cantidad de arcilla, puesto que, con valores similares de CIC se presentan características contrastantes, siendo en este caso pH y CE, ambas variables son dependientes de los sitios de carga en las arcillas, sin embargo, estas no presentan una relación lineal dado a los procesos de formación que dieron origen a los suelos estudiados (Figura 4), de esta forma con a una cantidad igual de arcilla, el pH presenta variaciones debidas al tipo de arcilla presente en la muestra. El tipo de arcilla dominate en el suelo determina la CIC, donde la CIC de las arcillas del tipo 2:1 es mayor a la del tipo 1:1, con base en esto, la CIC tiene una gradiente de acuerdo al tipo de arcillas, esméctica> ilita> caolinita (Yong et al., 1990).
La actividad de los iones predominantes en el suelo (Na+, Ca2+, K+, Cl-, SO2- 4, y CO2- 3, HCO2- 3 ) (He et al., 2012), está determinada por el tipo y cantidad de arcilla, ya que estos iones dependen de sitios de intercambio. Suelos arcillosos tienen la capacidad de adsorber más iones que suelos arenosos. La CE de los suelos analizados no presenta una relación lineal con el contenido de arcilla expresado como CIC, sino que son independiente del contenido y tipo de arcilla (Figura 5).
La CIC con intercepto (CICCI) tiene una relación lineal con la CIC sin intercepto (CICSI); es decir, que la estimación de la CIC realizada en la titulación del AgTU+ n con la suspensión de bentonita, se debe a la capacidad de la arcilla de los suelospara adsorber el AgTU+ n, sin que otros iones generen fuentes de variación que alteren el valor final de la CIC (Figura 6).











 text in
text in