Introducción
Las enfermedades poscosecha pueden ocasionar elevadas pérdidas económicas, debido al desecho de frutos que no llegan a su mercado final. En países desarrollados se estima que hasta 25% de los frutos pueden ser afectados por patógenos, mientras que en países en vías de desarrollo el porcentaje de pérdidas se duplica (Sharma et al., 2009). La pera no es la excepción, la principal infección en estos frutos, que son almacenados durante largos períodos de tiempo es causada por Penicillium expansum y la presencia de este hongo puede resultar en pérdidas económicas globales significativas, motivo por el cual este patógeno es considerado el más importante en frutos de pera en poscosecha (Rosenberger, 1990).
La aplicación de fungicidas químicos sintéticos es la primera táctica de control de este hongo en las empacadoras de pera y en otros frutos con la finalidad de reducir la incidencia (Hao et al., 2010); sin embargo, la aplicación repetida de estos productos ha generado una fuerte presión de selección sobre los patógenos, limitando el éxito en el control de las infecciones ocasionadas por Penicillium (Baraldi et al., 2003).
De hecho, desde hace varios años, existen reportes de cepas de Penicillium expansum resistentes a los Benzimidazoles y en estudios in vitro se demostró la resistencia cruzada con benomilo, carbendazim, thiophanato y thiabendazole (Koffmann et al., 1978). Sin embargo, el uso de fungicidas químicos sintéticos está siendo cada vez más restringido, no solo por la aparición de cepas resistentes, sino debido a los efectos nocivos causados en el ambiente y en la salud pública (Lima et al., 2011). Por lo anterior, se incrementó la conciencia del consumidor acerca de alimentos seguros, más nutritivos y amigables con el ambiente. También se han explorado métodos alternativos en el control de las enfermedades en poscosecha.
Una de estas alternativas es el empleo de compuestos de extractos obtenidos de plantas con actividad antimicrobial, los cuales se sabe son eficaces, además que tienen menos efectos ambientales y no dañan o hasta mejoran la salud humana (Azzouz, 1982; Amadioha, 2000; Paranagama et al., 2003). Los aceites esenciales son compuestos ampliamente usados para esta finalidad con la ventaja de que algunos de ellos son volátiles por lo que no dejan residuos en los frutos, tal es el caso del aceite de canela (Ayala et al., 2008), cuyo componente principal es el cinnamaldehído (China Farmacopeia Commission, 2010).
El aceite esencial de canela ha sido identificado por poseer propiedades antimicrobiales y antifúngicas (Chang et al., 2001; Kim et al., 2004; Singh et al., 2007). La severidad ocasionada por enfermedades fungosas en frutos de fresa disminuyó después de tratamientos con vapores de aceite de canela, en comparación con frutos no tratados (Tzortzakis, 2007). También se ha demostrado su efectividad antifúngica en contra de Fusarium moniliforme (Paran et al., 1996) y Fusarium proliferatum, este último, aislado de frutos de banano y en cuyo caso se requirió una concentración menor de aceite esencial de canela (0.05% v/v) que del fungicida benomilo (1% v/v) para alcanzar la dosis mínima necesaria para inhibir el crecimiento del hongo (Ranasinghe et al., 2002).
Por otro lado se ha estudiado el efecto del aceite esencial de canela en la producción de micotoxinas provenientes de Aspergillus flavus, encontrando una reducción significativa de aflotoxina B1 con una concentración de aceite esencial de canela al 2%, colocada en discos de polipropileno de los cuales se desprendían compuestos volátiles provenientes de dicho aceite, la inhibición total de la producción de aflotoxina B1 se logró con una concentración de 4% de aceite esencial de canela (Manso et al., 2014). Otros trabajos reportan la posible aplicación de aceite esencial de canela en los empaques debido al efecto antifúngico sobre los patógenos que afectan a los frutos de diversas especies en postcosecha (Nielsen y Ríos, 2000).
Tomando en consideración lo anterior, el presente trabajo tuvo como objetivo evaluar el efecto de aceite de canela a diferentes concentraciones en el desarrollo del hongo Penicillium expansum sobre frutos de pera en poscosecha.
Materiales y métodos
El trabajo de investigación fue realizado en las instalaciones de la Universidad Politécnica de Francisco I. Madero, en el municipio de Tepatepec, Hidalgo, específicamente en el Laboratorio de Análisis y química.
Aislamiento del patógeno y pruebas de patogenicidad
El hongo Penicillium expansum fue aislado de frutos de pera con síntomas característicos de la enfermedad, los cuales se obtuvieron de la central de abasto de la Ciudad de México. Se utilizaron fragmentos de aproximadamente 5 x 5 mm, con 20% de tejido infectado y 80% de tejido sano que se sembraron en cajas de Petri con Papa Dextrosa Agar (PDA, por sus siglas en inglés) y se incubaron a temperatura ambiente (26 ± 2 ºC) durante 10 días. Una porción de micelio fue transferida a otra caja Petri con PDA para purificar las cepas. Después de confirmada morfológicamente la identidad de Penicillium expansum mediante las claves morfológicas de Seifer et al. (2011), la cepa se sembró en medio de cultivo PDA donde estuvo desarrollándose por un período de 7 días, a una temperatura de 28 °C.
Cuando la colonia tuvo una edad de más de una semana, las esporas fueron raspadas y se preparó una suspensión, ajustándola a una concentración de 106 conidios mL-1. Dichos conidios se inocularon sobre frutos de pera var. Anjou (Pyrus communis) que fueron seleccionados de un comercio de frutas en el municipio de Actopan, Hidalgo, México. Todos los frutos a emplearse en el ensayo, estaban en madurez de consumo y se encontraban libres de daños, signos de infección y uniformes en tamaño. Cada uno de los frutos de pera se lavaron y desinfestaron con una solución de hipoclorito de sodio al 1% v/v y se les realizaron dos heridas de aproximadamente 2 mm de diámetro por 2 mm de profundidad causadas con una aguja de disección estéril, en las que se agregaron 20 µL de esporas del patógeno a una concentración de 106 conidios mL-1, lo anterior para reproducir la sintomatología, con el fin de corroborar la patogenicidad de P. exapansum. A los frutos testigo se les colocó PDA sin el hongo. Las cepas que ocasionaron el desarrollo de síntomas se conservaron en aceite mineral y PDA para su posterior utilización.
Control in vitro de Penicillium expansum con Cinnamomum zeylanicum
Para la preparación de cada tratamiento, se mezclaron 100 mL de medio de PDA (antes de gelificación) con cada una de las emulsiones del aceite de canela (60, 120 y 300 µL L-1), con 5 repeticiones de cada tratamiento, además del testigo comercial (Imazalil 500 mg L-1) y el testigo sin tratar, al cual no se le dio ningún tratamiento. Se permitió la gelificación de cada uno de los tratamientos, e inmediatamente P. expansum fue transferido en el centro de las cajas de Petri. Las cajas de Petri se incubaron a una temperatura de 28 °C durante 8 días.
La eficacia de cada tratamiento se determinó por la medición del crecimiento radial de las colonias del hongo cada 24 h, la velocidad de crecimiento de la colonia en el medio de cultivo, así como la esporulación al ser aplicados los diferentes tratamientos; para esta última variable, la concentración de conidios se determinó a los 10 días cuando se logró la máxima esporulación. Cada caja de Petri se enjuagó con agua destilada estéril (15 mL), la superficie se raspó con una varilla de vidrio y se filtró a través de una malla de algodón estéril. Alícuotas de la suspensión de esporas con un volumen de 0.5 mL de cada caja se transfirieron a una cámara de Newbauer para contar el número de conidios. El experimento se repitió dos veces, el segundo establecido a las 48 h posteriores al primero.
Efecto antifúngico in vivo
Se seleccionaron frutos de pera Var. Anjou de apariencia sana, sin daño ni infecciones, para ser inoculados artificialmente con Penicillium expansum.
Cada fruto se desinfectó con hipoclorito de sodio al 2% durante 3 min por inmersión, posteriormente se enjuagaron con agua destilada estéril y se secaron a temperatura ambiente sobre papel secante. De manera paralela, se preparó una suspensión acuosa de esporas de P. expansum a concentración de 106 conidios mL-1, y concentraciones de aceite de canela a 60, 120 y 300 µL L-1. Dichas emulsiones de aceite esencial fueron asperjadas sobre 25 frutos (5 repeticiones para 5 tratamientos) 24 h antes de la inoculación con P. expansum, se incluyó un testigo químico (Imazalil a una concentración de 500 mg L-1) y uno absoluto (agua destilada estéril). La inoculación de los frutos se realizó haciendo dos heridas de 2 mm de profundidad con aguja de disección estéril, sobre dicha herida se colocaron 20 µL de una suspensión acuosa de 106 conidios mL-1 con micropipeta.
Los frutos fueron colocados en grupos de dos dentro de recipientes plásticos herméticamente cerrados que mantenían una temperatura de 26 ± 2 ºC y más de 90% de humedad relativa. El diámetro de la lesión fue determinado cada 24 h mediante el análisis de imágenes digitales obtenida de los frutos enfermos por medio de una cámara fotográfica. Los frutos dentro de la cámara húmeda fueron fotografiados diariamente mediante una cámara marca fuji® de 12 megapixeles, colocada a una altura constante de 30 cm del límite de la cámara húmeda. Las imágenes obtenidas fueron procesadas mediante el software Photoshop CS6. El diámetro de la lesión que ocasionó el patógeno fue determinado en número de pixeles.
Análisis estadístico
Con los datos obtenidos del experimento in vitro se realizaron análisis de regresión para cada tratamiento, generando una ecuación que describía una curva representativa de cada uno de ellos. Cada curva generó un área debajo de ella que fue calculada con el método de los polígonos reportado previamente por (Liengme, 2002). Las unidades resultantes de este método son adimensionales. Los resultados fueron sometidos a análisis de varianza utilizando un diseño completamente al azar y pruebas de separación múltiple de medias de tukey mediante el programa SAS v.9 para Windows®. El incremento en el tamaño de la colonia fue calculado restando el tamaño de la colonia de un día determinado al tamaño de la colonia el día anterior y los resultados obtenidos fueron sometidos a análisis de regresión. Para los resultados in vivo se determinó el área bajo la curva del progreso de la enfermedad mediante el método antes descrito. Los valores de crecimiento micelial mínimos y de producción de esporas máximos fueron estimados a partir de la ecuación de regresión generada por el modelo con la ayuda del comando Solver de Microsoft Excel®.
Resultados y discusión
Experimentos in vitro
Crecimiento micelial
Los datos mostraron una disminución en el crecimiento del micelio de P. expansum en la concentración más alta de extracto de canela. El crecimiento micelial registrado en esta concentración fue estadísticamente igual al crecimiento registrado cuando el patógeno se desarrolló en presencia del testigo químico. En contraste los efectos de las concentraciones menores a 300 µL L-1 resultaron iguales a las observadas en el tratamiento testigo (Cuadro 1).
Cuadro 1 Efecto del aceite esencial de canela sobre el crecimiento micelial del hongo Penicillium expansum a los ocho días después de la siembra y en el crecimiento total.
| Concentración de Canela (Porcentaje de extracto v/v) | Promedio de crecimiento 8 días después de la siembra (cm)† | Área bajo la curva del crecimiento micelial†† |
| Testigo absoluto | 1.02 a | 6.47 a |
| Extracto de canela 60 µL L-1 | 1.16 a | 6.22 a |
| Extracto de canela 120 µL L-1 | 1.44 a | 5.78 a |
| Extracto de canela 300 µL L-1 | 0.81 b | 1.95 b |
| Imazalil (500 mg L-1) | 0 b | 0 b |
| DMS* | 0.95 | 2.05 |
†Letras iguales entre columnas no indican diferencias estadísticas significativas (Tukey, p= 0.05). DMS= diferencia mínima significativa. ††El cálculo del área bajo la curva arroja números adimensionales.
El crecimiento del micelio en las cajas de Petri que contenían extracto de canela fue menor en comparación con el testigo. Los modelos matemáticos permitieron estimar que en presencia del aceite esencial de canela a una concentración de 300 µL L-1, el patógeno detuvo su crecimiento 81 h después de la siembra, mientras que el hongo que crecía en medio libre de aceite esencial de canela nunca detuvo por completo su crecimiento; sin embargo, mostró un incremento mínimo de su tamaño 90.3 h después de la siembra, esto es, aproximadamente ocho horas después del tratamiento con 300 µL L-1 de aceite esencial (Figura 1). En el presente experimento el aceite esencial de canela mostró una inhibición del crecimiento del patógeno; sin embargo, después de algunas horas dicho crecimiento se restableció, por lo cual se observó un efecto fungistático.
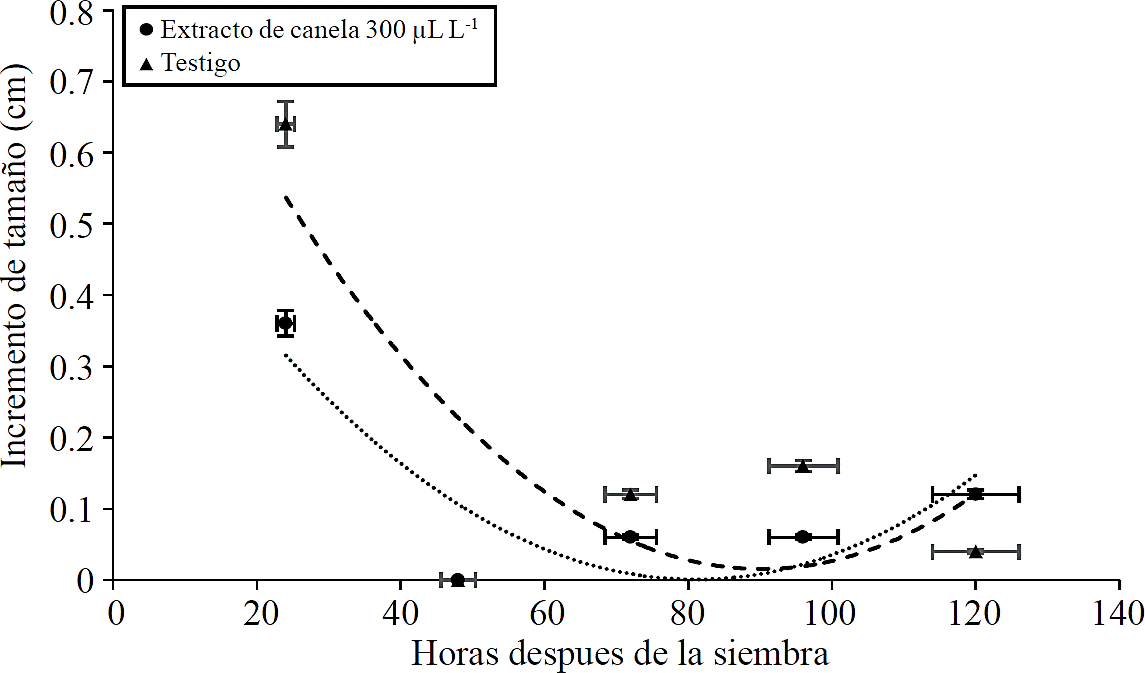
Figura 1 Efecto del aceite esencial de canela a 300 µL L-1 sobre el incremento en el diámetro micelial de Penicillium sp. en comparación con el tratamiento testigo (micelio creciendo en papa dextrosa-agar) en los primeros cinco días después de la siembra.
El incremento en el diámetro micelial de Penicillium creciendo en el extracto de canela se ajustó a una ecuación de la forma y= 9.6726 X 10-5 X2 + -0.015 X + 0.636; donde y= crecimiento micelial y X= horas después de la siembra. Mientras que el testigo se ajustó a una ecuación de la forma y= 0.0001 X2 -0.0215 X + 0.984. El coeficiente de determinación fue de 0.7 y 0.6 respectivamente.
El efecto antimicrobiano de los extractos de canela se reportó previamente por (Tzortzakis, 2009), que logró inhibir el crecimiento de la colonia de dos especies del género Colletotrichum y una del género Rhizopus que afectan frutos en postcosecha, así como la producción de esporas de una especie del genero Botrytis y otra del género Aspergillus. Desde hace algunos años se conoce que el aceite esencial de canela contiene concentraciones elevadas de cinamaldeido y eugenol compuestos que posiblemente sean los responsables de inhibir el crecimiento micelial (Helander, et al., 1995).
Recientemente se ha utilizado el aceite esencial de canela para impregnar películas que recubren a los frutos para el control de Penicillium (Montero-Prado, et al., 2011). En el presente trabajo los resultados mostraron que el aceite de canela logró una disminución significativa en el crecimiento del micelio del patógeno. Algunos autores han reportado que la efectividad de las aplicaciones de extractos de canela por medio de inmersión o aspersión son efectivos debido a que los compuestos hidrofóbicos presentes en los extractos se unen a los compuestos hidrofóbicos celulares afectando la actividad de las membranas celulares (Avila, et al., 2012).
Esporulación
Los resultados mostraron que el aceite esencial de canela ocasionó un incremento en la cantidad de esporas producidas por P. expansum. Los modelos matemáticos permitieron estimar el valor máximo de dicha producción (618.08 esporas mL-1) cuando el hongo se colocó en 135 µL L-1 de aceite esencial de canela. El mismo modelo matemático permitió observar que al incrementar la concentración de extracto de canela por encima de ese valor (135 µL L-1) la cantidad de esporas producidas disminuyó hasta inhibir por completo la producción de esporas con 312.38 µL L-1 (Figura 2). Otros autores han encontrado un comportamiento similar en algunos otros procesos fisiológicos de los hongos cuando son expuestos a diferentes concentraciones de aceites esenciales de canela, por ejemplo (Tzortzakis, 2009), encontraron un incremento en la germinación de las esporas y tamaño del tubo germinativo de Aspergillus niger cuando estas se colocaron en presencia de 25 o 50 ppm de extracto de canela, en contraste en concentración superiores a las 100 ppm ambas variables mostraron valores más bajos en relación con el testigo. Otras géneros como Colletotrichum coccodes y Rhizopus stolonifer mostraron una disminución en la germinación de las esporas por lo cual es posible que esta respuesta sea propia de cada especie.
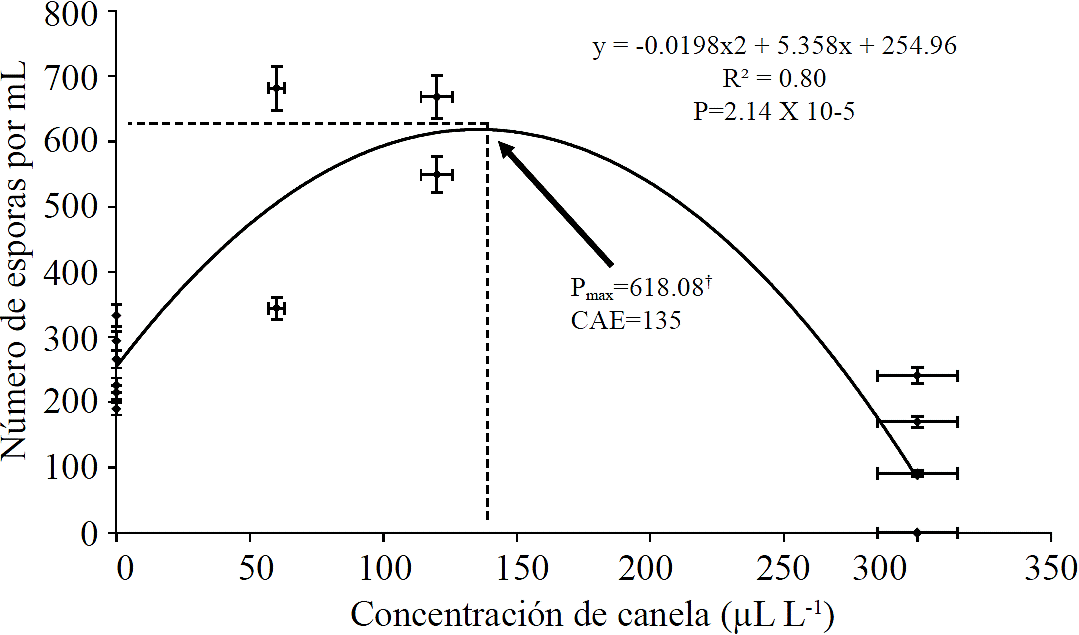
Donde: †Pmax= producción máxima de esporas por mililitro; CAE= concentración de aceite esencial de canela en µL L-1; ambos parámetros fueron estimados a partir de ecuación de la forma y= ax2 + bx + c; y= Número de esporas por mililitro, x= concentración de aceite esencial de canela. Los coeficientes de la ecuación aparecen en la figura.
Figura 2 Efecto del extracto de canela sobre la producción de esporas en Penicillium expansum.
La producción de esporas, conidios, cleistotecios y esclerocios está influenciada por factores relacionados con los compuestos presentes en el medio de crecimiento o factores ambientales (Calvo et al., 2002). En el caso de Penicillium las condiciones necesarias para la producción de esporas, son mucho más restrictivas que las necesarias para el crecimiento vegetativo (Sekiguchi y Gaucher, 1977). Lo anterior, es un indicador de que este proceso fisiológico es mucho más propenso a cambios que el crecimiento micelial.
En el presente trabajo el crecimiento micelial se vio inhibido cuando el hongo creció en presencia de 300 µL L-1 de aceite esencial de canela (Figura 1), por otro lado, la producción de esporas se incrementó en presencia de dosis inferiores a 135 µL L-1. Cuando el hongo creció dosis superiores a este valor disminuyó hasta inhibirse por completo (Figura 2).
Experimentos in vivo
Los frutos tratados con 300 µL/L de aceite esencial de aceite de canela mostraron un desarrollo de la enfermedad similar al de los frutos tratados con Imazalil a 500 mg L-1. En ambos casos el desarrollo de la enfermedad fue menor al del tratamiento testigo. En contraste las dosis de 60 y 120 µL L-1 de aceite esencial de canela no mostraron diferencias estadísticas significativas en comparación con el tratamiento testigo (Cuadro 2).
Cuadro 2 Efecto de diferentes concentraciones de aceite esencial de canela e imazalil sobre el desarrollo de la enfermedad durante ocho días producida por Penicillium expansum sobre frutos de pera en poscosecha.
| Dosis de aceite de canela (µL L-1) e Imazalil (mg L-1) | Área bajo la curva del progreso de la enfermedad† |
| 0 | 5327.3 a |
| 60 | 4886.5 a |
| 120 | 4409.6 ab |
| 300 | 3425.9 b |
| Imazalil (500 mg/L) | 3784.1 b |
| DMS* | 1000.6 |
†Letras iguales entre tratamientos no indican diferencias estadísticas significativas (Tukey, p= 0.05). El cálculo del área bajo la curva arroja números adimensionales.
*DMS= diferencia mínima significativa.
Durante los primeros días después de la inoculación, los frutos testigo así como los tratados con aceite esencial de canela a 300 µL L-1 o imazalil a 500 mg L-1, mostraron un comportamiento similar en cuanto al desarrollo de la enfermedad, sin embargo a partir del día número cinco, estos mismos frutos presentaron un desarrollo de los síntomas mucho más lentos en relación con los frutos no tratados.
A pesar de que tanto imazalil como el aceite esencial de canela mostraron un efecto significativo en el desarrollo de la enfermedad, Penicillium expansum continuo creciendo en los frutos tratados con ambos productos, aunque a un ritmo mucho menor que los frutos no tratados. En el último día de evaluación el área bajo la curva del progreso de la enfermedad de los frutos no tratados fue de 1 032 unidades, mientras que para los frutos tratados con aceite esencial de canela a 300 µL L-1 fue de 513 unidades, lo cual representa una disminución en el progreso de la enfermedad de 49.7%, por otro lado los frutos tratados con imazalil mostraron una disminución en el progreso de la enfermedad de 47.8% (Figura 3).
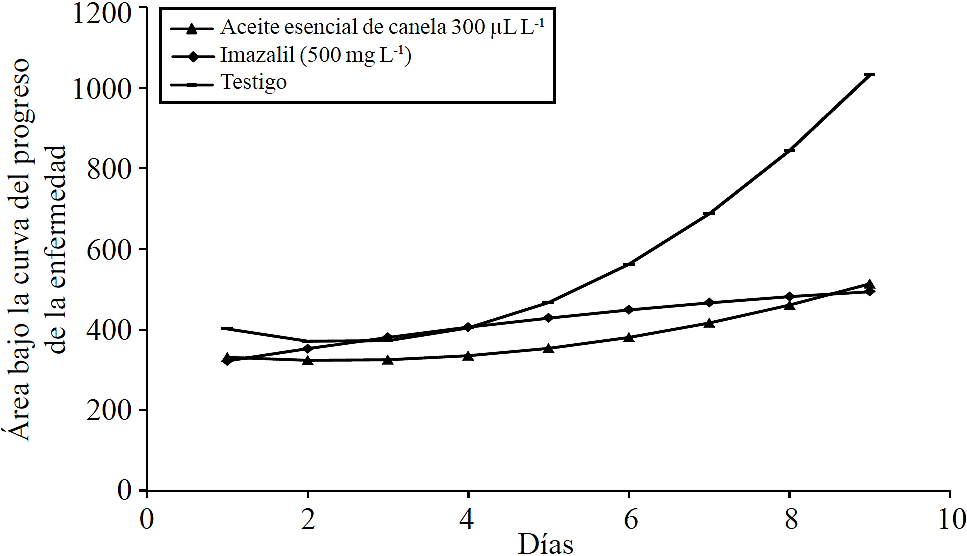
Figura 3 Área bajo la curva del progreso de la enfermedad en frutos de pera tratados con aceite esencial de canela a 300 µL L-1, imazalil a una concentración de 500 mg L-1 y frutos no tratados.
El modelo de regresión ajustado para aceite esencial de canela fue; y= -20.31549 x + 4.31269624x 2 + 347.0032, R2=0.74; para Imazalil fue y= 34.382655 x - 1.281755 x 2 + 288.6624, R2=0.71; para los frutos no tratados (testigo) el modelo fue; y= -77.11011 x +15.594707 x 2 + 462.82721 R2=0.98; donde: y= días después de la inoculación de los frutos con Penicillium, x = área bajo la curva del progreso de la enfermedad.
Desde hace algún tiempo es conocido que el aceite esencial de canela tiene una marcada efectividad biológica en contra de algunos microorganismos (Mahdi-Ojagh, et al., 2010). Los extractos de aceite esencial de canela se utilizan para el control de patógenos asperjándolos sobre los frutos o bien sumergiendo los frutos directamente en el extracto logrando incrementar la vida de anaquel (Ranasinghe, et al., 2003); sin embargo, en la mayoría de los trabajos de investigación se utilizan los extractos en combinación con otros métodos de control; por ejemplo, (Kyu Kyu Win, et al., 2007) encontraron una disminución estadísticamente significativa de la severidad en frutos de bananos cuando se inoculaban con C. musae and Fusarium spp, sin embargo, estos autores almacenaron los frutos a 13 °C, por lo cual el efecto observado sobre la severidad se debe no solo al extracto, sino a la interacción de éste con las temperaturas utilizadas. En otros trabajos se reportan resultados con la misma tendencia utilizando metodologías similares, (Melgarejo-Flores, et al., 2013) encontraron una disminución significativa en la severidad de las enfermedades ocasionadas por hongos en frutos de uva tratados con diferentes concentraciones de compuestos obtenidos de la canela; sin embargo, en la investigación antes mencionada los frutos fueron almacenados a 15 °C.
En el presente trabajo los frutos fueron almacenados en condiciones de temperatura ambiente (25± °C) y una alta humedad relativa (+90%) lo cual podría incrementar la tasa respiratoria de los frutos, con el consecuente incremento en la producción de CO2 y etileno (Taiz y Zeiguer, 2010). Algunos autores (Chilea et al., 1985) han señalado que este gas puede actuar como un factor de patogenicidad en las infecciones ocasionadas por Penicillium. Debido a lo anterior, las condiciones en las cuales se realizó el presente estudio pudieron proporcionar al patógeno una ventaja significativa para ocasionar daños en los frutos de pera, a pesar de las condiciones mencionadas anteriormente, el aceite esencial de canela fue tan eficiente como el imazalil para disminuir el progreso de la enfermedad en comparación con el testigo, con la ventaja de que el aceite esencial de canela ofrece un riesgo mínimo para la salud de los seres humanos, ya que se utiliza como ingrediente habitual de algunos alimentos.
Conclusiones
Los resultados del experimento in vitro mostraron que el aceite esencial de canela a una concentración de 300 µL L-1 logró inhibir el crecimiento micelial de Penicillium expansum. A partir de 135 µL L-1 se disminuyó la producción de esporas; sin embargo, a dosis menores a esta, la cantidad de esporas se incrementó. En el experimento in vivo Penicillium expansum mostró un crecimiento micelial estadísticamente igual cuando creció sobre frutos de pera asperjados con 300 µL L-1 de aceite esencial de canela en comparación al patógeno creciendo en presencia del testigo químico (Imazalil). Lo anterior soporta la idea de que el aceite de canela puede ser un compuesto de utilidad para mantener la vida de anaquel de frutos de pera en poscosecha.











 text in
text in 


