Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista mexicana de ciencias agrícolas
versão impressa ISSN 2007-0934
Rev. Mex. Cienc. Agríc vol.2 no.6 Texcoco Nov./Dez. 2011
Artículos
Crecimiento, rendimiento, metales pesados y microorganismos en suelo y frutos de nogal pecanero fertilizados con biosólidos*
Growth, yield, heavy metals and microorganisms in soil and fruit of pecans fertilized with biosolids
Socorro Héctor Tarango-Rivero1§, María Teresa Alarcón-Herrera2 y Erasmo Orrantia-Borunda2
1Campo Experimental Delicias. INIFAP. Carretera Delicias-Rosales, km 2. Delicias, Chihuahua, México. §Autor para correspondencia: starango@uach.mx.
2Centro de Investigación en Materiales Avanzados, A. C. Complejo Industrial Chihuahua, Miguel de Cervantes 120, Chihuahua, Chihuahua, México. (teresa.alarcon@cimav.edu.mx), (erasmo.orrentia@cimav.edu.mx).
* Recibido: febrero de 2011
Aceptado: octubre de 2011
Resumen
La aplicación de biosólidos digeridos anaeróbicamente como fuente de nutrientes para el nogal pecanero, Carya illinoinensis (Wangeh.) K. Koch, cultivar Western, fue evaluado por tres años. Las yemas crecieron un 16% más y la producción de nueces por árbol fue 11.3% mayor en el tratamiento con biosólidos en un promedio de tres años. La acumulación de As, Cd, Cr, Hg, Ni y Pb en el suelo debido a los biosólidos fue muy baja y de acuerdo con la norma de EE.UU., la concentración máxima permitida se alcanzará en 34 años. Las cantidades de Cd, Cr, Ni y Pb en la nuez estaban debajo de los límites detectables. El As y Hg se detectaron en cantidades muy pequeñas y estuvieron por debajo de los límites permitidos para nueces en el Reino Unido. Durante la pre-cosecha, en suelos fertilizados con biosólidos y en las nueces que tuvieron contacto con biosólidos, no se detectó la presencia de Escherichia coli y Salmonella sp.
Palabras clave: Carya illinoinensis, Escherichia coli, Salmonella sp., metales pesados.
Abstract
The application of anaerobically digested biosolids as a nutrient source for the pecan Carya illinoinensis (Wangeh.) K. Koch, cultivar Western, during three years was evaluated. The bearing shoot grew 16% more and nut production per tree was 11.3% higher in the biosolid treatment, on a three-year average. The accumulation of As, Cd, Cr, Hg, Ni and Pb in soil due to biosolids was very low and according to the U.S. standard, the maximum allowable concentration would be reached in 34 years. Quantities of Cd, Cr, Ni and Pb in the kernel were below detection limits. As and Hg were found in very small quantities, and were below the limits allowed for nuts in the United Kingdom. During the preharvest, in soil fertilized with biosolids and in nuts which had contact with biosolids, the presence of Escherichia coli and Salmonella sp. were not detected.
Key words: Carya illinoinensis, Escherichia coli, Salmonella sp., heavy metals.
INTRODUCCIÓN
El nogal pecanero, Carya illinoinensis (Wangeh.) K. Koch, cultivar Western es el árbol frutal caducifolio más importante de México, en donde se cultivan 84 429 hectáreas (SAGARPA, 2009). Durante el cultivo, el fertilizante es el insumo más caro de la producción y constituye el 25% de los costos de cultivo (Sparks, 1991; FIRA, 2009). Para que un nogal pueda crecer y producir adecuadamente, debe suministrársele un conjunto equilibrado de nutrientes: N, P, K, Ca, Mg, S, Zn, Cu, Fe, Mn, B, Cl y Na (Sparks, 1989; Smith, 1991). En los huertos de nuez, el fertilizante convencional NPK (CF) puede ser parcial o totalmente remplazado por biosólidos (BS), un producto de muy bajo costo, derivado de las plantas de tratamiento de aguas residuales. Los BS son una valiosa fuente de N, P, Zn, Cu, Mn y materia orgánica. La incorporación de BS en el suelo mejora las propiedades físicas, la actividad biológica y la fertilidad del suelo (Tester, 1990; Sullivan, 1998).
En México, una vez que el reglamento de agua potable (NOM-001-ECOL-96) se cumple a nivel nacional, alrededor de 650 000 t de BS secos se producen cada año (Jurado et al., 2004). En el estado de Chihuahua, cuatro plantas de tratamiento de aguas residuales producen 2 930 t de BS secos por mes (Flores, 2007). Si este subproducto no es aprovechado o reciclado, al ser depositado en vertederos ocuparán espacio, atraerá roedores e insectos vectores; contaminará el suelo y mantos subterráneos con compuestos orgánicos, microbios patógenos, metales pesados, nitratos y sales y el aire con metano. La incineración de B S contribuye a la contaminación atmosférica por la emisión de CO2, dioxinas y metales (USEPA, 1995; 1999).
Sin embargo, la aplicación de BS a suelos agrícolas tiene sus riesgos, que incluyen la acumulación de metales pesados, nitratos y sales y la contaminación por organismos patógenos y parásitos (Chaney et al., 1992; McBride, 1995). Todo esto depende en gran medida de la calidad de los BS; los BS de alta calidad no suelen causar problemas (USEPA, 1995). En el presente estudio, los BS fueron evaluados como una fuente alternativa de nutrientes a los fertilizantes inorgánicos para nogales, que tiene como objetivo determinar el efecto de la aplicación de biosólidos en el contenido de metales pesados y microrganismos en el suelo calcáreo y en dos tejidos del fruto del nogal.
MATERIALES Y MÉTODOS
Este estudio se llevó a cabo en Delicias, Chihuahua; en 2004, 2005 y 2006, en el huerto Rancho Trincheras. El material vegetal fue la variedad Western, en producción y con ocho años al inicio del estudio. Los árboles se encuentran a una distancia de 12*12 m y cada uno cuenta con 100 litros por hora para el riego con micro-aspersión. El suelo es de una textura grumosa, arenosa, muy pobre en materia orgánica (0.34%), pH= 8.4 y con baja salinidad (CE= 0.87 dS m-1).
Diseño experimental. Se utilizó un diseño completamente al azar con cuatro repeticiones por tratamiento. Cada árbol de nuez fue una repetición y a cada uno se le asignó un tratamiento de acuerdo a la similitud del diámetro de su tronco. Los siguientes tratamientos fueron evaluados cada año: 1) la fertilización inorgánica convencional. Fue utilizada la fórmula 45-15-15 g cm-1 del diámetro del tronco; el 15 de marzo, se aplicó el 50% del N y todo el P y K, y el 15 de mayo el 50% restante de N. Se utilizaron como fuente al nitrato de amonio, fosfato monoamónico y el nitrato de potasio; y 2) fertilizados con BS. Fue utilizado material de biosólidos de la planta del norte de la ciudad de Chihuahua.
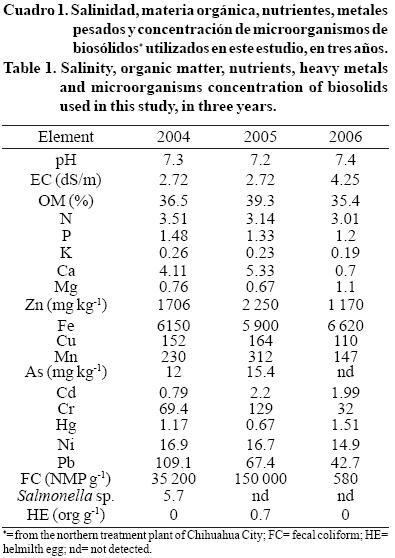
Para calcular una dosis de biosólidos, igual a 45 gN cm-1 de diámetro del tronco, se tomaron en cuenta el contenido de nutrientes y la humedad y, se asumió una mineralización del 50% de N para el primer año. Los biosólidos fueron esparcidos en la zona de riego por aspersión y se incorporaron con un rastrillo. El análisis de metales pesados de los biosólidos se presenta en el Cuadro 1. Durante los tres años, la dosis de fertilizante de biosólidos fue relativamente baja. Los árboles de 8, 9 y 10 años de edad recibieron una dosis seca-base de 2.41, 2.76 y 3.1 t ha-1, respectivamente. Los BS se clasificaron como un "tipo excelente" por su baja concentración de metales pesados y de "clase C" por su contenido de microrganismos el primer y segundo año; el tercer año fueron clasificados como "clase A", (SEMARNAT, 2002).
Variables
Crecimiento y rendimiento. La longitud de los brotes se evaluó en junio (una yema por cuadrante de nogal a una altura de 1.5 m). En octubre, el rendimiento fue pesado (kg de nueces por árbol).
Concentración en suelo de metales pesados (MP). Cada año y al final del ciclo vegetativo, las muestras de suelo fueron analizadas para medir su concentración de MP. Las muestras de suelo fueron tomadas a una profundidad de 0-30 cm en el centro de la zona de goteo de cada árbol; se hicieron tres muestras compuestas por tratamiento. Las muestras secas, tamizadas y homogeneizadas a 100 mallas, se digirieron con HNO3. En el caso de Al, que es un elemento inerte en su forma oxidada, se usó la digestión asistida por microondas. Al, Cd, Cr, Ni y Pb se determinaron por espectrometría de absorción atómica (AAS). El As y Hg se determinaron con la misma técnica y usando un generador de hidruros (AA-HG) como un método de introducción de muestras (Briggs y Meier, 1999).
Concentración de MP en los tejidos vegetales. Cada año, durante la cosecha fueron recogidas 10 nueces por árbol, separando la cáscara y semilla en cada nuez. Se realizaron tres muestras compuestas de 40 semillas y 40 cáscaras por tratamiento. Las cáscaras se secaron a la sombra y su superficie exterior se limpió con un cepillo de cerdas de plástico. Fueron molidas con un molinillo de Moulinex® con aspas de acero inoxidable y un vaso de plástico y, se almacenaron en bolsas de papel de cera. Finamente, las semillas fueron picadas con un cuchillo de acero inoxidable sobre una tabla forrada con papel bond y se almacenaron en bolsas de papel de cera. Las cáscaras y los granos se digirieron con HNO3. Se estimaron los límites de detección, se determinaron las concentraciones de Al, Cd, Pb, Hg, Cr, Ni, y As como se determina por AAS. Para el análisis de As y Hg, las muestras fueron introducidas por el método de AA-HG (Hageman y Welsch, 1996).
Determinación de microrganismos en la nuez y suelo.
Cada año, en octubre (antes de la cosecha), dos nueces de cada árbol se colocaron en el suelo durante dos días y se colocaron en frascos de vidrio esterilizados (en un autoclave durante 30 minutos a 120 °C) y se sellaron herméticamente. Se determinó la presencia de Escherichia coli y Salmonella sp. en la cáscara de la nuez y en el terreno abonado con BS. La muestra de suelo fue tomada a 0-3 cm de profundidad en el centro de la zona de goteo de cada árbol. En ambos casos se tomaron tres muestras compuestas, por tratamiento, en una zona de la huerta a 60 metros de donde se aplicaron los biosólidos. El análisis se realizó de acuerdo a la Norma Oficial Mexicana NOM-114-SS A1 -1994.
Análisis estadístico. Los datos fueron analizados por un test-T. Cuando el análisis de metales pesados en tejidos de la planta y el suelo determinaba que un elemento "no era detectado", se le asignaba un valor de cero al análisis de las variables. Los datos de los elementos con valores inferiores a 1 y los que incluían ceros fueron transformados usando la ecuación Vx+0.5 antes del análisis estadístico (Steel y Torrie 1985). Se utilizó el paquete estadístico SAS 8.2 (SAS Institute, 2001).
RESULTADOS Y DISCUSIÓN
Crecimiento y rendimiento
En dos de los tres años y en el promedio final, los nogales con BS tuvieron un tamaño de yema significativamente mayor que los árboles fertilizados; en promedio, los brotes de los nogales bajo el tratamiento orgánico crecieron 16% más (Cuadro 2). Debido que la fase de crecimiento de los brotes es muy corto en los nogales, el suministro adecuado de nutrientes tiene un efecto determinante sobre su vigor (Marquard, 1990). Esto significa que la mineralización de biosólidos es suficiente para proporcionar los nutrientes exigidos por el periodo de elongación-corto pero intenso del brote. El mejoramiento orgánico favoreció el crecimiento de brotes en el rango de máxima productividad en la variedad Western que se encuentra entre 15 y 30 cm de longitud (Storey, 1990).
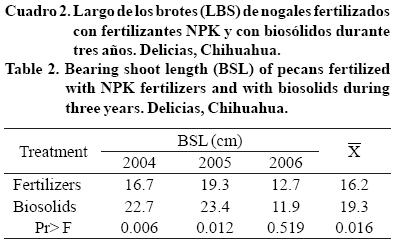
La producción de nueces fue estadísticamente igual entre los nogales modificados con BS y los que recibieron fertilizantes (Cuadro 3); sin embargo, el rendimiento fue siempre mayor en el primer grupo, 11.3% más al año, en promedio. De manera importante, la producción anual de un árbol de nuez depende del aporte adecuado de N durante las fases fenológicas de crecimiento de los brotes y llenado de grano (Wood, 2002). De lo anterior se deduce que los BS incorporados aun suelo del cultivo proporcionan suficientes nutrientes, especialmente N durante las etapas críticas del desarrollo de la nuez, para mantener una producción adecuada de nueces pecanas cada año.
Metales pesados en el suelo
El Cuadro 4 muestra el grado de acumulación de metales pesados con mayor potencial de toxicidad, para plantas y herbívoros a los tres años de aplicar los BS. Se encontró que la acumulación de PM fue un proceso lento, debido que los BS utilizados tenían un bajo contenido de PM (Cuadro 1) y la dosis relativamente baja en la que se aplicaba. La tasa mediana anual de acumulación (mg kg-1 de suelo), debido a los fertilizantes biosólidos fue de As 1.75, Cd 0.04, Cr 8.1, Hg 0.05, Ni 0.06 y Pb 4.3.

Con estos datos y usando la más estricta norma de referencia, que es de la Comunidad Europea (McGrath et al., 1995), el número de años que se necesitan para alcanzar la concentración máxima admisible (CMA) en suelos agrícolas de cada PM, sería: Cd 25-75, Cr 12.3-18.5, Hg 20-30, Ni 500-1 250 y Pb 11.6-69.7. Si como referencia se usa la norma de EE.UU. (CFR 40, Parte 503), el tiempo (años) necesario para llegar a la CMA es mucho mayor: Cd 500, Cr 185, Hg 160, Ni 3 500 y Pb 34.8.
De acuerdo a la norma europea, Cr y Pb son los elementos que limitan el uso seguro de los BS a corto plazo (12 años). Sin embargo, en los suelos alcalinos de la región nogalera de Chihuahua, ambos metales se precipitan como compuestos solubles, siendo absorbidos por la arcilla y la materia orgánica (Davies y Jones, 1992; Rostagno y Sosebee, 2001). Además, el Pb es prácticamente inmóvil en la raíz (Sommers y Barbarick, 1990). Dado que sólo una tercera parte de las raíces de alimentación de la nuez se localiza en la capa cultivable del suelo verdaderamente texturizado (Worley et al., 197 4) y, menos aún en suelos arenosos (Brison, 1976), estas condiciones reducirían la absorción y el efecto de los MP en los nogales.
Con base en los resultados de 2004, el Hg y Cd podrían acumular la CMA a mediano plazo (20 a 25 años); sin embargo, ya que éstos se detectaron sólo en uno de los tres años y en un suelo calcáreo, como el huerto en el presente estudio, el Hg se precipitaría como hidróxido o carbonato apenas soluble (Davies y Jones, 1992), lo que reduciría su disponibilidad para las plantas; además, este elemento prácticamente no se mueve en la raíz (Sommers y Barbarick, 1990). El Cd es muy móvil en el suelo y es fácilmente absorbido por las plantas (Breckle, 1991; Menzer, 1991), aunque este proceso es antagonizado por Mn, Fe, materia orgánica y más importante por el Zn y contenido de fosfato (Mengel y Kirkby, 1979; Allaway, 1986).
El níquel es un elemento común en el suelo, incluso en los tratamientos con CF. Los BS apenas contribuyeron este MP. Es el metal que requerirá más tiempo para alcanzar el límite de concentración en el suelo. En cuanto al As, los estándares de EE.UU. y Europa no establecen un CMA aunque, en Argentina el límite es de 20 mg kg-1 de suelo (Lavado y Taboada, 2002). Este metaloide también fue común en el suelo y debido a su contribución por los BS, el límite del elemento se alcanzará sólo en 11.4 años según la norma argentina. En suelos calcáreos, el As se precipita en forma apenas soluble (Davies y Jones, 1992). Los tratamientos con CF también muestran la presencia de MP en el suelo, lo que ocurre debido a la contribución de los fertilizantes sintéticos (especialmente Cd, Ni, y Pb) y sobre todo fosfatos (Colomer y Sánchez, 2000).
Metales pesados en las plantas
La acumulación de MP en las partes comestibles de plantas es importante, ya que son la entrada en la cadena alimentaria (Chaney y Giordano, 1986). El contenido de MP en las nueces pecanas fertilizadas con CF y BS se muestra en el Cuadro 5. Durante el primer año de estudio, se encontró que los CF y BS proporcionan MP a la cáscara y al grano. En general, los BS tienden a aumentar la concentración de MP en ambos tejidos, a pesar de esto, sólo se encontraron diferencias estadísticamente significativas en la cáscara para Ni y Pb. Al parecer, la cáscara no funciona como un filtro de tejido que acumule metales para reducir su paso hacia el grano. De hecho, se determinó un alto contenido de As en la parte comestible de la nuez. El Cd fue similar en ambos tejidos, el Cr y Hg fueron los más altos en la cáscara.

Durante el primer año, la concentración de As se mantuvo sin cambios y Cr casi sin cambios en el grano con CF y BS, mientras que el Hg prácticamente no se detectó en ambos tratamientos. El Cd en tratamientos con BS fue de 0.23 mg kg-1, muy por debajo del máximo de 5 mg kg-1 que un alimento vegetal puede tener para ser considerado seguro (Chaney et al., 2001). El Ni llegó a 5.3 mg kg-1, con la aplicación de los B S, 47% más que con CF. El Pb fue de 12 mg kg-1 para los tratamientos con BS, apenas 3.6 mg kg-1 más que con CF. En el Reino Unido (FSA, 2007), el CMA para las frutas, verduras y frutos secos es (mg kg-1): As 1, Cd 0.05, y Pb 0.1-0.2. De acuerdo a estos niveles, la concentración de As en la nuez estuvo dentro de los límites del Reino Unido con CF, así como con los B S. La concentración de Cd fue alta con CF y muy alta con los B S, y en cuanto al Pb, fue muy alto con ambos fertilizantes.
Se ha observado una importante acumulación de Cd en los tejidos de la planta cuando se utilizan altas dosis de BS (100 a 224 t ha-1) (Allaway, 1986; Chaney y Giordano, 1986); lo que equivale a 10-25 veces más abono del que se aplica a un huerto de nogales en producción. En varios estudios a mediano plazo, la añadidura de biosólidos no ha incrementado la concentración de Hg en tejidos del maíz Zea mays L., el nabo Brassica napus L. y la zanahoria Daucus carota L., pero ha aumentado en tomate Lycopersicon esculentum Mill. (Allaway, 1986; Chaney y Giordano, 1986). La aplicación de 10 t ha-1 de BS durante 5 años (Oliveira et al., 2005) o la incorporación de BS a 30 y 60 t ha-1 (Cuevas y Walter, 2004) no aumentó significativamente la concentración de MP en los brotes y granos de maíz. Esto sugiere que, una dosis baja de B S del tipo "excelente" aplicada a las nueces en el primer año, equivalente a 2.41 t ha-1, no debería incrementar la concentración de MP en comparación a los tratamientos con CF.
Durante el segundo año, cuando la dosis aplicada fue de 2.76 t ha-1, la concentración de Cd, Cr, Ni, Pb en la cáscara y el grano estaban por debajo de los límites de detección. El As sólo se detectó en el grano, en los tratamientos con CF, así como BS, en una cantidad inferior al límite permitido por la FSA (2007). El Hg se encontró en ambos tejidos y en el grano, la concentración media en los tratamientos con BS apenas fue 0.06 mg kg-1 mayor que con CF. En todos los casos no hubo diferencia estadísticamente significativa (Cuadro 5).
Durante el tercer año, la cantidad aplicada de BS fue equivalente a 3.1 t ha-1 y de nuevo Cd, Cr, Ni, Pb y no se detectaron en la cáscara o el grano; el As se encontró en el grano, pero en concentraciones más altas en los tratamientos con CF. El 0.18 mg kg-1 de As en tratamientos con BS están muy por debajo del 1 mg kg-1 permitido por la FSA (2007) para nueces. El Hg no fue detectado en el grano y, en la cáscara fue casi igual en ambos tipos de fertilizantes. Los resultados del segundo y tercer año, en una situación de efecto acumulativo debido a la aplicación repetida de BS, indican que las concentraciones de metales pesados que los fertilizantes biosólidos, aportan al grano no son mayores que los que aportan los CF a corto plazo.
Microrganismos en el suelo y la nuez
Durante los dos primeros años, el análisis del suelo antes de la cosecha no detectó la presencia de Escherichia coli o Salomonella sp. Durante el tercer año, con ambos tratamientos, se encontró la presencia de E. coli, pero no de Salmonella sp. Se considera que la E. coli no provino de los BS, sino que se debió a un problema de contaminación externa ya que también se detectó en el tratamiento con CF y, en un punto alejado 60 m de los árboles tratados con BS (Cuadro 6).

Esto ilustra cómo otras actividades en los huertos de nuez, como la defecación de los trabajadores entre los árboles o la presencia de fauna silvestre (Zaleski et al., 2005) pueden causar contaminación del suelo con microrganismos patógenos. Este hecho ha sido reportado por Montes et al. (2004), quienes encontraron bacterias coliformes en el orden de 300 NMP g-1 en diferentes suelos agrícolas sin la contribución de las aguas residuales o BS.
En gran medida, no detectar bacterias patógenas en la pre-cosecha se puede explicar. Cuando se fertiliza con biosólidos, la mayoría de la supervivencia de tales microbios (primordialmente de Salmonella y coliformes fecales) en la superficie del suelo es a corto plazo, dado que los microbios son destruidos por el calor, la sequedad, la luz ultravioleta y microrganismos antagonistas (Menzies, 1986; Sommers y Barbarick, 1990; Epstein, 2001). El antagonismo entre grupos microbianos es especialmente intenso.
Las poblaciones de E. coli son considerablemente reducidas por la micro-flora nativa del suelo (Jiang et al., 2002) donde pueden ser eliminadas rápidamente por las bacterias endoparásitos Bdellovibrio bacteriovorus (Martin y Focht, 1986). Tras la incorporación de BS en el suelo, en las dos primeras semanas, la densidad de bacterias heterótrofas muestran un incremento vigoroso y Salmonella spp. y E. coli se reducen significativamente (Zaleski et al., 2005). Por si mismos, los hongos nativos del suelo pueden eliminar aquellos provenientes de los BS (Kinsbursky et al., 1989).
La presencia de bacterias en la cáscara de la nuez, después de dos días en contacto con el suelo y residuos de BS, también fueron analizadas (simulando el proceso de explotación comercial). Ésta es una variable importante dado que, la principal vía de infección por patógenos de biosólidos es a través de la ingestión de frutas en contacto con el abono (Epstein, 2001). Durante los dos años de la muestra, no se detectó E. coli o Salmonella sp. en la cáscara de la nuez en ningún tratamiento (Cuadro 6). Una respuesta válida es el hecho de que al menos en la superficie de la tierra, no hubo evidencia de que los agentes patógenos provenientes de los BS sobrevivieran después de siete meses de aplicación. A través de este mecanismo, en un huerto donde se aplican los BS, la nuez no debe tener problemas de contaminación microbiana debido a fertilizantes.
CONCLUSIONES
La aplicación de biosólidos en dosis de 2.41, 2.76 y 3.1 t ha-1 en base seca, en nogales de 8, 9 y 10 años de edad, respectivamente, permitió a los árboles crecer y producir como los árboles tratados con fertilizantes. Los biosólidos no aumentaron el contenido de metales pesados tóxicos del suelo o de la fruta. No se detectaron coliformes tampoco Salmonella sp. en el suelo o en la cáscara al momento de la cosecha en otoño, cuando la aplicación de biosólidos se llevó a cabo en la primavera.
Literatura citada
Allaway, W. H. 1986. Food chain aspects of the use of organic residues. In: soils for management of organic wastes and waste waters. Second edition. SSSA-ASA-CSSA. 10-43 pp. [ Links ]
Breckle, S. W. 1991. Growth under stress. Heavy metals. In: Waisel, Y.; Eshel, A. and Kafkafi, U. (eds.). Plants roots. The hidden half. Marcel Dekker Inc. USA. 351-373 pp. [ Links ]
Briggs, P. H. and Meier, A. L. 1999. The determination of forty-two elements in geological materials by inductively coupled plasma-mass spectrometry. United States Geological Survey. Report. 99-166. 15 p. [ Links ]
Brison, F. R. 1976. Cultivo del nogal pecanero. México. CONAFRUT. 349 p. [ Links ]
Chaney, R. L. and Giordano, P. M. 1986. Microelements as related to plant deficiencies and toxicities. In: soils for management of organic wastes and waste waters. Second edition. SSSA-ASA-CSSA. 234-278 pp. [ Links ]
Chaney, D. E.; Drinkwater, L. E. and Pettygrove, G. S. 1992. Organic soil amendments and fertilizers. Publication 21505. DANR. University of California. 36 p. [ Links ]
Chaney, R. L.; Ryan, J. A.; Kukier, U.; Brown, S. L.; Siebielec, G.; Malik, M. and Angle, J. S. 2001. Heavy metal aspects of compost use. In: Stofella, P. and Kahn, B. (eds.). Compost utilization in horticultural cropping systems. CRC Press. 323-359 pp. [ Links ]
Colomer, M. J. C. y Sánchez, D. J. 2000. Agricultura y procesos de degradación del suelo. In: Santa Olalla, F. M. (ed.). Agricultura y desertificación. Mundi-Prensa. España. 109-131 pp. [ Links ]
Cuevas, G. y Walter, I. 2004. Metales pesados en maíz (Zea mays L.) cultivado en un suelo enmendado con diferentes dosis de compost de lodo residual. Rev. Int. Contam. Ambient. 20(2):59-68. [ Links ]
Davies, B. E. y Jones, L. H. P. 1992. Micronutrientes y elementos tóxicos. In: Wild, A. (ed.). Condiciones del suelo y desarrollo de las plantas. Mundi-Prensa. España. 819-853 pp. [ Links ]
Epstein, E. 2001. Human pathogens: hazards, controls and precautions in compost. In: Stofella, P. and Kahn, B. (eds.). Compost utilization in horticultural cropping systems. CRC Press. 361-380 pp. [ Links ]
Fideicomisos Instituidos en Relación con la Agricultura (FIRA). 2009. Costos de producción del nogal pecanero. Delegación Regional Delicias. FIRA-Banco de México. [ Links ]
Flores, M. J. P. 2007. Resinas de intercambio iónico para evaluar la mineralización de nitrógeno en suelos tratados con abonos orgánicos. In: uso y aprovechamiento de abonos orgánicos e inocuidad. México. Soc. Mex. Ciencia del Suelo. 386-412 pp. [ Links ]
Food Standards Agency (FSA). 2007. Survey of metals in a variety of foods. United Kingdom. URL: http://www.food.gov.uk/science. [ Links ]
Hageman, P. L. and Welsch, E. 1996. Arsenic, antimony, and selenium by flow injection or continuous flow-hydride generation-atomic absorption spectrometry. United States Geological Survey. Report 96-525. 24-30 pp. [ Links ]
Jiang, X.; Morgan, J. and Doyle, M. P. 2002. Fate of Escherichia coli O157:H7 in manure-amended soil. Appl. Environ. Microbiol. 68(5):2605-2609. [ Links ]
Jurado, G. P.; Luna, L. M. y Barretero, H. R. 2004. Aprovechamiento de biosólidos como abonos orgánicos en pastizales áridos y semiáridos. Téc. Pec. Méx. 42(3):379-395. [ Links ]
Kinsbursky, R. S.; Levanon, D. and Yaron, B. 1989. Role of fungi in stabilizing aggregates of sewage sludge amended soils. Soil Sci. Soc. Am. J. 53:1086-1091. [ Links ]
Lavado, R. S. y Taboada, M. A. 2002. Manual de procedimientos para la aplicación de biosólidos en el campo. Argentina. Fac. de Agronomía-Universidad de Buenos Aires. 54 p. [ Links ]
Marquard, R. 1990. Pecan biology. In: second pecan orchard management shortcourse. CES-New Mexico State University. [ Links ]
Martin, J. P. and Focht, D. D. 1986. Biological properties of soil. In: soils for management of organic wastes and waste waters. Second ed. SSSA-ASA-CSSA. 114-169 pp. [ Links ]
McBride, M. B. 1995. Toxic metal accumulation from agricultural use of sludge: are USEPA regulations protective? J. Environ. Qual. 24:5-18. [ Links ]
McGrath, S. P.; Chaudri, A. M. and Giller, K. E. 1995. Long-term effects of land application of sewage sludge: soils, microorganisms and plants. J. Indust. Microbiol. 517-533 pp. [ Links ]
Mengel, K. and Kirkby, E. A. 1979. Principles of plant nutrition. Second edition. International Potash Institute. Berna. 441-520 pp. [ Links ]
Menzer, R. E. 1991. Water and soil pollutants. In: casarett and doull's (ed.). Toxicology. The basic science of poisons. 4th Edition. Pergamon Press. 872-902 pp. [ Links ]
Menzies, J. D. 1986. Pathogen considerations for land application of human and domestic animal residues. In: soils for management of organic wastes and waste waters. Second edition. SSSA-ASA-CSSA. 574-585 pp. [ Links ]
Montes, R. G.; Espino, P. N. M.; Campagne, P. J. M. y Solís, G. S. 2004. Presencia de coliformes totales en la composta proveniente de lodos residuales. In: XV Congreso Nacional de Investigación y Desarrollo Tecnológico Agropecuario. México. DGETA-SEIT-SEP. Memoria. [ Links ]
Oliveira, K. W.; Melo, W. J.; Pereira, G. T.; Melo, V. P. and Melo, G. M. P. 2005. Heavy metals in oxisoils amended with biosolids and cropped with maize in a long-term experiment. Sci. Agric. 62(4):381-388. [ Links ]
Rostagno, C. M. and Sosebee, R. 2001. Biosolids application in the Chihuahuan desert: effects on runoff water quality. J. Environ. Qual. 30:160-170. [ Links ]
Secretaría de Agricultura, Ganadería, Pesca y Alimentación (SAGARPA). 2009. Avances de siembras y cosechas 2009. Chihuahua. URL: http://www.sagarpa.gob.mx. [ Links ]
Secretaría de Medio Ambiente y Recursos Naturales (SEMARNAT). 1997. Norma oficial mexicana NOM-001-ECOL-1996. Límites máximos permisibles de contaminantes en las descargas de aguas residuales en aguas y bienes nacionales. México. 18 p. URL: http://www.semarnat.gob.mx. [ Links ]
Secretaría de Medio Ambiente y Recursos Naturales (SEMARNAT). 2002. Norma oficial mexicana NOM-004-ECOL-2002. Lodos y biosólidos. Especificaciones y límites máximos permisibles de contaminantes para su aprovechamiento y disposición final. México. 52 p. URL: http://www.semarnat.gob.mx. [ Links ]
Secretaría de Salud (SS). 1994. Norma oficial mexicana NOM-114-SSA1-1994. Método para la determinación de Salmonella en alimentos. México. URL: http://www.salud.gob.mx. [ Links ]
Smith, M. W. 1991. Pecan nutrition. In: pecan husbandry: challenges and opportunities. First Nat. Pecan Work. Proc. ARS-USDA. 152-157 pp. [ Links ]
Sommers, L. E. and Barbarick, K. A. 1990. Constraints to land applications of sewage sludge. In: utilization, treatment, and disposal of waste land. Third edition. Soil Sci. Soc. Amer. 193-216 pp. [ Links ]
Sparks, D. 1989. Pecan nutrition. Twenty-third West. Pecan Conf. CES-New Mexico State University. 55-96 pp. [ Links ]
Sparks, D. 1991. Cultural practices. In: pecan husbandry: challenges and opportunities. First Nat. Pecan Work. Proc. ARS-USDA. 22-33 pp. [ Links ]
Statistical Analysis System (SAS Institute). 2001. SAS/STAT user's guide. Release 8.2 ed. SAS Institute, Cary, N.C. USA. [ Links ]
Steel, D. R. G. y Torrie, J. H. 1985. Bioestadística. Principios y procedimientos. 2da Edition. McGraw-Hill. México. 662 p. [ Links ]
Storey, J. B. 1990. Fertilization. In: texas pecan profitability handbook. TAES-The Texas A & M University System. VI1-2 p. [ Links ]
Sullivan, D. 1998. Fertilizing with biosolids. PNW 508. Oregon State University. 12 p. [ Links ]
Tester, C. F. 1990. Organic amendment effects on physical and chemical properties of a sandy soil. Soil Sci. Soc. Am. J. 54:827-831. [ Links ]
United States Environmental Protection Agency (USEPA). 1995. A guide to the biosolids risk assessements for the EPA part 503 rule. Office of Wastewater Management. 144 p. [ Links ]
United States Environmental Protection Agency (USEPA). 1999. Biosolids generation, use, and disposal in the United States. Office of Wastewater Management. 74 p. [ Links ]
Wood, B. W. 2002. Late nitrogen fertilization in pecan orchards: a review. In: Thirty-sixth West. Pecan Conf. Proc. NMSU-WPGA. 47-59 pp. [ Links ]
Worley, R. E. 1974. Effect of N, P, K, and lime on yield, nut quality, tree growth, and leaf analysis of pecan (Carya illinoensis W.). J. Amer. Soc. Hort. Sci. 99(1):49-57. [ Links ]
Zaleski, K. J.; Josephson, K. L.; Gerba, C. P. and Pepper, I. L. 2005. Potential regrowth and recolonization of salmonellae and indicators in biosolids and biosolid-amended soil. Appl. Environ. Microbiol. 71(7):3701-3708. [ Links ]















