Introducción
Los incendios forestales son fenómeno global que afecta a la mayoría de los ecosistemas del mundo (Whelan 1995, McKenzie et al. 2011). Whelan (1995) define los incendios forestales como todo aquel fuego fuera de control ocurrido en un bosque y que ha sido provocado maliciosamente, por accidente, mal manejo o por eventos naturales como un rayo o sobrecalentamiento de la maleza. Como proceso natural éstos son esenciales en aquellos ecosistemas que dependen del fuego para mantener el equilibrio natural y la diversidad de especies (Whelan 1995, FAO 2002, Nasi et al. 2002, Castillo et al. 2003, Sodhi et al. 2011). Sin embargo, con el aumento de la población humana y en consecuencia el incremento en la necesidad de utilizar cada vez más tierras para la expansión de la agricultura, urbanización, entre otros (Kotliar et al. 2002, Nasi et al. 2002, Castillo et al. 2003, Saab y Powell 2005, Dull 2008, Vicente y Valencia 2010), aunado a la incidencia del cambio climático que trae consigo aumentos de las temperaturas medias anuales, así como la recurrencia del fenómeno El Niño (FAO 2002; Nasi et al. 2002; FAO 2005) ha provocado una modificación dramática y alarmante en los regímenes de incendios en todo el mundo y gran impacto sobre la biodiversidad a través de la pérdida de hábitat, fragmentación (Fahrig 2003, García-Rodríguez et al. 2006, Vicente y Valencia 2010) y la extinción de especies (Sodhi et al. 2011).
En el mundo son afectadas por el fuego millones de hectáreas de bosques al año (FAO 2002, FAO 2005) y El Salvador no es la excepción a este patrón, se estima que anualmente afectan alrededor de 3,500 ha de bosques y pastizales, estos incendios ocurren durante la época seca, periodo en el cual se alcanzan las más altas temperaturas en el país (35 a 40°C) (CNIF 2012, CNIF 2013, Bomberos de El Salvador 2015). La Libertad es uno de los departamentos más afectados por estos fenómenos en el país, (CNIF 2012, CNIF 2013) y dentro de éste, una de las áreas que históricamente ha sido muy afectada por incendios forestales es el parque Natural Walter Thilo Deininger (WTD) (ISTU 2015), que constituye un conjunto de bosques de galería y seco, pastizales y pequeñas sabanas (Witsberger et al. 1982). Los antecedentes de incendios forestales se remontan a 1986, año en el que casi la mitad del parque se vio afectado, el incendio duró ocho días. A partir de este año el parque sufrió otros eventos similares cada año hasta 1990, desde esta última fecha sólo se registraron sucesos menores que afectaron algunas hectáreas de terreno, pero en 2005 se produjo un incendio de 279.72 ha. Trascurrieron ocho años para que el parque WTD de nuevo sufriera otro incendio, en 2013, éste duró ocho días y cubrió 400 ha de bosque. En 2015 fueron afectadas por el fuego 350 ha (ISTU 2015). El parque volvió a tener incendios hasta marzo de 2017, alrededor de 100 ha de bosque se vieron afectadas (El Metropolitano Digital 2017). Dada la naturaleza de los hábitats predominantes del parque WTD, los incendios forestales son normales y hasta necesarios cuando surgen de manera natural (Sodhi et al. 2011).
El parque WTD alberga alrededor 200 especies de aves (eBird 2020), lo cual representa el 36% del total de avifauna que ocurren en el país (Ibarra 2013). De éstas, con base en la lista roja más actualizada, 14 especies se encuentran dentro de alguna categoría de amenaza a nivel nacional (MARN 2015). Esta área natural es de gran importancia para la conservación de las mismas, tanto residentes como migratorias. Es por ello que Komar (2002) la incluyó en la posición número seis como una de las “Áreas Clave para la Conservación de las Aves en El Salvador” debido a que, para esta época, el parque contaba con 46 especies residentes y cinco especies migratorias amenazadas a nivel nacional, y además, dos aves endémicas de la región norte de Centroamérica. Asimismo, Komar e Ibarra-Portillo (2009) proponen al parque WTD como un “Área de Importancia para la Conservación de las Aves” (iba sv008) al cumplir con el criterio A3 de conservación, es decir, cuenta con especies restringidas a un bioma en particular, dado que los fragmentos de bosque seco caducifolio contienen representantes del bioma de la “Vertiente Árida del Pacífico” (PAS, por sus siglas en inglés).
A pesar de lo anterior, en esta área natural nunca se ha evaluado el impacto ecológico que los incendios forestales tienen sobre las comunidades de aves y su interrelación con la vegetación, asimismo, del área sólo existe un estudio publicado acerca de la diversidad de aves (Reyes et al. 1994) y ninguno relacionado con la influencia del fuego sobre la avifauna y cómo la fragmentación causada por estos eventos incide en la ocurrencia de los distintos gremios tróficos de éstas, situación que se extiende a otros bosques secos tropicales, pues el número de publicaciones sobre dicha temática es limitado (Sodhi et al. 2011). Con base en esto surge la presente investigación, en la cual se pretende analizar el efecto ecológico que los incendios forestales tienen sobre la avifauna de esta área natural y a su vez, determinar si existe diferencia de gremios tróficos entre parches quemados comparado con un parche con largo tiempo desde el fuego, además de relacionar estas variables con el tipo de vegetación encontrada.
Métodos
Descripción del área de estudio
El parque Walter Thilo Deininger está ubicado entre las coordenadas geográficas 13º31’ latitud norte y los 89º16’ longitud oeste; se encuentra a 5 km de la Ciudad de La Libertad, al norte de la carretera del Litoral (Witsberger et al. 1982, ISTU 2017) (Figura 1). Este parque natural está incluido en el Área de Conservación de la Costa del Bálsamo (MARN 2016), cuenta con una extensión de 732 ha, su rango altitudinal parte de los 4 msnm. hasta los 297 msnm (Witsberger et al. 1982, Reyes et al. 1994). Se encuentra dentro de la región climática “sabana tropical caliente o tierra caliente” comprendida entre los 0-800 msnm (clasificación de Köppen, Sapper y Laurer, 1954) y bajo el sistema de clasificación de Holdridge (1975) como “bosque húmedo subtropical, transición a tropical” (Citados por Witsberger et al. 1982, SNET 2017). La temperatura media anual está dentro del rango de los 22º a los 27ºC (Reyes et al. 1994). En la estación lluviosa se registra un promedio anual 1,594 mm de precipitación pluvial (Reyes et al. 1994, SNET 2017).
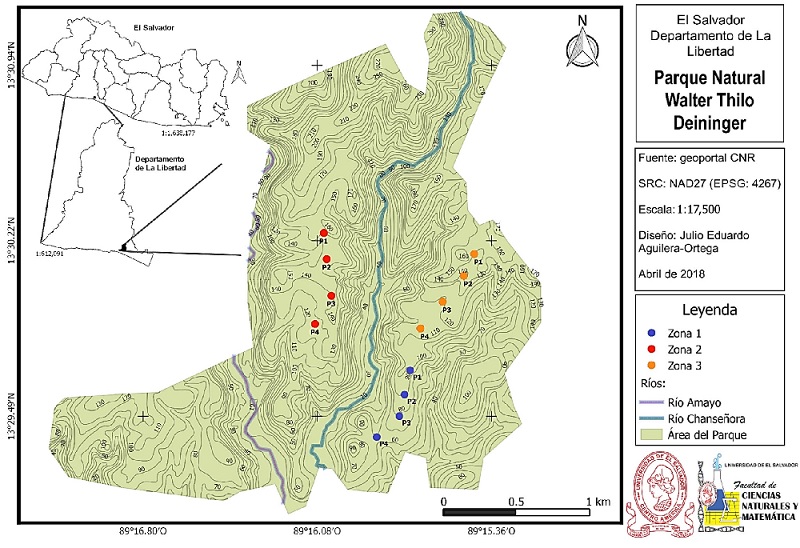
Figura 1 Ubicación y mapa general del Parque Natural Walter Thilo Deininger, se indican las zonas de muestreo, así como los puntos de radio fijo donde se realizó el registro de aves y vegetación.
Según Witsberger et al. (1982) en el parque WTD existen varios tipos de vegetación natural, cuya distribución está influenciada principalmente por las características topográficas del sitio, así como en la disponibilidad de agua y tipo de suelo. Se diferencian cinco tipos principales de comunidades vegetales: vegetación de playa, bosque húmedo caliente de los terrenos bajos (o bosque alto mixto), bosque de galería por la orilla de los ríos (perennifolio), bosque seco caducifolio y sabanas (morrales o chaparrales).
El bosque seco caducifolio se caracteriza por la pérdida del follaje de los árboles dominantes durante la estación seca. Dichos arboles alcanzan tamaños de entre 15 y 20 m, los cuales en la estación lluviosa forman un dosel cerrado. Este tipo de bosque fue durante mucho tiempo el bosque más extenso de El Salvador, y actualmente el parque WTD junto con otras áreas naturales alberga unos de los pocos relictos de este tipo de vegetación en el país (Witsberger et al. 1982, ISTU 2017).
Esta investigación estuvo enfocada al bosque seco caducifolio del parque WTD. Establecí tres zonas de muestreo con base al tiempo desde el fuego y su severidad. Generalmente el gradiente de severidad está dividido en tres niveles, basados en la respuesta de la vegetación al fuego (Kotliar et al. 2002), baja severidad (1), matan o eliminan temporalmente porciones vegetales sobre el suelo, esto es, capas herbáceas y de sotobosque, algunas veces queman las porciones inferiores de árboles maduros, sin matarlos. Severidad moderada (2), pueden matar, pero usualmente no consumen hojas de árboles de dosel, aunque puede producirse la mortalidad de los mismos. Severidad alta (3), suelen quemar la copa de los árboles al nivel de dosel, matando a la mayoría de éstos. A su vez, es posible que el incendio sea una mezcla de los anteriores, es decir, un cuarto tipo, severidad mixta (4), estos incendios ocasionan una mortalidad selectiva en la vegetación dominante, dependiendo de la susceptibilidad de diferentes especies de plantas al incendio, o queman parches diferentes con alta o baja gravedad (Saab y Powell 2005). Determiné esta variable para las tres zonas de forma cualitativa mediante comunicación personal con el equipo de guardaparques del sitio de estudio que han presenciado todos estos incendios y a su vez, a través de inspecciones en campo de las mismas, previo al establecimiento de los puntos de muestreo (Figura2). Por otra parte, cabe recalcar que este parque al ser un área protegida no ha experimentado ninguna modificación antropogénica en ningún sector, hasta la fecha de este estudio (com. pers. equipo de guardaparques).

Figura 2 Evidencia del daño causado por los incendios forestales en el Parque Walter Thilo Deininger. Arriba, izquierda: árbol de 11 m de altura afectado por el incendio de 2015 en la zona 2. Arriba, derecha: multiples arbustos calcinados por el incendio de 2015 en la zona 2. Abajo, izquierda, un árbol de gran tamaño afectado por el incendio de marzo de 2017, en la zona 3 del parque. Abajo, derecha: estrato arbustivo afectado por el incendio de marzo de 2017 en la zona 3, se observa la colonizacion de plantas rastreras y bejucos de rápido crecimiento.
La Zona 1 (Z1), es conocida como “El Pitarrio” y se encuentra dentro del “Sendero del Madrecacao”, en esta parte del parque no ha sucedido ningún incendio en aproximadamente cinco años, el último de los cuales fue de severidad moderada. Posee una elevación promedio (obtenida del promedio de elevación de los cuatro puntos de muestreo que componen las zonas) de 81.25 msnm, con una inclinación promedio del
5.1% a -5.0% (Figura 1, azul).
Por su parte la Zona 2 (Z2) es un área que históricamente ha sido afectada por una serie de incendios forestales de severidad y magnitud variable, el último de éstos sucedió en 2015, fue de alta severidad (zona estudiada), quedaron calcinados arboles de más de 10 m de altura. Este incendio forestal afectó principalmente los sitios conocidos como “Las Vacas Gordas” hasta “El Coyolar”, dentro del sendero “La Nancera” y “El Coyolar”. Con una elevación promedio de 142.75 msnm, y una inclinación media de 4.2% a -4.5% (Figura 1, rojo).
La Zona 3 (Z3) se encuentra en la montaña “Madrecacao”, en el límite Este del parque y dentro del mismo sendero que la Z1, esta área fue afectada por un incendio de severidad moderada en marzo de 2017. Posee una elevación promedio de 135.5 msnm, con una inclinación de entre el 5.4% y -1.3% (Figura 1, naranja).
Muestreo de la vegetación
Utilicé parcelas circulares de 25 metros de radio, ubicadas en el mismo lugar que los puntos de conteo de aves en cada una de las zonas. Para los árboles y arbustos (superiores) partí de un punto central, desde el cual muestreé dos transectos lineales de 50 m de largo por 10 m de ancho, para ello, seguí la orientación dada por los puntos cardinales, el primero siguiendo la dirección cardinal Este-Oeste y el segundo de Norte-Sur, únicamente las plantas encontradas en estos transectos fueron medidas. Estimé la altura de los árboles y arbustos mediante el uso de un estadal de 2 m de longitud; clasifiqué como arbustos aquellas especies vegetales con una altura de entre 3 y 5 m, y como árboles aquellas con más de 5 m de altura. Para las herbáceas (plantas entre 0 y 3 m de altura) utilicé una cuadrícula de 2 x 2 m, y coloqué al azar dos en cada una de las cuatro secciones de la parcela circular (O-N, N-E, E-S y S-O), en total ocho mediciones, tal como con los otros estratos registré altura y número de individuos por especie.
Muestreo de la avifauna
Empleé el método de conteo por puntos de radio fijo (Ralph et al. 1996); establecí cuatro puntos de 25 m de radio en cada una de las zonas (Sosa 2008, Sosa et al. 2010, Ponce et al. 2012), éstos estuvieron separados por una distancia mayor o igual a 250 m dependiendo de las condiciones de accesibilidad del sitio (Kotliar et al. 2007, Venegas et al. 2009, Sosa et al. 2010, Perfetti-Bolaño et al. 2013) (Figura 1).
Registré el número de individuos por especie de todas las aves vistas u oídas dentro del área de muestreo por un periodo de 10 minutos por punto, desde la salida del sol hasta cuatro horas después (Ralph et al. 1996, Sosa et al. 2010, PinedaDiez et al. 2012, Perfetti-Bolaño et al. 2013). No incluí en este estudio aves que fueran de paso y que no se percharan en el punto de muestreo, tampoco aquéllas que sobrevuelan el área, aves rapaces y especies de hábitos nocturnos (Milesi et al. 2002, Sosa 2008, Sosa et al. 2010, Pineda-Diez et al. 2012, Leyequién et al. 2014). Llevé a cabo tres repeticiones aleatorias en cada una de las zonas; realicé nueve muestreos entre septiembre y noviembre de 2017, meses que coinciden con la estación lluviosa, en la cual la cobertura vegetal del bosque caducifolio se ha regenerado, lo que permite la comparación entre zonas. No realicé ningún muestreo bajo condiciones climáticas de lluvia, viento, nubosidad abundante u otras que pudieran interferir en la actividad de las aves, visibilidad o audibilidad.
Las aves registradas en cada una de las zonas fueron catalogadas en cinco gremios alimentarios (Gray et al. 2007) frugívoros, granívoros, insectívoros, nectarívoros y omnívoros (cuando la dieta primaria pueda ser asignada a más de dos gremios). Si bien éstos parecen ser bastante amplios, son útiles para determinar la vulnerabilidad a la perturbación en las aves (Gray et al. 2007). En función de las especies registradas utilicé los listados reportados en algunos estudios sobre gremios tróficos de avifauna de la región (Ramírez-Albores 2006, PinedaDiez et al. 2012, Andino 2014), y en caso de no encontrar una especie en éstos, empleé recursos en línea especializados (Catalogue of Life 2017, EoL 2017).
Análisis de datos
Plantas
Para obtener una visualización del estrato dominante (A = arbóreo, B = arbustivo y H = herbáceo) por zona, calculé el porcentaje dividiendo el total de individuos encontrados en un Aguilera-Ortega estrato dado entre la totalidad de los individuos registrados en los cuatro puntos de observación de aves:
Con estos datos diseñé un gráfico de barras, en el que muestro el porcentaje para cada estrato, y a su vez, bigotes que muestran el error estándar (± EE) para los tres estratos en las zonas estudiadas.
Aves
Registré el número total de especies (S) e individuos en cada punto de muestreo, y a partir de estos datos calculé el índice de Shannon-Wiener (H’) para cada zona de estudio (Magurran 2004). Dicho índice se obtiene mediante la siguiente ecuación:
Donde pi = abundancia proporcional de la especie i. Este cálculo lo efectué de forma automatizada con el programa estadístico past versión 3.01 para Windows (Hammer et al. 2001).
A continuación, realicé una prueba t modificada por Hutcheson (α = 0.05) para determinar si existen diferencias significativas entre las zonas muestreadas con respecto a la diversidad de aves en éstas (Zar 1999, Gricera y Pavic 2007, Ponce et al. 2012, Perfetti-Bolaño et al. 2013, Troya 2017). Tal prueba se basa en el índice de Shannon-Wiener (H’) obtenido en dos muestras y evalúa la hipótesis nula de que las diversidades de las dos poblaciones muestreadas son iguales (Zar 1999). Para el cálculo de esta prueba t modificada utilicé la siguiente ecuación, donde H’1 y H’2 son el valor del índice de Shannon-Wiener para cada muestra:
En cada una de éstas se calcula la varianza del índice de diversidad mediante la expresión:
Donde n es el tamaño de la muestra, fi es el número de observaciones de la especie i y log2 f significa (log f)2. Los grados de libertad de esta prueba son aproximados en función de (Hutcheson 1970 citado por Zar 1999):
Debido a que la prueba t modificada por Hutcheson sólo establece si dos muestras son estadísticamente diferentes, basándose en el índice de Shannon-Wiener (H’), es necesario incluir un análisis en que determine la magnitud de esta diferencia, en términos de ganancia o pérdida de diversidad en cada zona. Para tal fin utilicé los números efectivos de especies, los cuales son una medida de la diversidad verdadera ( q D) de cada sitio, término que se emplea como distinción de una amplia gama de índices utilizados para medir la diversidad de una comunidad, pero que en realidad miden la entropía (ShannonWiener, Simpson, etc.). La diversidad verdadera proporciona una expresión unificada e intuitiva de la diversidad de especies mediante el algoritmo (Jost 2006):
Donde el exponente q -conocido como el orden de la diversidad verdadera- determina la sensibilidad del índice a las abundancias relativas de las especies, así, todos los valores debajo de la unidad favorecen a las especies raras o poco frecuentes, mientras que aquéllos arriba de uno favorecen a las especies comunes o más abundantes. El punto crítico donde el índice proporciona el mismo peso a las especies por su frecuencia, sin favorecer a las comunes o raras es cuando q = 1, por su parte cuando q = 0 es insensible a la frecuencia, por lo tanto, es equivalente a la riqueza de especies (S) (Jost 2006). La elección del orden de la diversidad depende enteramente de la naturaleza de cada estudio en cuestión, puesto que cada uno explica un aspecto concreto de la comunidad (Moreno et al. 2011). Para este estudio consideré la diversidad de orden 0 (0D) y 1 (1D), el cálculo de esta última se obtiene de forma directa mediante el exponente de H’, 1D = exp(H’) (Jost 2006).
Con el fin de evaluar la completitud de los muestreos realizados en cada una de las zonas, y a su vez, para compararlos con los valores obtenidos con los números efectivos empleados. Utilicé dos estimadores basados en la cobertura de la muestra. Estos estimadores son específicos para cada orden de la diversidad, de esta manera, para la diversidad orden 0 empleé el estimador no-paramétrico ace (Abundance-based coverage estimator), el cual separa a las especies observadas en grupos raros y abundantes, no obstante únicamente los datos en el grupo raro se usan para estimar el número de especies no detectadas (Chao y Lee 1992). Para la diversidad de orden 1 usé el estimador no-paramétrico del índice de Shannon (Bias-corrected Shannon diversity estimator), propuesto Incendios y avifauna en un bosque salvadoreño Para casos donde no se tiene un conocimiento completo de la comunidad; cuando se calcula el exponencial de éste se obtiene una buena medida de diversidad estimada (Chao y Shen 2003). Ejecuté estos cálculos de forma automática mediante el paquete SPADER (Chao et al. 2016), dentro del lenguaje de programación R (R Core Team 2017) para la plataforma Windows.
Empleé el coeficiente de similitud de Sørensen para datos cuantitativos para evaluar la posible similitud en la abundancia de individuos en los sitios que han sido afectados en comparación con el que no ha sido perturbado por incendios forestales por más de cinco años (Troya 2017). Sørensen cuantitativo asume valores entre 1 cuando los dos sitios son complemente similares, es decir, comparten el mismo número de individuos, y 0 cuando la similitud es mínima o nula. Éste se calcula a través de la fórmula,
Donde Na = número total de individuos en el sitio A; Nb = número total de individuos en el sitio B y jN = sumatoria de la abundancia más baja de cada una de las especies compartidas entre ambos sitios (Moreno 2001, Magurran 2004).
Finalmente, realicé un Análisis de Correspondencia (CA) para determinar si existe asociación entre los gremios alimentarios y las distintas zonas, así como entre éstos y el tipo de vegetación dominante; comprobé la significancia de la asociación con la prueba Chi-cuadrado. El CA se utiliza para explorar la relación entre variables categóricas (gremios tróficos, estrato de vegetación y zonas), el cual permite resumir y visualizar conjuntos de datos en un gráfico de dos dimensiones. En el CA se calculan los puntajes (coordenadas) tanto para las filas como para las columnas, estas coordenadas se utilizan para visualizar gráficamente la asociación entre los elementos de filas y columnas en una tabla de contingencia (Kassambara 2017). Este análisis lo realicé de forma automatizada mediante el paquete FactoMineR (Husson et al. 2010) y para su visualización gráfica empleé el paquete Factoextra (Kassambara 2017), ambos dentro del lenguaje de programación R (R Core Team 2017) para la plataforma Windows.
Resultados
Estructura de la vegetación por zonas
La Z1 estuvo dominada por el estrato arbóreo (A) con 42.18% con respecto del total muestreado en los cuatro puntos de radio fijo (n = 211), encontré 23 especies de las cuales las más representativas fueron Lonchocarpus minimiflorus (Chaperno) con 9.33 m de altura promedio, Cordia alliodora (Laurel) con una altura promedio de 8.62 m y Piptadenia obliqua (Pintadillo) con 9.43 m. El estrato herbáceo (H) representó el 36.97% del total de plantas registradas (n = 211), compuesto en su mayoría por plantas rastreras, zacates de entre 50 cm y 1 m y algunas enredaderas, la especie más abundante fue una marantaceae indeterminada seguida de Helicteres guazumifolia (coralillo). En esta zona el estrato arbustivo (B) fue el menos abundante con sólo el 20.85% de total muestreado (n = 211), del cual Bauhinia sp (pie de venado) fue la especie más abundante (Figura 3, Z1).
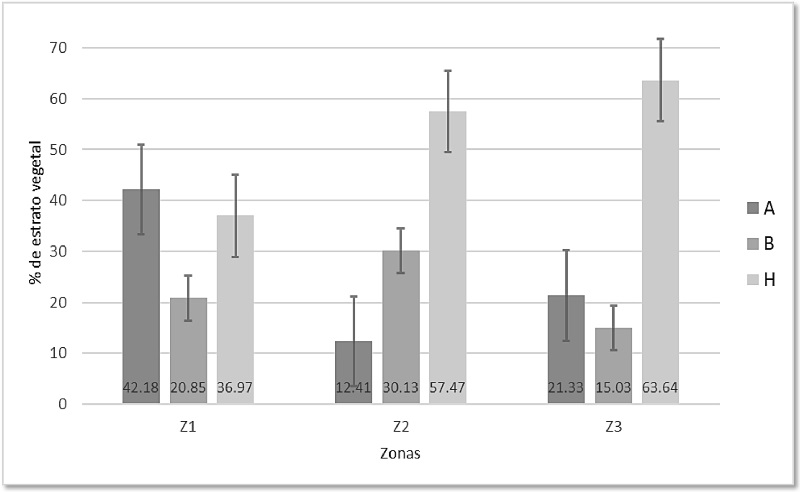
Figura 3 Porcentaje del estrato vegetal respecto al total muestreado por zona (cada barra muestra ± Error Estándar) en el Parque Walter Thilo Deininger. Estratos, A: arbóreo; B: arbustivo; H: herbáceo. Zonas, Z1: Zona 1; Z2: Zona 2; Z3: Zona 3. Aguilera-Ortega
Por su parte, en la Z2 encontré un total de 395 plantas. De éstas, 227 pertenecieron al estrato herbáceo, lo cual representa el 57.47% del total; este estrato estuvo dominado por poaceae indeterminadas y por representantes de la especie pie de venado; en segundo lugar, el estrato arbustivo con 30.13% del total registrado (n = 395), cuyas alturas promedio rondan los 4.45 m, y los más comunes fueron el laurel y el pie de venado. El estrato arbóreo fue el menos abundante, con tan sólo el 12.41% (Figura 3, Z2), la altura promedio de todos los individuos registrados fue de 7.29 m, y los más frecuentes fueron el laurel, Spondias purpurea (jocote pitarrio) y Luehea candida (cabo de Hacha).
En cuanto a la Z3, el 63.64% de todas las plantas muestreadas (n = 286) pertenecieron al estrato herbáceo (Figura 3, Z3), caracterizado por plantas rastreras de entre 10 y 20 cm, algunos zacates con alturas de entre uno y dos metros, y varias enredaderas y bejucos. Registré 61 individuos de árboles, lo cual representa el 21.33% con respecto al total (n = 286), con alturas de entre 6 y 12 m, de éstos los más comunes fueron Gliricidia sepium (madrecacao), laurel y Lonchocarpus phaseolifolius (chaperno). Los menos abundantes para esta zona fueron los arbustos, con 43 individuos (15.03%), de los cuales el más representativo fue Genipa americana (irayol) (Figura 3, Z3).
Diversidad y recambio de especies de aves
En todas las zonas de estudio registré 298 individuos, agrupados en 18 familias y 43 especies. El 50% de todos los individuos de aves estuvo concentrado en cuatro familias, de éstas, la más representativa fue la Tyrannidae con el 20% del total, seguido de las familias Columbidae (11%), Cuculidae (10%) y Troglodytidae (9%). Las especies más abundantes fueron Crotophaga sulcirostris (garrapatero pijuy) y Pitangus sulphuratus (luis bien te veo) del gremio de los insectívoros, seguidas por Eupsittula canicularis (perico frente naranja) (frugívoros) y Turdus grayi (mirlo pardo) (omnívoros) (Cuadro 1).
Cuadro 1 Frecuencia de individuos por especie de ave en las tres zonas de estudio del Parque Walter Thilo Deininger, La Libertad, El Salvador; muestreadas con el método de puntos de radio fijo (25 m). G: Gremios, F: frugívoro; G: granívoro; I: insectívoro; N: nectarívoro; O: omnívoro. Zona 1 (Z1), sin incendios forestales por aproximadamente cinco años. Zona 2 (Z2), zona quemada a alta severidad hace dos años. Zona 3 (Z3), zona quemada a severidad moderada hace aproximadamente seis meses. T: total.
| Familia | Especie | Nombre común | G | Z1 | Z2 | Z3 | T |
| Cracidae | Ortalis leucogastra | chachalaca vientre blanco | F | 4 | 0 | 5 | 9 |
| Columbidae | Zenaida asiatica | paloma ala blanca | G | 3 | 11 | 2 | 16 |
| Columbidae | Patagioenas flavirostris | paloma morada | G | 0 | 1 | 0 | 1 |
| Columbidae | Columbina inca | tórtola cola larga | G | 0 | 10 | 2 | 12 |
| Columbidae | Leptotila verreauxi | paloma arroyera | G | 1 | 1 | 1 | 3 |
| Cuculidae | Crotophaga sulcirostris | garrapatero pijuy | I | 0 | 24 | 4 | 28 |
| Cuculidae | Morococcyx erythropygus | cuclillo terrestre | O | 0 | 2 | 0 | 2 |
| Cuculidae | Piaya cayana | cuclillo canela | I | 0 | 1 | 0 | 1 |
| Trochilidae | Amazilia beryllina | colibrí berilo | N | 0 | 3 | 1 | 4 |
| Trochilidae | Hylocharis eliciae | zafiro garganta azul | N | 0 | 1 | 0 | 1 |
| Trochilidae | Archilochus colubris | colibrí garganta rubí | N | 0 | 5 | 7 | 12 |
| Trochilidae | Amazilia rutila | colibrí canela | N | 0 | 2 | 2 | 4 |
| Trochilidae | Heliomaster constantii | colibrí picudo | N | 0 | 0 | 3 | 3 |
| Trogonidae | Trogon elegans | trogón elegante | O | 2 | 1 | 0 | 3 |
| Momotidae | Eumomota superciliosa | momoto ceja azul | O | 0 | 1 | 0 | 1 |
| Picidae | Melanerpes aurifrons | carpintero cheje | I | 0 | 3 | 2 | 5 |
| Psittacidae | Eupsittula canicularis | perico frente naranja | F | 16 | 2 | 3 | 21 |
| Tityridae | Pachyramphus aglaiae | mosquero‐cabezón degollado | I | 0 | 0 | 2 | 2 |
| Tyrannidae | Pitangus sulphuratus | luis bien‐te‐veo | I | 13 | 2 | 10 | 25 |
| Tyrannidae | Myiozetetes similis | luis gregario | I | 4 | 0 | 0 | 4 |
| Tyrannidae | Empidonax minimus | mosquero mínimo | I | 0 | 0 | 1 | 1 |
| Tyrannidae | Tolmomyias sulphurescens | mosquero ojos blancos | I | 0 | 2 | 1 | 3 |
| Tyrannidae | Megarynchus pitangua | luis pico grueso | I | 3 | 1 | 1 | 5 |
| Tyrannidae | Myiarchus nuttingi | papamoscas de Nutting | I | 6 | 7 | 7 | 20 |
| Tyrannidae | Tyrannus melancholicus | tirano tropical | I | 0 | 0 | 1 | 1 |
| Troglodytidae | Campylorhynchus rufinucha | matraca nuca rufa | I | 0 | 7 | 1 | 8 |
| Troglodytidae | Thryophilus pleurostictus | chivirín barrado | I | 4 | 8 | 6 | 18 |
| Polioptilidae | Polioptila albiloris | perlita pispirria | I | 6 | 7 | 3 | 16 |
| Turdidae | Turdus grayi | mirlo pardo | O | 9 | 3 | 9 | 21 |
| Fringillidae | Euphonia affinis | eufonia garganta negra | F | 1 | 2 | 0 | 3 |
| Icteridae | Agelaius phoeniceus | tordo sargento | O | 0 | 1 | 0 | 1 |
| Icteridae | Icterus gularis | bolsero de Altamira | F | 0 | 2 | 3 | 5 |
| Icteridae | Icterus pustulatus | bolsero dorso rayado | F | 0 | 0 | 1 | 1 |
| Icteridae | Icterus galbula | bolsero de Baltimore | F | 0 | 1 | 0 | 1 |
| Icteridae | Icterus spurius | bolsero castaño | O | 0 | 1 | 0 | 1 |
| Parulidae | Parkesia noveboracensis | chipe arroyero | I | 0 | 1 | 1 | 2 |
| Parulidae | Basileuterus rufifrons | chipe gorra rufa | I | 2 | 0 | 0 | 2 |
| Parulidae | Leiothlypis peregrina | chipe peregrino | O | 0 | 8 | 6 | 14 |
| Parulidae | Setophaga petechia | chipe amarillo | I | 0 | 2 | 4 | 6 |
| Cardinalidae | Saltator atriceps | picurero cabeza negra | F | 8 | 1 | 0 | 9 |
| Cardinalidae | Cyanocompsa parellina | colorín azul negro | G | 0 | 1 | 0 | 1 |
| Cardinalidae | Passerina ciris | colorín sietecolores | G | 0 | 1 | 0 | 1 |
| Thraupidae | Piranga rubra | tángara roja | O | 0 | 1 | 0 | 1 |
| Total | 82 | 127 | 89 | 298 |
En el cuadro 2 presento los valores de los índices de Shannon (H’) y números efectivos de orden 0 y 1 con sus estimadores, para cada zona de estudio. Es posible apreciar que los valores del índice de Shannon varían comparados con la Z1. Esta resolución fue confirmada con la prueba de t modificada por Hutcheson. En la comparación por pares de la Z1 y Z2 encontré que esta última es significativamente más diversa que la primera (t = 5.198, gl = 208, P < 0.01). Asimismo, concluyó que la diversidad de aves de Z3 es significativamente mayor que en Z1 (t = 5.499, gl = 170, P < 0.01). En cuanto el contraste entre Z2 y Z3 determiné que no existen diferencias importantes en términos de diversidad (t = 0.202, gl = 216, P = 0.84).
Cuadro 2 Índices de diversidad de aves en las tres zonas de estudio del Parque Walter Thilo Deininger, La Libertad, El Salvador. Zona 1 (Z1), sin incendios forestales por aproximadamente cinco años. Zona 2 (Z2), zona quemada a alta severidad hace dos años. Zona 3 (Z3), zona quemada a severidad moderada hace aproximadamente seis meses. H’: diversidad de Shannon-Wiener. *Diversidad de orden 0 (q = 0). **Diversidad de orden 1 (q = 1).+ACE. ++Chao y Shen 2003.
| Diversidad Observada | Diversidad Estimada | ||||
| Zona | H | 0D* | 1D** | 0D+ | 1D++ |
| Z1 | 2.436 | 15 | 11.43 | 15.9 | 12.35 |
| Z2 | 3.042 | 35 | 20.95 | 55.7 | 26.44 |
| Z3 | 3.019 | 27 | 20.47 | 34.8 | 24.78 |
Con base en el estimador para la diversidad de orden 1 (q = 1) determiné que los muestreos en las tres zonas fueron adecuadamente representativos (Z1 = 93%, Z2 = 79% y Z3 = 83%). A su vez, con los valores dados por el índice de diversidad verdadera, es posible estimar la magnitud de la diferencia de diversidad entre una zona y otra. Los números efectivos de especies estimados de Z2 comparados con Z1 indican que la primera comunidad es más del doble (2.14 veces) de diversa que la primera, es decir, Z1 sólo posee el 47% de la diversidad efectiva que posee Z2. Esta tendencia se mantiene al comparar los datos obtenidos en Z3, la cual es 2.00 veces más diversa que Z1, por tanto, esta última posee únicamente el 50% de la diversidad efectiva que la primera. Las comunidades Z2 y Z3 fueron muy parecidas, puesto que únicamente difirieron 6% en diversidad verdadera.
Habiendo ya analizado la diversidad de especies entre zonas, es útil conocer la similitud de éstas en función del número de individuos observados en cada una de ellas. Con base en el coeficiente de Sørensen la Z2 y la Z3 son parecidas en 52% en cuanto al número de individuos, por lo tanto éstas son las comunidades más semejantes de este estudio. Por su parte, Zl y Z2 fueron las menos similares dado que compartieron únicamente el 31% de los individuos que pertenecen a especies idénticas. Finalmente, para el contraste entre Z1 y Z3 encontré una similitud del 48%.
Características de la vegetación que influyen en la ocurrencia de gremios tróficos
La prueba Chi-cuadrado de independencia aplicada para interpretar el significado del Análisis de Correspondencia (CA) mostró una fuerte asociación entre las variables de vegetación y la ocurrencia de gremios tróficos (x2 = 143.052, P < 0.01). El 100% de los datos estuvieron explicados en las dos dimensiones del CA, de las cuales la dimensión 1 explica el 79.5% de la variabilidad, mientras que la dimensión 2 el 20.5% (Figura 4). La Z2 estuvo relacionada principalmente con el estrato arbustivo y con el gremio de los granívoros, mientras que la Z3 mostró una fuerte asociación con el estrato herbáceo y con la ocurrencia de especies de aves nectarívoras. En cuanto a la Z1 el CA la agrupa en estrecha relación con el gremio de los frugívoros y el estrato arbóreo. Los resultados tanto para el gremio de los insectívoros como para los omnívoros no son concluyentes, puesto que en ambas dimensiones sólo se explica el 5.2% y 8.56% de la variabilidad, respectivamente, lo cual indica que la ocurrencia de estas aves está condicionada por otros factores no incluidos en este análisis (Cuadro 1).
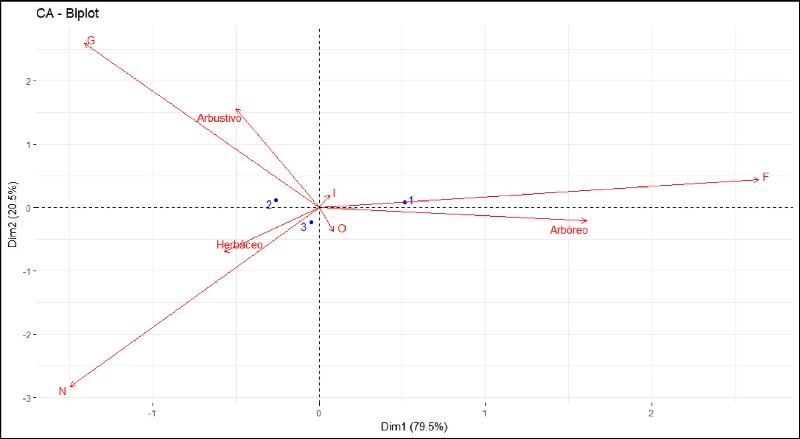
Figura 4 Gráfica bidimensional del Análisis de Correspondencia (CA) para características de vegetación (estratos) por zonas (Z1=1, Z2=2 y Z3=3) y gremios tróficos (F: frugívoros, G: granívoros, I: insectívoros, N: nectarívoros, O: omnívoros). El 79.5% de la variación de los datos esta explicada por la dimensión horizontal, mientras el 20.5% de éstos es explicada por la dimensión vertical.
Discusión
Diferencias en la estructura de la vegetación entre las zonas
Esta investigación evaluó los efectos del fuego tomando en cuenta dos aspectos importantes, relacionados íntimamente con las características de la flora (1) el tiempo desde el fuego y (2) su severidad. Es por ello que la variación en la composición de especies vegetales fue marcada en las tres zonas de estudio. (2) es consistente con lo descrito por Kotliar et al. (2002), quienes indican que a una alta severidad la vegetación de dosel (estrato arbóreo) es severamente afectada, como el caso de Z2 en este estudio, mientras que a una moderada intensidad el fuego perjudica a los estratos bajos, tanto al arbustivo como al herbáceo, lo cual está relacionado con Z3, donde hay una mayor cantidad de árboles comparado con Z2. (1) la Z1 tuvo más de cinco años de no verse afectada por incendios forestales, lo cual explica que más de la mitad de las plantas muestreadas pertenezcan al estrato arbóreo y arbustivo.
El bosque seco está catalogado como un ecosistema dependiente del fuego, puesto que los árboles que lo constituyen están muy bien adaptados a éste (Sodhi et al. 2011). Asimismo, este tipo de ecosistema se caracteriza por presentar una alta frecuencia de incendios de baja a moderada severidad (Kotliar et al. 2002, Sodhi et al. 2011). Witsberger et al. (1982) explican que el bosque seco caducifolio en el parque WTD ha sido paulatinamente invadido por vegetación típica de sabana, esto a raíz de los recurrentes incendios que ocurren en éste. Mismo comportamiento ha sido documentado por Nasi et al. (2002) para los bosques pluviales. En mi estudio ambas zonas recién afectadas por el fuego (Z2 y Z3) presentaron características de este tipo de hábitat.
Mis resultados en cuanto a la dinámica de las herbáceas encajan con lo encontrado por Lawrence (1966) en un estudio conducido en un chaparral de California, al primer año de la quema las plantas herbáceas aumentan en densidad, puesto que éstas son excelentes productoras de semillas, lo cual les permite dispersarse de manera más rápida, sin embargo, para el segundo año comienzan a decaer, mientras que la abundancia de árboles se mantiene constante, este mismo patrón puede observarse con facilidad en la Figura 3 (H), donde este estrato va disminuyendo en función del número de años desde el ultimo incendio. Resultados similares se encontraron en un estudio realizado en un bosque seco de Chile, en donde las zonas alteradas por incendios dominaron principalmente las plantas herbáceas (Perfetti-Bolaño et al. 2013).
La respuesta del estrato arbustivo tiene que ver con los dos componentes mencionados con anterioridad (1 y 2), fuegos de severidad moderada pueden dañar los arbustos de tamaño considerable o hasta eliminarlos por completo (Nasi et al. 2002, Saab y Powell 2005, Kotliar et al. 2007). En Z3 debido a que el incendio fue de este tipo de severidad hubo más árboles que de arbustos, los primeros pese a verse afectados en su base tienen mayores probabilidades de sobrevivir. El estrato arbustivo de esta zona (Z3) estuvo dominado por especies de crecimiento lento como el madrecacao e irayol, por lo que su recuperación puede tomar algunos años. Por su parte, Z2 presentó una alta abundancia de especies arbustivas, lo cual se explica por la frecuencia de incendios de alta severidad ocurridos en este sitio, que generaron una elevada penetración de la luz y marcada disponibilidad de suelo desnudo, lo que ha permitido que especies de crecimiento rápido y especialistas de claros como el laurel y el pie de venado dominen esta zona (Witsberger et al. 1982); estos resultados concuerdan con lo hallado por diversos autores, quienes encuentran una marcada dominancia del estrato arbustivo luego de un incendio (Kinnaird y O’Brien 1998, Smucker et al. 2005, Sosa et al. 2010, Perfetti-Bolaño et al. 2013, Troya 2017). No obstante, a medida que el bosque se va recuperando y en consecuencia la disponibilidad de la luz es menor por el cierre del dosel, los arbustos menguan su crecimiento (Z1), contrario a esto, en un estudio realizado en Monte Central, Argentina, se encontró que con el paso del tiempo (área quemada hace tres años y otra hace ocho años) el número de arbustos aumenta mientras los árboles se mantuvieron constantes (Milesi et al. 2002), cabe recordar que los ecosistemas que han evolucionado para ser beneficiados por el fuego presentaran características propias y respuestas específicas a estos fenómenos que aquellos en que éste no forma parte natural de su desarrollo.
En cuanto a la abundancia del estrato arbóreo en el parque WTD la Z2 es la que menor abundancia de árboles presentó, puesto que, la mayoría han sido arrasados por fuegos de alta severidad, este estrato estuvo dominado principalmente por la especie de crecimiento rápido, laurel, con alturas promedio de 6.80 m, cuando en otro tiempo este sector del parque estuvo representado de manera especial por Cochlospermum vitifolium (tecomasuche) y Bursera simaruba (jiote) con alturas de entre 8.1 y 13.6 m (Ventura 1980). En Z3 hay una mayor presencia de árboles, los cuales de no ocurrir otro incendio podrían recuperarse. Diversos estudios concuerdan que las zonas no perturbadas o con un largo periodo después del fuego (1) son dominadas principalmente por este estrato (A) (Barlow et al. 2002, Sosa et al. 2010, Ponce et al. 2012, Perfetti-Bolaño et al. 2013, Troya 2017), mismos resultados que encontré en Z1.
Respuesta de la avifauna a los incendios forestales
Mis resultados comprenden la primera evaluación del efecto ecológico de los incendios forestales sobre la avifauna en El Salvador. Uno de mis principales hallazgos es que los incendios forestales en el parque WTD han favorecido la diversidad de aves, por lo cual rechazo la hipótesis nula de que ésta fuera igual en todas las zonas. Las zonas quemadas (Z2 y Z3) fueron significativamente más diversas que la zona con un largo periodo después del fuego (Z1) (Cuadro 2). La magnitud de esta diferencia resultó elevada, basado en el número efectivo de especies de cada zona (q = 1). Asimismo, la similitud entre Z1 y ambas zonas perturbadas (Z2 y Z3) fue baja, por su parte ambas zonas perturbadas presentaron una similitud moderada. Esto último es importante si recordamos que entre más disímil es una comunidad de otra, la biodiversidad total del ecosistema es mayor, puesto que la composición de especies entre un sitio y otro es diferente, por lo tanto, la cantidad total de especies es mayor.
El fuego tiene un efecto reconstructor en aquellos ecosistemas dependientes de éste, por tanto, estos resultados pueden analizarse desde la idea de que los incendios aumentan la heterogeneidad del hábitat, lo que resulta benéfico para la avifauna (Gricera y Pavic 2007, Sosa 2008, Pineda-Diez et al. 2012, Ponce et al. 2012, White et al. 2015, Latif et al. 2016, Tingley et al. 2016, Troya 2017). Connell (1978) propuso la hipótesis del desequilibrio o de perturbación intermedia, la cual sostiene que la diversidad de un ecosistema es mayor cuando en éste ocurren perturbaciones en intensidad y tamaño intermedio; si bien esta hipótesis fue concebida en principio para organismos sésiles, un reciente hallazgo relacionado con la avifauna indica que, en efecto, la biodiversidad de una localidad es beneficiada siempre y cuando los incendios que ocurran en ésta sean de severidad mixta (Tingley et al. 2016). Esta premisa es reforzada por los resultados de Durães et al. (2013), quienes sostienen que la diversidad de aves aumenta con la perturbación (cuando ésta es leve o moderada), y a su vez, aquellos parches en regeneración rodeados por bosque continuo mantienen altos niveles de diversidad, incluso comparables con bosques antiguos; sin embargo, aseguran que la pérdida de hábitat resulta perjudicial para las especies, principalmente para aquéllas con algún grado de amenaza, y este daño es mayor cuando un disturbio y la pérdida de hábitat actúan de manera sinérgica.
Las especies de aves responden a los incendios forestales de maneras diversas dependiendo de distintos factores de su ecología -dieta, territorialidad y requisitos de refugio- (Kinnaird y O’Brien 1998), además, los efectos del fuego pueden ser catalogados como adversos, neutrales, benéficos o mixtos -respuestas tanto negativas como positivas-, dependiendo de la especie y el tiempo desde el fuego (Saab y Powell 2005). Así, los efectos del fuego sobre la diversidad en la comunidad avifaunística del bosque seco del parque WTD fueron favorables, lo que concuerda con lo encontrado en diversos estudios, los cuales analizan esta problemática en distintos ecosistemas, en general la diversidad de aves fue significativamente mayor (prueba t modificada por Hutcheson) en el área quemada comparada con la no afectada o con un largo tiempo desde el fuego (Gricera y Pavic 2007, PerfettiBolaño et al. 2013, Troya 2017), estos autores atribuyen esta respuesta positiva de la avifauna al aumento de la heterogeneidad del hábitat, una mayor disponibilidad de recursos alimenticios post-incendio, entre otros factores. Por su parte Lawrence (1966) encuentra que luego de un incendio en un chaparral estadunidense las poblaciones de aves aumentan en comparación con el control (sitio no quemado), y lo atribuyen a una mayor disponibilidad de alimento -semillas e insectos-, los cuales ocurrieron en mayor cantidad luego de la quema, además la poca vegetación del lugar los vuelve presa fácil para las aves. Newman et al. (2018) en un experimento conducido en un chaparral de California en el que se evaluó los efectos de un fuego prescrito, encontraron que la diversidad de aves fue mayor o muy parecida a la del control dependiendo de la estación meteorológica, no obstante, asegura que la evidencia indica que el fuego prescrito no debe ser tomado como incendio forestal originado de manera natural o accidental, pues sus efectos no siempre son similares al del experimento manipulativo. Muchas especies toleran o se comportan de manera resiliente ante la perturbación por incendios, mientras otras -que son parte de la misma comunidad- responden negativamente, a este efecto se le conoce como respuesta mixta (Saab y Powell 2005), y diversas investigaciones lo han documentado (Smucker et al. 2005, Kotliar et al. 2007, Robinson et al. 2014, White et al. 2015, Latif et al. 2016).
Mis resultados contrastan con lo encontrado en un estudio efectuado en un bosque templado-frío de México central, en el que evalúan un gradiente de tiempo desde el fuego y severidad, con un sitio quemado hace más de cinco años (C1), otros quemados hace un año a baja (C2) y alta (C3) severidad, en este caso la diversidad de especies fue mayor en el sitio con el más largo tiempo desde el fuego (C1 análogo a mi Z1); sin embargo, los autores reconocen el papel del fuego en el mantenimiento de la biodiversidad, al asegurar que la suma de todas las diversidades fue mayor que la de C1 como tal (Ponce et al. 2012). Por su parte, Barlow et al. (2002) en un bosque primario tropical, Venegas et al. (2009) en un bosque subantártico sudamericano y Sosa et al. (2010) en un bosque de caldén encontraron efectos negativos sobre la avifauna luego de los incendios forestales.
En cuanto a la similitud, mis resultados mostraron que fue de baja a moderada, misma tendencia que encuentran en los estudios que incluyeron este análisis (Barlow et al. 2002, Gricera y Pavic 2007, Ponce et al. 2012, Troya 2017), esto es importante ya que, a mayor disimilitud entre los puntos, sitios o zonas, mayor es la diversidad total del sistema.
Respuesta de los gremios tróficos de aves a los incendios forestales
Dividir a las especies de aves en gremios tróficos permite obtener un panorama general de la diversidad, abundancia y biomasa de las especies de aves que explotan un mismo recurso, igualmente, éste permite caracterizar un hábitat en función de los gremios que lo compongan (Greenberg 2016). Además, el empleo de los gremios es útil en los estudios comparativos de comunidades (Root 1967), dado que éste puede servir para predecir la respuesta de las especies a la perturbación (Greenberg 2016), como es el caso de este trabajo.
Mis resultados muestran asociación significativa entre los gremios tróficos de aves y el estrato dominante de vegetación presente en las distintas zonas estudiadas. Si bien no puedo aceptar en su totalidad la hipótesis de que la composición de la comunidad vegetal determina la presencia de ciertos gremios tróficos más que de otros en el parque WTD, encontré suficiente evidencia para algunos de ellos.
El gremio de los granívoros estuvo relacionado principalmente con el tipo de vegetación arbustiva-herbácea característico de la Z2, donde la abundancia de poaceae y cyperaceae, así como una gran abundancia de la fabaceae arbustiva pie de venado, provee de los recursos alimenticios necesarios para sostener una elevada abundancia de aves de este gremio, puesto que las especies con mayor abundancia fueron dos palomas comunes, la paloma ala blanca y la tórtola cola larga; esta observación es apoyada con lo establecido por Perfetti-Bolaño et al. (2013), quienes encuentran una mayor cantidad de aves granívoras en el sitio quemado de un bosque templado-cálido de Chile, debido a la abundancia del estrato graminoso-herbáceo. Igualmente, mis resultados concuerdan con diversas investigaciones, las cuales hallan que en las zonas quemadas este gremio es el más abundante (Milesi et al. 2002, Gray et al. 2007, Gricera y Pavic 2007, Sosa et al. 2010, Troya 2017, Newman et al. 2018).
El gremio de los nectarívoros mostró una fuerte asociación con el estrato herbáceo, por lo tanto, estuvo relacionado con Z3, zona que resultó con una marcada dominancia de este estrato, tal como sucede con los granívoros, lo cual se explica por la mayor abundancia de recursos alimenticios disponibles en las dos zonas quemadas, pues estas aves se alimentan principalmente en los estratos inferiores y medios (Pearman 2002), y quizá explique por qué no encontré ninguna especie de este gremio en la Z1; esto último concuerda con lo descrito por Ponce et al. (2012) quienes sólo encuentran representantes de este gremio en el sitio quemado a alta severidad, en un bosque templado-frío de México central. Por otro lado, contrasta con otras investigaciones que sostienen que la abundancia de especies de este gremio no se ve afectada por el fuego, y resulta ser la misma en los sitios perturbados como en los sitios no perturbados (Barlow et al. 2002, Gray et al. 2007). Por su parte, Venegas et al. (2009) encuentran que la abundancia de este gremio se vio reducida luego del incendio. El comportamiento que observé en la distribución de los nectarívoros concuerda con lo encontrado en un bosque caducifolio de Chile (PerfettiBolaño et al. 2013) y un bosque secundario perennifolio en Ecuador (Troya 2017), donde se evidencia que éstos aumentan en las zonas quemadas.
Los frugívoros del parque WTD decrecieron en función de la disminución del estrato arbóreo, por ello el CA lo relaciona con la Z1, donde la cobertura arbórea fue mayor, éste fue uno de los grupos más sensibles a la pérdida de la cobertura arbórea en el parque Deininger. En Z1 éstos pueden estar aprovechando los recursos aportados por varias plantas, entre éstas, Guazuma ulmifolia (tapaculo), jiote, Spondias mombin (jocote jobo) y jocote pitarrio, las cuales son productoras de frutos comestibles (Witsberger et al. 1982). Robinson et al. (2014) sugieren que los parches no quemados o de largo tiempo desde el fuego, mantienen grandes cantidades de frugívoros, lo cual concuerda con lo que encontré en mi trabajo, y a su vez, con otras investigaciones, que determinan que los frugívoros disminuyen luego de la perturbación, comparados con la zona no afectada (Kinnaird y O’Brien 1998, Nasi et al. 2002, Gray et al. 2007, Sosa et al. 2010). Por su parte Barlow et al. (2002) encontraron la misma abundancia de este gremio en las zonas quemada y no quemada, en un bosque primario tropical.
En cuanto al gremio de los insectívoros mis resultados no fueron concluyentes, es por ello que el CA no fue capaz de relacionar este gremio con ninguna zona ni estrato en particular. Asimismo, en el Cuadro 1 se observa que la abundancia de individuos de este gremio fue relativamente similar en todas las zonas. Voy a analizar este resultado considerando dos aspectos, el tipo de vegetación (1) y la clasificación de gremio que utilicé (2). (1) Pineda-Diez et al. (2012) sostienen que la composición mixta de la vegetación beneficia la diversidad de aves insectívoras, ya que algunas de ellas se favorecen del bosque primario y otras del bosque secundario, lo cual concuerda con lo que explica Pearman (2002), éste indica que dicho gremio responde de maneras diferentes a la heterogeneidad del hábitat. Estos factores pudieron tener efecto en la dispersión de este grupo de organismos a lo largo de todo el parque WTD, ya que se han visto favorecidos por la heterogeneidad de la estructura vegetal originada por los recurrentes incendios de severidad mixta ocurridos en éste. (2) La clasificación de gremio debió ejercer cierta influencia en la distribución del gremio de los insectívoros en el parque WTD; Pearman (2002) establece que las características principales para agrupar a las especies en los distintos gremios son el estrato de vegetación principal donde se alimenta, el tipo de alimento, la técnica principal de forrajeo y el sustrato de forrajeo. Algunas investigaciones en las que emplean el sistema propuesto anteriormente, encuentran respuestas variadas en este gremio (Barlow et al. 2002, Kotliar et al. 2007). No obstante, diversos autores emplean una variación del sistema propuesto por Pearman (2002), así, el gremio resulta de la combinación de algunas de las características antes mencionadas; Milesi et al. (2002) encuentran que los insectívoros de follaje disminuyen en la zona quemada mientras que insectívoros de vuelo largo fueron significativamente más abundantes en esta misma zona. Otra investigación halla que los insectívoros del follaje disminuyeron en el sitio quemado, mientras que los insectívoros de superficie y de vuelo largo no mostraron diferencia significativa entre los sitios estudiados (Sosa et al. 2010). En su estudio Saab y Powell (2005) determinaron que los insectívoros aéreos, terrestres y de corteza son más abundantes en hábitats quemados, mientras que los forrajeros de follaje prefirieron los hábitats no quemados, luego de haber analizado estos gremios en distintos ecosistemas de Norteamérica.
Por otra parte, mi resultado para Z2 y Z3, donde la suma de las abundancias de especies insectívoras es considerablemente más grande (109 individuos) que la Z1 (38 individuos), concuerda con aquellos estudios en los que se utiliza únicamente el “tipo de alimento” -gremio trófico como tal- para agrupar a las especies dentro de este gremio, en éstos encuentran una mayor abundancia de insectívoros en las zonas quemadas, lo cual es atribuido principalmente al aumento de insectos perforadores de madera (Kinnaird y O’Brien 1998) y xilófagos (Nasi et al. 2002), además, a que las aves se favorecen de los espacios abiertos, dado que hay una mayor visualización de las presas (Perfetti-Bolaño et al. 2013). Sin embargo, recomiendo en futuras investigaciones emplear el sistema de agremiación de Pearman (2002), dado que con éste tendrán mayores probabilidades de detectar diferencias significativas entre zonas, así como observar asociaciones con el tipo de vegetación (estrato, cobertura) y el gremio de los insectívoros.
Con respecto al gremio de los omnívoros -al igual que con los insectívoros- los datos no fueron concluyentes, puesto que las especies de omnívoros del parque WTD fueron igual de abundantes en las tres zonas de estudio, es por ello que, la variabilidad de este gremio no pudo ser explicada por el Incendios y avifauna en un bosque salvadoreño CA. Esto probablemente se deba a que los omnívoros poseen amplias estrategias de alimentación, las cuales se extienden por una gran área, aunado a que, las especies de este gremio son insensibles a la heterogeneidad del hábitat (Pineda-Diez et al. 2012). Mi hallazgo concuerda con Troya (2017), quien encuentra que la abundancia de este gremio es similar en la zona quemada y no quemada de un bosque secundario perennifolio. Por su parte Perfetti-Bolaño et al. (2013) observan una mayor abundancia de omnívoros luego del incendio, pues se ven favorecidos por el aumento en la disponibilidad de alimento en este sitio. Por otro lado, diversas investigaciones coinciden en que después del fuego este grupo de organismos se ve perjudicado (Kinnaird y O’Brien 1998, Barlow et al. 2002, Gray et al. 2007).
Este estudio aporta evidencia de que los incendios forestales en el parque WTD han favorecido a las comunidades de aves, lo que puede deberse a que el bosque seco es un ecosistema que de manera natural depende del fuego, por lo tanto, fuegos de magnitud e intensidad moderada propician la heterogeneidad del paisaje con lo cual la avifauna se ve beneficiada. Sin embargo, cuando este tipo de fenómenos es provocado con la intención de expandir la frontera agrícola, para el desarrollo de proyectos urbanísticos o algún otro tipo de cambio en el uso de suelo que conlleve a la pérdida definitiva del hábitat serán perjudiciales para la avifauna y para la biodiversidad en general. Además, cabe recalcar que este patrón no debería ser extrapolado para otros tipos de ecosistemas, más aún si éstos no poseen vegetación adaptada a los incendios forestales -como el bosque nebuloso o el bosque perennifolio- en este caso es necesario estudiar la respuesta de la avifauna en relación con el tipo de hábitat específico.











 text new page (beta)
text new page (beta)



