Introducción
Los humedales son importantes para las aves y contribuyen en la diversidad regional (Naiman et al. 1993, Pereira et al. 2014). La vegetación natural de los humedales presentes a lo largo de la vertiente del río Grijalva ha sido fuertemente transformada por actividades humanas, principalmente por la industria hidroeléctrica (Rodiles-Hernández et al. 2013). Además de la fragmentación por la agricultura y la ganadería extensiva (Rocha-Loredo et al. 2010). Estas acti vidades reducen la diversidad y distribución de la comunidad de aves nativas (Pineda-Diez de Bonilla et al. 2012, Ramírez-Albores et al. 2014). La construcción de la presa hidroeléctrica Belisario Domínguez La Angostura (Semarnat 2010a) ha transformado una superficie aproximada de 250 km a lo largo del cauce principal del río Grijalva (Gómez-González et al. 2015, Laino-Guanes et al. 2016) con lo que se amplió considerablemente la superficie cubierta por agua y creó un humedal artificial de tipo léntico, debido a la retención de agua de las presas (Rodiles-Hernández et al. 2013). Todas estas modificaciones han generado un paisaje fragmentado (Rocha-Loredo et al. 2010), lo que ha derivado en una considerable pérdida y modificación de hábitat para las especies residentes (Gómez-González et al. 2015), sobre todo endémicas (Ceballos y García 1995, Ceballos et al. 2010). Esto último cobra importancia para la conservación, ya que la región es considerada de gran importancia por su alto endemismo (38%) y recambio de especies (Ceballos y García 1995, Gillespie y Walter 2001). Se estima que en la Depresión Central de Chiapas (DCCH), por donde atraviesa el río Grijalva, habitan entre 298 y 305 especies de aves (Rangel-Salazar et al. 2005), pero esta zona ha sido poco estudiada (Altamirano et al. 2007, Ramírez-Albores et al. 2014) y es donde se concentra la menor diversidad de aves del estado, debido a las variaciones topográficas, ambientales y la historia biogeográfica de la avifauna (Rangel-Salazar et al. 2005, 2013).
A lo largo del cauce del río Grijalva se encuentran humedales naturales con bosques de galería (Pérez-Farrera y Espinoza 2010), que incrementan la diversidad de especies, ya que es una zona de transición con vegetación ribereña entre hábitats acuáticos y terrestres (Larsen et al. 2010, Domínguez-López y Ortega-Álvarez 2014). Actualmente los fragmentos de bosque tropical caducifolio (BTC) y humedales fungen como refugios para especies de vertebrados acuáticos y terrestres de ambientes vecinos más húmedos (López-Vila et al. 2009, Monterrosa-Pérez et al. 2011, Percino-Daniel et al. 2013), tal es el caso del Parque Nacional Cañón del Sumidero (Altamirano et al. 2007). El humedal inducido por el embalse de la presa La Angostura depende estrechamente del cambio en las condiciones relacionadas con el manejo del volumen de agua de la presa (Laino-Guanes et al. 2016), con lo que se afecta la cantidad y calidad del humedal (Naiman et al. 1993, Wang et al. 2013). Principalmente afecta en los remanentes de vegetación de bosque, pues éstos se convierten en los únicos hábitats disponibles para diversas poblaciones de aves (Pereira et al. 2014).
Se ha demostrado que los humedales artificiales de las presas hidroeléctricas de gran tamaño contienen una menor riqueza de especies de aves (Kingsford y Thomas 2004). Asimismo, cambian la composición de especies (Ma et al. 2004), respecto a humedales naturales, sobre todo para aquellas especies que utilizan los hábitats de las orillas de estos ambientes (Dimalexis y Pyrovetsi 1997). Pocos esfuerzos se han hecho en México para determinar el efecto de las presas hidroeléctricas sobre las comunidades de aves. Por todo lo anterior, la cuenca del Grijalva ofrece un escenario ideal para evaluar el efecto de una de las presas más grandes de México (La Angostura) sobre la diversidad de las comunidades de aves. En el presente estudio comparamos la riqueza y composición de especies de las comunidades de aves acuáticas y terrestres de tres tipos de humedales que han sido modificados por las actividades humanas. Con ello, se espera determinar si el humedal artificial de la presa tiene menor riqueza y diferente composición de especies de aves respecto a los humedales naturales del río y arroyo de la cuenca del Grijalva.
Métodos
Área de estudio
Los humedales estudiados se ubican en la región hidrográfica Grijalva-La Concordia (Semarnat 2010a), dentro de la Depresión Central de Chiapas (DCCH). En esta región se encuentra el embalse de la presa La Angostura, la cual se delimita del cauce natural del río Grijalva por la cortina de la presa (Figura 1). El clima es semicálido subhúmedo (“Aw2(w)igw”, García 1988). La vegetación natural original fue el BTC (Rzedowski 2006), que se ha reducido a menos del 2% de su superficie original en el país (Ceballos et al. 2010). Esta pérdida de bosque es debido al creciente desarrollo de áreas urbanas, agrícolas y pastizales inducidos (Rocha-Loredo et al. 2010, Pineda-Diez de Bonilla et al. 2012). La extensión aproximada de la cobertura actual del cuerpo de agua de la presa es de 380 km2, la cual está rodeada por fragmentos de vegetación original en diferentes estados sucesionales, los cuales están distribuidos a lo largo del cauce del Grijalva (Rocha-Loredo et al. 2010, Silva et al. 2015). En el área de estudio se encuentran tres tipos de humedales: presa, río y arroyo (Figura 1), que son zonas de cubiertas o saturadas de agua de manera permanente o estacional (Cowardin et al. 1979). Estas áreas están definidas por el tipo y profundidad del cuerpo de agua presente (Ramsar 2006). El humedal de la presa en el embalse es de tipo lótico, artificial (Berlanga-Robles et al. 2008). Este embalse tiene asociado a los márgenes del cuerpo de agua fragmentos de BTC separados por un margen de suelo desnudo, el cual es producto del recambio periódico en el nivel del agua por el manejo de la presa (Reitan y Thingstad 1999). El río es un humedal de tipo fluvial permanente, con profundidad mayor a 6 m, que corresponde al cauce natural del Grijalva. El río se ubica entre los embalses de las presas La Angostura y Malpaso (Rodiles-Hernández et al. 2013). Además, el río tiene un ancho aproximado de 100 m, con vegetación de galería asociada a sus márgenes (Pérez-Farrera y Espinoza 2010). En el arroyo, el humedal es de tipo fluvial estacional (Berlanga-Robles et al. 2008), con profundidad menor a 6 m (Velázquez-Velázquez et al. 2010). Este humedal corresponde a las orillas de los afluentes del río Grijalva, los cuales tiene un ancho máximo de 30 m y con vegetación de galería arbórea y arbustiva. En estos dos tipos de humedal se presenta la vegetación ribereña en la que predomina el junco (Typha dominguensis) y árboles de los géneros Ficus, Salix y Taxodium, así como palmas y árboles frutales (López-Vila et al. 2009, Gómez-González et al. 2015).
Colecta de datos
Para describir la riqueza y composición de aves de los tres tipos de humedal, realizamos conteos en 16 sitios ubicados a lo largo del área de estudio (Figura 1). Establecimos cinco sitios para el humedal tipo presa (p) ubicados a las orillas del embalse de la presa, los cuales tiene como vegetación asociada fragmentos de BTC. Seis sitios de humedal tipo río (r) y cinco sitios junto a los arroyos (a). En cada sitio realizamos de 2 a 6 recorridos en un horario de 06:00 a 12:00 pm y posteriormente de 17:00 a 19:00 h, durante el periodo reproductivo: abril-agosto y en invierno: noviembre-marzo de 2013 a 2015. Los recorridos, de alrededor de 500 m, los realizamos con trayectos libres y un tiempo fijo de una hora sobre la orilla del cuerpo de agua y los fragmentos de vegetación. La distancia entre los sitios más próximos fue de 1.9 km y entre los sitios más distantes de 136 km (Figura 1), lo que aumenta la independencia de los registros entre los sitios (Ralph et al. 1996). En los recorridos registramos todos los individuos vistos y escuchados en cada sitio y posteriormente para cada especie determinamos su hábitat (acuático o terrestre), su estatus migratorio (Howell y Webb 1995, National Geographic Society 2006, Van Perlo 2006, Peterson y Chalif 2008, Sibley 2011) y su estatus de conservación para México con base en la NOM-059-SEMARNAT-2010 (Semarnat 2010b). Además, indicamos los nuevos registros de especies para la región DCCH de acuerdo con Rangel-Salazar et al. (2005).
Análisis de datos
Estimamos la asíntota de especies esperadas de la comunidad de aves para cada humedal. Para ello, consideramos el número efectivo de especies y sus intervalos de confianza al 95%, con el método de análisis de la rarefacción por cober tura de la muestra y utilizando el procedimiento de Chao y Jost (2012) con el programa inext (Hsieh et al. 2016). Los análisis realizamos con 100 aleatorizaciones y extrapolando al número de individuos de la comunidad con la mayor abundancia. Utilizamos el estimador de orden cero (q0) de los números de Hill, el cual no toma en cuenta el efecto de la abundancia de las especies (Hsieh et al. 2016). Comparamos los valores de la mediana de riqueza de especies entre los tres tipos de humedal con la prueba de rangos de Kruskal-Wallis.
Para determinar las diferencias en la composición de especies entre los humedales hicimos un análisis de permanova y un análisis de ordenamiento nmds (Clarke et al. 2006), para la comunidad total. Para estos análisis utilizamos las matrices de distancias de similitud de especies entre sitios con el índice de Morisita; el cual considera el desbalance de muestreo debido a las diferencias en las abundancias entre sitios (Moreno 2001), los análisis los realizamos con el paquete BiodiversityR (Kindt y Coe 2005) y la función metanmds y ordiellipse de Vegan 2.5-5 (Oksanen et al. 2019).
Resultados
Identificamos un total de 170 especies de aves con 5,110 registros. Las especies que registramos pertenecen a 46 familias y 18 órdenes (Anexo 1). La composición de especies en la comunidad del área de estudio la distribuimos de la siguiente manera: 36 fueron especies acuáticas (21%) y 134 especies terrestres (79%); 128 residentes (75%) y 42 migratorias (25%). Registramos 10 especies en la categoría de sujeta a protección especial (PE) y seis especies en la categoría de amenazada (a) de acuerdo con la NOM-059-SEMARNAT-210. Las siguientes especies fueron las más abundantes en el área de estudio, pues estuvieron presentes en los tres humedales: el cormorán Neotropical (Phalacrocorax brasilianus) con 558 individuos, el garrapatero pijuy (Crotofaga sulcirrostris) con 403 individuos, el zanate mayor (Quiscalus mexicanus) con 379 individuos y el mirlo pardo (Turdus grayi) con 230 individuos. Por otra parte, registramos 39 especies que no habían sido reportadas anteriormente para la región de la DCCH (Anexo 1).
El humedal de la presa fue el que tuvo la menor riqueza total con 53 especies, seguida del arroyo con 104 especies y el río con 135 especies (Figura 2). La riqueza de especies entre sitios fue diferente significativamente entre los tres tipos de humedal para la mediana de las especies totales (K2 = 11.28, P = 0.003), para las aves terrestres (K2 =11.68, P = 0.0029), para las aves acuáticas (K2 = 7.9, P = 0.019), para las aves residentes (K2 = 10.8, P = 0.004) y para las aves migratorias (K2 = 11.9, P = 0.004).
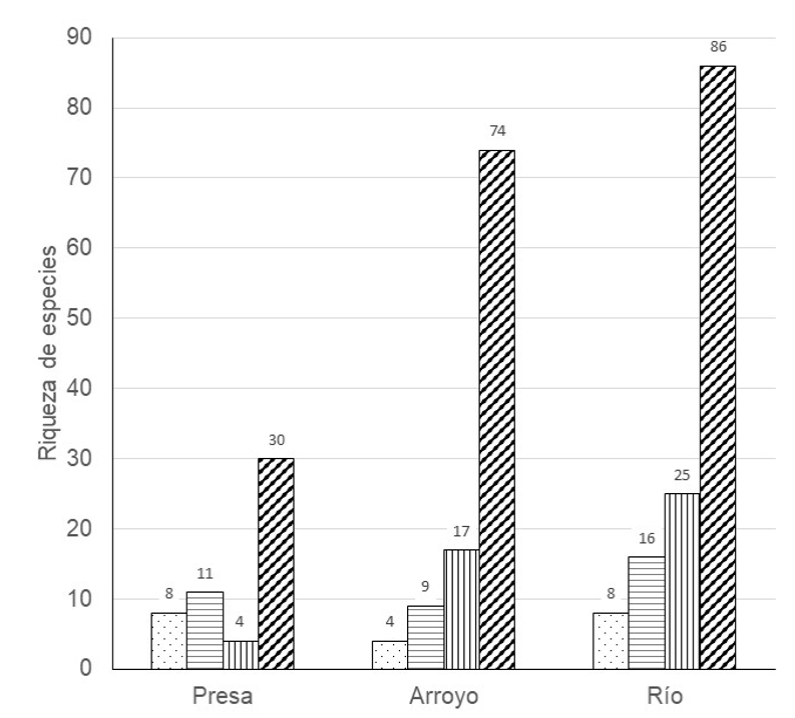
Figura 2 Riqueza de especies de aves migratorias acuáticas (puntos), residentes acuáticas (horizontal), migratorias terrestres (vertical) y residentes terrestres (diagonal) en los tres tipos de humedal de la cuenca alta del río Grijalva, Chiapas.
La riqueza estimada acumulada de especies de aves fue estadísticamente menor para el humedal de la presa, con 83 especies esperadas, dado que los intervalos de confianza de este humedal no se traslapan con los de los otros humedales. Sin embargo, entre el arroyo con 134 especies esperadas y el río con 135 especies esperadas no hay diferencias entre la riqueza debido al traslape de sus intervalos de confianza (Figura 3).
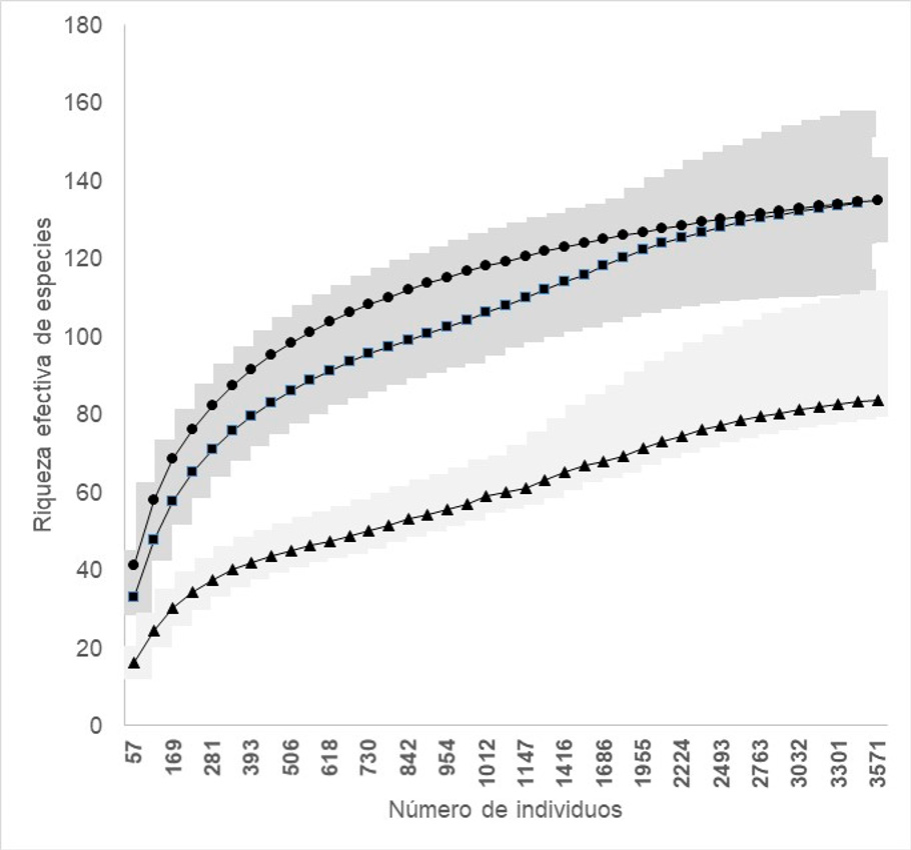
Figura 3 Curva acumulada de la riqueza efectiva de especies de aves (q0), en los humedales de la presa (triángulos), el arroyo (cuadros) y el río (círculos) de la cuenca alta del río Grijalva, tomando como referencia el número máximo de individuos registrados para el río, las áreas grises corresponden a los intervalos de confianza al 95%.
Encontramos que la menor similitud de especies fue entre los humedales de la presa y del arroyo (0.18), respecto a los valores de la similitud entre río y arroyo (0.59) y entre la presa y el río (0.63). Dentro de las diferencias significativas en la composición de especies entre los tres tipos de humedal (permanova pseudo-F2,13 = 3.93, P = 0.001), el humedal de la presa fue el que difirió más en la similitud de especies respecto al arroyo y el río, mientras que estos últimos tuvieron una mayor similitud, lo que puede notarse en la gráfica del análisis NMDS (Figura 4).

Figura 4 Ordenamiento de los humedales de: la presa (p), el arroyo (a) y el río (r), por el método de nmds con base en la similitud de especies de aves de los 21 sitios de muestreo, las elipses indican la desviación estándar del centroide de agrupamiento de los sitios de cada tipo de humedal, el valor de estrés del agrupamiento es de 0.08.
Discusión
Con este estudio se ha evidenciado que los embalses de las presas hidroeléctricas tienen un efecto negativo sobre la riqueza de especies de aves (Reitan y Thingstad 1999, Ma et al. 2004), principalmente en la pérdida de hábitat para aves acuáticas (Kingsford y Thomas 2004). Un ejemplo son las especies que usan la vegetación ribereña de las orillas de estos cuerpos de agua (Ma et al. 2009), ya que las fluctuaciones en el nivel del agua, resultado de manejo de la presa, eliminan la vegetación de galería, hábitat que utilizan estas especies de aves (Reitan y Thingstad 1999, Nilsson y Berggren 2000). De acuerdo con nuestros resultados, la diferencia en la riqueza total de aves en el humedal de la presa es hasta 2.5 veces menor respecto a la del arroyo o la del río. Esta diferencia en el número de especies entre los tipos de humedal también se mantuvo al comparar la riqueza de especies de las aves terrestres, las migratorias y las residentes. Los humedales naturales contribuyeron con una mayor riqueza de aves, el río 79% y el arroyo 61%, de la riqueza total de aves registradas para el área de estudio. Sin embargo, la riqueza en el humedal de la presa sólo contribuye con el 31% de las especies. La diferencia en la riqueza total de especies entre los humedales posiblemente se debe a la vegetación de galería presente en el río y en el arroyo, la cual está compuesta por vegetación adaptada a suelos inundables como juncos, carrizos y árboles como Salix sp. (Larsen et al. 2010, Pérez-Farrera y Espinoza 2010). La ausencia de esta vegetación en el humedal de la presa se debe a que los fragmentos de vegetación aledaña están separados por una franja de suelo desnudo. Esta franja no permite que se establezca la vegetación ribereña presente en los humedales naturales a consecuencia de la inundación temporal por el manejo del nivel del agua de la presa a lo largo del año (Nilsson y Berggren 2000); esto limita la presencia de aves, como las garzas, que forrajean o anidan en las orillas, por lo tanto, queda como único hábitat disponible el cuerpo de agua. Este tipo de hábitat sólo puede ser utilizado por las aves que se alimentan en aguas profundas como el cormorán Neotropical (Phalalcrocorax brasilianum) o el pelícano blanco americano (Pelecanus erythrorhynchos).
La composición de aves en el humedal de la presa difiere respecto a la del arroyo y la del río, mientras que la composición entre estas últimas es muy similar. Sin embargo, en el humedal de la presa se registraron 10 especies que no se comparten con los otros dos humedales, sobre todo especies acuáticas. Esto incrementa la diversidad beta de los humedales e incluso la diversidad gamma de la región. Los resultados concuerdan parcialmente con la evidencia de que los humedales artificiales pueden fungir temporalmente como hábitats adecuados para algunas especies de aves (Wang et al. 2013). Por ejemplo, para especies de aves migratorias que usan estos humedales como sitios de paso, o cuando se ha reducido la superficie de los humedales naturales aledaños (Ma et al. 2004). En este estudio encontramos que el humedal de la presa La Angostura favorece la presencia de especies de aves acuáticas buceadoras que usan los cuerpos de agua profundos, propias de las presas grandes (Kingsford y Thomas 2004). Por lo tanto, nuestros resultados podrían ser opuestos a la hipótesis de que los embalses grandes tienen efectos negativos sobre la composición de especies (Dimalexis y Pyrovetsi 1997). El agrupamiento de los 16 sitios de muestreo en los tres tipos de humedales indica que la variación de la riqueza y composición de los humedales podrían ser importantes para complementar la diversidad regional (Rangel-Salazar et al. 2005, Ceballos et al. 2010).
Los humedales estudiados en el mosaico de hábitats disponibles para las aves sobre las márgenes del río Grijalva y la presa contribuyen de manera importante a la diversidad de la región de la DCCH. De las 170 especies registradas, 39 no habían sido reportadas con anterioridad. Nuestros nuevos registros corresponden a 28 especies de aves terrestres que originalmente están presentes en ambientes tropicales húmedos. La presencia de estas especies en el área de estudio puede obedecer a la ampliación inducida de su distribución hacia estos humedales, como el caso de loro nuca amarilla (Amazona auropalliata) y del perico frente naranja (Eupsittula canicularis). Estas especies se distribuyen en la vertiente del Pacífico de Chiapas y fueron registradas tanto en el río como en el arroyo.
Seis especies de aves acuáticas migratorias estuvieron presentes exclusivamente en el humedal de la presa, que corresponde al 16% del total de especies acuáticas registradas (36 especies). Esto significa que el humedal de la presa representa un hábitat adicional para las aves que hacen un uso temporal de los humedales como sitios de parada y reabastecimiento (Ma et al. 2004). La presencia de estas especies en la DCCH puede deberse a una respuesta similar a la de especies especialistas del BTC que sugieren Gordon y Ornelas (2000); donde algunas utilizan un gradiente de hábitat como extensión temporal a su hábitat original en respuesta a la fragmentación (Pineda-Diez de Bonilla et al. 2012, Ramírez-Albores et al. 2014). Así también el aislamiento de los ambientes más húmedos de las regiones vecinas (Altamirano et al. 2007) han ampliado la distribución de estas especies dentro de la DCCH. Aprovechando la presencia del ecotono entre los humedales y los fragmentos de bosque tropical asociados al borde del río Grijalva.
A pesar de que los humedales artificiales como el que se encuentra en la presa albergan una baja riqueza de aves localmente y a escala regional pueden aportar más especies. Sin embargo, es necesario realizar más estudios para obtener un listado más completo de la avifauna y determinar la persistencia y distribución temporal y espacial de las aves de este ambiente. Esto ayudará a valorar su importancia para la diversidad local.
Se recomienda que para conservar la diversidad de aves de la cuenca del Grijalva se conserven los tres tipos de humedales y se mantengan los fragmentos de vegetación natural asociados a estos humedales. Estas acciones pueden maximizar la presencia de especies acuáticas, terrestres migratorias y endémicas del BTC. También es necesario realizar estudios ornitológicos a largo plazo con el fin de valorar la importancia del embalse de la presa La Angostura para la conservación del hábitat para aves migratorias y acuáticas.











 nueva página del texto (beta)
nueva página del texto (beta)




