Introducción
Con el incremento de la urbanización a nivel global y la consecuente pérdida de hábitats naturales, las ciudades son consideradas en la actualidad sistemas alternativos para el mantenimiento de determinadas comunidades bióticas (Fontana et al. 2011, Magle et al. 2012, Lepczyk et al. 2017). La urbanización genera cambios en el paisaje, por lo que las especies que habitan en las ciudades varían de acuerdo al grado de sensibilidad frente a estas modificaciones (Clergeau et al. 1998). La urbanización no siempre tiene un efecto negativo sobre las especies, algunas prosperan en ambientes urbanos, mientras que otras disminuyen sus tamaños poblacionales o desaparecen ante cualquier alteración (Crooks et al. 2004, Chace y Walsh 2006, McKinney 2006, Kark et al. 2007, Bocz et al. 2017). De esta manera, las especies han sido agrupadas en tres categorías en función del uso de los recursos ante la influencia humana: 1) especies “urban exploiters” que utilizan los recursos disponibles en exceso y dependen de ellos, y logran mayores valores de abundancia en áreas urbanizadas; 2) especies “urban adapters” que explotan facultativamente los recursos adicionales disponibles en este entorno y muestran valores de abundancia intermedios; y 3) especies “urban avoiders” que son sensibles a los cambios antropogénicos en el paisaje y sus valores de abundancia máximos se localizan en áreas naturales (Beissinger y Osborne 1982, Blair 1996, Fischer et al. 2015, Leveau y Zuria 2017).
Las aves que anidan en cavidades, tanto primarias como secundarias, pueden estar particularmente limitadas en el entorno citadino debido a la reducción en la abundancia de sitios para la cría y la competencia por las cavidades con especies no nativas (Forero et al. 1996, Banda y Blanco 2009, Remacha y Delgado 2009). Sin embargo, la actividad humana puede proporcionar directa e indirectamente este recurso, especialmente a aquellas que dependen de cavidades secundarias para nidificar (por ejemplo: cajas nido, oquedades propias de la arquitectura, grietas en objetos, otros), compensando parcialmente los efectos negativos de la urbanización (Etxezarreta y Arizaga 2014).
El Convento San Francisco de Asís (CSFA), ubicado en el centro histórico de La Habana, presenta en sus paredes externas una serie de cavidades que son usadas por diferentes especies de aves. Las cavidades constituyen huellas del sistema de andamiaje utilizado durante la construcción de la edificación. Ellas albergan anualmente la mayor colonia reproductiva conocida de Progne cryptoleuca (golondrina azul cubana) en la capital del país. García-Lau y Vives (2016), caracterizaron las cavidades disponibles en el CSFA como potenciales sitios de nidificación para aves que usan cavidades secundarias, y examinaron su uso por P. cryptoleuca como primera aproximación al estudio del hábitat de cría. Esta especie migratoria neotropical sólo cría en el archipiélago cubano, donde presenta una amplia distribución (Turner 2004, Garrido y Kirkconnell 2011). Durante el invierno abandona el país, emigra hacia territorios no identificados de América del Sur (Brown 1997, Turner 2004). Las cavidades presentes en el CSFA también son usadas por otras especies de aves que usan cavidades secundarias para nidificar como Columba livia (paloma doméstica) y Passer domesticus (gorrión doméstico). Ambas especies fueron introducidas en Cuba a mediados del siglo XVI y XIX, respectivamente (Garrido y García 1975).
Las interacciones entre las especies y los mecanismos subyacentes a la estructura comunitaria en ambientes citadinos son los aspectos menos estudiados de la ecología urbana (Shochat et al. 2010, González-Lagos y Quesada 2017). La presencia de especies invasoras en las ciudades, que por lo general presentan altas densidades poblacionales, pueden afectar la conducta y la dinámica poblacional de las especies nativas (González-Lagos y Quesada 2017, Leveau y Zuria 2017). Teniendo en cuenta la disponibilidad de cavidades adecuadas para la reproducción de P. cryptoleuca (cavidades ubicadas a más de 18 m de altura, según García-Lau y Vives 2016) y la presencia de competidores potenciales en el CSFA, así como el desconocimiento general existente sobre la historia natural de la especie, realizamos el presente estudio con los siguientes objetivos: 1) caracterizar la comunidad de aves usadora de cavidades secundarias presente en esta área altamente urbanizada de La Habana y 2) analizar las variaciones temporales en el uso de estas cavidades por P. cryptoleuca, teniendo en cuenta la presencia de otras especies de aves que usan cavidades secundarias para nidificar.
Métodos
Área de estudio
Llevamos a cabo el estudio en el CSFA (23°08’13” N, 82°20’54”W), ubicado en La Habana Vieja, segundo municipio con mayor densidad poblacional de la capital cubana (Figura 1). Esta edificación se asienta en las proximidades de la Bahía de La Habana, a 20 m de la línea costera. En su entorno se encuentran edificios de oficinas, hoteles, la terminal de cruceros, plazas, restaurantes, entre otras instalaciones.
Figura 1 Ubicación geográfica del Convento San Francisco de Asís (23°08’13” N, 82°20’54” W), municipio Habana Vieja, La Habana, Cuba. Figura tomada de García-Lau, y Vives (2016).
El convento fue construido en 1738 con piedra de cantería (roca caliza). Tiene en uno de sus vértices una torre escalonada de 36 m de altura que se continúa con las naves perimetrales de 16 m de altura. En las paredes externas de todos los niveles se encuentran ubicadas simétricamente una serie de cavidades que son usadas por diferentes especies de aves que nidifican en cavidades secundarias. Todas las cavidades presentan disposición horizontal y dimensiones de la entrada similares (García-Lau y Vives 2016). Predominan las cavidades entre 6 y 18 m de altura, con edificaciones en su cercanía, expuestas al sol durante la tarde, con una sola entrada y con un grado de acceso mínimo. Debido a la disposición espacial que presentan la mayor parte de las cavidades, distante de los balcones u otros puntos de acceso, nos resultó difícil la inspección visual directa de su contenido.
Toma de datos
Previamente se realizó un croquis del convento donde ubicamos y numeramos las 351 cavidades disponibles. El estudio fue desde febrero de 2012 a febrero de 2013, periodo en el que realizamos un total de 36 visitas que agrupamos en 14 observaciones (entre una y dos observaciones mensuales). Las visitas correspondientes a una observación las realizamos en días consecutivos o alternos, siempre entre las 09:15 h y 10:30 h. Antes de la toma de datos, visitamos el área en diferentes momentos del día y constatamos que éste fue el horario de mayor actividad en la colonia, relacionado con la entrada y salida a la cavidad. Igualmente, Finlay (1971) reconoce para la golondrina azul (Progne subis) que el horario de la mañana es el más apropiado para realizar observaciones. En cada visita registramos las cavidades usadas por especie, con la ayuda del croquis y de binoculares de 10 x 42. En general, consideramos como activas aquellas cavidades donde las especies presentaron alguna de las siguientes conductas: individuos entrando y saliendo en un corto periodo de tiempo, acarreando alimento o materiales para el nido, adultos o pichones posados en la entrada de la cavidad. Las cavidades activas en al menos una de las tres visitas correspondientes a una observación las consideramos como usadas por una especie, siempre que en las restantes visitas no detectáramos individuos de especies diferentes.
De manera colateral, realizamos visitas esporádicas al área de estudio en enero (7:30 h a 9:30 h) y de agosto a octubre (18:00 h a 20:30 h) con el fin de detectar el arribo y partida de P. cryptoleuca, respectivamente. Durante estas visitas contamos el número de individuos de esta especie que sobrevolaban el convento.
Procesamiento de datos
Determinamos la frecuencia de cavidades usadas por especie para caracterizar la comunidad de aves que usa cavidades secundarias en el CSFA. Igualmente, analizamos las variaciones temporales en el uso de las cavidades durante el periodo. Para ello calculamos además, los estadísticos de tendencia central y de dispersión (media ± DE, mín-máx). Utilizamos la prueba U de Mann-Whitney para comparar el uso de cavidades por P. cryptoleuca antes y después de la fecha de máxima ocupación. Además, analizamos la relación del uso de cavidades entre las especies más abundantes (C. livia y P. cryptoleuca) a través de correlaciones de rangos de Spearman. Los resultados de las pruebas estadísticas los consideramos significativos para P ≤ 0.05. Las pruebas estadísticas las realizamos utilizando el programa STATISTICA versión 8.0 (StatSoft 2007).
Resultados
De las 351 cavidades disponibles, 79% (n = 277) fueron usadas por cinco especies de aves y la abeja doméstica (Apis mellifera, 1%, n = 4); las restantes (21%, n = 74) permanecieron desocupadas. De acuerdo con la frecuencia de uso de las cavidades, el orden de importancia de las especies de aves fue: C. livia (46%, n = 160), P. cryptoleuca (17%, n = 58), P. domesticus (4%, n = 16), Dives atroviolaceus (totí, ˂ 1%, n = 2) y Falco sparverius (cernícalo americano, ˂ 1%, n = 1). Adicionalmente, 10% (n = 36) del total de cavidades fueron usadas durante el periodo de estudio por más de una de estas especies.
Al analizar las variaciones temporales en el uso de cavidades durante el periodo de estudio, evidenciamos el mismo orden de importancia encontrado anteriormente en relación con la frecuencia de uso por especie (Figura 2). Por lo general, C. livia y P. domesticus usaron las cavidades durante todo el año (media ± DE, mín-máx; C. livia: 42.6 ± 13.5, 14-68 y P. domesticus: 4.7 ± 2.8, 0-10). No ocurrió así para P. cryptoleuca, D. atroviolaceus y F. sparverius, las cuales usaron las cavidades únicamente entre enero y julio.
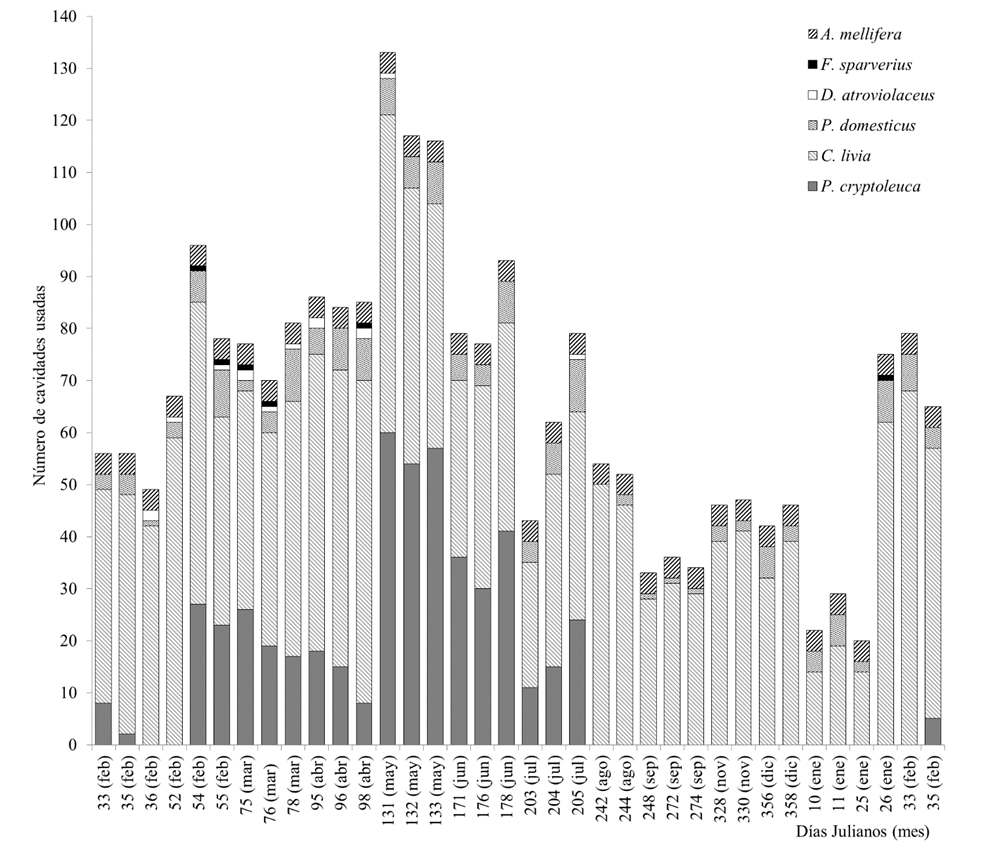
Figura 2 Variación temporal del número de cavidades usadas por cinco especies de aves y la abeja doméstica (Apis mellifera) en el Convento San Francisco de Asís, La Habana (total de cavidades disponibles: n = 351).
En particular, P. cryptoleuca mostró amplia variación en el uso de las cavidades (media ± DE, mín-máx: 23.4 ± 17.8, 0-60), el cual se extendió del 2 de febrero al 23 de julio de 2012 (Figura 2). En abril (7 de abril de 2012), encontramos una marcada disminución en el número de cavidades usadas por la especie (n = 8), mientras que un mes después encontramos el valor máximo (n = 60; 10 de mayo de 2012). El número de cavidades usadas previo a esta última fecha (media ± DE, mín-máx: 13.6 ± 9.8, 0-27) fue significativamente menor al que encontramos posteriormente (media ± DE, mín-máx: 36.4 ± 18.1, 11-60; Z = -2.74, P = 0.01). Durante el periodo de permanencia de P. cryptoleuca en el convento no encontramos una correlación entre el número de cavidades usadas por esta especie y C. livia (correlación de rangos de Spearman: r = -0.07, P = 0.77).
Durante todo el estudio, el 21% de las cavidades disponibles no fueron usadas. Sin embargo, el número de cavidades desocupadas en cada visita superó este porcentaje (Figura 2). El menor número de cavidades desocupadas lo detectamos en mayo (62%), mientras que en enero esta variable alcanzó su valor máximo (94%).
Discusión
Debido a la transformación, el deterioro y la pérdida de los hábitats naturales, la disponibilidad de sitios de cría alternativos dentro de áreas urbanas es cada vez más importante para las aves que nidifican en cavidades secundarias (Blewett y Marluffz 2005, Reale y Blair 2005). La comunidad de aves que usa cavidades secundarias en el CSFA está compuesta por especies introducidas y nativas. Específicamente, las especies introducidas estuvieron representadas por C. livia y P. domesticus, siendo la primera la más representativa. Ambas especies aprovechan los recursos brindados por los humanos en forma directa y son comunes en centros urbanos del mundo (Krakowski y Payne 1996, Blair 1996, Clergeau et al. 1998, Lim y Sodhi 2004, Leveau y Leveau 2005, MacGregor-Fors y Schondube 2012, Leveau 2013). La presencia y permanencia de C. livia en el área se vio favorecida en las últimas décadas por la ubicación de cajas con fines reproductivos y disponibilidad de alimento. En la actualidad las cajas no existen y la especie ha pasado a utilizar las cavidades presentes en el CSFA como sitios de cría y refugio. Varios factores como son el presentar una dieta basada en granos, una estructura social gregaria, hábitos sedentarios y el uso de sitios rocosos para la nidificación han favorecido el éxito de esta especie como explotadora urbana (Kark et al. 2007).
Por su parte, las especies nativas estuvieron representadas por P. cryptoleuca, D. atroviolaceus y F. sparverius. Las dos últimas especies presentaron frecuencias de uso de cavidades muy bajas, pues sólo observamos dos y una pareja usando las cavidades, respectivamente, lo cual podría asociarse a su alta territorialidad. En cambio, P. cryptoleuca fue la segunda especie más importante en el área. A diferencia de C. livia, la presencia y abundancia de P. cryptoleuca en el convento ha ocurrido de manera natural y no ha estado determinada por acciones de manejo, como por ejemplo, la ubicación de cajas nidos. La presencia de P. cryptoleuca en el área y el uso de los recursos allí presentes fue reportado por Gundlach (1876) hace más de un siglo. Al parecer, las características de las cavidades disponibles en el área, específicamente la altura a la que se encuentran, han favorecido su uso por los individuos de esta especie (García-Lau y Vives 2016).
En concordancia con su conducta migratoria y su estatus de residente de verano en Cuba (Garrido y Kirkconnell 2011), el uso de las cavidades por P. cryptoleuca ocurrió entre principios de febrero y finales de julio. No obstante, desde finales de enero (26 de enero de 2012) observamos las primeras golondrinas sobrevolando el convento (n = 4) y la permanencia en el área se extendió hasta mediados de octubre (18 de octubre de 2012), cuando detectamos por última vez un bando de 160 individuos adultos y juveniles. Las visitas realizadas al área en el horario de la tarde revelaron que a finales de septiembre (20 de septiembre de 2012) los individuos de P. cryptoleuca pernoctaban en los árboles próximos al convento, no así en las cavidades usadas con anterioridad como sitios de cría y refugio. Una conducta similar fue reportada por Brown (1980) para una colonia de P. subis establecida en Sherman, al norte de Texas.
Las variaciones detectadas en el uso de las cavidades por P. cryptoleuca no parecen estar determinadas por la presencia de C. livia en el área, pues no encontramos correlación alguna entre el número de cavidades usadas por ambas especies. Además, a lo largo del periodo de estudio el número de cavidades desocupadas permaneció relativamente alto. La disponibilidad de un número alto de cavidades desocupadas en un área puede resultar ventajosa al constituir sitios de nidificación alternativos y reducir la competencia intra e interespecífica (Robertson y Gibbs 1982). García-Lau y Vives (2016) pudieron constatar que en el área existen cavidades con características adecuadas para la especie que permanecieron desocupadas (cavidades ubicadas a más de 18 m de altura). Las variaciones pudieran estar más relacionadas con el estatus migratorio de la especie y la conducta asociada a las diferentes etapas del periodo reproductivo. Desde finales de enero observamos los primeros individuos de P. cryptoleuca sobrevolando el convento y a principios de febrero comenzaron a usar las primeras cavidades. Klomp (1970) resaltó la importancia de una rápida selección del sitio de cría en especies migratorias y su influencia sobre el éxito reproductivo de la nidada. Por otra parte, el número de cavidades usadas mostró un incremento que se vio interrumpido en el mes de abril, momento en el cual detectamos la menor actividad en la colonia. Resultados similares fueron encontrados para P. subis, donde la tendencia al incremento de la actividad en las cavidades correspondió con las etapas de arribo, selección y defensa de la cavidad, formación de parejas y construcción del nido (Gaunt 1959, Johnston y Hardy 1962, Finlay 1971). La posterior disminución de la actividad en una colonia de P. subis en Edmonton, Alberta, fue interpretada por Finlay (1971) como un indicador de las etapas de puesta e incubación, pues la permanencia en la cavidad junto a los huevos es considerada la mejor estrategia de defensa contra depredadores y les brinda un ambiente térmico adecuado durante su desarrollo. A su vez, es probable que el uso máximo de cavidades detectado en mayo se corresponda con la presencia de pichones en sus primeros estadios, cuando requieren un suministro de alimento constante, por lo que los adultos entran y salen con mayor frecuencia a la cavidad. Durante esta etapa se ha reportado para P. subis hasta un promedio de 13.2 visitas/h al nido por cada pichón de la nidada (Michael 1970). A medida que avanza el desarrollo de los pichones la actividad en la cavidad comienza a descender hasta que éstos se encuentran preparados para abandonar el nido (Finlay 1971), tal y como observamos en los meses de junio y julio en la colonia de P. cryptoleuca presente en el CSFA.
Al considerar las fechas aproximadas de arribo y salida registradas para la colonia, así como las variaciones temporales detectadas en el número de cavidades usadas, el acotamiento de la etapa reproductiva en la literatura a los meses entre abril y agosto (Garrido y Kirkconnell 2011) y el porcentaje de cavidades desocupadas en el área, suponemos que las cavidades presentes en el CSFA son usadas por P. cryptoleuca básicamente con fines reproductivos. En futuros estudios se deberá corroborar la fenología reproductiva de la especie a través de la inspección directa del contenido de las cavidades y del seguimiento metodológico de la conducta de la colonia.
A diferencia de P. cryptoleuca, las variaciones temporales en el uso de cavidades por C. livia y P. domesticus fueron menos marcadas y se extendieron a todo el año. Este resultado pudiera relacionarse directamente con su condición de residentes permanentes (Garrido y Kirkconnell 2011) y con que ambas especies pueden tener más de una puesta al año (Anderson 1994, Hetmański 2004). Por otra parte, estas especies también utilizan las cavidades para pernoctar y como refugio. A pesar de que el uso de cavidades por P. cryptoleuca en el CSFA no parece estar influenciado por la presencia de otras especies de aves que también utilizan cavidades, no debe ignorarse el efecto que podría tener un incremento poblacional de C. livia en el área.











 text new page (beta)
text new page (beta)



