Introducción
En los últimos años el objetivo de la cirugía trata de enfocarse en ofrecer la mejor posibilidad para una pronta recuperación y reincorporación a las labores cotidianas, no sin remarcar que ésta debe cursar con una calidad analgésica adecuada, acorde a protocolos mundiales como ERAS (Enhanced Recovery After Surgery 2001).1
Estas cuestiones representan un reto para el anestesiólogo en la elección de los medicamentos a usar durante el periodo transanestésico, estimulando la investigación de nuevos fármacos que pudieran cumplir con este perfil, tal es el caso de la dexmedetomidina. Asimismo es importante considerar los efectos no deseados del uso de opioides como medida analgésica y la repercusión de su uso en el sistema inmunológico, por supuesto también la temida dependencia de opioides que día con día aumenta en la población mundial.2
El uso eficaz de los agentes hipnóticos y analgésicos forma parte de la comodidad y de la seguridad del paciente. La elección del agente o su combinación apropiada es fundamental para aliviar los estímulos nocivos, el estrés y la ansiedad,³ pero al mismo tiempo se deben minimizar los efectos adversos. Por ello, el objetivo de este trabajo es cuantificar y demostrar la disminución de la administración de opioides durante el periodo transanestésico con el uso de dexmedetomidina en perfusión.
La dexmedetomidina es un agonista de los adrenoceptores α-2 extremadamente selectivo (1,600 veces mayor para el receptor α-2 que para el receptor alfa-1), por lo cual posee propiedades sedantes, ansiolíticas, simpaticolíticas y analgésicas.4
El receptor adrenérgico α-2 consiste en tres α-2 isorreceptores (α-2a, α-2b y α-2c), que se ligan a agonistas y antagonistas α-2 con afinidades similares, comparten una homología de composición aminoacídica de aproximadamente de 70 a 75%.5
Se considera que cuenta con un efecto neuroprotector; en varios modelos experimentales de cerebros en formación con isquemia cerebral y daño cerebral hipóxico-isquémico dexmedetomidina se demostró un mejor resultado. Los mecanismos exactos de neuroprotección no están muy claros, parece que las estructuras catecolaminérgicas poseen un papel importante.6
A nivel ventilatorio disminuye la frecuencia respiratoria, pero mantiene la pendiente de la curva de respuesta respiratoria al CO2. Los efectos en la respiración se explican por el estado de sueño inducido al actuar sobre el locus coeruleus, predominantemente con un descenso en el volumen corriente, no así en la frecuencia respiratoria o inhibición.
A nivel cardiovascular se ha reportado hasta 5% de pacientes que pueden presentar bradicardia con disminución de 30% de cifras basales, la cual puede ser particularmente pronunciada en los pacientes con aumento del tono vagal, accesos de tos, hipoxemia o aquéllos que utilizan fármacos que disminuyen el tono simpático como los betabloqueadores.7
Por lo tanto, dada la propensión a hipotensión y/o bradicardia es importante determinar la dosis correcta que puede maximizar el ahorro en el uso de anestésicos y analgésicos teniendo la menor incidencia de efectos cardiovasculares adversos.
La respuesta analgésica a la administración de dexmedetomidina parece producirse a nivel de la raíz dorsal, donde los agonistas α-2 bloquean la liberación de la sustancia P en la vía nociceptiva. Se considera que los efectos analgésicos aparecen gracias a su mecanismo de acción en la proteína G inhibitoria, también activa las vías inhibitorias descendentes gracias al bloqueo de los receptores de aspartato y glutamato. De esta forma se puede atenuar la hiperexcitabilidad espinal, lo que ejerce un verdadero efecto preventivo al dolor. Dicho de otro modo, su acción analgésica es debida a la inhibición de la liberación de neurotransmisores excitadores en la médula espinal.8
El efecto hipnótico de la dexmedetomidina es mediado por la hiperpolarización de las neuronas noradrenérgicas en el locus coeruleus del tronco cerebral (un pequeño núcleo bilateral que contiene muchos receptores adrenérgicos), que es la región principal de modulación de la vigilia. Cuando el receptor α-2 es activado, inhibe el adenilato ciclasa y por ende la producción de AMP cíclico, que deriva como consecuencia en el cambio de la conductancia de los iones de la membrana, lo que lleva a la hiperpolarización de la membrana, que a su vez anula la descarga neuronal en el locus coeruleus así como a la actividad de la estructura noradrenérgica ascendente, misma que está implicada en la integración de impulsos nociceptivos.
Estos receptores también localizados fuera del sistema nervioso central siguen el mismo comportamiento, inhibiendo los impulsos nociceptivos mediante la hiperpolarización celular en fibras Alfa Delta y tipo C.
La ausencia de control de la inhibición sobre el núcleo preóptico ventrolateral (VLPO) trae como resultado la liberación de ácido gama-aminobutírico (GABA) y galanina, que inhibe más todavía el locus coeruleus y el núcleo tuberomamilar (NTM). Esa respuesta inhibitoria también causa una disminución en la liberación de histamina que conlleva a una respuesta hipnótica, respuesta similar a la encontrada en el sueño fisiológico.
Existen algunas teorías acerca de cómo funciona la neuroprotección por medio del uso de dexmedetomidina, se cree que inhibe la entrada de sodio y retrasa al igual la de potasio, con ello aumenta las señales extracelulares para cinasas reguladoras ERK 1/2 que son pieza clave en la mitosis activada por proteínas cinasas que están involucradas en la supervivencia celular y la memoria.9
Tiene un inicio de acción posterior a su administración de aproximadamente 15 minutos, los picos de concentración se obtienen por lo general dentro de una hora después de la perfusión intravenosa continua. Su vida media Alfa (t ½ α) es de seis minutos en los adultos en dosis de 0.2-0.7 μg/kg/h, tiene una vida media beta (t ½ β) de entre dos y tres horas.
Presenta una breve respuesta cardiovascular bifásica dependiente de la dosis posterior a la administración inicial de la dexmedetomidina. La dosis del bolo de 1 μg/kg ocasiona un aumento inicial en la presión sanguínea y una caída se refleja en la frecuencia cardiaca que se observa más a menudo en pacientes jóvenes y sanos. Se cree que la estimulación de los receptores α-2b en el músculo vascular liso puede ser la causa del aumento de la presión sanguínea.
Esa respuesta inicial dura entre cinco y 10 minutos, y viene acompañada de una ligera disminución de la presión sanguínea debido a la inhibición del flujo simpático central, al igual puede presentarse bradicardia.10
Material y métodos
Diseño de estudio y selección de pacientes
Se realizó un estudio de tipo prospectivo, observacional y descriptivo, del tipo casos y control aleatorizado con simple ciego. Se estudiaron 26 pacientes, en quienes se llevó a cabo algún tipo de cirugía mayor no cardiaca bajo anestesia general balanceada durante el periodo del 01 de octubre de 2019 al 01 de febrero de 2020 en un hospital privado de alta especialidad, Hospital Angeles Clínica Londres en la Ciudad de México.
Se seleccionaron pacientes que se someterían a cirugía mayor no cardiaca de forma programada con edades entre 18 y 60 años, contaran con ASA I o II, sin cursar con bradicardia o uso de betabloqueadores, embarazo, enfermedad hepática, abuso de sustancias, uso crónico de opioides y obesidad, ya que serían parámetros que modifican el perfil de seguridad y/ o el perfil farmacológico de la dexmedetomidina.
Se realizó la división de los pacientes en dos grupos por medio de una Tabla para aleatorizar, obteniendo 13 pacientes por grupo de estudio. Para realizar el procedimiento se estandarizó el uso de fármacos y dosis durante la anestesia general balanceada así como la utilización de monitoreo transanestésico (presión arterial continua no invasiva en miembro torácico derecho, oximetría, CO2 espirado y electrocardiograma continuo de cinco derivaciones).
Se administraron fármacos adyuvantes para el proceso anestésico en ambos grupos: analgésicos inflamatorios no esteroideos (ketorolaco 10 mg, paracetamol 1 g y parecoxib 40 mg), opioides débiles (tramadol 25 mg), antiemético (palonosetron .075 mg), protector de la mucosa gástrica (omeprazol 40 mg) y analgésico esteroide (dexametasona 16 mg).
Para la inducción anestésica se preoxigena con una FiO2 de 50% a 3 LPM con mascarilla facial durante tres minutos, por vía intravenosa periférica se administra midazolam como ansiolítico e hipnótico en dosis de 0.2 mg/kg, fentanilo en dosis de 1.8 μg/kg con un objetivo de concentración plasmática de 0.003 μg/mL, propofol como inductor a dosis preestablecida de 1-2 mg/kg y como bloqueador neuromuscular rocuronio en dosis de 0.6 mg/kg (DIOT).11
Con tiempo adecuado de latencia para cada fármaco se realizó intubación orotraqueal (IOT) con dispositivo avanzado de la vía aérea (King visión™), e iniciamos ventilación mecánica con desflourane a CAM (concentración alveolar mínima) dosis respuesta para hipnosis, posteriormente de acuerdo a las variables hemodinámicas se consideró la aplicación de fentanilo en dosis de rescate de 1-3 μg/kg/dosis si éstas aumentaban por arriba de 20% de las variables hemodinámicas basales; una vez finalizado el acto quirúrgico se egresó a los pacientes a la unidad de cuidados postanestésicos (UCPA) para su vigilancia, y se registró en escala verbal del dolor (ENA) del cero al 10 el dolor que presenta el paciente, se repite la valoración de (ENA) a su egreso. En el grupo de casos se realizó exactamente el mismo procedimiento, con la diferencia de aplicar dexmedetomidina desde el momento de la inducción a dosis de 0.5 μg/h durante 10 minutos, después se ajustó dosis respuesta hasta dosis terapéuticas preestablecidas y se suspendió su perfusión 10 minutos antes del término del procedimiento quirúrgico.
Análisis estadístico
Se realizó el análisis estadístico en el programa Epi Info™ 7.2 para Windows, utilizando estadística descriptiva para medias, frecuencias y porcentajes en el caso de variables cualitativas y análisis de la sociodemografía del grupo de estudio, en el caso de las medidas cuantitativas se utilizaron pruebas estadísticas de comparación de grupos como ANOVA y U de Man Whitney, prueba de prueba de Bartlett’s para determinar significancia estadística en los grupos.
Resultados
De los 26 pacientes pertenecientes al estudio en ambos grupos, se asignó 50% al grupo de intervención y 50% al grupo de control, mientras que en el caso del comportamiento de las variables sociodemográficas en ambos grupos no se evidenció una diferencia significativamente estadística en los rubros de edad, talla, índice de masa corporal, ASA, sexo y duración de los procedimientos quirúrgicos, logrando así una homogenización de los grupos de estudio para su mejor comparación. El promedio de edad entre los grupos fue de 47 años, con una variación de género en el grupo control de 53.8% conformado por mujeres y en el grupo de la intervención de 38.4%, sin evidenciar algún tipo de comportamiento de análisis en los resultados del estudio. En ambos grupos la predominancia en la escala de ASA fue II con 69.2%, lo cual podría explicarse por la media en la edad de los pacientes pertenecientes al estudio, la mayoría con padecimiento de alguna enfermedad crónica bajo control. El tiempo anestésico requerido para la realización de los procedimientos fue de 55 a 66.9 minutos en promedio con desviación estándar comentada en la Figura 1, sin encontrar significancia estadística (Tabla 1).
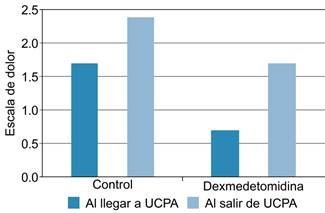
Figura 1: Nivel de dolor en ambos grupos en escala numérica del dolor con p< 0.05 en el grupo de dexmedetomidina en comparación con el grupo control. UCPA = Unidad de Cuidados Posanestésicos, ENA = escala numérica del dolor.
Tabla 1: Variables sociodemográficas de grupos de estudio.
| Grupo control (N = 13) | Grupo dexmedetomidina (N = 13) | |
|---|---|---|
| Edad (años) | 47.07 ± 12.60 | 47.15 ± 15.68 |
| Talla (m) | 1.64 ± 1.08 | 1.66 ± 0.10 |
| Peso real (kg) | 67.30 ± 10.33 | 70.69 ± 13.62 |
| Peso corregido (kg) | 68.20 ± 7.84 | 66.62 ± 10.97 |
| IMC (kg/m2) | 26.33 ± 2.35 | 25.47 ± 10.53 |
| ASA (EF) n (%) | ||
| I | 3 (23.08) | 4 (30.77) |
| II | 10 (69.2) | 9 (69.23) |
| Sexo n (%) | ||
| Mujeres | 7 (53.85) | 5 (38.46) |
| Hombres | 6 (46.15) | 8 (61.54) |
| Tiempo quirúrgico (min) | 55.15 ± 14.75 | 66.92 ± 22.03 |
IMC = índice de masa corporal, ASA (EF) = estado físico por grados.
Con respecto al tipo de cirugías realizadas en ambos grupos de pacientes, la mayoría de los procedimientos fueron cirugías abdominales, siendo la colecistectomía laparoscópica el procedimiento más realizado en ambos grupos de estudio con 46.15%, sin demostrar una significancia estadística para el estudio. El resto de las cirugías no pertenecientes a la rama de cirugía general fueron histerectomías laparoscópicas con 15.38% en el grupo control y con 7.69% en el grupo de intervención (Tabla 2).
Tabla 2: Tipo de procedimiento quirúrgico por grupo de estudio. (N = 26).
| Grupo control (N = 13) | Grupo dexmedetomidina (N = 13) | |
|---|---|---|
| Tipo de cirugía | n (%) | n (%) |
| Colecistectomía laparoscópica | 6 (46.15) | 6 (46.15) |
| Hernioplastia inguinal | 3 (23.08) | 4 (30.77) |
| Histerectomía laparoscópica | 2 (15.38) | 1 (7.69) |
| Apendicetomía laparoscópica | 2 (15.38) | 2 (15.38) |
Respecto a la presencia de dolor en ambos grupos, se obtuvo lo siguiente: a su llegada a UCPA el grupo control cuenta con un promedio de 1.69 ± 1.31 en ENA, mientras que el grupo con dexmedetomidina cuenta con un 0.69 en ENA (DE ± .63); en contraste más bajo el grupo control, a su salida 60 minutos después, el grupo control presenta 2.38 en promedio de ENA y el grupo con dexmedetomidina continúa contando con puntajes más bajos en ENA con 1.69 con un valor de p < .05 (Figura 1).
Hemodinámicamente el grupo al cual se le realiza la intervención presenta valores más bajos de TAM (tensión arterial media) y frecuencia cardiaca (FC), que podrían estar relacionados con la disminución del dolor durante el procedimiento; sin embargo, es parte del comportamiento farmacológico de la dexmedetomidina, por lo que no es posible relacionarlos a la calidad analgésica (Figura 2).

Figura 2: Variables hemodinámicas en ambos grupos. Tiempos ( T ) = tomas de tensión arterial y frecuencia cardiaca (FC)basales cada 10 minutos en ambos grupos con p < 0.05 en T6 en el grupo de dexmedetomidina en comparación con el grupo control.
Respecto al consumo durante el periodo transanestésico de fentanilo como analgésico, los requerimientos fueron significativamente menores en el grupo de dexmedetomidina con una p < 0.05 a través de la prueba de Bartlett’s (Figura 3).
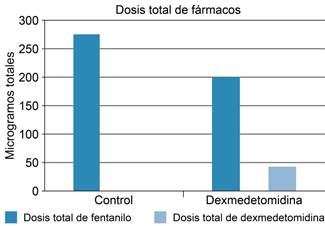
Figura 3: Consumo de fentanilo en ambos grupos con p < 0.05 en el grupo de dexmedetomidina en comparación con el grupo control.
Este estudio tuvo como objetivo la cuantificación del consumo de fentanilo durante el periodo transanestésico asociado a la perfusión de dexmedetomidina; el grupo control tuvo un consumo de 276 μg (DE ± 32.54), mientras que el grupo intervenido consumió 198.84 μg (DE ± 56.4) total de fentanilo, lo cual resultó estadísticamente significativo con un valor de p < .05; en el caso de la perfusión de dexmedetomidina, en el grupo intervenido en promedio se utilizó 44.28 μg en total perfundidos a dosis respuesta en un tiempo promedio de 66.9 minutos y suspendida su perfusión 10 minutos antes del término de procedimiento quirúrgico/anestésico.
Una vez demostrada la disminución del consumo de opioides en este contexto, podemos pensar en el uso de la dexmedetomidina como un auxiliar en la recuperación pronta y óptima del paciente, sin dejar de considerar que siempre será un resultado de diversas variables como el estado previo del paciente, la calidad analgésica del transoperatorio y postoperatorio, la baja incidencia en la presencia de complicaciones asociadas al uso de opioides y por supuesto la técnica quirúrgica.
Discusión
En los últimos 15 años ha aumentado el interés en las guías de recuperación y rehabilitación postoperatoria (ERAS). El enfoque para reducir la duración de la estancia hospitalaria es multifactorial e incluye objetivos de manejo para varios parámetros como la hemodinamia, administración de fluidos, ventilación, alimentación, motilidad intestinal, movilidad precoz y el manejo del dolor postoperatorio que debe ser un área de enfoque fundamental.
Los opioides son ampliamente conocidos por tener un perfil de efectos secundarios que en ocasiones ralentiza la recuperación hospitalaria, retrasando tanto el alta hospitalaria como el retorno a la normalidad funcional. Estos efectos secundarios incluyen la disminución de la motilidad intestinal, náuseas, vómito postoperatorio, sedación y delirio.
Debido a la actividad antinociceptiva central de la dexmedetomidina se convierte en una opción atractiva para usar como analgésico y/o sedante, ya que no deriva en los efectos adversos del uso de opioides y por ende en una buena herramienta cuando el objetivo es disminuir el consumo transanestésico de los mismos.
Por otro lado, dentro de las implicaciones comentadas en la técnica quirúrgica, 76.8% de las cirugías realizadas en el grupo control fueron cirugías laparoscópicas, mientras que en el grupo con dexmedetomidina fueron 69.22%, en ambos grupos la mayoría de las cirugías realizadas fueron laparoscópicas. En un estudio realizado por Cochrane en 2018 se comparaban los resultados de pacientes sometidos a apendicectomía abierta versus apendicectomía laparoscópica con 9,765 pacientes y se concluyó que el dolor en las primeras 24 horas posteriores era menor en los pacientes en quienes se llevó a cabo laparoscopia así como la reducción en la estancia hospitalaria en hasta un día, igualmente el retorno a la actividad normal fue menor en pacientes bajo laparoscopia; sin embargo, los resultados no pudieron aseverarse debido a la falta de información de los estudios contenidos en el metaanálisis.
La cirugía laparoscópica podría tener un rol en el desarrollo del dolor y en los bajos puntajes presentados en los pacientes del estudio durante su estancia en UCPA.
Durante el análisis de las variables hemodinámicas se visualiza una tendencia similar en ambos grupos; sin embargo, debido a las características de la dexmedetomidina farmacológica, hasta 10 minutos posteriores a la inducción comienza a notarse el efecto del fármaco con tendencia a la baja en la hemodinamia en el análisis comparativo, el cual se muestra significativamente estadístico. Recordemos que hasta la fecha no existe para el manejo transoperatorio una forma exacta de cuantificar el dolor, siendo más bien un proceso deductivo de los parámetros del paciente presentados en nuestro monitoreo, por lo que resulta imposible afirmar alguna relación entre la calidad analgésica y las variables hemodinámicas mostradas; no obstante, los pacientes tienen un requerimiento menor de analgésico opioide basado en esta misma tendencia de descenso de las variables hemodinámicas.
Por último, la calidad analgésica, como hemos mencionado, tiene un rol importante en la recuperación del paciente, los pacientes con perfusión de dexmedetomidina durante el transanestésico en este estudio presentaron menor grado de dolor tanto a su llegada a UCPA como a su egreso y por ende, menor administración de fentanilo durante su evento quirúrgico, por lo que podríamos inferir, pero sin afirmar, que la perfusión de dexmedetomidina influyó en la calidad analgésica de este grupo de pacientes.
Sin embargo, no es posible establecer una conclusión con los datos obtenidos, ya que la cantidad de muestra no es representativa con respecto a la población general y sólo es un reflejo de algunos pacientes con un perfil sociodemográfico muy particular pertenecientes al Hospital Angeles Clínica Londres, por lo que es necesario realizar más estudios que con el tiempo puedan usarse como generadores de nuevas teorías y de hechos establecidos para la mejoría día con día del manejo transoperatorio del paciente sin importar el tipo de procedimiento quirúrgico.











 text new page (beta)
text new page (beta)


