Introducción
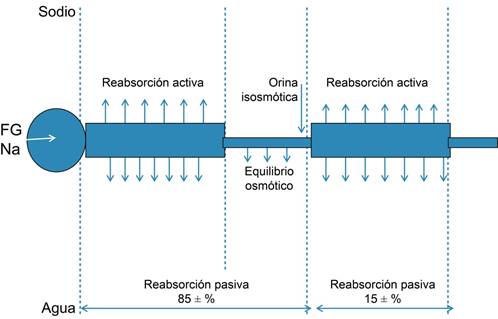
Una gran controversia que se suscitó en el siglo XX sobre la fisiología del riñón y en el que estuvo involucrado el Dr. Homer W Smith, en ese momento el líder de la fisiología del riñón, ocurrió en la década de los años 50 y se relacionaba con el mecanismo renal de la concentración urinaria, proceso fundamental en el control de nuestro medio interno.1,2 En esa época, el Dr. Smith3 dibujaba la nefrona en forma rectilínea como se ejemplifica en la Figura 1.
¿Por qué el Dr. Smith y todos los libros de la época pintaban la nefrona rectilínea? Ya desde 1862 en su obra monumental Handbuch der systematischen Anatomie des Menschen Friedrich Gustav Jakob Henle4 describe el asa que desde entonces lleva su nombre, y en la monografia The Secretion of the Urine, publicada en 1917, Arthur Cushny,5 un notable farmacólogo, plasma en la página 3 de ese libro el esquema de una nefrona con su asa de Henle, desplegada a todo color (Figura 2).

Figura 2: Esquema de la nefrona de Cushny publicada en 1917 con el asa de Henle donde esquematiza una nefrona profunda (izquierda) y otra superficial (derecha).4
Sin embargo, Smith se negaba a darle un valor fisiológico a este segmento de la nefrona y la consideraba como un remanente embrionario. Si esta parte del riñón fuera sólo un accidente de la organogénesis, ¿cuántos otros no lo serán? Sería un razonamiento falso: si desconozco para qué sirve el asa de Henle, pues no sirve.
Homer Smith6 relata que en agosto de ese mismo 1950, se enfrentó con otra visión del problema: “al calor de varias cervezas Carlsberg con motivo del XVIII Congreso Internacional de Fisiología en Copenhague en compañía del Dr. Heinrich Wirz de Basilea, uno de sus exalumnos, lo retó con una idea novedosa y opuesta a la que él sustentaba hasta ese momento”.
No era fácil tener una conversación con el Dr. Smith, pero Wirz había pasado un año 1946-47 en su laboratorio y pudo desplegarle con detalle los sorprendentes resultados que había obtenido. Estas observaciones se referían al mecanismo por el cual el riñón de los mamíferos forma una orina osmóticamente más concentrada que la sangre. Este comportamiento es importante cuando las reservas de agua son escasas y se tiene que echar mano de un ahorro de este vital líquido con la excreción de una orina concentrada.1,2,6 Todos los vertebrados pueden eliminar orina isotónica y diluida pero sólo los mamíferos y algunas aves pueden excretar orinas concentradas y compensar para un déficit sustancial de agua. Se ha especulado que esta capacidad de concentrar la orina de los mamíferos haya influido en su habilidad para sobrevivir a los dinosaurios y a los reptiles al final de la era Mesozoica.7
La elaboración de una orina concentrada amerita que la orina se concentre en alguna región a lo largo del nefrón y para eso hay que sustraerle al filtrado glomerular, que es isosmótico al plasma, agua sola, para de ese modo concentrar las sales que permanecen en la luz tubular. En 1950 se intuía que la concentración del filtrado glomerular se llevaba a cabo en el tubo colector. ¿Cuál era el mecanismo responsable? La única explicación posible en esa época era que las células epiteliales de esa parte del tubo colector transportaran activamente moléculas de agua en contra de un gradiente de concentración, de la luz tubular hacia al intersticio renal. Interpretación que para muchos no era aceptable, ya que un transporte activo de agua era un tanto difícil de aceptar y se parecía más a una visión vitalista clásica del siglo XIX.
Orígenes
Las observaciones que Heinrich Wirz8 le relató al Dr. Smith eran muy simples. Por medio de un método crioscópico, que echaba mano de las propiedades coligativas de las soluciones, y que consistía en congelar cortes muy delgados del riñón de la rata que iban de la corteza a la médula. Los cristales de hielo de cada sección vistos al microscopio se descongelaban a diferentes temperaturas y eso indicaba un gradiente de concentración de las sales atrapadas en su interior y que alcanzaba su valor máximo (la menor temperatura de congelación) en lo más profundo de la papila (isosmótico en la corteza y progresivamente más hiperosmótico hacia la papila). A cualquier nivel del corte hecho en el riñón en que se incluía túbulos, capilares e intersticio, no había diferencias en la osmolaridad. O sea, que el riñón estaba conformado por capas de osmolaridad iguales pero cada vez más concentradas de corteza hacia la papila. Para explicar este sorprendente resultado, Wirz y sus colegas físicos Bartolomeo Hargitay y Werner Kuhn de la Universidad de Basilea8 invocaron un principio físico denominado multiplicador por contracorriente, en el que los flujos opuestos de las ramas ascendente y descendente del asa de Henle juegan un papel primordial. De acuerdo con Smith y otros fisiólogos,6 esta explicación era un tanto confusa, ya que el sistema de contracorriente pone gran parte de su peso en la rama delgada descendente del asa de Henle (es el mayor componente de la nefrona en la médula) y su estructura con sólo una capa delgada de células parece muy débil para soportar tamaña carga de trabajo. Esta hipótesis requería además que el tubo colector fuese permeable al agua y que la orina se concentrara por la difusión pasiva de este elemento hacia un intersticio cada vez más hiperosmótico, determinado por el asa de Henle, particularmente como hacía énfasis Smith,6 por sus ramas delgadas. La hipótesis requería que la orina se concentrará en algún punto del asa de Henle para posteriormente diluirse a la entrada del tubo distal, lo que según él y desde el punto de vista teleológico, era un desperdicio de energía.
Para el Dr. Smith6 esto era difícil de aceptar, además tenía dudas sobre el método crioscópico para estimar la osmolalidad y lo objetaba en términos técnicos. Pensaba que la hiperosmolaridad del colector al ser medida por la presión de vapor se sublimara y se igualara con la presión de vapor de las estructuras vecinas, el intersticio y vasa recta. Esta crítica le pareció válida al Dr. Wirz; sin embargo, con los posibles defectos del método crioscópico, inadecuado como parecía, dio resultados notables y la hipótesis de la contracorriente es ya parte de la fisiología del riñón. Eso escribió el Dr. Homer Smith en 19596 (Figura 3).
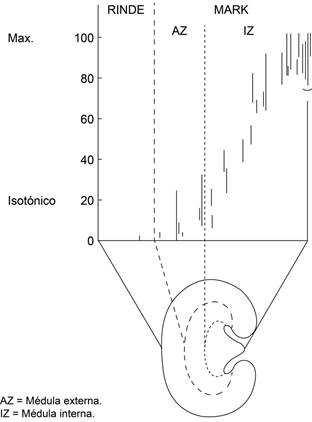
Figura 3: Osomolaridad tisular de rebanadas de corteza, médula externa y médula interna en rata hidropénica, Wirz, Hargitay y Kuhne 1951.5,8
El principio básico de la contracorriente es que dos corrientes que se mueven en dirección opuesta y que están yuxtapuestas intercambian entre sí energía o sustancias, en una forma u otra. ¿Qué forma? es irrelevante para el principio. Hay dos formas de contracorriente la simple y la multiplicadora. La primera es aquella de intercambio simple muy utilizado en ingeniería, pero no es una idea patentable, ya que la naturaleza ha echado mano de este principio desde hace millones de años. Por ejemplo, las aves que viven en el Ártico poseen un sistema de intercambio calórico en que la temperatura de sus extremidades se iguala o se acerca a la temperatura exterior ya que la rete mirabile de sus miembros intercambia calor: las arterias lo pierden al descender a la superficie de las patas cercanas a la nieve y las venas que retornan recuperan la temperatura de la sangre como se observa en la Figura 4.9,10 Este mecanismo determina un ahorro sustancial de energía calórica en estos animales. Lo mismo se ha descrito en la piel exterior de ballenas y focas, alces, caribúes, perros del ártico, puercoespines y otros animales.10 Todos presentan una red capilar superficial que enfría la superficie del cuerpo del animal y después regresa la sangre venosa cada vez más caliente para mantener la temperatura corporal en límites normales, al echar mano de este mecanismo se impide la pérdida calórica del organismo, o bien, que ésta sea mínima.10-15 Ya Claudio Bernard en 18761 había hecho hincapié en este hecho.
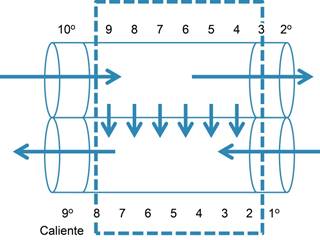
Tomado de: Scholander.9
Figura 4: Muestra un ejemplo de intercambio calórico por contracorriente simple. Dos corrientes en sentido opuesto que ingresan calientes y emergen frías y viceversa. Para que funcione el sistema tiene que estar aislado.
La Figura 5 ejemplifica un clásico osmómetro, en que al aplicar presión en el compartimiento C1, pasa solvente al C2, el primero se concentra y el C2 se diluye, o sea, el efecto de la presión hidrostática es que substrae solvente de un lado (C1) y lo suma en el otro (C2).

Figura 5: En un osmómetro convencional en que se separa una solución coloidal por una membrana semipermeable, si aplicamos presión en el lado C1 pasara agua sola al lado C2 y este último se diluirá y el C1 se concentrara de acuerdo a las características de la membrana y el grado de presión aplicada.
Ahora bien, el sistema multiplicador por contracorriente difiere del sistema simple en que, además de sustraer y sumar, también multiplica. La manera en que ésta ocurre es que las corrientes sean opuestas y para que el intercambio multiplique el efecto, es necesario que estén unidos por un asa en uno de los extremos y los otros dos extremos estén libres. La Figura 6 ejemplifica el modelo de Hargitay y Kuhne. En este ejemplo, el efecto de presión hidrostática se multiplica al unir los dos lados con un asa delgada que permite el paso del líquido ya concentrado y establecer un gradiente de osmolaridad mayor en la punta y progresivamente menor al llegar a los extremos, uno de los cuales está abierto. Los compartimientos se llenan de una solución coloidal, se aplica presión en el lado C1 que pasa líquido a través de la membrana semipermeable que los separa, de modo que el lado C1 se concentra y el lado C2 se diluye. Al dejar pasar la solución concentrada del lado C1 por el asa capilar distal, la concentración en la porción distal del compartimiento C2 aumenta, ya que la solución entrante es permanentemente nueva y lo hace a muy baja velocidad y a esa misma velocidad es eliminada en la parte proximal del compartimiento C2; el asa final multiplica el efecto con cambios infinitamente pequeños que se equilibran en ambos lados de la membrana para alcanzar su máxima concentración en la zona pegada al asa y de ese punto en adelante el gradiente decrece hasta eliminarse a la misma concentración que ingresa (Figura 6). De hecho, con una presión de 3.75 atmosferas la concentración inicial de 100 mosmoles se incrementó en el asa a 2,000 mosmoles o sea 20 veces. Para alcanzar esta misma osmolaridad sin el efecto multiplicador y en un solo paso de C1 a C2 (Figura 5), la presión que se debía aplicar debía ser de 50 atmosferas o un poco más.
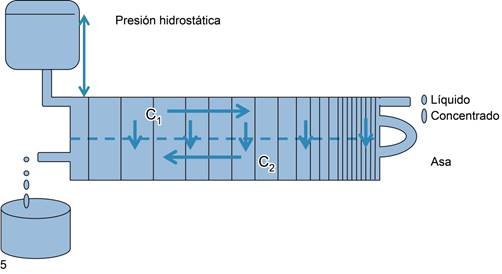
Figura 6: El asa delgada al operar continuamente como un sistema multiplicador por contracorriente diseñado por Hargithay y Kuhne. A la derecha se muestra el asa donde se comunican ambas ramas y se extraen pequeñas cantidades de solución concentrada.
Para que este modelo se pudiera aplicar en el riñón, debía haber en el intersticio una presión hidrostática muy elevada, por lo que el mecanismo que permitiera la multiplicación en el asa de Henle debía ser otro, para resolver el enigma de cuál sería la fuente de energía que permite concentrar la orina por medio de un mecanismo multiplicador por contracorriente y crear el gradiente de concentración de la corteza a lo más profundo de la papila. El Dr. Wirz por medio de la técnica de micropunción de Richards y colaboradores de la Universidad de Pensilvania16 y que el Dr. Wirz aprendió con una de las sobrevivientes de ese gran grupo, la famosa Dra. Philis Bott que era la única investigadora que en esa época, la década de los años 50, utilizaba y conocía esta técnica que le permitió realizar las siguientes observaciones.8 Tuve la oportunidad de escuchar esa plática de labios del mismo Dr. Wirz que nos ilustró sobre los experimentos realizados con los fisicoquímicos Bartolomé Hargitay y el profesor Werner Kuhn todos ellos de la Universidad de Basilea en la Suiza alemana. La plática la expuso con gran detalle en el Henry Ford Hospital en Detroit, Michigan a fines del año de 1959, recién llegado yo a la Universidad de Michigan en Ann Arbor, en el verano de ese mismo año. Con ojos de asombro escuché con arrobo esos experimentos que habían revolucionado la fisiología renal en esa década. Hasta muchos años después me di cuenta de la fortuna que había tenido al escuchar que frente a mí se estaba gestando la historia de la medicina y de la nefrología en particular.
Lo que escuché en esa memorable reunión. El Dr. Wirz con la técnica de micropunción en diferentes modelos animales y con su fuerte acento alemán para hablar en inglés, hizo tres observaciones puntuales. Primero, la reabsorción de sodio es isosmótica en el tubo proximal; segundo, la sangre obtenida por micropunción de los vasa recta en la papila de la rata era igual a la osmolaridad de la orina. La tercera y no menos importante fue que al puncionar la porción inicial del túbulo distal a la altura de la mácula densa, otro de los sitios asequibles a la punción, el líquido tubular tenía una concentración menor a la de la sangre (la relación orina/plasma era de 0.8 y 0.6); al infundir solución salina a la rata esta relación se hacía más conspicua con valores aun menores de O/P cercanos a 0.3. Esto sugería que el sodio debía reabsorberse en la rama ascendente gruesa del asa de Henle. Eso le permitió concluir que la reabsorción de sodio en este segmento debía ser el mecanismo que crea el gradiente hiperosmótico intersticial de corteza a médula y al final una orina hipertónica. La hipótesis de Wirz y colaboradores sostenía que las corrientes opuestas de las ramas descendente y ascendente del asa de Henle, por medio del mecanismo de contracorriente y facilitado por la reabsorción de sodio en la porción ascendente del asa, creaba las condiciones para el establecimiento de un gradiente de concentración como se esquematiza en las Figuras 7 y 8. Hubo en esos tiempos otras investigaciones que reafirmaron los hallazgos de Wirz y colaboradores y su hipótesis.8,17-19

Esquema de: Wirz, Hargithay y Kuhne.
Figura 7: Regiones del riñón de la rata hidropénica estudiadas con presión osmótica expresada en secciones paralelas de la zona cortico-medular y papila.

Wirz, Hargitay y Kuhne.
Figura 8: Nefrona individual que muestra el aumento progresivo en la presión osmótica de la corteza a la médula interna, esto mismo se observa en el tubo colector.
Considero que los experimentos más sobresalientes que confirmaban sin lugar a dudas las observaciones y la hipótesis de Wirz fueron los realizados en el hámster dorado, en la rata y en la rata canguro del desierto por Carl Gottschalk y Margaret Mylle20 en la Universidad de Carolina del Norte. Es más, en la rata y el hámster dorado estos autores demostraron que en máxima antidiuresis tanto la sangre capilar de los vasa recta como la orina tubular en la vecindad de la punta del asa de Henle tenían la misma presión osmótica, así como la orina de los tubos colectores adyacentes. De hecho también estos resultados fueron presentados por el Dr. Gottschalk en esa misma reunión de Detroit en 1959.
La hipótesis ofrecida por Gottschalk y Mylle20,21 de cómo funciona el mecanismo de contracorriente fue básicamente que la reabsorción de sodio ocurre en la parte gruesa de la rama ascendente del asa de Henle, que además debe ser impermeable al paso del agua, esto explica la hipotonicidad de la primera porción líquido tubular distal16,20,21 con respecto a la sangre. Otra condición necesaria era que el epitelio de la rama delgada descendente del asa debía ser permeable al agua para equilibrarse con el intersticio que es progresivamente más hipertónico a medida que el líquido tubular de la rama descendente viaja a través de un intersticio cada vez más hipertónico. Esto permitiría al líquido tubular concentrarse progresivamente hasta alcanzar el máximo en la punta del asa tal como encontraron los autores en ratas, hámster dorado y ratas del desierto deshidratadas.
Otros estudios realizados años atrás (1947) ya habían descrito la presencia de un gradiente de cloro de la corteza a la médula, en rebanadas de riñón de conejo, donde el contenido de este elemento era máximo en la punta de la papila.22
Jarausch y Ullrich23 en Alemania insertaron microcatéteres a los tubos colectores del riñón del hámster y examinaron la orina en dos niveles de este tubo. Hilger, Klumper y el mismo Ullrich24 confirmaron estos resultados al encontrar que la concentración osmótica de la orina aumentaba a lo largo del túbulo colector. Al mismo tiempo mostraron que la reabsorción de sodio continuaba en el tubo colector. Los autores sugirieron que la rama delgada descendente del asa de Henle era permeable al agua y esto favorecía la hipertonicidad de este segmento al descender por un intersticio progresivamente más hipertónico para alcanzar su máximo en la porción del asa que se doblaba antes de transformarse en la rama ascendente que es impermeable al agua y que transporta sodio activamente hacia el intersticio, particularmente en la porción gruesa de esta rama y determina la formación de orina hipotónica en la primera porción del túbulo distal como en la Figura 9. Para explicar la gran concentración que se alcanza en la punta del asa, la salida de sodio del colector debía ser muy abundante hacia el intersticio. A pesar de eso, para explicar la gran osmolaridad en la papila se encontró su explicación en los trabajos que independientemente publicaron Klumper, Ullrich y Hilger25 así como Levinsky, Davidson y Berliner,26-29 Que mostraron que en los animales hidropénicos, el colector no sólo era permeable al agua sino también a la urea. La concentración de la urea en la parte más profunda de la médula interna era igual a la concentración de urea en la orina. Y cambios en la primera repercutían en la segunda en condiciones tales como: reducción de la filtración glomerular, restricción proteica, diuresis de manitol y de urea.
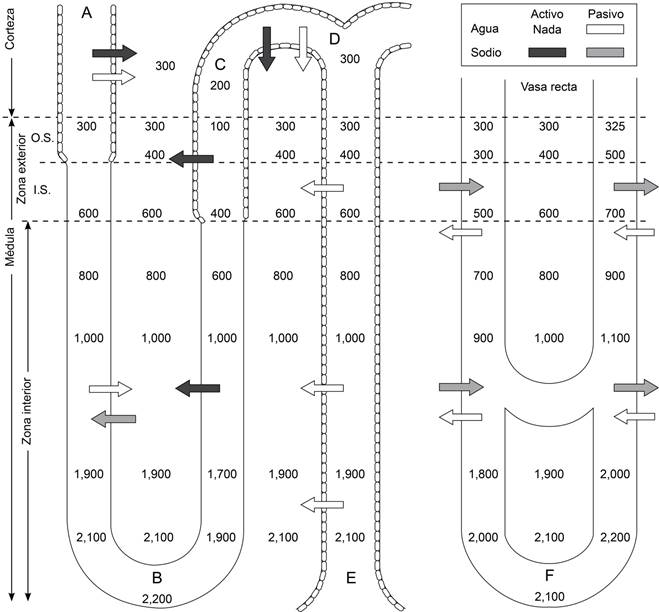
Figura 9: Gottschalk y Mylle conceptuaron el mecanismo de contracorriente del asa de Henle que dependía básicamente de la reabsorción activa de sodio que se extendía desde la parte delgada de la rama ascendente hasta la parte gruesa de la misma y continuaba en el túbulo distal. Toda la rama ascendente (delgada y gruesa) era impermeable al agua asegurando la llegada de orina diluida a la porción inicial de túbulo distal como se ve en el diagrama. La rama descendente delgada permeable al agua y posiblemente también transportaba sodio en forma pasiva hacia el interior de la luz tubular. Esto permitía que la orina que llegaba a la punta del asa fuera altamente hiperosmótica y se equilibraba con la punta de los vasa recta y con el tubo colector que al viajar por un ambiente cada vez más concentrado de la corteza al final de la médula interna alcanzaba la misma concentración que la punta del asa como se ve en la Figura.20
Esta hipótesis de la contracorriente fue atractiva para los investigadores de la época por tres hechos muy atractivos. El primero es que el líquido tubular se concentra a lo largo del asa de Henle, por la existencia de un gradiente osmótico progresivo de corteza a médula. Segundo, la hipótesis elimina el transporte activo de moléculas de agua y toda la operación es mediada por el transporte activo de sodio, proceso que en grado variable ocurre a lo largo de los distintos segmentos de la nefrona. El tercer hecho es que el mismo mecanismo de reabsorción de sodio permite no sólo concentrar la orina sino también diluirla. Para cumplir esta premisa tenemos que echar mano de la acción de hormona antidiurética (HAD). La HAD aumenta la permeablidad al agua del epitelio tubular en el tubo distal y el tubo colector. Desde esa época Sawyer30 y Wirz31 independientemente atribuyeron su acción a la presencia de “poros” en las células tubulares, que facilitaban la difusión del agua, tal como habían demostrado en 1952 Koefoed-Jolnsen y Hans Ussing32 en la piel de la rana.
Como se ha descrito durante la antidiuresis, la orina aparece diluida en el origen del tubo distal,16,20,21 pero por la acción de la HAD se establece un equilibrio osmolar entre la orina y la sangre desde la mitad del tubo distal, a partir del cual la orina permanece isosmótica hasta que ingresa al tubo colector y durante su trayecto se concentra progresivamente. En diuresis acuosa en ausencia de HAD, la orina permanece hipotónica desde que penetra al tubo contorneado distal y se diluye aún más en el trayecto del tubo colector que es impermeable al agua y además le substrae sodio a esta orina ya de por si diluida. En resumen, la interpretación más sencilla de estos datos es suponer que la apertura de poros por acción de la HAD se extiende desde el tubo distal al colector, se reabsorbe agua a lo largo de estas estructuras y se excreta orina concentrada. En ausencia de HAD, toda el agua libre generada por la reabsorción de solutos, primariamente sodio, que ocurre desde la rama ascendente del asa de Henle, continúa en el tubo distal hasta llegar al colector, y este último en ausencia de HAD es impermeable al agua y se encuentra aislado de la hiperosmolaridad de la médula interna; el agua libre generada en estos segmentos de la nefrona emerge del riñón como un copioso volumen de orina diluida.
Hay que admirar a todos estos investigadores que con su destreza, ingenio y trabajo permitieron el desarrollo de esta hipótesis que en la década de los 50 del siglo pasado revolucionó la fisiología renal y ha sido trascendente en el conocimiento del metabolismo del agua y del sodio.
Mi estancia en los EUA a finales de los años 50 y principios de los sesenta me permitió escuchar de primera mano a un gran número de estos investigadores y sus conceptos y dudas sobre este complejo mecanismo que llegó para quedarse, aun cuando todavía no hay una explicación plausible para el aumento de la osmolaridad en la médula interna y en la papila renal, hay varias hipótesis donde la urea, el sodio y otros solutos juegan un papel determinante en la concentración máxima y final de la orina. Se han propuesto tres hipótesis para explicar la hiperosmolaridad de la médula interna y la papila, la de Kokko y Rector,33 la de Stephenson34 y finalmente la de Dantzler WH, Layton AT y colaboradores35 en modelos tridimensionales de la médula interna. A pesar de los estudios tan complejos de estos últimos autores, su modelo matemático sólo explica la hiperosmolaridad de la médula interna en ratas moderadamente antidiuréticas (máxima osmolaridad de 1,200) pero falla al tratar de predecir la osmolaridad obtenida en ratas con máxima deshidratación (osmolaridad de 2,700). Este problema sigue pendiente y debe resolverse en los siguientes años.











 text new page (beta)
text new page (beta)