Introducción
El objetivo de este artículo es observar y valorar la utilidad del manejo por parte de radiología intervencionista para el cirujano en el sangrado de tubo digestivo bajo en pacientes con presencia de angiodisplasias yeyunales que no pudieron ser controlados o diagnosticados por métodos convencionales, y evaluar la tasa de éxito y morbimortalidad intrahospitalaria. El sangrado de tubo digestivo es una importante causa de ingreso hospitalario, 50% de estos ingresos corresponden a sangrado de tubo digestivo alto, 40% a sangrado de tubo digestivo bajo (STDB) y 10% a hemorragias de origen oscuro.1 El sangrado de tubo digestivo bajo se define como aquél que se origina distal al ligamento de Treitz; en más de 95% de los pacientes con STDB se puede encontrar el origen a nivel de colon, la enfermedad diverticular es la causa más común, representando 30% de los casos, sólo en 5% de los pacientes se identificará un sangrado proveniente del intestino delgado y en 3% de los pacientes no se logrará identificar el origen del sangrado.1 La valoración inicial adecuada en estos pacientes nos orienta a posibilidades diagnósticas para el origen del sagrado. El STDB no debe evaluarse de manera superficial, ya que en patologías graves como es el caso de tumores malignos, éste puede ser el único dato clínico, por lo que es importante un interrogatorio adecuado de antecedentes personales y comorbilidades. La exploración física detallada nos puede orientar a patologías específicas como masas abdominales, signos de hepatopatía crónica, telangiectasias en piel, labios y mucosas, lesiones pigmentadas, lesiones purpúricas, acantosis nigricans, etcétera. Es importante la adecuada valoración de las heces para identificar melena y hematoquecia. La hemorragia digestiva de origen indeterminado es aquélla en la cual no se ha identificado un origen certero después de haber realizado una endoscopia alta, colonoscopia y tránsito de bario, puede ser una hemorragia visible en pacientes que presentan melena o hematoquecia, o puede ser una hemorragia oculta en la cual se realiza una prueba positiva a sangre en heces sin datos clínicos sugestivos de hemorragia. En 75% de los pacientes con hemorragia digestiva de origen oculto la causa se encuentra en el intestino delgado.1 Hay distintas causas de hemorragia de origen indeterminado, en pacientes jóvenes se debe sospechar tumor, divertículo de Meckel o enfermedad de Crohn; en pacientes mayores se debe sospechar presencia de angiodisplasias, comunicaciones anómalas entre venas, arterias y capilares tortuosos que se encuentran en la mucosa y submucosa intestinal. Aunque la prevalencia de estas lesiones es menor de 1% reportado en la literatura, y corresponde hasta en 20% a episodios de hemorragia intestinal baja masiva.1
Material y métodos
En la Tabla 1 se observan las características de los pacientes involucrados en este estudio. Los criterios de inclusión fueron pacientes de 16 a 80 años, ambos sexos, con o sin comorbilidades, que acudieron al servicio de urgencias por la presencia de sangrado de tubo digestivo bajo, sin identificación por métodos convencionales del sitio de sagrado y con presencia de angiodisplasias confirmadas por angio TAC de enero de 2015 a enero de 2017.
Tabla 1: Características de los pacientes estudiados.
| 20 pacientes | |
|---|---|
| Características | n (%) |
| Edad (años) | |
| < 60 | 1 (5) |
| 60-69 | 9 (45) |
| 70-79 | 7 (35) |
| > 80 | 3 (15) |
| Género | |
| Masculino | 13 (65) |
| Femenino | 7 (35) |
| Razón de admisión hospitalaria | |
| Melena | 4 (20) |
| Hematoquecia | 16 (80) |
| Comorbilidades | |
| Hipertensión arterial sistémica | 11 (55) |
| Etilismo | 9 (45) |
| Tabaquismo | 15 (75) |
| Artritis reumatoide | 2 (10) |
| Síndrome metabólico | 7 (35) |
| Gastropatía crónica | 5 (25) |
| Enfermedad de Parkinson | 3 (15) |
| Segmento intestinal resecado | |
| Íleon terminal | 2 (10) |
| Yeyuno proximal | 18 (90) |
Se excluyeron pacientes por debajo de 16 años, quienes no contaran con todas las variables a estudiar reportadas en expediente clínico y aquéllos que fueron trasladados.
Las variables de estudio fueron edad, sexo, comorbilidades, tiempo quirúrgico empleado para la resección intestinal posterior a la embolización, longitud del segmento resecado, necesidad de transfusión y requerimiento de estancia en la unidad de terapia intermedia o intensiva.
Los pacientes que cumplieron los criterios de inclusión y fueron elegibles para el análisis estadístico fueron n = 20.
El protocolo utilizado fue el siguiente:
Los pacientes ingresaron por el servicio de urgencias, siguiendo el protocolo se realizó la endoscopia, panendoscopia y colonoscopia; los hallazgos fueron distintos como várices esofágicas, gastritis antropilórica, enfermedad diverticular, gastritis antral, entre otros. Al continuar con datos de sangrado de tubo digestivo bajo se decidió realizar angiotomografía.
Se efectuó angiotomografía con contraste de 330 mmol/mL calculado a 1.5 mL por kg de peso, administrado a un caudal de 4 a 5 mL por segundo, canalizados en pliegue de brazo izquierdo. Se hicieron cortes directos a los 18 segundos de iniciado el medio de contraste con un corte de grosor de 3.75 mm y reconstrucción a 1.25 mm. Se encontraron datos de sangrado de tubo digestivo bajo secundario a presencia de angiodisplasias yeyunales, por lo que se decidió realizar angiografía diagnóstica.
-
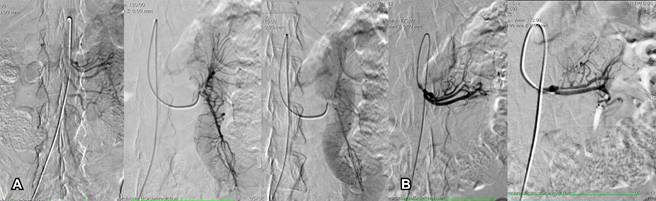
Los pacientes se pasaron a la sala de hemodinamia donde se efectuó angiografía diagnóstica, posterior a punción percutánea con técnica de Seldinger de la arteria femoral común colocando introductor/dilatador. Se introdujo catéter hidrofílico con curva cobra 5 Fr y apoyo con guía hidrofílica hacia la arteria mesentérica superior y se inyectó medio de contraste de manera selectiva corroborándose el diagnóstico de angiodisplasias yeyunales. Después, se realizó cateterización superselectiva con microcatéteres de las arterias yeyunales en la región de las angiodisplasias y una vez asegurada la región afectada se procedió a la embolización con microesferas de 500 micras mezcladas con azul de metileno y medio de contraste hidrosoluble relación uno a uno para lograr valorar la inyección en tiempo real (Figuras 1A y B).
Lo anterior tuvo como finalidad que el cirujano en el tiempo quirúrgico pudiera identificar con facilidad el sitio a resecar. Para considerar una adecuada técnica de embolización se tomó en cuenta el origen de las arterias; su trayecto y su calibre deben ser normales. Se debe tener en cuenta que el calibre de los vasos va disminuyendo de manera distal. Siempre hay que recordar las variantes anatómicas, sobre todo en los orígenes y las posibles anastomosis que se deben diferenciar de colaterales patológicas. La división de los vasos debe ser ordenada, sin interrupciones bruscas de los trayectos vasculares, no debe haber zonas avasculares ni zonas de neoformación. Los trayectos deben ser siempre nítidos. Las fases vasculares deben estar conservadas, sin zonas de retraso, tinción tisular persistente o flujo venoso acelerado focal que produzca duda de fístulas arteriovenosas o malformaciones vasculares. El retorno venoso debe ser simétrico, sin áreas de estancamiento o ausencia del medio de contraste inyectado.
-
Posterior a la embolización los pacientes pasaron a quirófano con cirujano tratante, donde se hizo resección intestinal de acuerdo con cada paciente (Figura 2).
Al finalizar la cirugía todos los pacientes se trasladaron a la unidad de terapia intensiva para monitoreo estrecho con la finalidad de detectar a tiempo signos y síntomas que sugirieran la presencia de isquemia (dolor abdominal, náusea, diarrea, fiebre, datos de irritación peritoneal y de sepsis) (Figura 3).
Resultados
Se estudiaron 20 pacientes en total, en todos ellos la principal razón de admisión fue el sangrado de tubo digestivo bajo; fueron 13 pacientes masculinos y siete pacientes femeninos. Se encontró una media de edad de 73 años, mínimo 58, máximo 89. Todos los pacientes mostraron comorbilidades, dentro de ellas: enfermedad de Parkinson, síndrome metabólico, gastropatía crónica, hipertensión arterial sistémica, artritis reumatoide, etilismo, diabetes mellitus tipo 2, entre otras; predominando la hipertensión arterial sistémica (11 pacientes), etilismo (nueve pacientes) y tabaquismo (15 pacientes) en nuestra población. Los pacientes tuvieron una estancia hospitalaria con una media de 17 días, siendo la mínima 12 días y la máxima 26 días. Todos los pacientes fueron sometidos a resección intestinal posterior a la embolización con un tiempo quirúrgico con media de 85 minutos, y una longitud del segmento intestinal resecado promedio de 60 cm con 100 cm3 de sangrado transoperatorio (Tabla 1).
Los pacientes fueron trasladados a la unidad de terapia intensiva posterior a la resección intestinal para monitoreo estrecho (desequilibrio hidroelectrolítico, datos de isquemia intestinal, reanimación guiada por metas, entre otras complicaciones); dos pacientes requirieron apoyo con aminas durante su estancia en la UCI y ningún paciente necesitó apoyo avanzado de la vía aérea. En los 20 pacientes se obtuvo una media de estancia en la UCI de seis días, con una máxima de 15 días y una mínima de tres días.
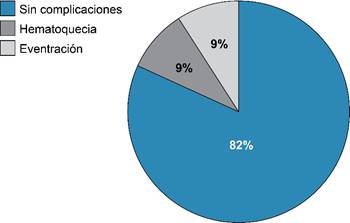
Los pacientes fueron estrechamente monitorizados durante su estancia hospitalaria, de los 20 pacientes cuatro tuvieron complicaciones durante su estancia, las cuales se muestran en la Figura 4, las complicaciones asociadas observadas en nuestra población fueron hematoquecia y eventración. Dos pacientes mostraron hematoquecia, uno de ellos con hematoquecia cuantificada en 200 cm3 junto con delirio hiperactivo, el otro paciente sólo presentó hematoquecia de 250 cm3, los dos pacientes requirieron de hemotransfusión para optimizar parámetros hemodinámicos (tres y dos concentrados eritrocitarios respectivamente). Los otros dos pacientes evidenciaron eventración, la cual requirió laparotomía con plastia de pared y colocación de malla por el equipo de cirugía general.
Cien por ciento de los pacientes sobrevivieron la estancia intrahospitalaria y fueron dados de alta en adecuadas condiciones médicas. No se dio seguimiento a los pacientes posterior a su egreso hospitalario.
Discusión
Se debe tener en cuenta múltiples consideraciones anatómicas como el tronco celíaco y la arteria mesentérica superior, son las dos primeras ramas de la aorta abdominal que originan la gran circulación regional, la que tiene muchas ramas y colaterales que irrigan la parte alta del tubo gastrointestinal. La extensa red de colaterales entre estas dos grandes ramas protegen esta región, lo que permite llevar a cabo procedimientos quirúrgicos y de embolización, con un relativo bajo riesgo de isquemia secundaria. Las arterias mesentéricas superior e inferior forman una serie de arcos que se interconectan y producen una circulación colateral que fluye a través de la porción baja del tubo digestivo. Aunque la descripción clásica de la anatomía vascular mesentérica se puede encontrar en diversas comunicaciones, es importante recordar que las variantes anatómicas son muy comunes.2,3 En el reporte de Nelson y colaboradores4 se menciona que sólo los patrones clásicos de descripción de vasos arteriales correspondientes al tronco celíaco, la mesentérica superior y mesentérica inferior se manifestaron sólo en 22, 24 y 16% respectivamente en los casos estudiados por disección en cadáveres.1 Se deben considerar ciertos puntos clínicos como la velocidad del sangrado y la presencia de enfermedades asociadas que condicionan la presentación clínica del sangrado gastrointestinal. Los pacientes pueden mantenerse asintomáticos hasta que la cantidad de sangre perdida excede 100 mL diarios. La taquicardia y la hipotensión arterial por lo regular aparecen cuando la pérdida aguda de sangre rebasa 500 mL y los datos de colapso vascular típicamente aparecen cuando hay pérdida del 15% o más del volumen sanguíneo circulante.5 En cerca de 75% de los casos de hemorragia superior y 80% de inferior el sangrado se detiene de forma espontánea con las medidas de soporte; en el restante 20 a 25% son necesarias otras intervenciones para detenerla, lo que involucra a cirujanos, gastroendoscopistas y radiólogos intervencionistas.5
Estudios radiológicos como la angiotomografía abdominal se considera el estudio ideal, tomando en cuenta que es preferible que se realice después de un estudio de medicina nuclear con eritrocitos marcados con un resultado positivo para sangrado. No debemos olvidar que este estudio requiere un sangrado con una velocidad de 0.3 mL/min para poder ser visualizado por el médico radiólogo con una sensibilidad de 90% y especificidad de 99%.1 Se debe realizar sin medio de contraste oral yodado debido a que puede pasar inadvertido el sitio de sangrado por la similitud de densidades con el contraste IV. Tampoco debe administrarse contraste oral neutro, ya que puede diluir el contraste IV que se fuga en el sitio de hemorragia. El diagnóstico de sangrado activo por este método se efectúa al identificar una imagen hiperdensa por el contraste extravasado dentro de la luz intestinal. Se puede mostrar como una imagen lineal descrita como una “corriente en chorro” en espiral, elíptica o en depósito localizado o puede llenar por completo la luz del intestino, identificándose muy densa el asa. Se deben hacer cortes simples y contrastados para poder identificar la existencia de cambios en las densidades referidas, ya que si sólo se hace una de las fases, el diagnóstico puede ser no concluyente por falta de comparación. De esta manera, las diferencias medidas en estudio simple y en estudio contrastado de un sitio sospechoso de lesión vascular por arriba de 90 unidades Hounsfield hacen el diagnóstico certero de sangrado activo. Donde existe dificultad para identificar con precisión estos cambios es en hemorragias de poca cantidad o cuando la fuga simula una “corriente en chorro”, pues la densidad puede no cambiar de manera significativa.1 Aunado a esto, se tienen cuatro grandes ventajas de este estudio: la primera ventaja es que para realizarse no necesita preparación intestinal; la segunda es que en caso de no identificar el sitio de sangrado puede detectar patologías abdominales probablemente asociadas como puede ser el caso de diverticulitis, enfermedad inflamatoria, angiodisplasias o pólipos; la tercera es que detecta complicaciones de la patología o dificultades para efectuar el estudio de arteriografía como calcificaciones arteriales, disecciones aórticas, trombosis, injertos o stents previos, y la cuarta es que puede servir de guía anatómica a la arteriografía. La ubicación es prioritaria para la planeación adecuada. Una gran ventaja es que reduce la radiación en la angiografía al tener noción del sitio de sangrado y así se toman menos imágenes durante el procedimiento. Dentro del protocolo del estudio para detectar sangrado gastrointestinal se sugiere seguir los siguientes parámetros importantes:
Realizar siempre una serie de cortes sin uso de ningún tipo de contraste para así poder identificar áreas de hiperdensidades preexistentes y no confundirlas con zonas de hemorragia en el estudio contrastado. Para esto se hacen cortes de 3 mm de grosor con intervalos de 3 mm y tiempo de rotación de 0.5 segundos.
Los cortes con contraste endovenoso deben tener un grosor de 0.9 mm, e intervalos de 0.45 mm, con tiempo de rotación de 0.75 segundos.
Sólo se emplea contraste endovenoso y nunca oral, pues este último podría condicionar dificultad en identificar sitio de sangrado porque las densidades se igualarían.
La cantidad de contraste endovenoso a emplear es de 100 mL a una velocidad de inyección de 4 mL/segundo, con retardo para el inicio de los cortes de 25 segundos, iniciando los cortes a nivel de apófisis xifoides hasta las regiones inguinales.
Evalúe siempre los estudios en todos los cortes axiales antes de efectuar reconstrucciones coronales y sagitales. Éstas se realizarán después de identificar el sitio de hiperdensidad para así localizar el segmento de intestino con hemorragia, siguiendo la distribución anatómica del mismo y para el detalle anatómico del mapeo vascular.
La interpretación rápida de los hallazgos y la comunicación de éstos son esenciales para el manejo óptimo del caso (Figuras 5A y B).7,8

Figura 5: (A y B) Angiotomografía abdominal donde se identifican vasos arteriales dilatados, tortuosos, submucosos en asas de yeyuno proximal, con fuga de contraste a la luz intestinal.
Previo a decidir la embolización, se debe saber que la realización de una arteriografía requiere una velocidad de sangrado de 0.5 mL/min para poder identificarlo con sensibilidad de 90% en tubo digestivo alto y bajo con una especificidad de 86% y sólo un 12% de falsos negativos.1 Esto se ha logrado con la mejora de materiales y catéteres angiográficos. La característica principal de las imágenes por angiografía en las angiodisplasias son vasos tortuosos con llenado lento por ectasia vascular y capilares submucosos dilatados en la fase arterial (Figuras 6A y B). El único dato directo de sangrado es la fuga de material de contraste, mientras que los datos indirectos de sangrado son la visualización de angiodisplasias, aneurismas, malformaciones vasculares, fistulas, neovascularidad y fuga a un espacio confinado (Figuras 7A y B). Con la evolución de la angiotomografía se disminuyó la realización de este estudio por situaciones invasivas; sin embargo, con los últimos avances en la radiología intervencionista dicho estudio está retomando auge, ya que tiene la ventaja de poder aplicar azul de metileno previo al evento quirúrgico, quedando marcado el sitio de sangrado para la cirugía facilitando así la exploración del intestino delgado para los cirujanos. La aplicación de este material no es tóxica, con la única excepción de un déficit de glucosa 6 fosfato deshidrogenasa. La dosis máxima recomendada es de 1 a 2 mg/kg en inyecciones de 0.5 mL (5 mg), la eliminación es por vía renal.9 El éxito es inferior en los grandes vasos y neovascularidad en hemorragias por neoplasias malignas debido a la menor capacidad de constricción en sus paredes en comparación con los capilares.

Figura 6: Arteriografía mesentérica superior que muestra vasos dilatados, ectásicos, con aumento en el número, con fuga del medio de contraste tanto en yeyuno (A) como en ciego (B).
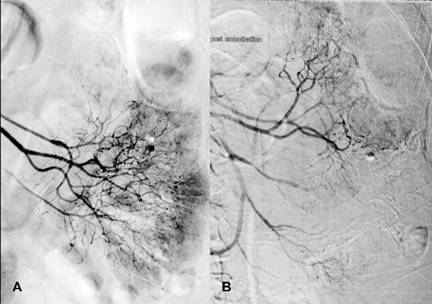
Figura 7: Arteriografía selectiva de arteria yeyunal con técnica coaxial que identifica aumento en la vascularidad con vasos tortuosos dilatados. (A) Fuga de contraste a la luz intestinal. (B) Zona avascular en sitio de embolización previa.
Una técnica que ha tenido un auge creciente en los últimos años es la embolización con diversos materiales como pueden ser fragmentos de gelatina, espirales metálicas en sus diferentes modalidades de tamaño, forma y recubrimientos hidrofílicos, partículas de alcohol polivinílico, coágulos autólogos modificados e isobutil-2-cianoacrilato. Se debe tener en cuenta que en el caso de sangrado de tubo digestivo bajo es necesario aplicar la menor cantidad de embolizante por la escasa cantidad de colaterales, sólo contando con la arcada de Rolando, logrando un éxito de 96% con una tasa de complicaciones de 7.4 a 20%.1 A causa de esto, se extreman las precauciones en el empleo de este procedimiento, el cual siempre se dirige lo más cerca posible al sitio de sangrado mediante cateterismo superselectivo utilizando agentes de oclusión temporal, microcatéteres 2.8 F; se emplean agentes de oclusión permanente sólo para lograr la hemostasia y después se realiza la embolización con agentes temporales.
Se prefiere la embolización con microcoil para tubo digestivo bajo, mientras que existen controversias con respecto a su empleo como agente óptimo en el tubo digestivo alto, siendo el resultado de la combinación de varios agentes embolígenos más efectivo si se compara con el empleo de uno solo.10
La primera descripción del uso de un colorante vital para la identificación preoperatoria de una lesión vascular en intestino delgado se atribuye a Folger y Golemb en 1978.11 Desde ese momento, la utilización de la angiografía ha sido pilar en el tratamiento de las lesiones hemorrágicas del intestino delgado.
La importancia de realizar este procedimiento por parte de radiología intervencionista radica en un rápido diagnóstico con opción de control inmediato del sangrado, lo que hace que las complicaciones quirúrgicas disminuyan, ya que una vez ubicado el sitio del sangrado mediante angio TAC se procede a un rápido acceso al sitio de sangrado en hemodinamia, acortando el tiempo de angiografía y procediendo a la embolización con marcaje de la zona afectada mediante azul de metileno. De esta manera se vigila el sangrado, facilitando el control del desequilibrio metabólico, la reposición de líquidos y en el acto quirúrgico se ubica de forma fácil el sitio de sangrado por el azul de metileno, reduciendo el tiempo de exploración intraoperatoria (importante mencionar que las angiodisplasias no siempre son palpables ni visibles, ya que son submucosas) y tiempos anestésicos con sus respectivas complicaciones.
Entre las principales ventajas que se observan en la angiografía mesentérica y embolización es que no requiere de gran cooperación del paciente, ya que sólo involucra punción a nivel de arteria femoral bajo sedación y control de la respiración durante inyección de medio de contraste y embolización para evitar artefactos de movimiento.
También se puede realizar en pacientes muy inestables, puesto que no necesita preparación, la angiografía puede detectar el sitio de sangrado sin importar si es a nivel de mucosa, submucosa, muscular o serosa, lo que lleva al cirujano a una mejor precisión quirúrgica, ya que la localización macroscópica a simple vista de una MAV en el intestino delgado durante el transoperatorio es prácticamente imposible. La palpación y la transiluminación para localizar una MAV conllevan una certeza diagnóstica muy baja.12 La embolización preoperatoria (EP) es la herramienta esencial que ha tenido gran auge durante los últimos años.
La principal complicación del procedimiento por radiología intervencionista suele ser la isquemia o infarto intestinal causado por émbolos colocados fuera de lugar, reflujo de émbolos por el catéter o embolización excesiva, tomando en cuenta la poca colateralidad vascularidad existente a nivel intestinal, la cual, como tal, ya representa un riesgo.
Situaciones desventajosas:
Sangrado venoso.
Errores al realizar el procedimiento como inyecciones en la arteria equivocada, inyección no selectiva, volúmenes y velocidad de inyección inadecuados y exclusión del sitio de sangrado dentro del campo de visión radiológica.
Control definitivo de la hemorragia previo al procedimiento.
Desaparición temporal de la hemorragia por hipotensión (efecto vasovagal o pérdida excesiva de sangre) o por ser de carácter intermitente.1,13
En casos de procedimientos en territorio de tubo digestivo bajo se debe utilizar la cantidad mínima necesaria para lograr el control del sangrado, esto debido a la circulación colateral insuficiente que se aprecia en esta región.
Dentro del manejo por parte del servicio de cirugía, las técnicas que permiten determinar la causa y la localización de la STDB son la videocápsula endoscópica (VE) y la enteroscopia profunda (EP) en distintas modalidades, siendo la enteroscopia de doble balón (EDB) la que más se utiliza a nivel mundial.4,14 Dentro de los estudios no endoscópicos tenemos el uso de eritrocitos marcados TC-99, la angiotomografía y la angiografía mesentérica, siendo esta última tanto diagnóstica como terapéutica por las razones explicadas de manera previa, ya que se ha observado gran disminución del tiempo quirúrgico.15,16
La razón por la que se ha buscado aumentar el uso de radiología intervencionista en este padecimiento va de acuerdo con el concepto de que la cirugía debe ser la última línea de tratamiento por dificultad diagnóstica en cuanto al origen y al amplio rango de error, lo que ocasiona tiempo quirúrgico, anestésico más prolongado y mayor resección de segmento intestinal resecable.17 La angiografía y embolización con marcaje del sitio de sangrado permiten que el cirujano entre a quirófano con los datos suficientes para la correcta localización de la lesión y mejor control hemodinámico.18,19
Conclusión
Nuestro estudio es reflejo de las ventajas que ofrece la embolización en pacientes con STDB, la sobrevida intrahospitalaria fue de 100%, dentro de la morbilidad relacionada encontramos la hematoquecia y eventración, ambas relacionadas al procedimiento quirúrgico de laparotomía y resección intestinal.
Con la embolización se produce un control más rápido de la hemorragia y se evitan los problemas que implica la permanencia prolongada del catéter intraarterial, como sucedía con el empleo de la vasopresina, así como los efectos colaterales cardiovasculares. Por supuesto, se requiere un grupo radiológico intervencionista capacitado para lograr éxito tanto en el cateterismo superselectivo como en la embolización.
Las condiciones clínicas en las que el paciente ingresa a la sala de operaciones son fundamentales para un resultado postoperatorio favorable, por lo que el rápido diagnóstico y control del sangrado es prioritario para mejorar el estado hemodinámico del paciente. La embolización preoperatoria permite que el paciente pueda ser reanimado de forma inicial e ingresado a quirófano después de corregir acidosis y coagulopatía ocasionadas por el sangrado. Se ha descrito que la morbimortalidad en el manejo quirúrgico de pacientes con sangrado de tubo digestivo sin embolización previa puede ser hasta de 40%. Es el tiempo y la decisión que permiten el éxito.
En nuestro estudio al 100% de la población se le realizó una embolización selectiva y marcaje previo al evento quirúrgico, lo que consideramos fue factor crucial para el 0% de mortalidad reportada.











 text new page (beta)
text new page (beta)