Es de todos sabido que el sobrepeso y la obesidad constituyen una verdadera pandemia; nuestro país es el segundo en el mundo con mayor número de obesos en población adulta y el primero en población infantil.1 Es de origen multifactorial y de un complejo abordaje; el tratamiento es probablemente lo más difícil, ya que implica cambios conductuales, familiares, sociales e idiosincráticos.
La obesidad suele asociarse al llamado síndrome metabólico, el cual es un conjunto de factores de riesgo para el desarrollo de cardiopatía isquémica (CI), diabetes mellitus (DM), enfermedad cerebrovascular (ECV), y más recientemente vinculado a la esteatohepatitis no alcohólica (EHNA).2 Los factores más reconocidos son:
Incremento en la circunferencia abdominal (obesidad visceral).
Hipertrigliceridemia.
Disminución en los niveles de colesterol de alta densidad.
Hipertensión arterial sistémica.
Hiperglucemia.
En la medida que más factores van apareciendo, y con mayor severidad, aumenta de manera exponencial el riesgo de los eventos cardiacos y cerebrales señalados, y se asume que, en el futuro próximo, será la principal causa de cardiopatía, incluso desbancando al tabaquismo.
El síndrome metabólico es cada vez más frecuente, en la medida que hay más obesidad en pacientes cada vez más jóvenes. Si bien el exceso de peso es el factor predominante, el sedentarismo sin actividad física, así como la resistencia a la insulina, también son actores relevantes.
También se han señalado otras condiciones concomitantes: hipercoagulabilidad, respuesta inflamatoria leve y constante, esteatosis hepática, ovarios poliquísticos, colelitiasis y apnea del sueño.
En los Estados Unidos se ha demostrado que la población más susceptible para presentarlo es la de origen mexicano-estadounidense, seguida por los anglosajones y los afroamericanos.3
Las cifras más recientes acerca de la frecuencia de obesidad en México, publicadas por el Observatorio Mexicano de Enfermedades No Transmisibles a través de la Encuesta Nacional de Salud y Nutrición 2016,4 son las siguientes:
Niños de edad escolar: prevalencia combinada sobrepeso/obesidad de 33%.
Adolescentes: prevalencia combinada sobrepeso/obesidad de 36%.
Adultos: prevalencia combinada sobrepeso/obesidad de 72%.
Probablemente el factor detonante para la aparición del síndrome metabólico (SM) sea la obesidad, y como se ha demostrado en la población mexicana, hay también una alarmante prevalencia de diabetes mellitus tipo 2 (DM2). Esta mezcla demográfica aunada a los hábitos occidentales que promueven el sedentarismo y una dieta hipercalórica, hacen que la población de nuestro país sea una de las más afectadas por el síndrome metabólico.
Recientemente se ha hecho énfasis en una patología que aparece como una nueva enfermedad, es la infiltración grasa hepática (esteatosis), la cual ha sido vinculada con una variada lista de causas: ingesta de alcohol, dislipidemias, embarazo, incremento o decremento de peso, quimioterapia, entre muchos otros. Se considera que es la enfermedad hepática más común en el mundo.5-7 En los Estados Unidos se considera que 25% de los adultos tiene esteatosis en ausencia de una ingesta alta de alcohol, entidad que se llama esteatosis hepática no alcohólica (EHNA). Si bien hay discrepancia en términos de una definición formal de cuál es la ingesta de alcohol que podría ser la causante del daño hepático, el Instituto Nacional de Abuso de Alcohol y Alcoholismo (National Institute on Alcohol Abuse and Alcoholism) de los Estados Unidos, propone que en varones más de 21 bebidas alcohólicas y en mujeres más de 14 bebidas en una semana podrían ser el factor etiológico. Una vez excluido este factor, se calcula que 25% desarrollarán una forma mucho más agresiva, llamada esteatohepatitis no alcohólica (EHNA), también conocida como NASH, por sus siglas en inglés (nonalcoholic steatohepatitis). Dicha entidad, como veremos más adelante, se acompaña de cambios celulares y parenquimatosos del hígado que lo llevan a la formación de fibrosis, y eventualmente a la cirrosis.
La esteatohepatitis no alcohólica es una entidad dinámica, cambiante, que puede regresar a únicamente ser esteatosis no alcohólica (ENA), o progresar a cirrosis hepática. La progresión tiende a ser lenta, y algunos estudios señalan que la progresión desde algo incipiente hasta la cirrosis, puede durar 20 años. Desde hace varios años, se acepta la clasificación histopatológica de fibrosis hepática en cuatro etapas: F0 (normal), F1 (fibrosis portal sin septos), F2 (fibrosis portal con septos aislados), F3 (septos uniendo venas centrales y venas portales), y F4 (cirrosis). Se calcula que entre F2 y F4, pasarán aproximadamente dos décadas.8-10
En un estudio reciente que involucró 22 países, se detectaron 8.5 millones de personas que tienen EHNO, en los cuales, más del 80% cursaban con sobrepeso, síndrome metabólico y diabetes mellitus tipo 2, por ello, la relevancia de tomar en cuenta la posibilidad de hepatopatía en los pacientes obesos y con síndrome metabólico. La prevalencia de ENA en Estados Unidos es de 25% en la población adulta, de entre 5 y 6% de EHNO, y cirrosis (y potencialmente a carcinoma hepatocelular). Esta ecuación traducida en número de pacientes, son 55 millones de adultos con ENA, 3 millones con EHNO y 825 mil con cirrosis.11,12
La progresión de la fibrosis en pacientes con EHNA es resultado del intento del cuerpo por crear un efecto reparativo permanente de la arquitectura hepática, y resulta en un proceso de regeneración anormal, que incrementa la fibrosis misma y, por ende, mayor riesgo de transformación a cirrosis y al desarrollo de sus complicaciones; carcinoma hepatocelular e hipertensión portal.13
En los Estados Unidos, estas cifras suponen que la esteatohepatitis no alcohólica será la primera causa para la realización de un trasplante hepático en pocos años, frente a la respuesta a tratamiento nuevo para la hepatitis C.
Frente a esta nueva realidad, resulta entonces primordial el diagnóstico temprano de los pacientes que padezcan el síndrome metabólico, frente a la posibilidad de coexistencia de esteatosis hepática no alcohólica (ENA), así como el seguimiento de la misma, ya que existe un riesgo de que se convierta en EHNA, es decir, que exista un proceso inflamatorio crónico en el hígado.
La patogénesis de la EHNA es una compleja interacción que surge de los precursores de los triglicéridos, que provocan muerte celular, y durante ese proceso hay liberación de citocinas así como de células de la respuesta inflamatoria, lo que perpetúa ese círculo vicioso, que concluye en más fibrosis.
Desde hace algunos años también se han vinculado factores genéticos y ambientales, como la interacción que surge entre el funcionamiento hepático, el sistema inmunológico, el intestino delgado y el tejido adiposo. Se identificó el receptor farnesoide X (FXR), el cual juega un papel relevante en la modulación del metabolismo y la sensibilidad de la insulina a través de la conjugación de los ácidos biliares lipofílicos. También la alteración del eje hepato-intestinal, con el desarreglo de la microbiota intestinal lo que permite la producción de endotoxinas derivadas del intestino con permeabilidad alterada; algunas de ellas son la adipocectina lo mismo que factor alfa de necrosis tumoral.14-16
Desde el punto de vista clínico, esta entidad suele cursar asintomática, aunque algunos pacientes con EHNA han llegado a referir dolor vago hacia el cuadrante superior derecho del abdomen, fatiga y/o plenitud epigástrica. Como hallazgo en la exploración física podría únicamente encontrar hepatomegalia. Cuando el daño es más severo, podemos enfrentar datos claros de una hepatopatía crónica (eritema palmar, ascitis, ictericia, red venosa colateral, esplenomegalia, entre otros). Habitualmente la ENA se descubre con pruebas de función hepática alteradas y/o anormalidades en un ultrasonido abdominal superior; generalmente se identifican elevaciones moderadas de aspartato aminotransferasa (AST) y de alanina aminotransferasa (ALT). En casos de EHNO la elevación es significativa sobre todo de la ALT. Otras enzimas que se alteran son la fosfatasa alcalina (FA) así como la gamma-glutamil transpeptidasa (GGT).
Un porcentaje alto de pacientes con ENA (cerca de la mitad), tiene alteración en las pruebas de función hepática, y en los pacientes con EHNA el 80% tendrá elevación de la ALT. Cuando clínicamente tengamos un paciente con síndrome metabólico y anormalidad en la pruebas de función hepática, estamos obligados a efectuar pruebas más específicas en búsqueda de la EHNA, ya que como se señaló con anterioridad, es una entidad que, puede ser reversible o progresar a estadios más avanzados de la enfermedad.17
Se han diseñado esquemas de identificación (cribaje), en los cuales se incluyen la raza blanca, índice de masa corporal, circunferencia abdominal, pruebas de función hepática (ALT, AST, albúmina sérica), hemoglobina glucosilada, resistencia a la insulina niveles de ferritina, en los cuales la sensibilidad fue baja (56%), pero con una especificidad del 90%, para el diagnóstico de EHNA.
El ultrasonido abdominal (con Doppler) es una herramienta muy útil en la valoración de los pacientes con sospecha de hepatopatía (aguda o crónica), pudiendo valorar dimensiones, ecotextura y patrón ecogénico, así como la presencia de lesiones focales y/o datos concomitantes de hipertensión portal (ascitis, esplenomegalia, circulación colateral, alteraciones en el flujo y calibre de la vena porta, entre otros).
El estándar de oro para el diagnóstico de la fibrosis hepática es la biopsia, procedimiento invasivo que implica la obtención de por lo menos cinco tractos portales, aunque el contar con once es lo ideal; cada biopsia (con aguja de corte) debe por lo menos de tener 2 cm de longitud. Se han diseñado diversos métodos de estadificación, y probablemente el más popularizado sea el METAVIR (desde F0 hasta F4), y aunque inicialmente se desarrolló para hepatitis virales, se ha extendido su empleo. Lamentablemente las biopsias de hígado no están exentas de complicaciones (1.7% hemorragias y 0.1% de muerte); además, es relevante considerar que la fibrosis no afecta de igual manera a todo el parénquima hepático, por lo que los hallazgos en la biopsia pueden no ser representativos de la entidad. Otro punto relevante es la variabilidad intra- e interobservador de los médicos patólogos, aun con los más experimentados (hasta 20% de discordancia en el grado de fibrosis).
Se han diseñado paneles completos de muestras en sangre para conocer la fibrosis hepática, comercialmente en los Estados Unidos los más conocidos son: HepaScore y FibroSure. Se basan en complicados algoritmos que emplean edad, sexo, niveles de bilirrubinas totales, de GGT, de alfa-2 microglobulina, de ácido hialurónico, de apoliproteína A-1, así como ALT y AST. Los resultados son variables y tienen buena correlación con los pacientes que ya cursan con fibrosis avanzada.18
Como se señaló con anterioridad, la imagenología juega un papel relevante, y afortunadamente ya contamos con técnicas no invasivas, entre las que destaca la elastografía por ultrasonido (E-USG).
La elasticidad de un material se define como la tendencia de regresar a su forma y tamaño originales una vez que fueron sometidos a una fuerza deformante; el cambio de forma y/o tamaño se llama tensión; la fuerza que actúa sobre una unidad de área se denomina estrés. La elastografía se refiere a la técnica de imagen que identifica por la imagen misma y cuantifica la elasticidad (propiedades mecánicas) de un tejido. La E-USG valora la rigidez del tejido analizado mediante suposiciones mecánicas del tejido (naturaleza visco-elástica, isotropismo, homogeneidad e incompresibilidad).
Se han diseñado varias técnicas de E-USG: la estática, la casi estática y la dinámica. La casi estática tiene valor para el estudio de órganos superficiales (tiroides, mama, etcétera), y la dinámica, para órganos profundos.
La E-USG se ha desarrollado desde principios de los 90, teniendo dos vertientes: la de ondas de choque (shear wave) y la de tiempo real. Probablemente la más famosa y antigua es el Fibroscan, tecnología francesa que genera un tipo de ondas transitorias y unidimensionales; son lentas y miden la velocidad de propagación. Desafortunadamente no hay imágenes en tiempo real, con serias limitaciones en pacientes obesos y con ascitis. Se considera que los resultados no son confiables en cerca de 20% de los pacientes.
Una de las modalidades más empleadas por los equipos modernos es la ARFI (acoustic radiation force impulse), la cual implica el empleo de ondas de ultrasonido enfocadas, que provocan que el tejido sea desplazado en sentido posterior y la fuerza de recuperación se propaga en sentido lateral, generando una onda de corte (cizallamiento), la cual es medida en metros/segundo. Esta onda de corte se mide mediante un sistema integrado al equipo de ultrasonido.19,20 Los fabricantes Siemens, Hitachi y General Electric la emplean ya comercialmente, con la ventaja de poder tener integrada la imagen en tiempo real. De manera original, la unidad empleada para medir la rigidez del tejido fue el kiloPascal (kPa), unidad de presión del sistema internacional de unidades. Los datos aportados por el Fibroscan así estaban expresados. Contamos ya con Tablas de equivalencia entre kPa y m/s, los cuales se anexan en la Tabla 1, en donde además también se incluye la clasificación de METAVIR.
Tabla 1: Equivalencia entre kPa y m/s.
| METAVIR | ARFI (m/s) | kPa |
|---|---|---|
| F0 (normal) | < 1.30 | |
| F1 (fibrosis leve) | 1.31 a 1.55 | |
| F2 (fibrosis moderada) | 1.56 a 1.70 | 7.1 |
| F3 (fibrosis severa) | 1.71 a 1.85 | 8.7 |
| F4 (cirrosis) | > 1.86 | 10.4 |
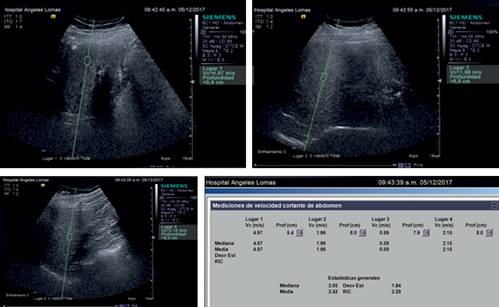
En el Departamento de Imagenología de nuestro Hospital tenemos un equipo de ultrasonido Siemens Acuson S-2000, que cuenta con sistema de E-USG con técnica de ARFI. El protocolo implica la toma de ocho mediciones mediante el ROI (region of interest), cuya profundidad se sitúa entre 2 y 7 cm, y alejado de estructuras vasculares grandes, así como de la vesícula biliar, del ligamento falciforme, de los conductos biliares principales y del diafragma. Una vez logrado, el equipo automáticamente presenta los valores obtenidos, tomando en cuenta la mediana como valor relevante. Resulta muy importante señalar que la capacidad de poder estudiar los cambios por fibrosis mediante elastografía por ultrasonido es 60 veces más grande (en volumen) que los resultados obtenidos mediante una biopsia hepática.
Como cualquier otro método diagnóstico, no está exento de fallas inherentes al procedimiento como a la técnica per se. Dentro de las fallas más comunes (y todas incrementan de manera artificial los valores), destacan:
El efecto del lóbulo izquierdo: generado por la presión de la fuerza de la contracción cardiaca.
El efecto por la profundidad: a más de 7 cm de profundidad el volumen hepático circundante genera mayor presión.
El efecto por cercanía: la vecindad con estructuras vasculares, biliares y anatómicas provoca que las ondas se alteren, dando una medida de la onda de cizallamiento anormalmente alta.
Es también relevante que el personal que efectúa las mediciones tenga experiencia en la realización de estudios de ultrasonido (sean médicos y/o técnicos radiólogos experimentados), ya que no sólo es obtener la Tabla de dichas mediciones (Figura 1), sino también la valoración completa. Dicha valoración ultrasonográfica debe incluir: rastreo en escala de grises del hígado (tamaño, contornos, patrón ecogénico, presencia de lesiones focales), así como la valoración completa de la circulación arterial del hígado, portal y suprahepática, y finalmente, la búsqueda intencionada de datos de hipertensión portal intercurrente (ascitis, esplenomegalia, circulación colateral).21
Tal y como hemos podido enunciar y describir, resulta central la identificación de los pacientes que cursan con enfermedad hepática no alcohólica (sea en su forma leve [esteatosis], o en su vertiente más agresiva [esteatohepatitis]), así como poder contar con una herramienta confiable y no invasiva, la cual puede repetirse con la finalidad de establecer el comportamiento individual de la enfermedad.
Se han propuesto una serie de medidas terapéuticas para combatir particularmente el síndrome metabólico, entre las que destacan la pérdida ponderal, hacer ejercicio con regularidad, la plioglitazona (tiazolidinedionas, las cuales incrementan la sensibilidad a la insulina en tejidos muscular y adiposo), la vitamina E (alfa-tocoferol) como antioxidante, así como nuevos fármacos que están en vías de investigación (tales como el ácido obitecólico, la pentoxifilina, la metformina, entre otros).22-25
La altísima prevalencia de sobrepeso, obesidad y síndrome metabólico en México y en muchos otros países, ponen de manifiesto que muchos de estos pacientes cursan con esteatosis hepática, y que un porcentaje no despreciable (cerca del 5% de la población adulta), podría cursar con esteatohepatitis y eventualmente, acabar con cirrosis hepática. Proponemos como una estrategia de diagnóstico temprano para pacientes con factores de riesgo (sobrepeso, obesidad, síndrome metabólico, dislipidemias), incluir dentro de su valoración integral: historia clínica con exploración completa, exámenes de laboratorio que incluyan lípidos séricos y pruebas de funcionamiento hepático, así como una valoración por ultrasonido con Doppler hepático con elastografía por ultrasonido con la técnica de ARFI (Figuras 1 y 2).

Figura 2: Ejemplo de paciente con esteatosis hepática severa y con elastografía sin fibrosis (mediana de 1.13 m/s; F0 de METAVIR).
Recientemente se publicaron las guías para el diagnóstico y manejo de la hepatopatía secundaria a infiltración grasa por la Asociación Americana para el Estudio de las Enfermedades del Hígado. Esas guías no proponen, en primer nivel de atención para pacientes obesos, diabéticos y/o con síndrome metabólico, hacer a manera de cribaje estudios de imagen, argumentando que no hay evidencia amplia (no hay estudios controlados a largo plazo) y no se ha establecido la relación costo-beneficio (considerando el enorme número de pacientes).26
El problema epidemiológico y el manejo en población pediátrica y adolescente no es diferente al ya señalado, con los mismos criterios integrales.27,28
Considerando que el ultrasonido (con sus modalidades ya ampliamente descritas) es un método inocuo, no radiante y reproducible, y que los pacientes fueron ya seleccionados por sus médicos tratantes, la propuesta de realizar un estudio de E-USG puede identificar a los pacientes que estén cursando con esteatosis únicamente, o bien quienes estén ya desarrollando esteatohepatitis potencialmente con diversos grados de fibrosis.
Es prudente señalar que existe otra modalidad de imagen que también ha servido para valorar el potencial daño hepático, que es la elastografía por resonancia magnética, la cual es muy confiable, pero lamentablemente no popularizada en nuestro medio, además de que involucra costos mucho más altos.29











 text new page (beta)
text new page (beta)