Introducción
Uno de los retos más frecuentes y complejos que enfrenta un pediatra en urgencias es la fiebre en los lactantes menores de tres meses. Son pacientes particularmente vulnerables a infecciones invasivas y por eso es muy común que se les dé tratamientos agresivos, en ocasiones sin justificación. El presente artículo pretende revisar el manejo de la fiebre sin foco evidente en los lactantes menores de tres meses, explorando los protocolos más significativos de los últimos 30 años, así como la mejor evidencia disponible a la fecha para su estudio y tratamiento.
Definiciones
La fiebre se define como temperatura corporal (por medición rectal, oral o axilar) de 38 oC o mayor. Fiebre sin foco evidente es aquélla en la que no se logra identificar la causa después de haber realizado una historia clínica y un examen físico exhaustivo. En los pacientes menores de tres años, sólo el 5% de los casos de fiebre sin foco evidente se asocian a bacteremia, pero más del 50% de los pacientes con bacteremia oculta se presentan con fiebre sin foco evidente.1 Las causas y, por tanto, el abordaje y manejo de la fiebre varían mucho en diferentes edades, siendo muy distintos en neonatos (cero a 30 días), lactantes pequeños (uno a tres meses) y lactantes mayores (tres a 36 meses).2 Aquí nos enfocamos solamente en el grupo de lactantes pequeños.
Lo importante es identificar oportunamente a los pacientes con infección bacteriana seria (IBS) con sospecha en orina, tracto gastrointestinal, hueso, pulmón o sistema nervioso central (SNC) y, en particular, la infección bacteriana invasiva (IBI), cuando se demuestra su presencia en sangre o líquido cefalorraquídeo.3 Los pacientes con estas infecciones pueden sufrir sepsis o choque séptico, en el cual hay datos inequívocos de hipoperfusión central manifestada en SNC y periférica.4
Epidemiología y etiología
La IBS aparece en 8.5 a 17% de los lactantes pequeños con fiebre sin foco y la meningitis hasta en 4%, en particular aquéllos con apariencia tóxica.5 Debe tomarse en cuenta que la incidencia de IBS es mayor en un porcentaje que oscila entre 11 y 25%. La IBS más frecuente es la infección de vías urinarias, por lo que siempre debe buscarse a los lactantes que se presentan con fiebre al Servicio de Urgencias, pues éstos es mucho más probable que tengan IBS que los que llegan a la consulta externa.6
Los virus son por mucho los patógenos más frecuentes en los lactantes pequeños con fiebre, especialmente influenza, enterovirus y virus sincitial respiratorio y llegan a estar presentes en 40% de aquéllos a quienes se les hacen pruebas por reacción en cadena de polimerasa; estos pacientes tienen menos riesgo de padecer IBS.7
Los patógenos bacterianos más comunes que causan IBS son Gram negativos, principalmente Escherichia coli, Salmonella y Klebsiella, seguidos de Streptococcus grupo B (SGB) y con menos frecuencia Streptococcus pneumoniae. Recientemente, se ha incrementado la presencia de Staphylococcus aureus a través de infecciones cutáneas.8
Evaluación clínica
Como en cualquier otro paciente, la realización de una historia clínica completa y una exploración física exhaustiva son la base de una buena evaluación. Sin embargo, se ha visto que tanto factores subjetivos como la preocupación de los padres o el instinto del médico que revisa al paciente, así como datos objetivos como la irritabilidad, hiporreactividad, taquipnea, taquicardia, cianosis o palidez, pero sobre todo las combinaciones de varios de estos datos, deben hacer sospechar infecciones invasivas.9
Desde los años 80 se hizo un índice de severidad en el que se tomaron en cuenta cinco predictores que incluyen esfuerzo respiratorio, coloración de piel, actividad, temperatura y habilidad para jugar; se encontró para el diagnóstico de enfermedades no serias un valor predictivo positivo de 98.7% con un valor predictivo negativo de 1.3%. En contraparte, en la predicción de la enfermedad seria el índice fue correcto en 84.2% de los casos y dio falsos positivos en el 15.8%.10
Posteriormente, se hizo una escala de valoración clínica en estos pacientes, conocida como Yale Observation Scale (YOS) que toma en cuenta seis criterios cada uno con 1, 3 o 5 puntos, pudiendo alcanzar 6 a 30 puntos totales:
Calidad del llanto (1: fuerte o sin llanto, 2: débil, 3: muy débil o agudo).
Reacción a padres (1: se tranquiliza, 2: llanto intermitente, 3: no se tranquiliza).
Estado de alerta (1: se despierta fácil, 2: difícil para despertar, 3: no despierta).
Color (1: rosa, 2: acrocianosis, 3: palidez o cianosis central).
Hidratación (1: mucosas húmedas, 2: boca ligeramente seca, 3: mucosas secas y ojos hundidos).
Respuesta social (1: alerta y sonríe, 2: alerta y breve sonrisa, 3: no sonríe y está ansioso o irritable).
En el estudio original por McCarthy et al. se evaluaron 312 menores de dos años con fiebre, de los cuales, 32 tenían una IBS, y mediante análisis de regresión lineal se establecieron como criterios independientes de valor los ya mencionados. En conjunto, estos seis criterios tienen una sensibilidad de 77% y una especificidad de 88%, con valor predictivo negativo de 97.8%.11
Esta escala ha sido validada con varios estudios posteriores, entre los cuales el más completo fue publicado en 2009, hallando un valor predictivo negativo de 97.8% y un valor predictivo positivo de 52%, con sensibilidad y especificidad de 96 y 65%, respectivamente. Esto último sucede cuando se toma el 8 como puntaje de corte para diferenciar a los graves de los no graves; la sensibilidad va disminuyendo a medida que se aumenta el punto de corte. Esto coincide con los cuatro estudios previos que estudia la misma escala.12
Actualmente, se han sintetizado, en lo que se conoce como triángulo de evaluación pediátrica, tres aspectos: perfusión (palidez, llenado capilar lento), estado de alerta (letargia o irritabilidad y falla para reconocer a los padres) y patrón respiratorio (taquipnea, cianosis o bradipnea) (Figura 1). Este sencillo pero poderoso concepto que se muestra en la Figura 1 se ha vuelto la piedra angular de avanzados cursos pediátricos de soporte de vida y es igualmente válido ante los niños con fiebre.13
Estudios paraclínicos
Los lactantes pequeños con fiebre deben ser evaluados por lo menos con una biometría hemática completa, un examen general de orina (EGO), un urocultivo y un hemocultivo. Algunos protocolos sugieren la toma de líquido cefalorraquídeo (LCR) para detección oportuna de meningitis, pero no es necesario si se cumplen los demás criterios de bajo riesgo. También se sugiere la toma de coprocultivos cuando hay diarrea y la toma de pruebas de reacción en cadena de polimerasa para detección de virus que pondrían al paciente en bajo riesgo también. Los estudios de fase aguda como la proteína C reactiva y la procalcitonina se han incluido en los protocolos más recientes por su alto valor predictivo.14
La proteína C reactiva (PCR) es sintetizada en el hígado y se une a la fosfocolina de las células muertas y algunas bacterias para activar el sistema de complemento.15 La PCR tiene mucho valor para predecir IBS en lactantes y sobre todo es un excelente marcador de seguimiento. Así lo demuestra un estudio prospectivo con 408 niños de siete días a 36 meses con fiebre, a quienes se les midió leucocitos, neutrófilos totales, PCR y procalcitonina y se encontró que los cuatro marcadores son significativamente más altos en pacientes con IBS y valores por debajo de la curva (punto de corte) de 0.82 para procalcitonina, 0.85 para PCR, 0.71 para leucocitos y 0.74 para neutrófilos totales. Sin embargo, sólo la procalcitonina (OR: 1.32; 95% IC: 1.11-1.57; p < 0.001) y la PCR (OR: 1.02; 95% IC: 1.01-1.03; p < 0.001) son predictores significativos de IBS en un modelo de regresión múltiple. El estudio concluye que la procalcitonina es el mejor marcador para el inicio de la infección, pero la PCR es altamente confiable y sensible.16
La procalcitonina es un péptido precursor de la calcitonina producida en las células parafoliculares neuroendocrinas de los pulmones y el intestino. Se ha observado que aumenta en infecciones bacterianas, pero permanece baja en infecciones virales e inflamatorias, con mejor sensibilidad, especificidad y valores predictivos que la proteína C reactiva, la interleucina 6 y el interferón alfa.17
Protocolos de manejo de fiebre
En los últimos 30 años se han hecho esfuerzos por identificar no sólo los factores de alto riesgo, sino sobre todo los de bajo riesgo para IBS en niños con fiebre; el objetivo es reducir mortalidad y morbilidad, pero también evitar tratamientos innecesarios.
En 1985, se llevó a cabo, en el Hospital General de Rochester, un protocolo con 233 lactantes pequeños previamente sanos con fiebre sin foco. Se establecieron cinco criterios de bajo riesgo y se encontró que, de los 144 pacientes que cumplieron con todos los criterios, sólo uno (0.7%) presentó IBS. De los 89 que no cumplieron con al menos un criterio, 22 (25%) tuvieron IBS y 10 (8.9%) tuvieron IBI demostrada con hemocultivo positivo. Los criterios de bajo riesgo, conocidos como Criterios de Rochester fueron:6
buena apariencia;
sin foco infeccioso evidente a la exploración física;
leucocitos 5 a 15 mil y menos de 1,500 bandas totales;
menos de 10 leucocitos por campo en orina;
menos de cinco leucocitos por campo en heces.
En un estudio realizado entre 1984 y 1992 con 1,057 lactantes febriles menores de 60 días, se clasificaron como de bajo riesgo quienes cumplieran los criterios de Rochester arriba mencionados. Se encontró que 437 pacientes cumplieron dichos criterios, de los cuales, cinco tuvieron IBS, incluyendo dos con IBI por bacteremia. Así, se vio un valor predictivo negativo de 98.9% para IBS y 99.5% para bacteremia.18
Los criterios de Filadelfia surgieron a raíz de un estudio que se realizó entre 1987 y 1992 con 747 lactantes entre 27 y 56 días de vida. Se incluyeron pacientes previamente sanos que se presentaron al Philadelphia Children’s Hospital con temperatura rectal de 38.2 oC o mayor. A todos se les realizó una historia clínica y exploración física completa, con lo que se les asignó un puntaje de observación de acuerdo al YOS para evaluar su estado clínico; además, se les realizó una biometría hemática completa con diferencial, radiografía de tórax en dos proyecciones, examen general de orina (EGO), punción lumbar (PL) y cultivos de sangre, orina y líquido cefalorraquídeo (LCR). A los niños con diarrea también se les realizó coprocultivo y citología fecal. De acuerdo al puntaje de observación y los resultados de laboratorio, se distribuyeron los pacientes en dos grupos: A) terapéutico: pacientes con cualquier alteración de laboratorio o puntaje mayor a 10 en el YOS se consideraron de alto riesgo y se les dio manejo con antibiótico intrahospitalario y; B) observación: aquéllos con puntaje del YOS de 10 o menor, con análisis de laboratorio normales y sin evidencia de infección en la exploración física, se consideraron negativos. A los pacientes en observación se les asignó aleatoriamente a observación ambulatoria o intrahospitalaria. Se asignaron al grupo terapéutico 460 pacientes (61.6%), 139 (18.6%) a observación ambulatoria y 148 (19.8%) a observación intrahospitalaria. Dos de los pacientes de observación ambulatoria (1.4%) tuvieron que ser hospitalizado en las siguientes 48 horas y un paciente de observación intrahospitalaria (0.6%) tuvo que iniciar antibióticos. De los 480 pacientes del grupo terapéutico ,64 tuvieron IBS demostrada, mientras que del grupo de observación sólo uno tuvo IBS. De manera que, usando los criterios de Filadelfia, el valor predictivo positivo es de 14% con especificidad de 42%, pero el valor predictivo negativo es de 99.7% con sensibilidad de 98%.19
Los criterios de Filadelfia que se aplicaron fueron:
Buena apariencia general de acuerdo a la escala de observación de Yale con 10 puntos o menos;
biometría hemática con menos de 15 mil leucocitos por mm3;
relación banda-neutrófilo menor a 0.2;
examen general de orina con menos de 10 leucocitos por campo;
LCR con menos de ocho leucocitos por campo y Gram sin hallazgo;
radiografía de tórax normal;
coprológico sin sangre y con menos de cinco leucocitos por campo.
En 1992, se llevó a cabo un protocolo prospectivo de cohorte en el Boston Children’s Hospital, donde se identificaron pacientes de 28 a 89 días de vida que cumplieran con los siguientes criterios: no haber tomado antibióticos ni recibido vacunas en las 48 horas previas, fiebre sin foco clínicamente evidente y padres confiables. A todos se les tomó tele de tórax, biometría hemática, urianálisis y punción lumbar, así como cultivos de orina, sangre y LCR. Aquéllos que cumplieron criterios de bajo riesgo establecido se les aplicó ceftriaxona 50 mg/kg/dosis y se les envió a su casa para seguimiento telefónico a las 12 horas y presencial a las 24 horas con otro seguimiento telefónico a los dos y siete días. Aquéllos con crecimiento bacteriano en cualquier cultivo se les consideró con IBS y se compararon los grupos con IBS y sin IBS, siendo 27 y 476 pacientes, respectivamente. La temperatura, el porcentaje de bandas en la BH y las bandas absolutas fueron significativamente mayores en los pacientes con IBS. De los pacientes sin IBS, sólo 23 (4.7%) fueron admitidos al hospital durante el seguimiento; aquéllos con IBS documentada respondieron bien al inicio del tratamiento. El estudio concluye que el tratamiento inicial con ceftriaxona ambulatoria en lactantes menores de bajo riesgo es exitoso aun cuando exista IBS. Los criterios de Boston de bajo riesgo fueron:20
signos vitales normales, bien hidratado, sin apariencia tóxica (de acuerdo al YOS);
tele de tórax normal;
biometría con menos de 20 mil leucocitos;
urianálisis con menos de 10 leucocitos por campo sin esterasa;
LCR con menos de 10 leucocitos por campo.
Basada en la revisión de 85 artículos, la revista Pediatrics publicó, en 1993, una guía para el manejo de fiebre en pacientes de cero a 36 meses. En el caso de bebés menores de tres meses, se hace una revisión de los criterios de bajo riesgo mencionados en las líneas anteriores y se enfatiza en dos aspectos importantes: el primero es que la apariencia tóxica de un paciente debe siempre alertar sobre la necesidad de hospitalización, aunque sea para observación. Su presencia se relaciona con riesgo de IBS de 17%, 11% de bacteremia y 4% de meningitis. La segunda es que cualquier paciente que cumple criterios de bajo riesgo y que tiene padres confiables con los que se puede asegurar un seguimiento cercano pueden ser tratados ambulatoriamente, previos cultivos de sangre y orina, así como EGO, tal y como lo propone el estudio de Boston. También se acepta que un niño con criterios de bajo riesgo sin foco evidente puede tratarse de manera ambulatoria sin antibiótico; de cualquier forma, se recomienda una reevaluación en las siguientes 24 horas. Los autores de este artículo proponen un algoritmo práctico, que se ilustra en la Figura 2.21
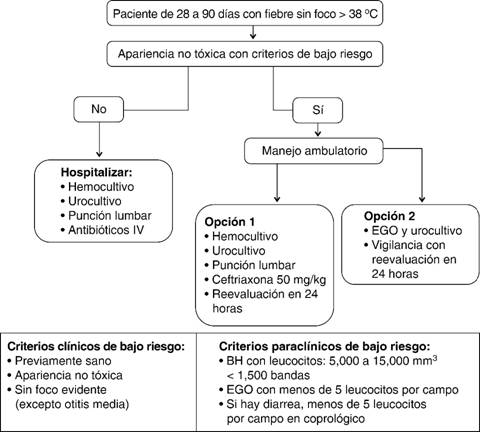
Figura 2: Algoritmo para el manejo de pacientes de 28 a 90 días con fiebre sin foco evidente propuesto por Larry J . Baraff y cols. en 1993.
En 2001, se realizó, en el Boston Children’s Hospital, un modelo de predicción de IBS en lactantes menores y neonatos sin foco evidente. En una análisis retrospectivo de Servicios de Urgencias urbanos entre 1993 y 1999, se identificó a 5,279 pacientes con fiebre sin foco y se les dividió en aquéllos con y sin IBS, de acuerdo a los cultivos de orina, sangre y LCR. Mediante un análisis de regresión múltiple se hizo un árbol de decisión para identificar a los pacientes de alto riesgo. Los predictores potenciales fueron la edad, la temperatura, el EGO y la cuenta de leucocitos (Figura 3). Se encontró IBS en 373 (7%), de los cuales, 316 (84%) tuvieron infección de vías urinarias (IVU), 17 (4%) meningitis y 59 (16%) bacteremia (ocho con meningitis y 11 con IVU). En este modelo, el EGO fue el mejor discriminador de IBS con una sensibilidad de 71% y una especificidad de 81%. La sensibilidad del modelo para identificar IBS fue de 82% con valor predictivo negativo de 98.3% y con especificidad de 76% con valor predictivo positivo de 21%. Si bien puede ser útil para uso empírico de antibióticos, este modelo está limitado por ser retrospectivo y por no tomar en cuenta el aspecto del paciente.22

Figura 3: Árbol de decisión para identificar pacientes de bajo riesgo propuesto por Bachur y Harper en 2001.
En 2008, se desarrolló una herramienta conocida como índice Lab-Score para identificar pacientes con IBS. Se realizó un análisis prospectivo de dos cohortes diferentes en la Universidad de Ginebra con niños de siete a 36 meses; a todos se les mantuvo en observación 48 horas y se les tomaron cultivos, biometría, procalcitonina, proteína C reactiva y urianálisis. A través de un análisis de regresión se encontró que sólo la procalcitonina, la proteína C reactiva y la tira reactiva urinaria tenían valor independiente, por lo que se hizo un puntaje usando solamente procalcitonina (0.2 y 4 puntos), proteína C reactiva (0.2 y 4 puntos) y tira reactiva urinaria para esterasa leucocitaria (0 y 1 punto). Se estudiaron 202 niños, de los cuales 54 (27%) tuvieron IBS y en el análisis multivariado se encontró que el índice Lab-Score tiene una sensibilidad de 94% y especificidad de 78% cuando el índice es igual o mayor a 3.23
En 2014, un grupo de urgencias pediátricas desarrolló un nuevo algoritmo para la atención de pacientes menores de tres meses con fiebre sin foco y la identificación de criterios de bajo riesgo. Este abordaje, conocido como Step by Step evalúa secuencialmente:
la apariencia general del niño (a través del triángulo de evaluación pediátrica);
la edad;
examen general de orina;
biomarcadores específicos (proteína C reactiva, procalcitonina y cuenta total de neutrófilos).
Este abordaje se validó retrospectivamente en 1,123 pacientes al comparar la eficacia para identificar IBS con los criterios de Step by Step, Lab-Score y Rochester en siete departamentos de urgencias europeos. Se encontró prevalencia de IBS en 0.2% de los pacientes evaluados con Step by Step, 0.7% en los evaluados con Lab-Score y 1.1% en los de criterios de Rochester, demostrando mejor identificación de pacientes de bajo riesgo con Step by Step.24 Posteriormente, se realizó un estudio prospectivo en un hospital multicéntrico europeo (ocho en España, dos en Italia y uno en Suiza) involucrando a 2,185 pacientes y encontrando 87 pacientes con IBI y donde se evaluó la efectividad tanto del sistema Step by Step en comparación con los criterios de Rochester y el índice Lab-Score, hallando una sensibilidad y un valor predictivo negativo de 92 y 99.3% para Step by Step, respectivamente, comparado con 81.6 y 98.3% para criterios de Rochester y 59.8 y 98.1% del índice Lab-Score.25
En mayo de 2015, Elena Martínez y colaboradores de la Universidad del País Vasco y el hospital Universitario de Barakaldo, España, realizaron un estudio observacional prospectivo con 2,362 lactantes menores con fiebre sin foco para determinar la incidencia real de meningitis bacteriana, su etiología y la relación de signos clínicos y paraclínicos con este padecimiento. Así, se les realizó punción lumbar (PL) a todo aquel paciente menor de 90 días con fiebre sin foco que tuviera mala apariencia o signos clínicos sugestivos de meningitis, menos de 21 días de edad, biometría con menos de 5,000 o más de 15,000 leucocitos por mL, neutrófilos totales mayores a 10,000 por mL, proteína C reactiva mayor de 20 mg/mL, procalcitonina mayor a 0.5 ng/mL. Se tomó PL a 639 pacientes; de los cuales, 603 fueron adecuadas. Se diagnosticó meningitis bacteriana a 11 pacientes. Sólo 87 se catalogaron como de mala apariencia y de ellos, cinco (5.7%) tuvieron meningitis, mientras que, de los 2,275 pacientes de buena apariencia, seis (0.26%) tuvieron meningitis. Dos de los 11 pacientes tenían más de 21 días de edad, pero ambos mostraban mala apariencia al ingreso. Este estudio concluye tajantemente que no es necesario realizar PL de manera sistemática en pacientes no neonatales; en éstos, sobre todo la apariencia al ingreso, basados en el triángulo de evaluación pediátrica (TEP) que es fácil de aprender, debe tomarse en cuenta para realizar PL, incluso por encima de los resultados de biometría hemática y PCR y PCT.26
Un estudio retrospectivo realizado en España para predecir IBS en menores de tres meses con fiebre con marcadores séricos determinó que la procalcitonina (PCT), la proteína C reactiva (PCR) y la cuenta de neutrófilos tienen un valor predictivo intrínseco, pero, cuando la fiebre dura menor de 12 horas, la PCT es significativamente superior a los otros marcadores.27 Posteriormente, un estudio prospectivo en Francia demostró que la PCT es igual de efectiva que la PCR para detección de IBS, pero tiene mejor sensibilidad para detección de IBI, incluyendo IVU.28 Este estudio, así como un metaanálisis realizado en Inglaterra que involucró siete estudios y 2,317 pacientes, demuestra que la PCT es el mejor marcador, en especial cuando se usan como punto de corte los 0.3 ng/mL, de manera que los pacientes con PCT debajo de este nivel se pueden considerar de bajo riesgo.29
Conclusiones
La fiebre en pacientes de uno a tres meses sin foco evidente es un problema que debe abordarse de manera inmediata, pues hay un importante riesgo de infección bacteriana invasiva, que puede derivar en sepsis e incluso acarrear la muerte, de no atenderse con prontitud. Sin embargo, más del 80% no tiene infección invasiva y por tanto no amerita hospitalización, ya que la mayoría de las infecciones son virales. Desde los años 80 se han realizado diversos protocolos para identificar a pacientes de bajo riesgo y evitar el sobretratamiento. Se puede concluir que los tres criterios para considerar a un paciente de bajo riesgo son: a) que clínicamente no tenga “apariencia tóxica” de acuerdo al triángulo de evaluación pediátrica o en la escala de observación de Yale; b) que tenga un examen general de orina normal, ya que la infección de vías urinarias representa la entidad invasiva más frecuente; c) que presente biomarcadores específicos (neutrófilos totales, proteína C reactiva y procalcitonina) normales. Cualquier paciente que no cumple al menos uno de estos tres aspectos debe recibir vigilancia hospitalaria.











 text new page (beta)
text new page (beta)



