Introducción
La leucemia mieloide crónica (LMC) es una neoplasia mieloproliferativa maligna que se asocia con la presencia del cromosoma Filadelfia (Ph+), el cual es una anormalidad citogenética que ocurre por la traslocación recíproca de los brazos largos de los cromosomas 9 y 22 (El gen Abelson en el cromosoma 9q34 con la región BCR del cromosoma 22q11.2), lo que produce el gen BCR/ABL, que origina una tirosina cinasa, proteína anormal, fundamental en el desarrollo de la LMC.1-4
La enfermedad representa entre el 15 y 20% de las leucemias en adultos en los Estados Unidos,5,6 con una incidencia anual de 1-2 casos por cada 100,000 habitantes.4,5,7
La LMC tiene un curso clínico trifásico: fase crónica (FC), fase acelerada (FA) y crisis blástica.8,9 Aproximadamente el 85-90% de los pacientes se diagnostica en FC, y sin tratamiento tiene progresión a FA o crisis blástica después de tres a cinco años. En la era pre-inhibidores de tirocina cinasa (TKI), la proporción de progresión fue del 20% y ahora es de 1 a 5% al año2,8,10 y sólo un 10-15% de los pacientes se diagnostica en FA o en crisis blástica.2
La FA de la LMC se caracteriza por un incremento de la agresividad de la enfermedad y resistencia al tratamiento. Existe un aumento de la proliferación celular con mayor proporción de blastos, basófilos, promielocitos, trombocitopenia o trombocitosis, anemia, esplenomegalia y presencia de otras anormalidades cromosómicas, lo cual se asocia a peor pronóstico y menor supervivencia.11
El tratamiento estándar antes del año 2000 fue con interferón alfa y citarabina,12 hasta que el estudio IRIS (International Randomized Study of Interferon and STI571)13 demostró que con el uso de mesilato de imatinib (MI) se logra un mayor número de pacientes con respuesta citogenética, en comparación con el uso de interferón y citarabina, por lo que en el 2001 la Food and Drug Administration (FDA) autorizó su uso como tratamiento de primera línea para LMC y así ha sido durante los últimos años.14-18
El MI es un inhibidor selectivo de tirosina cinasa (TKI); asimismo, inhibe la proliferación e induce apoptosis de las células BCR/ABL (+).19,20 Las metas del tratamiento de la LMC se definen con base en la respuesta hematológica completa (RHC), la respuesta citogenética mayor (RCgC) y la respuesta molecular mayor (RMM).21,22 Alcanzar las metas del tratamiento se asocia con incremento de la supervivencia (cura funcional) y los pacientes con mayor beneficio de la terapia con TKI son aquéllos que alcanzan y mantienen la RCgC por al menos dos años.20,23
La información de la supervivencia de los pacientes con LMC en tratamiento con MI demuestra que los pacientes en FC tienen respuesta favorable con una RHC en el 95% y RMM en el 60%, y mantienen la RCgC hasta siete años. La supervivencia de los pacientes con FA en tratamiento con MI se comparó con la terapia con interferón alfa y se encontró que la supervivencia era mayor; aun así, la respuesta del MI es menor, del 20-40%, a los cuatro años y una RHC de 82%.19,24-27 Actualmente, las opciones de tratamiento con los TKI varían. En nuestras instituciones, el MI es la primera línea disponible y la información sobre el beneficio de los pacientes en FA en comparación con FC a largo plazo es escasa.
Material y métodos
Se llevó a cabo un estudio clínico comparativo y retrospectivo de los datos de pacientes con LCM Ph+ en los últimos 10 años en dos instituciones de referencia y se dividieron en dos grupos: el grupo de FC y el grupo de FA. Se clasificó a los pacientes en FA de acuerdo a los criterios de la OMS (blastos en sangre periférica o médula ósea de 10 al 19%, basófilos en sangre periférica de 20% o más, plaquetas < 100,000/μL, evolución clonal citogenética durante el tratamiento, esplenomegalia progresiva y aumento de leucocitos que no responden al tratamiento).26
Los pacientes en FC recibieron MI 400 mg vía oral por día y los pacientes en FA recibieron MI 600 mg vía oral al día. Los criterios de respuesta que se utilizaron fueron la RHC, la cual se definió por una biometría hemática y exploración física normal;22,26 la respuesta citogenética se documentó mediante el método de hibridación in situ con fluorescencia (FISH) con un conteo mínimo de 200 núcleos demostrando < 1% de los núcleos BCR/ABL positivos.28 La remisión molecular mayor (RMM) se determinó en sangre periférica con la reacción de la polimerasa de transcripción reversa (RT/PCR) en el laboratorio de referencia del Instituto Nacional de Cancerología (pacientes de la Ciudad de México) con capacidad de expresar los resultados de acuerdo a la escala internacional.29
Los criterios de respuesta óptima se analizaron a los tres, seis, 12 meses y después en cualquier momento después del año. A los tres meses se buscó un BCR/ABL igual o menor a 10% o Ph+ igual o menor a 35%, a los seis meses BCR/ABL ≤ 1% o Ph+ de 0% y a los 12 meses o en cualquier momento después del año BCR/ABL igual o menor a 0.1% (Tabla 1).21,22
Tabla 1: Definición de respuesta óptima a TKI como tratamiento de primera línea en leucemia mieloide crónica Ph+.
| Tiempo | Respuesta óptima |
|---|---|
| 3 meses | BCR/ABL ≤ 10% y/o Ph+ ≤ 35% |
| 6 meses | BCR/ABL ≤ 1% y/o Ph+ 0% |
| 12 meses | BCR/ABL ≤ 0.1% |
| En cualquier momento después del año | BCR/ABL ≤ 0.1% |
Con el uso de una base de datos se capturó la información y el análisis estadístico se llevó a cabo en el programa SPSS Statistics 22.0 Software (IBM, Armonk, NY). Los datos demográficos y no paramétricos se expresaron con medianas. La supervivencia global y la supervivencia libre de enfermedad se calcularon con el método de Kaplan-Meier, (Log-Rank Mantel Cox).30
Resultados
En un periodo de 10 años se analizaron los datos de 75 pacientes: 40 (53.3%) en FC y 35 (46.7%) en FA. En el grupo de FC, la mediana de edad fue de 43 años (rango de 19 a 70 años), el 62.5% (n = 25) fueron hombres y el 37.5% (n = 15) mujeres. En el grupo de FA, la mediana de edad fue de 40 años (rango 20-70 años), el 54.2% (n = 19) fueron hombres y el 45.8% (n = 16) mujeres (Tabla 2).
Tabla 2: Datos demográficos.
| Fase crónica | Fase acelerada | |
|---|---|---|
| n = | 40 (53.3%) | 35 (46.7%) |
| Mediana de edad (años) | 43 (19-70) | 40 (20-70) |
| Género | Hombres: 62.5% (n = 25) Mujeres: 37.5% (n = 15) |
Hombres: 54.2% (n = 19) Mujeres: 45.8% (n = 16) |
La mediana de tiempo para lograr la RHC fue de un mes (rango 1-4 meses) en la FC y de tres meses (rango 1-13) en la FA. La RCgC se logró en ocho meses (1-57 meses) en la FC y 12 meses (4-72 meses) en 15 pacientes (42.9%) de FA y en 20 casos (57.1%) no se logró. La RMM se alcanzó en el 82.5% (n = 33) de los pacientes en el grupo de FC y en el 14.2% (n = 5) de los pacientes en el grupo de FA.
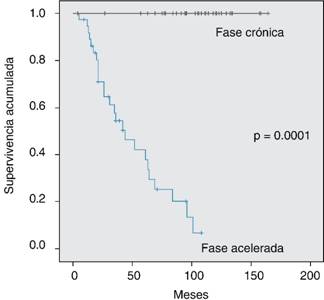
La duración de la RCgC en la FC fue de 73 meses (rango 8-149 meses) en el 100% de los pacientes y en la FA de 30 meses (6-100 meses) en los 15 pacientes que la alcanzaron (42.9%). Después de un seguimiento de 120 meses, la mediana de supervivencia global fue de 70 meses en la FA y de 150 meses en la FC (p < 0.001) Kaplan-Meier Log Rank Mantle Cox (Figura 1). La mediana de supervivencia libre de enfermedad en la FC fue de 73 meses (8-149 meses) y de 30 meses (5-108) en los 15 pacientes en FA (Tabla 3 y Figura 2).
Tabla 3: Resultados.
| Fase crónica | Fase acelerada | |
|---|---|---|
| Tiempo para RHC (meses) | 1 | 3 |
| Tiempo para RCgC (meses) | 8 | 12 |
| RMM (n) | 33 | 5 |
| Supervivencia libre de enfermedad (meses) | 73 (p < 0.001) | 30 |
| Supervivencia global (meses) | 150 (p < 0.001) | 70 |
Discusión
En el año 2002, Talpaz y cols. reportaron que la dosis óptima de MI era de 600 mg para la FA en un seguimiento de 18 meses, y se estableció como la terapia estándar;27 ese mismo año, Kantarjian y cols. realizaron un estudio en donde se evaluó la supervivencia y respuesta al MI en estos pacientes y encontraron que el 80% alcanzó una RHC. En cuanto a la RCgC, se logró sólo en el 45%, lo cual fue similar a nuestro estudio, donde encontramos que el 42.9% obtuvo RCgC; asimismo, el tiempo en alcanzar la RHC y la RCgC fue de 1 y 8.5 meses, lo cual difiere de nuestro reporte, ya que nuestro grupo de pacientes alcanzó la RHC en tres meses y la RCgC en 12.19
En el 2012, Kantarjian y cols. reportaron que la supervivencia estimada a ocho años en la fase acelerada fue del 75%; sin embargo, los pacientes de mayor edad tuvieron una supervivencia más corta.31 En el 2014, Ohanian M y cols. reportaron en un estudio de 51 pacientes en FA con seguimiento de 65 meses que la tasa de RHC fue del 96% en un periodo de un mes y una RCgC de 80% con MI, la cual se logró en tres meses y del 90% con TKI de segunda generación. La RMM con imatinib fue del 63%, lo cual difiere de nuestro grupo de estudio, ya que la RMM sólo se alcanzó en el 14.5%. La supervivencia global en el estudio de Ohanian et al. fue del 87% a los 36 meses.4 Thota y cols., por otro lado, reportaron un tiempo para lograr la RHC de tres meses, lo cual es similar a nuestro estudio; asimismo, la RCgC a los seis meses fue del 59%. La supervivencia global fue de 61 meses con MI,32 lo cual también es similar a nuestros resultados en que ocurrió a los 70 meses. En estos estudios los pacientes en FA se compararon con pacientes en crisis blástica y se encontró que la respuesta de los primeros fue mejor; sin embargo, en nuestro estudio, la comparación fue con pacientes en FC.
Conclusiones
Los pacientes en FA tienen menor respuesta con MI, en comparación con los pacientes en FC. El beneficio del MI en FA sólo se observó en el 42.9% de los pacientes con una mediana de supervivencia de 70 meses. El resto de los pacientes tuvo una evolución fatal, en comparación con la respuesta en la FC al imatinib con una supervivencia de 150 meses y una clara diferencia estadística. Los resultados de nuestro estudio nos sugieren la necesidad de hacer un cambio en el tratamiento inicial de los pacientes en FA, al menos en nuestras instituciones.











 nueva página del texto (beta)
nueva página del texto (beta)