http://zoobank.org/urn:lsid:zoobank.org:pub:645ABE8D-275A-437E-BB5C-C765277F6B66
Introducción
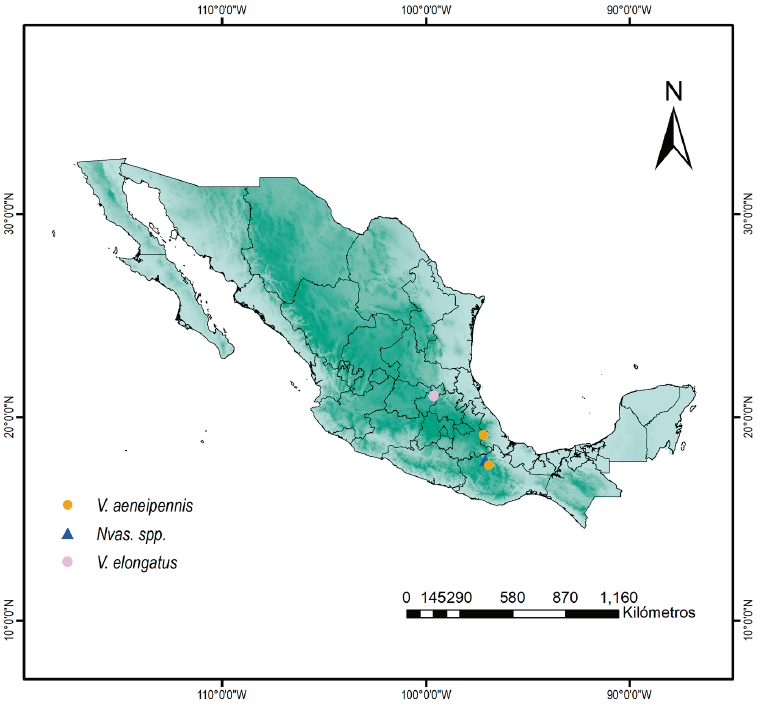
El género Vasaces fue descrito por Champion (1889) con 3 especies: V. aeneipennisChampion, 1890, V. costatusChampion, 1890 y V. sordidusChampion, 1890. Posteriormente, Arnett (1953) describió 4 nuevas especies basado en material recopilado del sur de los EUA. Vasaces se caracteriza por tener el segmento apical de los palpos maxilares triangular o cultriforme, ápice de las mandíbulas bífido, segundo segmento antenal casi tan largo como el tercero, cuerpo no aplanado dorsoventralmente y la mayoría de las especies presentan dorsalmente brillo metálico (Arnett, 1953, 1961). Por otra parte, los genitales de Vasaces se caracterizan por un lóbulo medio corto, con la base más ancha, sin apodemas basales, y el tegmen con los parámeros estrechos hacia el ápice, posteriormente emarginado y sin apodemas basales. Las especies son morfológicamente similares, los caracteres utilizados para separarlas son los utilizados en las descripciones originales y principalmente se basan en la forma del palpo maxilar y la coloración de los élitros y el pronoto (Arnett, 1953, 1961; Champion, 1889). El género se distribuye desde el suroeste de los EUA hasta Guatemala (Arnett, 1953, 1983; Domínguez-León y Zaragoza-Caballero, 2021); en México, solo se ha registrado en Puebla (Domínguez-León y Zaragoza-Caballero, 2021).
El último tratamiento sistemático del género lo realizó Arnett (1953), en el cual describió 4 nuevas especies para el sur de los EUA. Asimismo, relacionó a Vasaces con HeliocisArnett, 1951y SisenesChampion, 1889. Vasaces presenta los ojos ligeramente emarginados que lo distinguen de Heliocis, mientras que el tamaño de los palpos maxilares, los segmentos antenales no aplanados y los colores en su mayoría obscuros y metálicos que éstos presentan lo separan de Sisenes (Arnett, 1953).
En este trabajo, se describen e ilustran 3 nuevas especies de Vasaces, se presentan 2 nuevos registros y se incluye una clave para las especies del género.
Materiales y métodos
La determinación a nivel de género se realizó mediante la clave de Arnett (1961). Los nuevos registros se reconocieron a partir de la clave de Arnett (1953) y las nuevas especies mediante la revisión de las descripciones originales (Arnett, 1953; Champion, 1889) y el estudio morfológico de ejemplares que se encuentran depositados en la Colección Nacional de Insectos (CNIN). Para la revisión de los ejemplares, la separación del edeago de los machos y la toma de medidas de los genitales y esternitos VII-IX se utilizó un microscopio estereoscopio Carl ZeissTM Discovery V8; las medidas se expresan en mm. Todos los ejemplares se depositaron en la Colección Nacional de Insectos (CNIN) del Instituto de Biología, UNAM.
Para la observación de los terminalia, el abdomen de los especímenes fue extraído y puesto en una solución de KOH 10% durante 8 horas para ablandar el tejido. Posteriormente, fue colocado en una solución de alcohol al 70% durante 10 minutos, para proceder a disectar los genitales, esternitos y tergitos VII-IX. Al finalizar las observaciones las estructuras se conservaron en microviales con glicerina.
La terminología utilizada en la descripción de los caracteres morfológicos se basa en Arnett (1949, 1951, 1953), Švihla (1986), Vázquez (1993) y Lawrence (2005). La terminología para la venación del ala se basa en Kukalová-Peck y Lawrence (1993, 2004).
La información del resumen taxonómico se estandarizó mostrando primero el estado donde se registra la especie, la localidad y posteriormente la fecha; la información restante se presenta de acuerdo con la etiqueta. Para separar información de distintas etiquetas se utilizó "|". Las fotografías se tomaron con un microscopio Zeiss Axio Zoom V16 equipado con una cámara Axiocam MRC5.
Resultados
Los ejemplares revisados pertenecen al género Vasaces, de los cuales se identificaron 5 especies.
VasacesChampion, 1889
Cuerpo elongado, con lados casi paralelos, no aplanado dorsoventralmente. Cabeza corta o elongada, con los ojos ligeramente emarginados. Antenas largas, con 11 antenómeros, segundo casi tan largo como el tercero, fosetas antenales separadas del margen anterior de los ojos. Ápice de mandíbulas bífido. Segmento apical de los palpos maxilares en forma triangular o cultriforme. Pronoto ligeramente más largo que ancho, ligeramente más angosto en la base. Patas largas, delgadas; pro, meso y metatibias con 2 espolones; penúltimo tarsómero de 3 pares de patas bilobulado y con euplántula presente, uñas tarsales simples. Octavo esternito hendido en la parte media, con abundantes sedas largas en la mitad posterior. Noveno esternito de forma trapezoidal unido a las proyecciones del spiculum gastrale. Los genitales se caracterizan por un lóbulo medio corto, con la base más ancha estrechándose hacia el ápice, sin apodemas basales; tegmen con los parameros estrechos hacia el ápice, posteriormente emarginado, sin apodemas basales.
Vasaces martini sp. nov. (figs. 1a-c, 2a-f)
http://zoobank.org/urn:lsid:zoobank.org:act:85CA7491-5A5F-4276-BBDE-74DA67BE71EA

Figura 1 Vasaces martini sp. nov. a) Vista dorsal, b) pronoto y c) ala. V. ishwari d) vista dorsal, e) pronoto y f) ala. V. anelae g) vista dorsal, h) pronoto y i) ala.
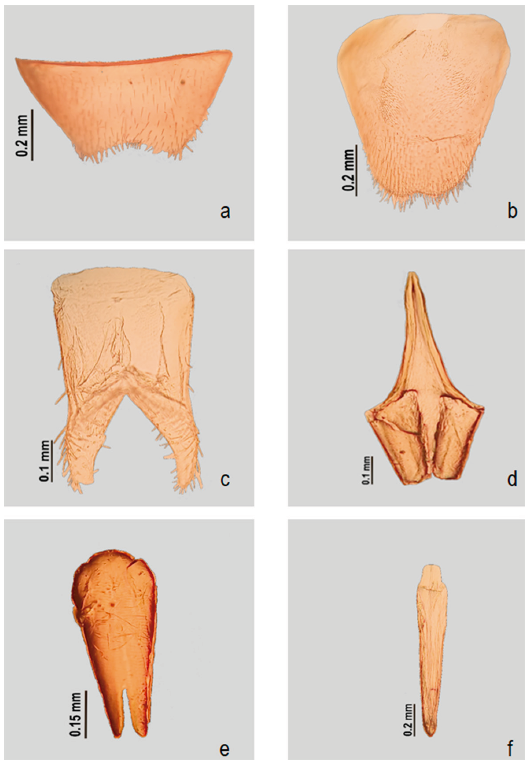
Figura 2 Vasaces martini sp. nov. a) Séptimo esternito, b) séptimo tergito, c) octavo esternito, d) noveno esternito, e) tegmen y f) lóbulo medio.
Diagnosis. Largo total 5.44 mm, ancho 1.15 mm. Pronoto café con la parte media del margen anterior y posterior amarillos, élitros de color café con manchas amarillas que se extienden por la sutura elitral hasta el ápice. Pronoto lateralmente con 2 ligeras concavidades, otras 2 presentes en la parte media anterior y posterior, surco medio ausente. Costillas elitrales suavemente impresas, costillas 1 y 2 desvaneciéndose a la mitad de los élitros, costilla elitral subhumeral más larga que las posteriores desvaneciéndose antes del ápice elitral. Último esternito abdominal con una emarginación amplia en el margen posterior, ángulos laterales estrechados en la parte media, con abundantes sedas pequeñas en la superficie. Último tergito ojival con el margen posterior con una pequeña emarginación.
Macho. Largo 5. 44 mm, ancho 1.15 mm (fig. 1a). Coloración: cabeza color café, clípeo con el margen anterior amarillo claro, mandíbulas amarillas a excepción del ápice color café, palpómeros maxilares con la tercera parte basal amarilla el resto café, palpómeros labiales amarillos, y antenas con mitad basal de antenómeros amarilla y posterior café, excepto último antenómero que es amarillo y en la parte media café. Pronoto café con parte media del margen anterior y posterior amarillos; élitros color café con manchas amarillas en la parte anterior que se extienden por la sutura elitral hasta el ápice; prosterno y mesosterno cafés con margen posterior amarillo, metasterno café. Cabeza: corta, distancia interantenal 2 veces más pequeña que la distancia del margen anterior del ojo al clípeo (0.35 mm × 0.7 mm); superficie con puntuación grande y dispersa entre los ojos, más concentrada y pequeña entre las fosetas antenales; integumento brillante y liso; revestimiento con finas sedas doradas procumbentes; labro subtrapezoidal; último palpómero maxilar triangular; último palpómero labial obtriangular; foseta antenal próxima al margen anteromesal del ojo; las antenas exceden longitud media elitral, antenómero filiformes; primer antenómero ligeramente curvado (0.36 mm), segundo antenómero un poco más pequeño que el tercero (0.26 mm × 0.36 mm); escotadura del último artejo antenal ausente; ojos reniformes grandes, poco más de la mitad de longitud de la cabeza (0.54 mm × 0.84 mm), y protuberantes con emarginación poco marcada y redondeada; distancia interocular un poco más pequeña que la distancia del margen posterior del ojo a cresta epistomal (0.48 mm × 0.52 mm). Tórax: pronoto más largo que ancho (0.91 mm × 0.81 mm), cordiforme, ligeramente emarginado en margen anterior, superficie irregular, lateralmente con 2 ligeras concavidades, otras 2 presentes en la parte media anterior y posterior, puntuación del pronoto pequeña y esparcida, integumento liso, con escasa pilosidad corta y procumbente de color dorado (fig. 1b); escutelo trapezoidal, superficie brillante, con abundante puntuación y abundante pilosidad procumbente de color dorado; élitros paralelos, ápice de los élitros ligeramente redondeados 3 veces más largos que anchos (3.76 mm × 1.15 mm), integumento chagrinado, con abundante pilosidad dorada procumbente en casi toda la superficie elitral a excepción del ápice donde es decumbente; con 3 costillas elitrales suavemente impresas, costillas 1 y 2 desvaneciéndose a la mitad de los élitros, costilla elitral subhumeral más larga que las posteriores, desvaneciéndose antes del ápice elitral; patas largas, delgadas; pro, meso y metatibias con 2 espolones; el penúltimo tarsómero de los 3 pares de patas bilobulado y con euplántula presente, uñas tarsales simples con la base cuadrada. Ala membranosa 2.3 veces más larga que ancha (4.95 mm × 2.1 mm), área apical 0.4 veces del total del largo del ala (2.25 mm × 4.95 mm), con una mancha longitudinal ubicada en el área apical cercana a la celda radial; celda radial cerrada, vena r3 presente, vena r4 incompleta (no alcanzando a RP), recta, poco visible, unida a la base de r3; bucle radio-medial estrecho; espolón medial recto, no alcanzando el margen del ala; área medial ausente de una mancha medial; la base de MP3+4 ligeramente alejada de MP1+2; celda anal apicalmente aguda, más larga que el espolón medial (0.50 × 0.45 mm), base de celda cercana a AA3; venas AA3 y CuA1+2 con el mismo origen (fig. 1c). Abdomen: último esternito abdominal con emarginación amplia en el margen posterior, ángulos laterales estrechados en la parte media, con abundantes sedas pequeñas en toda la superficie (fig. 2a); último tergito ojival con margen posterior con una pequeña emarginación, con abundantes sedas largas en la mitad posterior (fig. 2b), un poco más pequeño que el último esternito (0.72 mm × 0.46 mm); octavo esternito hendido en la parte media, con abundantes sedas largas en la mitad posterior y cortas en el ápice (fig. 2c); octavo tergito emarginado, poco esclerotizado en los márgenes laterales, parte media membranosa, con escasas sedas largas en el margen lateral del ápice; spiculum gastrale en forma de "V"; noveno esternito de forma trapezoidal, unido a proyecciones del spiculum gastrale (fig. 2d); noveno tergito con ápice redondeado, poco esclerotizado con escasas sedas en el ápice; tegminito ausente; tegmen un poco más corto que lóbulo medio (0.59 mm × 0.83 mm), sin apodemas basales, parámeros glabros, redondeados en el ápice (fig. 2e); lóbulo medio robusto, sin esclerito de soporte, más ancho en la mitad anterior, ápice romo ligeramente curvado hacia la parte ventral (fig. 2f).
Hembra. Desconocida.
Resumen taxonómico
Etimología. Especie dedicada al Dr. Martín Zurita García, amigo y apasionado entomólogo que dedicó su vida a la enseñanza y al estudio de los elatéridos.
Material examinado. Holotipo macho. México: Oaxaca: Dominguillo, 760 m snm 17°38'90.7" N, 96°54'70.3" O, 22-III-1998, S. Zaragoza col.
Comentarios taxonómicos
Es parecida a V. ishwari, de la que puede diferenciarse por el largo del cuerpo, la ausencia de un surco medio en el pronoto, impresión de las costillas elitrales, forma de la emarginación del quinto esternito y forma del margen posterior del último tergito visible.
Vasaces ishwari sp. nov. (figs. 1d-f, 3a-f)
http://zoobank.org/urn:lsid:zoobank.org:act:A90BA6D6-164C-4DA2-B80C-E01DD26B4342

Figura 3 Vasaces ishwari sp. nov. a) Séptimo esternito, b) séptimo tergito, c) octavo esternito, d) noveno esternito, e) tegmen y f) lóbulo medio.
Diagnosis. Largo 6.33 mm, ancho 1.36 mm. Pronoto café con la parte media del margen anterior y posterior amarillos, élitros color amarillo con manchas cafés en la base de los élitros. Pronoto con surco en forma de "M", lateralmente con 2 ligeras concavidades, y un surco medio longitudinal interrumpido por una pequeña concavidad en forma de "V". Costillas elitrales fuertemente impresas, las 3 costillas de similar longitud desvaneciéndose antes del ápice elitral. Último esternito abdominal con emarginación amplia en el margen posterior, ángulos laterales no estrechados en la parte media. Último tergito ojival.
Macho. Largo 6.33 mm, ancho 1.36 mm (fig. 1d). Coloración: cabeza color café, clípeo con el margen anterior amarillo, mandíbulas amarillas a excepción del ápice color café, palpómeros maxilares color café con la parte basal amarilla, palpómeros labiales amarillos, antenas con base amarilla, el resto café. Pronoto café con parte media del margen anterior y posterior amarillos; élitros color amarillo con manchas cafés en la base de los élitros; prosterno café con margen posterior amarillo, mesosterno y metasterno cafés. Cabeza: corta, distancia interantenal 2 veces más pequeña que la distancia del margen anterior del ojo al clípeo (0.39 mm × 0.86 mm); superficie con puntuación pequeña y distribuida de manera homogénea en la cabeza, integumento brillante y liso; revestimiento con finas sedas doradas procumbentes; labro subtrapezoidal; último palpómero maxilar triangular; último palpómero labial obtriangular; foseta antenal próxima al margen anteromesal del ojo; las antenas exceden la longitud media elitral, antenómeros filiformes; primer antenómero ligeramente curvado (0.41 mm); segundo antenómero más pequeño que el tercero (0.29 mm × 0.4 mm); escotadura del último artejo antenal ausente; ojos reniformes grandes, poco más de la mitad de la longitud de la cabeza (0.52 mm × 0.95 mm) y protuberantes, con la emarginación poco marcada y redondeada; distancia interocular un poco más pequeña que la distancia del margen posterior del ojo a la cresta epistomal (0.52 mm × 0.55 mm). Tórax: pronoto más largo que ancho (1 mm × 0.88 mm), cordiforme, ligeramente emarginado en margen anterior y posterior, superficie irregular, con un surco en forma de "M", lateralmente con 2 ligeras concavidades y surco medio longitudinal interrumpido por una pequeña concavidad en forma de "V", puntuación del pronoto de diferentes tamaños y esparcida, integumento chagrinado, con escasa pilosidad corta y procumbente de color dorado (fig. 1e); escutelo rectangular, superficie brillante, con escasa puntuación y abundante pilosidad procumbente de color dorado; élitros paralelos, ápice de los élitros poco más de 3 veces más largos que anchos (4.5 mm × 1.37 mm), integumento chagrinado, con abundante pilosidad dorada procumbente en casi toda la superficie elitral a excepción del ápice donde es decumbente; con 3 costillas elitrales fuertemente impresas, de similar longitud, desvaneciéndose antes del ápice elitral; patas largas, delgadas; pro, meso y metatibias con 2 espolones; penúltimo tarsómero de 3 pares de patas bilobulado y con euplántula presente, uñas tarsales simples con base ligeramente redondeada. Ala membranosa: 2.8 veces más larga que ancha (5.95 mm × 2.12 mm), área apical 0.4 veces del total del largo del ala (2.60 mm × 5.95 mm), con una mancha longitudinal ubicada en el área apical cercana a la celda radial; celda radial cerrada, vena r3 presente, vena r4 incompleta (no alcanzando a RP), ligeramente curvada, poco visible, unida a la mitad de r3; bucle radio-medial estrecho; espolón medial recto, no alcanzando el margen del ala; área medial ausente de una mancha medial; la base de MP3+4 alejada de MP1+2; celda anal apicalmente aguda, más larga que espolón medial (0.66 mm × 0.59 mm), la base de la celda cercana a AA3; venas AA3 y CuA1+2 con mismo origen; lóbulo anal amplio, vena AP 3+4 presente y alargada (fig. 1f). Abdomen: último esternito abdominal con emarginación amplia en margen posterior, ángulos laterales no estrechados en parte media, con abundantes sedas pequeñas en toda la superficie (fig. 3a); último tergito ojival con abundantes sedas pequeñas en mitad posterior (fig. 3b), casi 2 veces más largo que el último esternito (0.96 mm × 0.45 mm); octavo esternito hendido en parte media, con abundantes sedas largas en la mitad posterior y el ápice (fig. 3c); octavo tergito emarginado poco esclerotizado solo en los márgenes laterales, la parte media membranosa, con escasas sedas largas en ápice y 2 pequeñas protuberancian en emarginación; spiculum gastrale en forma de "V"; noveno esternito de forma trapezoidal unido a proyecciones del spiculum gastrale (fig. 3d); noveno tergito con ápice redondeado, poco esclerotizado con escasas sedas en ápice; tegminito ausente; tegmen poco más corto que el lóbulo medio (0.56 mm × 0.87 mm), sin apodemas basales, parámeros glabros, redondeados en ápice (fig. 3e); lóbulo medio robusto en parte la basal, ligeramente estrechado en la parte apical, sin esclerito de soporte, ápice romo, curvado hacia parte ventral (fig. 3f).
Hembra. Desconocida.
Resumen taxonómico
Etimología. Especie dedicada al biólogo Ishwari G. Gutiérrez Carranza, entusiasta entomólogo y gran amigo enfocado al estudio de los lampíridos y carábidos.
Material examinado. Holotipo macho. México: Oaxaca: Dominguillo, 760 m snm N 17°38'90.7" N 96°54'70.3" O, 25-III-1998, S. Zaragoza col.
Comentarios taxonómicos
Es similar a V. martini, de la que puede diferenciarse por el largo del cuerpo, la presencia de un surco en la superficie pronotal en forma de M y un surco medio, impresión de las costillas elitrales, forma de la emarginación del quinto esternito y forma del margen posterior del último tergito visible.
Vasaces anelae sp. nov. (figs. 1g-i, 4a-f)
http://zoobank.org/urn:lsid:zoobank.org:act:2E7C350C-C263-4662-88AC-D8832B1DDFAF

Figura 4 Vasaces anelae sp. nov. a) Séptimo esternito, b) séptimo tergito, c) octavo esternito, d) noveno esternito, e) tegmen y f) lóbulo medio.
Diagnosis. Largo 8.2 mm, ancho 1.58 mm. Pronoto café con la parte media del margen anterior y posterior con 2 manchas amarillas, élitros pardos. Pronoto con 4 ligeras concavidades, 2 presentes lateralmente, 2 presentes en la parte media anterior y posterior, y un surco longitudinal medio. Costillas elitrales débilmente impresas, las 3 costillas de similar longitud, desvaneciéndose antes del ápice elitral. Último esternito abdominal con emarginación amplia en margen posterior, ángulos laterales estrechados en parte media. Último tergito ojival, margen posterior con pequeña emarginación.
Macho. Largo 8.2 mm, ancho 1.58 mm (fig. 1g). Coloración: cabeza color café, márgenes laterales posteriores a las fosetas antenales amarillos, mandíbulas amarillas a excepción del ápice color café, palpómeros maxilares color café, con parte basal ligeramente amarilla, palpómeros labiales cafés, antenas con base amarilla, el resto café. Pronoto café, con la parte media del margen anterior y posterior con 2 manchas amarillas; élitros pardos; prosterno, mesosterno y metasterno cafés. Cabeza: elongada, distancia interantenal 3 veces más pequeña que la distancia del margen posterior del ojo al clípeo (0.33 mm × 1.15); superficie con puntuación de diferentes tamaños, distribuida de manera homogénea en la cabeza, integumento chagrinado; revestimiento con finas sedas doradas procumbentes; labro cuadrado; último palpómero maxilar cultriforme; último palpómero labial obtriangular; foseta antenal alejada del margen anteromesal del ojo; antenas exceden longitud media elitral, antenómeros filiformes; primer antenómero recto (0.45 mm), segundo antenómero más pequeño que el tercero (0.34 mm × 0.42 mm); escotadura del último artejo antenal ausente; ojos reniformes pequeños, la mitad de la longitud de la cabeza (0.61 mm × 1.21 mm) y protuberantes, con emarginación poco marcada y redondeada; distancia interocular más pequeña que la distancia del margen posterior del ojo a la cresta epistomal (0.49 mm × 0.84 mm). Tórax: pronoto más largo que ancho (1.1 mm × 0.88 mm), rectangular con ligero ensanchamiento en la parte anterior, emarginado en margen anterior, superficie irregular, con 4 ligeras concavidades, 2 presentes lateralmente, 2 presentes en la parte media anterior y posterior, y un surco longitudinal medio, puntuación del pronoto de pequeña y concentrada, integumento chagrinado, con escasa pilosidad corta y procumbente de color dorado (fig. 1h); escutelo trapezoidal, superficie brillante, con numerosa puntuación pequeña y abundante pilosidad procumbente de color dorado; élitros paralelos, 3 veces más largos que anchos (4.75 mm × 1.58 mm), ápice de élitros ligeramente redondeados, integumento chagrinado, con abundante pilosidad dorada procumbente en toda la superficie elitral; con 3 costillas elitrales débilmente impresas, las 3 costillas de similar longitud, desvaneciéndose antes del ápice elitral; patas largas, delgadas; pro, meso y metatibias con 2 espolones; penúltimo tarsómero de 3 pares de patas bilobulado y con euplántula presente, uñas tarsales simples con base ligeramente redondeada. Ala membranosa: 3.30 veces más larga que ancha (8.2 mm × 2.5 mm), área apical 0.3 veces del total del largo del ala (2.91 mm × 8.2 mm), con mancha longitudinal ubicada en el área apical cercana a la celda radial; celda radial cerrada, vena r3 presente, vena r4 incompleta (no alcanzando a RP), ligeramente curvada, poco visible, unida a mitad de r3; bucle radio-medial estrecho; espolón medial recto, alcanzando margen del ala; área medial sin mancha medial; base de MP3+4 alejada de MP1+2; celda anal apicalmente aguda, más larga que espolón medial (1.2 mm × 0.72 mm), base de celda cercana a AA3; venas AA3 y CuA1+2 con el mismo origen; lóbulo anal amplio, vena AP3+4 presente y corta (fig. 1i). Abdomen: último esternito abdominal con emarginación amplia en margen posterior, ángulos laterales estrechados en parte media, con abundantes sedas pequeñas en toda la superficie (fig. 4a); último tergito ojival, margen posterior con pequeña emarginación, con abundantes sedas pequeñas en mitad posterior (fig. 4b), un poco más largo que el último esternito (0.88 mm × 0.52 mm); octavo esternito hendido en parte media, con abundantes sedas largas en mitad posterior y ápice (fig. 4c); octavo tergito emarginado no esclerotizado, con escasas sedas largas en ápice; spiculum gastrale en forma de "V"; noveno esternito de forma trapezoidal unido a proyecciones del spiculum gastrale (fig. 4d); noveno tergito truncado con ápice con emarginación redondeada, poco esclerotizado, sin sedas; tegminito ausente; tegmen poco más corto que el lóbulo medio (0.51 mm × 0.81 mm), sin apodemas basales, parámeros glabros, redondeados en ápice (fig. 4e); lóbulo medio robusto en la parte basal, ligeramente estrechado en la parte apical, sin esclerito de soporte, ápice romo curvado hacia la parte ventral (fig. 4f).
Hembra. Desconocida.
Resumen taxonómico
Etimología. Especie dedicada a la comprometida estudiante Anel Teresa Mercedes Núñez Monroy, interesada en el fascinante mundo de la taxonomía de los coleópteros y los hongos.
Material examinado. Holotipo macho. México: Oaxaca: Dominguillo, 760 m snm 17°38'90.7" N, 96°54'70.3" O, 25-III-1998, M. Morales col.
Comentarios taxonómicos
Es una especie particular, ya que presenta una combinación de caracteres que la relacionan con V. linearis y V. elongatus. De la primera puede diferenciarse por el tamaño de la cabeza, la coloración de los élitros, y el número, impresión y ápice de las costillas elitrales. De V. elongatus se diferencia por la coloración de los élitros, la forma del último palpo maxilar y la presencia de un surco medio en el pronoto.
Nuevos registros
Vasaces aeneipennis Champion, 1890 (fig. 5a-c) se ha citado para México, Puebla (Tototzinapán), Guatemala (Santa María) y Honduras (San Juancito) (Arnett, 1953; Champion, 1890; Domínguez-León y Zaragoza-Caballero, 2021). Se registra por primera vez con un ejemplar para Oaxaca: "México, Oaxaca, Dominguillo, a 760 m snm, 17°38'90.7" N, 96°54'70.3" O, 1,370 m, 25.III.1998, col. S. Zaragoza (1 ejemplar)" (fig. 6).

Figura 5 Vasaces aeneipennis. a) Vista dorsal, b) pronoto y c) ala. V. elongatus d) vista dorsal, e) pronoto y f) ala.
Vasaces elongatus (fig. 5d-f) se ha registrado únicamente para los EUA, Texas (montañas Chisos) (Arnett, 1953). Se registra por primera ocasión con 2 ejemplares para Querétaro: "México: Querétaro, Misión Bucareli, 21°02'28" N, 99°36'85.5" O, 01.III.1998, cols. G. Ortega y E. Barrera (2 ejemplares)" (fig. 6).
| Clave para la identificación de especies del género Vasaces | ||
| 1. Palpómero maxilar cultriforme, con el borde exterior sinuado | 2 | |
| 1'. Palpómero maxilar triangular | 5 | |
| 2. Élitros sin color uniforme | 3 | |
| 2'. Élitros de color uniforme | 4 | |
| 3. Costillas, suturas y márgenes elitrales de color café obscuro, intervalos más claros; antenas uniformemente cafés | ||
| a excepción de pequeña área en la parte posterior de color amarillo; patas cafés, ligeramente más claras en extremo | ||
| posterior | V. linearis Arnett | |
| 3'. Base y ápice de los élitros cafés, resto de superficie elitral de color amarillo con maculas cafés de distribución | ||
| aleatoria; antenas uniformemente de color café a excepción de base que es amarilla; patas de color café, con pequeñas | ||
| partes de color amarillo | V. anelae sp. nov. | |
| 4. Élitros de color cobrizo uniforme | V. costatus Champion | |
| 4'. Élitros obscuros | V. knulli Arnett | |
| 5. Coloración del cuerpo normalmente amarilla o pajiza, élitros con costillas y suturas con fila indistinta e ininterrumpida | ||
| de finas rayas oblongas a cada lado | V. sordidus Champion | |
| 5'. Coloración del cuerpo normalmente café obscuro o con otras marcas | 6 | |
| 6. Cabeza corta: distancia interantenal 2 veces más pequeña que distancia del margen anterior del ojo al clípeo | ||
| (fig. 7a) | 7 | |
| 6'. Cabeza elongada: distancia interantenal un poco más de 3 veces más pequeña que distancia del margen anterior del | ||
| ojo al clípeo (fig. 7b) | 9 | |
| 7. Pronoto de color naranja con manchas negras | V. maculatus Arnett | |
| 7'. Pronoto de color café obscuro, con margen anterior y posterior amarillos | 8 | |
| 8. Pronoto con un surco en forma de "M", lateralmente con 2 ligeras concavidades y surco medio longitudinal | ||
| interrumpido por pequeña concavidad en forma de "V" | V. ishwari sp. nov. | |
| 8'. Pronoto con 2 concavidades redondeas ubicadas lateralmente y 2 de forma triangular en parte media anterior y | ||
| posterior, con surco longitudinal medio | V. martini sp. nov. | |
| 9. Pronoto con ambos lados casi paralelos | V. elongatus Arnett | |
| 9'. Pronoto con ambos lados sinuados | V. aeneipennis Champion | |
|
| ||











 text new page (beta)
text new page (beta)