Introducción
El registro de una especie en un lugar específico en un momento dado es la unidad de información esencial sobre la cual se construyen los inventarios de especies. La compilación de registros de especies ha servido para conocer la riqueza de diversas áreas geográficas o ecosistemas (Álvarez y Ojeda, 2019a; Villaseñor, 2016). Son la herramienta principal sobre la cual se basan otros estudios sobre la regionalización de la biota y el funcionamiento de la comunidad (Martínez-Meyer et al., 2014; Morrone, 2019). Así mismo, en ellos se ha basado la designación de áreas de conservación, permitiendo identificar “hotspots” de biodiversidad, además de clasificar grandes regiones geográficas (e.g., Mittermeier et al., 1997). Por otra parte, los inventarios bióticos que se realizan sistemáticamente a través del tiempo son ahora herramientas fundamentales para monitorear cambios en los patrones de distribución de las especies a diversas escalas espacio-temporales (Carabias et al., 2015; González-Contreras et al., 2015). Sin inventarios bióticos no se podrían calcular tasas de deterioro o de recuperación y sería muy difícil detectar especies introducidas y entender su impacto en las comunidades nativas. Desde la década de 1980, se ha formalizado el monitoreo de largo plazo de comunidades o ecosistemas para detectar cambios que no son perceptibles, por ejemplo, en estudios de corto plazo con duraciones de meses o de un año (Gosz, 1996). Existen cambios naturales o provocados por el hombre que pueden tardar en ocurrir o volverse apreciables en periodos de lustros o décadas (Alcocer-Durand y Bernal-Brooks, 2009) y el registro de la mayoría de las especies de un ecosistema también puede tardar varios años en conseguirse. De igual manera, existen procesos ecológicos cuya fenología es de tan larga duración que se requiere de una serie larga de observaciones en el tiempo para lograr su detección y estudio (Vander-Zanden y Vadeboncoeur, 2020).
Los inventarios bióticos deben estar respaldados por ejemplares de referencia depositados en colecciones biológicas reconocidas y deben estar consultables para realmente incidir en el manejo de las áreas naturales. De esta forma, es posible confirmar la identidad de las especies o bien rectificarla, hacer seguimientos en tallas promedio, épocas de reproducción y fecundidad, o en la aparición de nuevas enfermedades (Basanta et al., 2021; Krabbenhoft et al., 2014; Ortega et al., 2016). Los inventarios bióticos y los programas de monitoreo son conjuntos de registros que van describiendo los cambios en los ecosistemas y son la herramienta básica para determinar qué áreas contienen una mayor proporción del total de especies de la región.
Desde el 2005, Natura y Ecosistemas Mexicanos, S.C. (de aquí en adelante “Natura”) ha promovido la operación del “Programa de monitoreo de los ambientes acuáticos de la Selva Lacandona” para determinar el grado de deterioro y/o conservación que presentan la estructura y funcionamiento de los ecosistemas acuáticos que se localizan en esta importante región ecológica del país. La mayor parte del territorio que ocupa la Selva Lacandona se localiza en la cuenca media del río Usumacinta, una zona que por su intrincada geología, fisiografía y edafología alberga la mayor diversidad de especies terrestres y acuáticas del país (Carabias et al., 2015). El principal río que atraviesa la Selva Lacandona es el Lacantún, que se origina en la confluencia de los ríos Jataté y Santo Domingo, y tiene una escorrentía anual promedio de 696.8 m3/seg, con variaciones que fluctúan entre 138.6 y 1,325.5 m3/seg (Núñez y Meli, 2015). En la subcuenca del río Lacantún existen ríos y arroyos que, en su mayor parte, presentan un buen estado de conservación con una de las ictiofaunas de agua dulce mejor conservadas del país, además de especies acuáticas emblemáticas como la nutria de río (Lontra longicaudis), el cocodrilo (Crocodylus moreletii) y la tortuga blanca (Dermatemis mawii) (Ramírez-Martínez et al., 2015), aunque existen algunos otros con diferentes niveles de degradación. En su trayecto, el río Lacantún limita en su margen derecho con la región de Marqués de Comillas, una zona que se encuentra ocupada principalmente por población indígena tzeltal proveniente de los Altos de Chiapas y campesinos que migraron en la década de 1970 desde varios estados, principalmente Oaxaca, Guerrero, Michoacán y Veracruz, y en su margen izquierdo el río limita con la Reserva de la Biosfera de Montes Azules (RBMA), el área natural protegida con mayor extensión de la Selva Lacandona, la cual constituye el macizo de selva tropical mejor conservado, no solo de México sino de Mesoamérica, que es considerado un “hotspot” por la enorme biodiversidad que la habita. Debido a esta particular conformación ecológica y social que se presenta en la región, en el 2008 Natura impulsó el “Programa de monitoreo de los ambientes acuáticos de la Selva Lacandona” con el objetivo de describir la riqueza biológica que habita en el río Lacantún y sus tributarios. El resultado es una forma de evaluar el grado de conservación o deterioro, que permite emitir alertas tempranas en caso de que se detecten situaciones de alteración en la estructura y el funcionamiento de este tipo de ecosistema, y también es conducente a elaborar estrategias de implementación rápida que sean capaces de revertir las alteraciones identificadas.
El programa de monitoreo se encuentra integrado por 2 componentes principales: la determinación del grado de deterioro y la conservación de los ambientes acuáticos estudiados a través del estudio de bioindicadores (peces, helmintos parásitos de peces, moluscos acuáticos y crustáceos), y la realización de evaluaciones periódicas de calidad del agua para determinar la presencia y evolución de contaminates en los ecosistemas acuáticos estudiados (Álvarez-Porebsky et al., 2015; Ramírez-Martínez et al., 2015).
Dentro del programa de muestreo se incluyeron ríos y arroyos tributarios del cauce principal del Lacantún ubicados en la zona limítrofe sur de la RBMA, desde el sitio conocido como el Cañón del Colorado hasta la desembocadura del río Lacanjá, en donde se establecieron 13 estaciones de monitoreo, 7 localizadas dentro de la RBMA y 6 en las comunidades de López Mateos, Galacia, Playón de la Gloria y Boca de Chajul en el municipio Marqués de Comillas y Loma Bonita, Trece de Septiembre e Ixcán en el municipio Maravillas Tenejapa, en Chiapas.
El inicio del programa de monitoreo incluyó la realización periódica de muestreos de calidad del agua y el monitoreo de las poblaciones de moluscos acuáticos, al que se le fueron agregando el resto de los grupos biológicos estudiados conforme se incorporaron especialistas de distintas instituciones de investigación al grupo de trabajo. De esta manera, actualmente se cuenta con más de 10 años de muestreos en la red de estaciones de monitoreo establecidas en el río Lacantún y sus tributarios. En el presente estudio se describe el listado de especies acuáticas de 6 phyla a partir del cual se analiza la diversidad, distribución y permanencia de las especies como un índice de cambio o deterioro del ecosistema acuático.
La información generada durante este proyecto ha servido para describir 7 nuevas especies (Caspeta-Mandujano et al., 2021; Mendoza-Franco et al., 2013, 2018, 2019; Mendoza-Franco, Caspeta-Mandujano et al., 2015; Mendoza-Franco, Tapia et al., 2015), se han dirigido 10 tesis de licenciatura y posgrado, se han publicado 18 artículos y capítulos de libro, y 3 libros (Carabias et al., 2015; Espinosa-Pérez et al., 2019; Salgado-Maldonado et al., 2014). Sin embargo, hasta ahora no se tenía el listado completo de las especies acuáticas registradas. Cabe aclarar que los resultados sobre insectos acuáticos han sido tratados aparte en otras publicaciones (Castillo et al., 2018; Ramírez-Martínez et al., 2015).
Materiales y métodos
Durante el periodo 2010-2020 se realizaron más de 40 campañas en las que participaron investigadores, técnicos y estudiantes de licenciatura y posgrado, de 5 instituciones nacionales de educación superior e investigación, llevando a cabo la colecta, procesamiento e identificación taxonómica de todos los grupos biológicos estudiados.
La red de estaciones se estableció para tener representados: 1) sitios en el cauce principal del río Lacantún (5): río Ixcán, río Chajul, río Lacantún, río Tzendales y río Lacanjá; 2) arroyos y cuerpos de agua considerados como conservados dentro de la RBMA (4): arroyo San Pablo, arroyo José, arroyo Miranda y Humedal Lacanjá; 3) cuerpos de agua en la parte perturbada de la zona de estudio (4): arroyo Puerto Rico, arroyo Lagarto, arroyo Danta y arroyo Manzanares (Tabla 1; Fig. 1). En cada estación se realizaron colectas con diversos artes de pesca: chinchorro, equipo de electropesca, red de cuchara, tamices y colecta manual (Ramírez-Martínez et al., 2015). Se colectaron ejemplares de especies que no se pueden identificar en campo, que sirvieron para realizar disecciones en busca de helmintos parásitos o para toma de muestras de ADN (Caspeta-Mandujano et al., 2021); sin embargo, la gran mayoría de los organismos fueron identificados, contabilizados y liberados en el sitio de la colecta. Las muestras que se tomaron fueron conservadas de acuerdo con el protocolo apropiado para cada grupo de organismos (Ramírez-Martínez et al., 2015).
Tabla 1 Localidades de muestreo en la cuenca media del río Lacantún: número de la estación, nombre la localidad, abreviatura, latitud N, longitud O y altitud en metros.
| Estación | Localidad | Abrev. | Latitud | Longitud | Altitud |
|---|---|---|---|---|---|
| 1 | Río Ixcán | IXC | 16.09314 | -91.09199 | 173 |
| 2 | Arroyo Puerto Rico | PRC | 16.0795 | -91.02090 | 167 |
| 3 | Arroyo San Pablo | SPB | 16.10301 | -91.01468 | 161 |
| 4 | Río Chajul | CHJ | 16.09716 | -90.95490 | 160 |
| 5 | Río Lacantún | LCT | 16.11041 | -90.93975 | 159 |
| 6 | Arroyo José | JOS | 16.11606 | -90.94008 | 157 |
| 7 | Arroyo Miranda | MIR | 16.13809 | -90.92199 | 152 |
| 8 | Arroyo Lagarto | LAG | 16.12604 | -90.90988 | 149 |
| 9 | Arroyo Danta | DNT | 16.15138 | -90.89664 | 146 |
| 10 | Arroyo Manzanares | MNZ | 16.17085 | -90.84375 | 138 |
| 11 | Río Tzendales | TZE | 16.29437 | -90.88598 | 137 |
| 12 | Río Lacanjá | LCJ | 16.40726 | -90.78357 | 134 |
| 13 | Humedal Lacanjá | HUM | 16.41002 | -90.78046 | 129 |
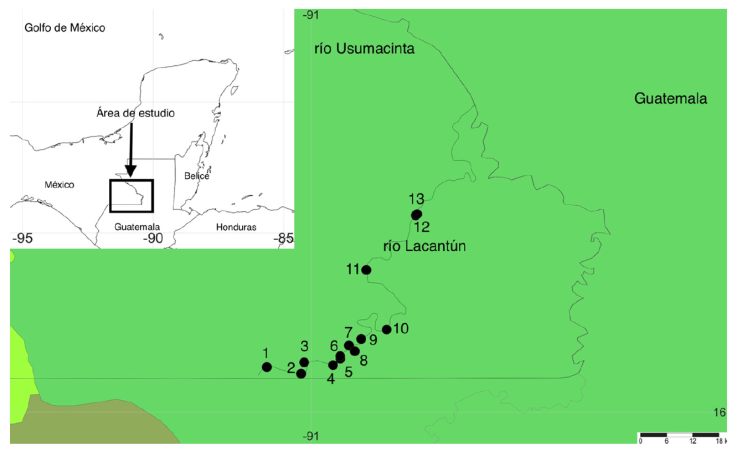
Figura 1 Área de estudio en el sur de México y red de estaciones sobre la cuenca media del río Lacantún. Las estaciones de muestreo están identificadas en la Tabla 1.
Todos los registros presentados corresponden a ejemplares depositados en colecciones biológicas reconocidas como sigue: CNHE, Colección Nacional de Helmintos; CNCR, Colección Nacional de Crustáceos; CNMO, Colección Nacional de Moluscos; y CNPE, Colección Nacional de Peces, todas pertenecientes al Instituto de Biología, Universidad Nacional Autónoma de México (UNAM) y BMNH, British Museum Natural History, en Londres, Reino Unido.
En el listado se incluyeron registros históricos que corresponden al área de estudio sin una localidad específica (10), estos registros se consideraron importantes por tratarse de colectas con más de 50 años y un registro reciente de colector anónimo, también dentro del área de estudio. Algunos organismos no se identificaron a nivel de especie y se reportan como “sp.” porque representan especies nuevas que se describirán en otros trabajos.
La curva acumulativa de especies se construyó tomando en cuenta como base los registros de moluscos de la CNMO. Sobre estos datos se añadieron registros de helmintos que se compilaron en varias publicaciones (Salgado-Maldonado, Caspeta-Mandujano, Moravec, Soto-Galera, Cabañas-Carranza et al., 2011; Salgado-Maldonado, Caspeta-Mandujano, Moravec, Soto-Galera, Rodiles-Hernández 2011; Salgado-Maldonado et al., 2014) y de peces (Espinosa-Pérez et al., 2019) y por último los registros derivados de este estudio de crustáceos y vertebrados.
Para cada especie del listado se revisó el patrón de distribución y su estatus de conservación, basándonos en la NOM-059-SEMARNAT-2010 actualizada en 2020 y en las evaluaciones disponibles de la UICN. Se considera a una especie nativa a aquella cuyo intervalo de distribución original comprende la cuenca del río Usumacinta; endémica, a aquella cuya área total de distribución se encuentra dentro de la cuenca media del río Lacantún o dentro del área de influencia de la RBMA. Las especies introducidas fueron aquellas cuyo intervalo de distribución geográfica original no abarcaba la cuenca media del río Lacantún.
Resultados
Se reportan 236 especies de 6 phyla, agrupadas en 10 clases, 27 órdenes, 79 familias y 164 géneros (Tabla 2, Apéndice). Del total de especies, 220 (93.2%) son nativas, 25 (10.6%) son endémicas de la región y 16 (6.8%) son introducidas. En total se presentan 919 registros en las 13 estaciones de muestreo que se componen, en orden decreciente, en: 38.8% Pisces, 30.9% Platyhelminthes, 13.6% Mollusca, 11.7% Nematoda, 2.2% Crustacea, 1.7% Anura, 0.6% Acanthocephala y 0.2% Sauropsida.
Tabla 2 Número de especies, géneros, familias, órdenes y clases registrados por phylum en este estudio en la cuenca media del río Lacantún. Arthropoda incluye solamente crustáceos y Chordata a peces, anfibios y reptiles.
| Phyla | Clases | Órdenes | Familias | Géneros | Especies | Nativas | Endémicas | Introducidas |
|---|---|---|---|---|---|---|---|---|
| Platyhelminthes | 3 | 1 | 23 | 57 | 74 | 70 | 7 | 4 |
| Acanthocephala | 1 | 1 | 1 | 2 | 2 | 2 | - | - |
| Nematoda | - | - | 13 | 19 | 33 | 33 | 4 | - |
| Arthropoda | ||||||||
| Crustacea | 1 | 1 | 3 | 4 | 6 | 6 | 4 | - |
| Mollusca | 2 | 5 | 8 | 19 | 35 | 32 | 1 | 3 |
| Chordata | ||||||||
| Pisces | 1 | 16 | 25 | 54 | 74 | 65 | 9 | 9 |
| Amphibia | 1 | 1 | 4 | 7 | 10 | 10 | - | - |
| Sauropsida | 1 | 2 | 2 | 2 | 2 | 2 | - | - |
| Total 6 | 10 | 27 | 79 | 164 | 236 | 220 | 25 | 16 |
El promedio de especies registrado por localidad a lo largo de todo el programa de muestreo fue de 70.7, con un intervalo de 41 en el río Lacanjá a 112 en el río Tzendales (Fig. 2). La mayoría de las especies (72) tuvieron una distribución que abarcó tanto el curso principal del Lacantún como los arroyos conservados y los perturbados. El segundo grupo más grande (60) se registró únicamente en el cauce principal del río Lacantún. El resto de las especies se encontró mostrando diversos patrones dependiendo del grupo (Fig. 3), pero con más especies solamente en arroyos conservados (17) o compartiendo el cauce principal del Lacantún con arroyos perturbados (26) (Fig. 4). Como era de esperarse, estos resultados muestran que debe considerarse tanto el cauce principal del Lacantún, como sus ríos y arroyos tributarios.

Figura 2 Número de especies colectadas de todos los phyla por estación de muestreo en la cuenca media del río Lacantún. El orden de las estaciones es de oeste a este. Los nombres completos de las estaciones de muestreo aparecen en la Tabla 1.

Figura 3 Distribución de especies por phyla de acuerdo al tipo de cuerpo de agua en donde fueron registradas.

Figura 4 Distribución de todas las especies de acuerdo al tipo de cuerpo de agua en donde fueron registrados.
La curva acumulativa de especies muestra varios elementos importantes (Fig. 5). El primero es que las prospecciones iniciales del río Lacantún que se realizaron del 2004 al 2010, registraron hasta 64 especies de los grupos que aquí se tratan. Durante el desarrollo del presente proyecto se incrementó el número de especies registradas de 118 en 2011 a 167 en 2020, y, finalmente, con la revisión hecha para este estudio se llegó a 236 (Fig. 5).
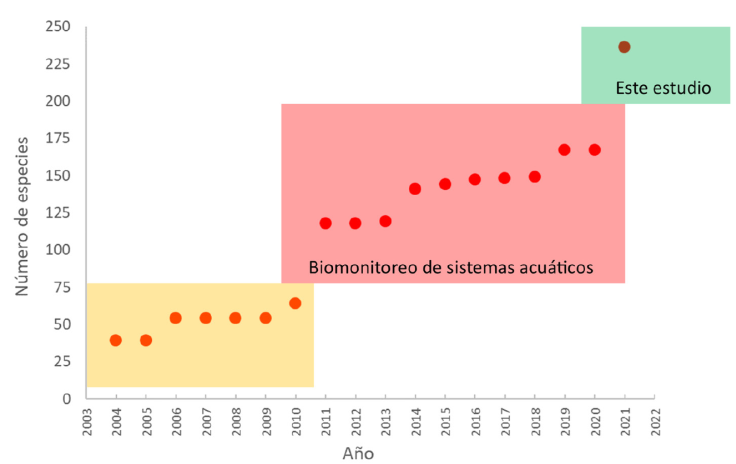
Figura 5 Número acumulativo de especies acuáticas registradas en la sub-cuenca del río Lacantún por año del 2004 al 2021, sombreado en amarillo están las estimaciones previas a este proyecto, sombreado en rojo son las estimaciones hechas durante el proyecto de “Biomonitoreo de sistemas acuáticos” y sombreado en verde la estimación hecha en este estudio.
La forma de la curva es difícil de interpretar pues sugiere que el incremento en el registro de especies continuará, aunque debido al alto número al que ya se ha llegado, esto parece poco probable. La compilación y actualización de la diversidad acuática en el área de estudio se ha llevado a cabo en diferentes etapas con diferentes intensidades de muestreo. La última fase del proyecto “biomonitoreo de sistemas acuáticos” se ha enfocado en grupos de especies poco conocidos y en la descripción de hallazgos previos, lo que puede explicar el salto de 167 a 236 especies que aquí se presenta.
Especies endémicas
Helmintos. Se registraron 11 especies endémicas de helmintos, platelmintos más nemátodos, todos parásitos de peces. Este nivel de endemismo no es particularmente alto, porque el río Lacantún alberga una muestra de las especies de helmintos que parasitan a los peces de la cuenca del río Usumacinta (Quiroz-Martínez y Salgado-Maldonado, 2013b; Salgado-Maldonado et al., 2014). Algunas de estas especies pueden señalarse actualmente como endémicas del río Lacantún; sin embargo, con los datos disponibles, estos señalamientos son únicamente tentativos.
En general, las especies de helmintos muestran una especificidad hospedatoria que los refiere a la familia de sus hospederos y no a especies particulares de hospederos, de forma que su distribución geográfica se explica con la distribución geográfica de las familias de hospederos (Salgado-Maldonado, 2006, 2008). Por esta razón, el número de endemismos registrado en los helmintos de peces del río Lacantún es bajo. En efecto, las familias de peces que hemos examinado en el Lacantún son las familias de más amplia distribución en Centroamérica, incluyendo a los carácidos, cíclidos, heptaptéridos e incluso poecílidos. Lo cual explica que el registro helmintológico actual de los peces del río Lacantún esté constituído primordialmente por helmintos de amplia distribución en los peces Centroamericanos.
Un caso interesante son los helmintos del gérrido, Eugerres mexicanus (Actinopterygii: Gerreidae), que tiene una distribución restringida a la cuenca media del río Usumacinta, incluyendo el río Lacantún. Su registro helmintológico incluye a los monogéneos Aristocleidus lacantuni y A. mexicanus y al nemátodo Rhabdochona juliacarabiasi, y posiblemente exhibirán una distribución geográfica en concordancia con la distribución de su hospedero, limitada a la cuenca media del río Usumacinta, incluyendo el Lacantún. De la misma manera, la fauna de monogéneos reconocida en el agujón maya Strongylura hubbsi, incluyendo Ancyrocephalus chiapanensis y Paracolpenteron hubbsiensis, puede ser considerada endémica del Usumacinta, de acuerdo con la distribución geográfica restingida del hospedero.
El nemátodo Spinitectus tabascoensis parásito de ictalúridos, solo ha sido registrado en poblaciones de peces de esta familia y en cuerpos de agua de la cuenca del Usumacinta, incluyendo el río Lacantún, lo que podría indicar que es endémica de la cuenca del Usumacinta.
La mayoría de los géneros son monotípicos en el área, pero algunos destacan por la diversidad que han alcanzado en los peces del río Lacantún, por ejemplo: Rhabdochona (5 y 1 por identificar), Cucullanus (3 y 3 por identificar), Spinitectus (3) y Procamallanus (3) en los nemátodos, Genarchella (3) en los tremátodos y Cacatuocotyle (3) y Urocleidoides (3) en los monogéneos. La familia de helmintos con mayor número de géneros en los peces del río Lacantún resultó Allocreadiidae (Trematoda) con 5 géneros. A su vez, las familias de peces más ricas en helmintos fueron: Characidae (29), Cichlidae (17), Poeciliidae (12) y Heptapteridae (7). Las especies de peces más parasitadas fueron: Astyanax brevimanus (Characidae) con 24 especies de helmintos, Vieja intermedia y V. bifasciata (Cichlidae) con 8 y Rhamdia guatemalensis (Heptapteridae), Eugerres mexicanus (Gerridae) y Atherinella alvarezi (Atherinidae) con 7.
Crustáceos. Dentro de las especies endémicas de crustáceos destacan el langostino Macrobrachium vicconi y los cangrejos Potamocarcinus chajulensis y Odontothelphusa lacanjaensis, que teniendo áreas de distribución muy reducidas, se han encontrado en todos los muestreos realizados. Las 3 especies presentan desarrollo larval abreviado, es decir, de los huevos eclosionan prejuveniles o juveniles que ya no requieren de migraciones para buscar áreas adecuadas para el desarrollo larval, típicamente áreas con aguas salobres. El resultado es que estas especies tienen áreas de distribución reducidas que se mantienen en las mismas zonas a través del tiempo, mostrando así un alto nivel de endemismo (Álvarez y Villalobos, 1998; Román et al., 2000).
Peces. Entre los peces, Lacantunia enigmatica (Lacantuniidae) y Batrachoides goldmani (Batrachoididae), ambas endémicas de las cuencas del Grijalva y el Usumacinta, han sido colectadas ocasionalmente a lo largo de los periodos de muestreo. Potamarius nelsoni y P. usumacintae (Ariidae) son especies cuya presencia en aguas dulces solo se conoce para el río Usumacinta (Betancur y Willink, 2007), también han sido capturadas en los últimos 3 años. Las siguientes especies también registradas en este estudio: Leptophilypnus guatemalensis (Eleotridae), Wajpamheros nourissati (Cichlidae), Maskaheros argenteus (Cichlidae), Kihnichthys ufermanni (Cichlidae), Rheoheros lentiginosus (Cichlidae), Theraps irregularis (Cichlidae) y Xenodexia ctenolepis (Poeciliidae), son mencionadas por Miller et al. (2009) como endémicas o nativas para el sistema Grijalva-Usumacinta.
Anfibios y reptiles. Ninguna de las 12 especies de anfibios y reptiles que se registran en este estudio son endémicas de la región. Dentro de los anuros, la especie con el menor intervalo de distribución, del río Lacantún hasta Honduras, es el sapo Incilius campbelli y dentro de los reptiles son, la tortuga blanca Dermatemys mawii, desde el sur de México a Honduras, y el cocodrilo Crocodylus moreletti, de Tamaulipas, México a Guatemala.
Especies introducidas
Helmintos. La introducción de especies de peces no nativos o la dispersión de éstas a partir de puntos secundarios hacia el río Lacantún ha traído entre otras consecuencias la introducción de helmintos parásitos. En este listado únicamente registramos 4 especies de helmintos introducidas a los peces del río Lacantún, incluyendo los monogéneos Heteropriapulus sp. de los “plecos” o “peces diablo” Pterygoplichthys pardalis y los monogéneos del género Jainus, parásitos en las branquias de Astyanax brevimanus. Se documenta también la presencia de otras 2 especies invasoras de helmintos, las metacercarias de Centrocestus formosanus y el céstodo asiático, Schyzocotyle acheilognathi.
Moluscos. Las especies introducidas de moluscos son 3: los gasterópodos Tarebia granifera y Melanoides tuberculata y el bivalvo Corbicula fluminea, todos de origen asiático (Pace, 1973). De éstas, las más abundantes son T. granifera y C. fluminea, mientras que Melanoides tuberculata es notablemente menos abundante.
Peces. Entre los peces se cuentan 9 especies introducidas. Las tilapias Oreochromis mossambicus, O. niloticus y O. aureus, además del guapote Parachromis managuensis, que arribaron como producto de su utilización en la acuicultura o el acuarismo (Ramírez-Martínez et al., 2015). Las especies de loricáridos Pterygoplichthys disjunctivus, P. pardalis y P. multiradiatus arribaron como producto del acuarismo y las carpas Ctenopharyngodon idella y Cyprinus carpio fueron introducidas para el control de vegetación acuática.
Especies de amplia distribución
Crustáceos. Dentro de los crustáceos se registraron 2 especies de langostinos que son de muy amplia distribución a lo largo de la costa Atlántica de América: Macrobrachium carcinus y M. heterochirus. La primera se distribuye de Florida, EUA, hasta el sur de Brasil, incluyendo las Antillas; mientras que la segunda de Veracruz, México a Sao Paulo, Brasil. Ambas especies pueden penetrar decenas de kilómetros tierra adentro a partir de las desembocaduras de ríos y alcanzar altitudes cerca de los 1,000 m, por lo que su presencia en el río Lacantún no es sorprendente (Mejía-Ortiz y Álvarez, 2010).
Moluscos. Los gasterópodos más ampliamente distribuidos son: Gundlachia radiata, presente desde sur de EUA, América Central, algunas zonas de Las Antillas hasta el norte de Sudamérica (Barbosa-dos Santos, 2003); Pomacea flagellata que se distribuye desde Tamaulipas, México, hasta el sistema hidrológico del río Magdalena, Colombia (Cowie y Thiengo, 2003); Cochliopina francesae, de los Pantanos de Centla, Tabasco, México a Guatemala (Goodrich y van der Schalie, 1937; Ortiz-Lezama et al., 2009; Trinidad-Ocaña et al., 2018); C. infundibulum, de la cuenca baja del Usumacinta en Tabasco, México a la región del Petén, Guatemala (Goodrich y van der Schalie, 1937; Thompson, 2011; von Martens, 1890-1901) y Drepanotrema lucidum, de Pantanos de Centla, Tabasco a Yucatán, Belice, Guatemala y Nicaragua (Bequaert y Clench, 1936; Paraense, 2000; Rangel-Ruiz y Gamboa-Aguilar, 2000; Thompson, 2011). En cuanto a los bivalvos uniónidos: Anodontites cylindracea se distribuye desde San Luis Potosí, Veracruz, Tabasco y Chiapas, México a Guatemala (Graf y Cummings, 2021); Delphinonaias largillierti de Tabasco, Yucatán y Chiapas, México a Belice, Guatemala y Honduras; (Graf y Cummings, 2021); Psoronaias crocodilorum desde Pantanos de Centla, Tabasco a Guatemala (Arévalo-de la Cruz et al., 2015; Graf y Cummings, 2007a, b); P. semigranosa se encuentra desde Texas, EUA, a Tamaulipas, San Luis Potosí, Querétaro, Veracruz, Tabasco, Chiapas y Guatemala (Graf y Cummings, 2021) y Megalonaias nervosa (se encuentra desde Minnesota, EUA a Guatemala (Pfeiffer et al., 2018).
Peces. En el grupo de los peces, destaca la mención de especies que requieren de la conectividad longitudinal del río. Especies como el peje lagarto Atractosteus tropicus (Lepisosteidae) y el sábalo Megalops atlanticus (Megalopidae), relativamente comunes en aguas costeras y las partes bajas del Usumacinta, llegan a ascender estos ríos y se presentan ocasionalmente dentro de la zona de estudio.
Anfibios y reptiles. Dentro de este grupo nuestros resultados muestran a Rhinella marina, el sapo gigante neotropical, distribuido originalmente en Centro y Sudamérica, pero ahora ampliamente introducido a todo el gran Caribe y a islas del Pacífico sur; asimismo, las ranas Agalychnis callidryas (sur de México a Colombia), Dendropsophus ebraccatus y D. microcephalus (de México a Ecuador y a Brasil, respectivamente), Trachycephalus typhonius (de México a Argentina) y Lithobates vaillanti (de México a Ecuador), tienen muy amplias distribuciones.
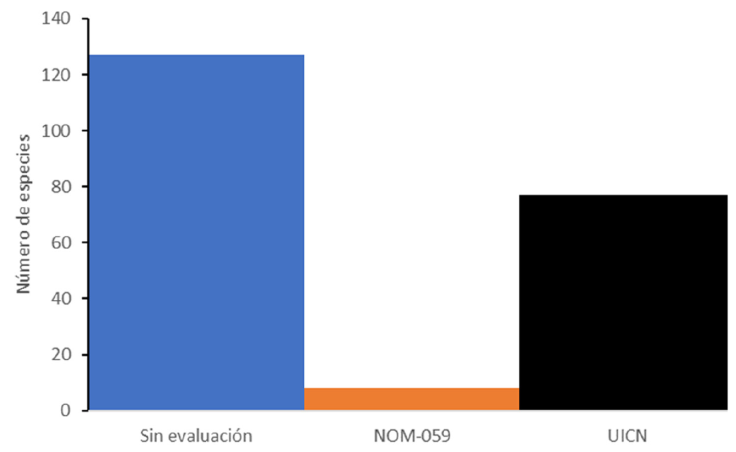
Con respecto al estatus de conservación, se consideraron 129 especies (crustáceos, moluscos, peces, anfibios y reptiles), pues los helmintos no se han tomado en cuenta en las evaluaciones de conservación. De las 129 especies, solamente 8 están en la NOM-059- SEMARNAT-2010. El primero es un molusco, el mejillón Megalonaias nervosa (Lea, 1834), categorizado como en peligro de extinción (como Megalonaias nickliniana (Lea, 1834), ver discusión). También están 4 peces: Lacantunia enigmáticaRodiles-Hernández, Hendrickson y Lundberg, 2005, categorizado como en peligro de extinción; Potamarius nelsoni (Evermann y Goldsborough, 1902), bajo protección especial; Rhamdia guatemalensis (Günther, 1864), bajo protección especial y Thorichthys socolofi (Miller y Taylor, 1984), como especie amenazada. Le sigue la rana Rhinophrynus dorsalis Duméril y Bibron, 1841, bajo protección especial; la tortuga Dermatemys mawii Gray, 1847, en peligro de extinción y el cocodrilo Crocodylus moreletii Duméril y Bibron, 1851, bajo protección especial. En contraste, 77 (60%) de las 127 especies consideradas tienen una evaluación por parte de la UICN. De éstas, 17 se clasifican con datos insuficientes (DD), 57 de menor preocupación (LC), 1 vulnerable (VU): Lacantunia enigmatica y 1 en crítico peligro de extinción (CR): Dermatemys mawii.
Discusión
En varias regiones de México se han llevado a cabo programas de muestreo de largo plazo, algunos que empezaron de manera ocasional y se fueron formalizando y otros que han tenido como objetivo desde el principio el describir los cambios en la biota a través de periodos multianuales. Similares al estudio “Monitoreo de los ambientes acuáticos de la cuenca media del río Lacantún”, que aquí presentamos, están los estudios hechos en Cuatro Ciénegas, Coahuila (Álvarez y Ojeda, 2019b), en la laguna de Alchichica, Puebla (Alcocer, 2019) o en Los Tuxtlas, Veracruz (Reynoso et al., 2017), todas áreas de gran diversidad e importancia. En todos estos estudios destaca que la visión general de la importancia y diversidad real de los ecosistemas solamente puede obtenerse a través de observaciones de largo plazo. Las fluctuaciones naturales de las poblaciones, un reemplazo continuo de especies y la variabilidad en los métodos y esfuerzos de muestreo, impiden que las estimaciones de la diversidad en grandes ecosistemas puedan conseguirse con muestreos ocasionales o con una cobertura temporal corta.
Helmintos. Una alta diversidad de helmintos parásitos refleja un ecosistema bien conservado que mantiene tanto hospederos finales como intermediarios y paraténicos. Los datos aquí aportados confirman que el río Lacantún es un “hotspot” de diversidad de helmintos parásitos de peces dulceacuícolas (Quiroz-Martínez y Salgado-Maldonado, 2013a, b; Salgado-Maldonado et al., 2014). El presente trabajo enlista 107 especies en los peces del río Lacantún, que comparativamente con otras cuencas (Atoyac 9, Ayuquila 15, Lerma 20, Tehuantepec 21, Pánuco 23, Balsas 28, Papaloapan 49, cuerpos de agua de la península de Yucatán 51; Quiroz-Martínez y Salgado-Maldonado, 2013a, b; Salgado-Maldonado, 2006), es la máxima diversidad reconocida en los cuerpos de agua dulce de México, que se explica por la alta diversidad de peces.
Crustáceos. Las especies registradas de crustáceos son las esperadas en el área de estudio (Álvarez et al., 2011). El conjunto de langostinos, endémicos y de amplia distribución, los cangrejos de agua dulce y un acocil, endémicos de la región, son las especies que se esperaría encontrar. Un aspecto relevante es que todas estas especies, salvo los langostinos de amplia distribución, han estado presentes en bajas densidades en todos los muestreos sugiriendo que son poblaciones estables.
Moluscos. Los nuevos registros de gasterópodos para el país son: Aroapyrgus cf. conchensensis, Cochliopina dulcensis, Cochliopina hinkleyi y Pachychilus (Potamanax) sargi. Todas estas especies forman parte de la fauna malacológica de Guatemala. Contrastan los registros de Aroapyrgus pasionensis, Cochliopina hinkleyi y Planorbella trivolvis que se encuentran, hasta ahora, únicamente en el río Tzendales; Psoronaias martensi y P. percompressa solamente se han hallado en el río Lacanjá; mientras que Cochliopina dulcensis, descrita del río Dulce, Guatemala (Marshall, 1920), se encuentra en el arroyo Lagarto, en el río Tzendales y en el río Lacanjá. Por otra parte, el hábitat de las especies del género Cochliopina en los arroyos está restringido a una angosta zona ligeramente arriba de la línea del oleaje (Morrison, 1946); tal patrón lo encontramos de forma notoria en el litoral del río Tzendales. La presencia de Pachychilus sargi con unos cuantos ejemplares en el río Ixcán, es posiblemente un efecto de arrastre o sugiere que habitó el río en otro tiempo, ya que no se encontraron ejemplares vivos ni en concha en ninguna otra estación de muestreo.
La pequeña especie pateliforme Gundlachia radiata se distribuye ampliamente en todas las esteaciones de muestreo, excepto en el río Chajul. Gundlachia radiata habita cuerpos de agua lénticos, con poca corriente, no contaminados, sobre o debajo de hojas en descomposición, o sobre tallos o ramas (Barbosa-dos Santos, 2003). Las familias más diversas en este sistema comprenden a los bivalvos Unionidae (13 spp.) y a los gasterópodos Cochliopidae (7) y Planorbidae (6); a nivel nacional, las familias Cochliopidae y Planorbidae han sido reconocidas como las más diversas (Czaja et al., 2020).
La especie Megalonaias nickliniana (Lea, 1834) se ha categorizado como en peligro de extinción desde 1976 por la Convention on International Trade in Endangered Species (CITES, Appendix 1) y por el United States Fish and Wildlife Service (USFWS). Hasta antes de 2018, se asumía que el género Megalonaias constaba de 2 especies: M. nervosa (Rafinesque, 1820) y M. nickliniana. Pfeiffer et al. (2018) analizaron 40 poblaciones de Megalonaias de Minnesota a Guatemala que mostraron diferencias menores a 1% en el CO1 y el ITS1 no mostró variación. Se concluyó que Megalonaias nickliniana es un sinónimo junior de Megalonaias nervosa. Por tanto, el género es monotípico y esta almeja no se encuentra en riesgo de extinción.
El género Megalonaias es particular dentro de la subfamilia Ambleminae por poseer un ámbito de distribución muy amplio, otros ambleminos poseen ámbitos de distribución restringida y por ser huésped-generalista, ya que sus larvas pueden desarrollarse en varios géneros de peces de varias familias, al contrario de otros ambleminos que utilizan una sola especie o especies emparentadas cercanamente. Además, su larva se puede enquistar en las agallas de los peces y posee una cuerda larvaria, estrategias que comparte con otros linajes de almejas generalistas (Unioninae, Hiriidae) (Pfeiffer et al., 2018).
En México, Megalonaias nervosa (como Megalonaias nickliniana - Unio nicklinianus) ha sido registrada en Tamaulipas y Tabasco; además de otros registros con el rótulo: “México”, con localidades en el río Usumacinta en Guatemala (Graf y Cumming, 2021).
Nuestros resultados muestran que la cuenca media del río Lacantún es un sitio altamente diverso (32 especies), hasta ahora el más diverso de México si se contrasta con la riqueza calculada a nivel de estado de los más diversos, como Tabasco (con 35 especies), San Luis Potosí, Coahuila (ambos con 32 especies) y Veracruz (con 28 species; Czaja et al., 2020). Al comparar el número de moluscos dulceacuícolas habitantes del río Lacantún con la diversidad en otras regiones del mundo, nuestra fauna (32 especies, sin incluir las introducidas) está por debajo de la diversidad del río Tombigee-Alabama, de la cuenca de la bahía de Mobile, EUA, con “110-118” especies, pero por encima del río del bosque de las tierras bajas al oeste de Guinea y la Costa de Marfil que contienen 28 especies (Strong et al., 2008).
Peces. La cuenca del Usumacinta es una de las de mayor diversidad íctica en el país. En su porción mexicana, el Usumacinta alberga 172 especies en un área aproximada de 307,000 km2 (Soria-Barreto et al., 2018). A ello hay que añadir las varias especies que podrían ocurrir en Guatemala y Belice. Además de ser una cuenca rica en especies, existen posibilidades de aumentar la riqueza de la cuenca con base en nuevos estudios taxonómicos y sistemáticos (Soria-Barreto et al., 2018).
Aunque la cuenca del Usumacinta está sometida a fuertes alteraciones producto de la contaminación y el cambio del uso de suelo, es importante destacar que aún no ha sido fuertemente afectada en su porción mexicana por la alteración hidrológica, producto de la construcción de infraestructura hidráulica (e.g., grandes presas). Esto permite la permanencia de flujos relativamente naturales que ayudan a la conectividad longitudinal del ecosistema y posibilita la presencia de taxones marinos con hábitos migratorios, como algunos miembros de las familias Centropomidae, Megalopidae y Mugilidae.
Espinosa-Pérez et al. (2019) registraron 71 especies de peces en el río Lacantún, lo que contrasta con las 78 que aquí se reportan (Tabla 2, Apéndice). Si consideramos que en México hay unas 505 especies de peces dulceacuícolas (Espinosa-Pérez, 2014), entonces la subcuenca del río Lacantún tiene 15.4% de la diversidad total, dentro de la cual destaca la gran riqueza de Cichlidae y Poeciliidae, las familias más características del a ictiofauna mesoamericana.
Anfibios y reptiles. Se asume que la diversidad de anfibios y reptiles acuáticos en el área es mucho mayor a lo aquí reportado, puesto que las estaciones de muestreo no fueron las ideales para el registro de estos grupos. De igual manera muchas de estas especies pueden utilizar los cuerpos de agua por periodos diferentes y, por lo tanto, puede ser difícil encontrarlos directamente con especies totalmente acuáticas. Ramírez et al. (2015) reportaron 28 especies de ranas para la RBMA, mientras que en nuestro estudio solamente se registraron 12, la mayoría de amplia distribución y sin consideraciones importantes sobre su estado de conservación; asimismo, registraron 7 especies de tortugas, algunas de las cuales se encuentran en pozas o pantanos, que no formaron parte de nuestra red de estaciones. Como resultados de este estudio, destacan la tortuga blanca y el cocodrilo mexicano como 2 especies con áreas de distribución restringidas y que se categorizan como en peligro de extinción la primera y como protegida la segunda.
Especies introducidas
Helmintos. La fauna invasiva de monogéneos en los peces del Lacantún debe ser mayor, puesto que las tilapias africanas y las carpas asiáticas son abundantes en la zona. La introducción de monogéneos de las tilapias a los peces nativos ha sido documentada en otros cuerpos de agua del país, por ejemplo el Lago de Catemaco, Veracruz (Jiménez-García et al., 2001; Salgado-Maldonado y Rubio-Godoy, 2014). La fauna de monogéneos introducidos con las carpas asiáticas en otras partes del mundo es muy diversa, sin embargo, para México no se ha documentado.
Las formas adultas de C. formosanus son parásitos de aves ictiófagas. El único registro de adultos en México es en una garza, Butorides striatus de Morelos (Scholz et al., 2001). Se asume que esta especie invasora procede del Medio Oriente y se ha introducido y dispersado en México junto a su hospedero intermediario, el caracol invasor Melanoides tuberculata (Thiaridae) que es el único hospedero intermediario registrado experimentalmente y en ambientes naturales en México (Scholz et al., 2001). Sin embargo, en el sureste asiático, específicamente en Tailandia, se ha registrado a otro tiárido Tarebia granifera como hospedero intermediario frecuente para esta especie (Dechruksa et al., 2007; Veeravechsukij et al., 2018). De forma que el registro de T. granifera en la cuenca media del río Lacantún en el presente trabajo sugiere que éste pudiera ser otro hospedero intermediario para C. formosanus. Este caracol supera en la amplitud de su distribución y en abundancia en el Lacantún a M. tuberculata. La presencia de estos tiáridos en el río Lacantún explica el registro de las metacercarias de C. formosanus en los peces de estos ambientes. La extensión de la distribución espacial en el Lacantún y abundancia de T. granifera, comparativamente con la de M. tuberculata, sugiere que la presencia de C. formosanus en México, sus rutas de inmigración o introducción y de dispersión, necesitan de mayores datos empíricos para interpretar la amplia distribución y presencia de estas metacercarias invasoras presentes en la ictiofauna dulceacuícola del país (Salgado-Maldonado, 2006).
El céstodo asiático, S. acheilognathi, es la especie de helminto parásito de peces dulceacuícolas más exitosa en todo el mundo, considerando la amplitud actual de su distribución geográfica y el número de especies de peces en que se ha registrado (Kuchta et al., 2018). Es una especie que produce patología de importancia en sus peces hospederos, principalmente en crías y en peces de tallas pequeñas (Salgado-Maldonado y Pineda-López, 2003). La repetida introducción de carpas asiáticas con fines de acuicultura a incontables cuerpos de agua de México, ha favorecido su amplia dispersión en el país (Salgado-Maldonado y Pineda-López, 2003). La presencia de S. acheilognathi en los peces del río Lacantún, y en general en los cuerpos de agua de Chiapas, se conoce desde hace más de 30 años (Velázquez-Velázquez et al., 2016). La magnitud de esta invasión ha sido documentada en la cuenca endorreica del San Cristóbal, en Profundulidae, peces endémicos y originarios de Centroamérica, con relación a la introducción de carpas en criaderos hace más de 50 años (Velázquez-Velázquez et al., 2016).
Moluscos. Tres especies muy invasivas de moluscos ya ampliamente distribuidas en México han sido registradas en la cuenca media del Lacantún: el bivalvo Corbicula fluminea y los gasterópodos Tarebia granifera y Melanoides tuberculata. En mayo de 2008 se dio el primer avistamiento de T. granifera en el playón del río Lacantún, frente al pueblo “Adolfo López Mateos” y en el arroyo Lagarto en la misma campaña. Coincidentemente, en mayo de 2008 hallaron a T. granifera en la cuenca baja del sistema hidrológico Grijalva-Usumacinta en la laguna Tintal, municipio de Centla, Tabasco (Rangel-Ruiz et al., 2011). Corbicula fluminea fue localizada en un brazo del río Lacantún frente al pueblo Playón de la Gloria en mayo de 2009. Barba-Macías y Trinidad-Ocaña (2017) registraron a la misma especie en 40 humedales del sistema hidrológico Grijalva-Usumacinta en Tabasco y Chiapas. En contraste, Melanoides tuberculata fue registrada con escasos ejemplares en el río Ixcán en enero de 2017, y en abril del mismo año, en el arroyo Lagarto, con pocos ejemplares también. Esta especie había sido registrada en la cuenca del río Grijalva, Villahermosa, en octubre de 1987 (Contreras-Arquieta et al., 1995).
Se ha comentado ampliamente sobre los efectos de estas especies en ambientes fuera de su ámbito de distribución: desplazamiento de especies nativas, pérdida de la diversidad a nivel global y aclaramiento de la turbidez del agua con cambios en las comunidades de la microbiota (Naranjo-García y Olivera-Carrasco, 2014). En este sistema fluvial se ha observado un posible cambio de hábitos, ya que el bivalvo C. fluminea está siendo utilizado como alimento de algún animal en los arroyos Manzanares y Lagarto, donde se han hallado restos de conchas con muestras de depredación. Lo mismo se ha observado en otros países, como en Brasil, donde 2 aves acuáticas están cambiando sus hábitos de alimentación con la presencia de C. fluminea (Sazima y D’Angelo, 2013) y en Texas, donde en los 50 años de la presencia de C. fluminea, las tortugas hembra Graptemys versa cambiaron su tipo de alimentación, antes variada, a basada casi exclusivamente en esta almeja; lo opuesto ocurre con los machos que no han modificado su dieta (Lindeman, 2006).
Peces. Los ciprínidos Ctenopharyngodon idella y Cyprinus carpio, y 3 especies de pez diablo del género Pterygoplichthys son capaces de reducir la diversidad y causar grandes daños a la biota nativa desplazando especies raras o endémicas (Barrientos et al., 2018; Morales-Hernández y Rodiles-Hernández, 2000). Todas ellas tienen una amplia distribución en las aguas continentales de México.
Las especies de cíclidos no nativos de la cuenca, probablemente iniciaron su invasión del Usumacinta en la década de 1980, como producto de esfuerzos gubernamentales para la diseminación de ejemplares para el desarrollo acuícola. Los loricáridos quizás comenzaron su dispersión en la década de 1990, producto probablemente del acuarismo (Wakida-Kusunoki y Amador-del Ángel, 2008; Wakida-Kusunoki et al., 2007). Específicamente, este último grupo ha tenido efectos importantes sobre la estabilidad de las orillas de río y juega parte, cada vez más importante, de interacciones con la fauna nativa (Gaitán et al., 2020).
La carpa Ctenopharyngodon idella se registró por primera vez, formalmente, en 1996 en el Lacantún, pero testimonios de pescadores sugieren que apareció en la zona en 1987 (Morales-Román y Rodiles Hernández, 2000). Por su parte, Cyprinus carpio parece ser más abundante en aguas abajo del área de estudio que aquí se cubre, en donde se presenta solo ocasionalmente (Mendoza-Carranza et al., 2018).
Estatus de conservación
Es claro que muchos grupos biológicos en México requieren de evaluaciones actualizadas de su estado de conservación. Aunque se cuenta con la metodología establecida por la autoridad ambiental (Sánchez et al., 2007), es frecuente que no se cuente con los datos mínimos para realizar las evaluaciones. Con los datos aquí presentados será posible realizar evaluaciones que ayuden a orientar los esfuerzos hacia ciertos grupos y localidades.
Es notable que se tengan 77 especies evaluadas con el protocolo de la UICN, versus solamente 8 en la NOM-059-SEMARNAT-2010 (Fig. 6). Por ejemplo, 3 especies de crustáceos, endémicos de la región, el langostino Macrobrachium vicconi y los cangrejos Odontothelphusa lacanjaensis y Potamocarcinus chajulensis, calificarían por lo menos como especies amenazadas por su distribución restringida. Otras especies dentro de este listado pueden ahora ser evaluadas para asignarles un estatus de riesgo para que la región pueda contar con protección adicional por contener una variedad de especies amenazadas.
Importancia del monitoreo de largo plazo
Debido a muchas limitantes, como el financiamiento continuo, la formación de un grupo de trabajo que se mantenga a través de los años, el seguimiento de un protocolo estandarizado de muestreo y recolección de datos, o bien, que el ecosistema que se estudia conserve su integridad para poder seguir siendo estudiado, es que los monitoreos de largo plazo son igualmente raros como valiosos (Sutter et al., 2015). El definir claramente y desde un inicio los objetivos y alcances del proyecto de monitoreo, es de la mayor importancia, puesto que la inversión de tiempo y esfuerzo no se puede recuperar en caso de detectar deficiencias en el planteamiento original.
El “Programa de monitoreo de los ambientes acuáticos de la Selva Lacandona” que aquí se reporta, se ha llevado a cabo por más de 10 años con, básicamente, el mismo equipo de trabajo y con financiamiento continuo. Los resultados muestran que la cuenca media del río Lacantún es un “hotspot” de diversidad acuática, que el recambio de especies a través del periodo de monitoreo ha sido intenso, pues su número se sigue incrementando con el mismo protocolo de muestreo. Se aprecia también que las especies introducidas aún no han tenido un impacto visible sobre las especies nativas; sin embargo, ya son notorios los debilitamientos y erosión de las orillas del río en algunas secciones debido a las madrigueras de los peces diablo, o a los tapetes del caracol Tarebia granifera y a la acumulación de conchas de la almeja Corbicula fluminea en varios tributarios del Lacantún.
Pero más allá de la acumulación de datos, un programa de monitoreo de largo plazo debe servir para implementar acciones sobre la conservación del ecosistema y para darle seguimiento a éstas, para definir políticas públicas ligadas al uso sustentable y para establecer redes de monitoreo en diversos ecosistemas (Haase et al., 2018). El caso particular del “Programa de monitoreo de los ambientes acuáticos de la Selva Lacandona” es una oportunidad única para continuar generando datos sobre el comportamiento de la diversidad acuática en, probablemente, el sitio más biodiverso de México.











 text new page (beta)
text new page (beta)