Introducción
El aumento en la introducción de especies va de la mano con el imparable crecimiento poblacional humano y su desarrollo urbano. Por ello, en los últimos años el estudio de las invasiones biológicas ha tomado mayor interés entre la comunidad científica (Elton, 1958; Richardson y Pyšek, 2008). La introducción de especies puede tener efectos socioeconómicos y ecológicos en los sitios receptores, ya que éstas se pueden convertir en especies invasoras (Pimentel et al., 2005; Richardson et al., 2000). Para mitigar tales efectos es necesario estudiar la biología de las especies introducidas, y llevar a cabo estudios en los sitios de nueva ocupación, a fin de conocer las interacciones ecológicas que han desarrollado. Entre las especies invasoras uno de los grupos más estudiados es el de las aves, para las cuales se ha propuesto que su éxito invasor se debe principalmente al oportunismo ecológico, es decir, que las aves invasoras son capaces de explotar recursos que las aves nativas no usan (Beissinger y Osborne, 1982; MacGregor-Fors et al., 2011; Sol et al., 2012; Zuria et al., 2012).
Las ciudades son un punto clave en el estudio de las especies invasoras, pues muchas especies exóticas se benefician de las zonas urbanas por ser islas térmicas, fuentes seguras de alimento todo el año, áreas con escasos depredadores naturales y por presentar una alta disponibilidad de sitios para anidar (Chace y Walsh, 2006; Evans et al., 2009), aun cuando las ciudades significan hábitats fragmentados con disturbios constantes y contaminación de suelo, agua y aire (Shanahan et al., 2014). La urbanización tiende a favorecer a aves granívoras y omnívoras, además de aquellas que anidan en huecos, por lo que la composición vegetal y la estructura de las zonas urbanas son características importantes para el establecimiento de especies invasoras (Chace y Walsh, 2006). En la ciudad de Querétaro la paloma de collar turca (Streptopelia decaocto), el perico monje argentino (Myiopsitta monachus), el mirlo dorso canela (Turdus rufopalliatus) y el estornino pinto (Sturnus vulgaris) son especies exóticas de reciente introducción con potencial invasor. Los primeros registros en Querétaro del estornino pinto y del mirlo dorso canela se documentaron en el 2009 y en el 2011 se registró a la paloma de collar turca y al perico monje argentino (Pineda-López y Malagamba-Rubio, 2009, 2011).
Se sabe que estas especies interactúan con especies de aves locales que pueden verse afectadas por competencia, desplazamiento o agresión interespecífica como la paloma de alas blancas, la tortolita canela, el mirlo primavera, el gorrión doméstico y el carpintero cheje (Chablé-Santos et al., 2012; Ingold, 1996; Macgregor-Fors et al., 2011). Después del 2011 se han realizado pocas observaciones sistemáticas de estas especies en Querétaro (Pineda-López et al., 2013), por lo que los objetivos de este estudio fueron analizar las preferencias de hábitat de la paloma de collar turca, el perico monje argentino, el mirlo dorso canela y el estornino pinto, así como su ocupación y abundancia en áreas verdes de la ciudad de Querétaro e identificar coexistencias con las especies de aves locales. Esperamos inicialmente que las especies estudiadas estuvieran relacionadas con diferente intensidad a la cobertura vegetal de las áreas verdes urbanas, y que co-ocurrieran con especies que favorecieran su establecimiento, como el carpintero cheje con el estornino pinto, o que no coocurrieran con posibles especies competidoras, como la paloma de alas blancas con la paloma de collar turca.
Materiales y métodos
El muestreo de poblaciones de aves se llevó a cabo con observaciones directas en puntos de conteo fijos de 50 m de radio, ubicados cada 100 m en 19 áreas verdes (unidades de muestreo, de aquí en adelante) dentro de la zona urbana de Querétaro (fig. 1). Estas unidades de muestreo se escogieron debido a que las especies de aves exóticas suelen establecerse primero en áreas urbanas para después colonizar otras zonas, además de que se favorecen con la vegetación no nativa (Camacho-Cervantes y Schondube, 2018). El tamaño de las unidades de muestreo fue variable: las más pequeñas contaron con un solo punto de conteo, mientras que las más grandes contaron con hasta 23 puntos de conteo. Se ubicaron un total de 100 puntos de conteo en las 19 unidades de muestreo, las cuales incluyen áreas verdes en escuelas, parques públicos, un panteón y zonas residenciales (tabla 1). En estas unidades se ha documentado la presencia de las aves exóticas en estudios anteriores y con registros ocasionales no publicados (Malagamba-Rubio et al., 2013; Pineda-López y Malagamba-Rubio, 2009, 2011; Pineda-López et al., 2013).
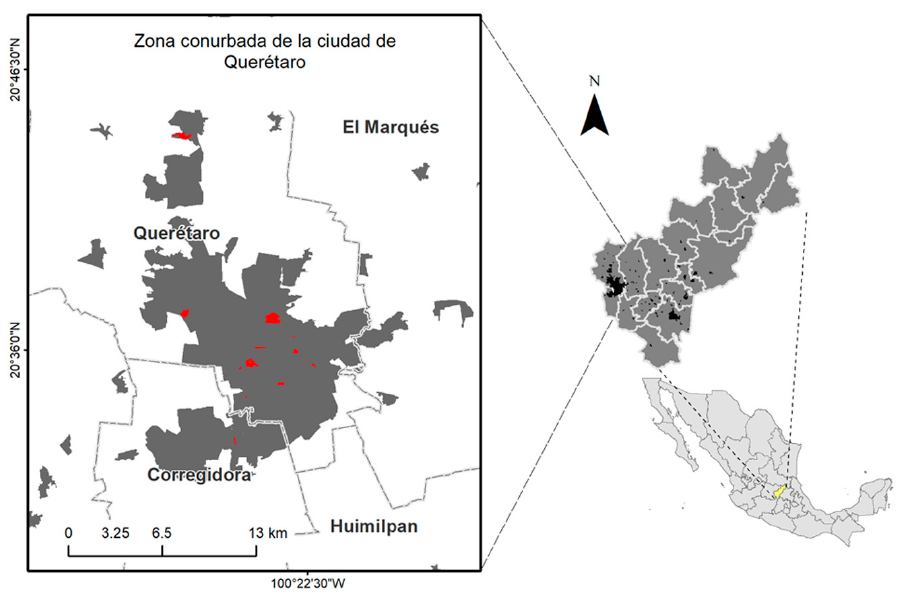
Figura 1 Localización del área de estudio en México y el estado de Querétaro (derecha), y dentro de la zona urbana de la ciudad de Querétaro (izquierda). Los polígonos más oscuros muestran las zonas urbanas y los rojos las unidades de muestreo.
Tabla 1 Tamaño, cantidad de puntos de conteo y ubicación de las unidades de muestreo en la ciudad de Querétaro.
| Unidad de muestreo | Tamaño (ha) | Puntos de conteo | Coordenadas geográficas |
|---|---|---|---|
| Álamos | 1.80 | 2 | 20°36’30.86”N, 100°23’2”O |
| Alcanfores | 5.87 | 7 | 20°36’6”N, 100°24’22”O |
| Alfalfares | 19.69 | 8 | 20°37’25”N, 100°27’2”O |
| Bicentenario | 29.18 | 12 | 20°43’57.22”N, 100°27’6.21”O |
| Bosques del Acueducto | 0.36 | 1 | 20°35’40.35”N, 100°22’33.35”O |
| Carretas | 3.57 | 4 | 20°35’26”N, 100°22’17”O |
| Cerro de las Campanas | 4.04 | 3 | 20°35’36.08”N, 100°24’37.01”O |
| C.U UAQ | 28.70 | 15 | 20°35’29.45”N, 100°24’36.29”O |
| Inst. Queretano San Javier | 9.24 | 6 | 20°35’55.07”N, 100°22’59.85”O |
| Italia | 2.17 | 2 | 20°35’19.92”N, 100°25’2.05”O |
| Jardín Zenea | 0.48 | 1 | 20°35’34.09”N, 100°23’31.46”O |
| Jardines de la Hacienda | 1.49 | 2 | 20°34’13”N, 100°24’47”O |
| Jardines de Querétaro | 0.20 | 1 | 20°35’46.26”N, 100°22’51”O |
| Las Plazas | 0.07 | 1 | 20°34’18.99”N, 100°25’3.55”O |
| Panteón mpal. de Querétaro | 8.45 | 6 | 20°34’45”N, 100°23’29”O |
| Parque Querétaro 2000 | 56.59 | 23 | 20°37’6.83”N, 100°23’50.28”O |
| Pie de la Cuesta | 0.19 | 1 | 20°37’49.32”N, 100°24’28.29”O |
| Tejeda | 3.74 | 4 | 20°32’34.59”N, 100°25’11.91”O |
| Wenceslao | 0.22 | 1 | 20°34’59.19”N, 100°23’21.34”O |
El muestreo se realizó de enero a diciembre del 2018 para incluir las 4 estaciones del año, visitando todas las unidades por triplicado en cada estación durante las primeras 4 horas a partir de la salida del sol. Se registraron todos los individuos de cada especie detectados visualmente en cada punto de conteo durante 5 minutos con ayuda de binoculares Vortex 10 × 32 mm (Fuller y Langslow, 1984). La identificación a nivel de especie se realizó con ayuda de la guía de campo Sibley (Sibley, 2016). Además, se registraron las conductas agresivas interespecíficas. En caso de alguna agresión, se agregaron 5 minutos de observación para documentar mejor dicha conducta.
La abundancia y la ocupación se analizaron por cada estación del año. Se consideró para cada estación el número máximo de individuos observados en alguna de las 3 repeticiones en cada punto (Johnson, 2008) y, posteriormente, se obtuvo la abundancia por unidad de muestreo sumando las abundancias máximas de puntos no contiguos (únicamente para la abundancia), lo que permitió evitar en lo posible el conteo doble de un mismo individuo. La ocupación se consideró como la cantidad de unidades de muestreo en donde se registró a cada especie.
Las variables ambientales que se midieron fueron: la cobertura arbórea (CA), arbustiva (Ca), de pasto (CP), de pasto sintético (CPS), de zonas impermeables (CZI, como pavimento, concreto y edificios) y de suelo desnudo (CSD); además la altura arbórea máxima (AMA), la densidad foliar máxima (DFM), el diámetro máximo a la altura del pecho (DAP), el área (A), el perímetro (P), el índice de forma (SHAPE) y la distancia al borde urbano (DBU) de cada unidad de muestreo. Las coberturas, áreas, perímetros y distancias al borde urbano se obtuvieron mediante el programa QGIS versión 3.10 (QGIS Development Team, 2020). En el caso de la distancia al borde urbano, se utilizó la herramienta de medición de distancia de dicho programa; la densidad foliar máxima se obtuvo con un densiómetro esférico cóncavo, el valor obtenido por la cuadrícula se multiplicó por 1.04 y restado a 100. El índice de forma se obtuvo multiplicando 0.25 por el valor del perímetro y dividiéndolo entre la raíz cuadrada del área (McGarigal, 2015).
Para analizar los cambios estacionales, se sumaron las abundancias de aves exóticas de cada unidad de muestreo, lo que permitió obtener el total por estación. Posteriormente, los datos se acomodaron en una tabla de contingencia y se aplicó una prueba de chi cuadrada (Brown y Rothery, 1993; Zar, 2010). Los cambios en la ocupación se analizaron con la misma prueba, utilizando la cantidad de unidades de muestreo con registro de las especies estudiadas.
Para identificar la preferencia de hábitat de acuerdo con las características de las unidades de muestreo, se redujeron las variables ambientales mediante un análisis multivariado de componentes principales (PCA) con una matriz de correlación (Wold et al., 1987). Posteriormente, mediante un análisis de correspondencia canónica (CCA), se evaluó la relación entre las condiciones ambientales de las unidades de muestreo y la ocupación de las especies (Legendre y Legendre, 1998). Se realizaron 2 CCA para cada temporada, el primero con valores de presencia-ausencia y el segundo con valores de abundancia. Se determinó la significancia de cada CCA con una prueba de 999 permutaciones y se estimó la fracción de variación explicada obteniendo el valor de R2 ajustado (Borcard et al., 2018). Se seleccionó el CCA con mayor porcentaje de variación explicada y se extrajo la posición de las especies respecto a los 2 primeros ejes canónicos del CCA seleccionado (puntajes, de aquí en adelante). Se realizó un agrupamiento jerárquico con el método de Ward utilizando dichos puntajes, y posteriormente se determinó el número de grupos con base en el índice de Calinski-Harabasz (Borcard et al., 2018). La preferencia de hábitat y la coexistencia entre especies locales y exóticas se estimaron mediante dicho CCA. Los análisis estadísticos fueron realizados utilizando el programa Past 3.19 (Hammer et al., 2001) y el paquete Vegan (Oksanen et al., 2017) para R 3.5.2.
Resultados
A lo largo del año de muestreo, se registró un total de 71 especies de aves (tabla S1, material suplementario). Al considerar a las especies que son objeto del presente estudio, la más abundante fue el perico monje argentino seguido por la paloma de collar turca. Las abundancias máximas observadas fueron, para la paloma de collar turca, 73 individuos en primavera, para el perico monje argentino, 77 en verano, para el mirlo dorso canela, 51 en verano, y para el estornino pinto, 54 en invierno (fig. 2). La abundancia total de las especies muestreadas presentó diferencias durante las estaciones (chi cuadrada: 57.569, g.l: 9, p < 0.0001) y estas se presentaron agrupadas. A nivel de punto de conteo, el perico monje argentino presentó agrupaciones de hasta 32 individuos durante el otoño, la paloma de collar turca de 15 individuos en primavera, el mirlo dorso canela de 9 individuos en otoño y el estornino pinto de hasta 16 individuos en invierno. Por otro lado, las especies no presentaron diferencias estacionales en su ocupación (chi cuadrada: 6.6779, g.l: 9, p 0.67062). La paloma de collar turca fue la especie con mayor ocupación en la ciudad de Querétaro, con presencia en 79% de las unidades de muestreo durante la mayor parte del año (fig. 3).
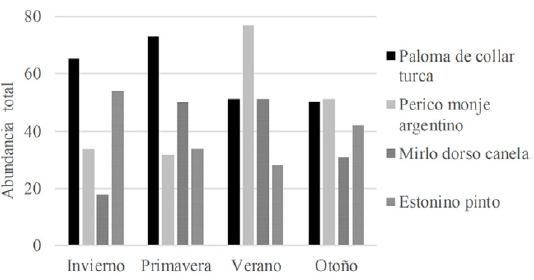
Figura 2 Abundancia de las especies estudiadas para las diferentes estaciones del año dentro de las unidades de muestreo en la ciudad de Querétaro.
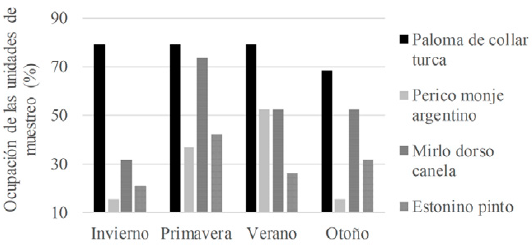
Figura 3 Ocupación de las unidades de muestreo por las especies estudiadas durante las diferentes estaciones del año en la ciudad de Querétaro.
Se obtuvieron 3 componentes principales que agrupan una varianza total de 70.4% (fig. 4). El primero está formado por las variables A, P, CA, CPS, Ca, CP y CZI, que presentan 45.1% de la varianza. Este grupo de variables fue denominado tamaño-heterogeneidad (TH), ya que refleja la asociación del área de las unidades de muestreo con la diversidad de coberturas. El segundo está conformado por las variables DAP, DBU, DFM y AMA, que agrupan 13.7% de la varianza y se denominó complejidad arbórea-antigüedad (CAA) porque agrupa árboles altos, de gran densidad foliar y un DAP mayor, que se ubican principalmente en parques más céntricos y antiguos. El tercero agrupa las variables AMA y SHAPE con valores positivos, y Ca, DAP, CPS y CSD con valores negativos, integra 11.6% de la varianza y se nombró altura-forma (AF).

Figura 4 Análisis PCA. Variables ambientales: A (área), AMA (altura máxima arbórea), CA (cobertura arbórea), Ca (cobertura arbustiva), CP (cobertura de pasto), CPS (cobertura de pasto sintético), CSD (cobertura de suelo desnudo), CZI (cobertura de zonas impermeables), DAP (diámetro a la altura del pecho), DBU (distancia al borde urbano), DFM (densidad foliar máxima), P (perímetro), SHAPE (forma). Componentes principales: TH (tamaño-heterogeneidad), CAA (complejidad arbórea-antigüedad), AF (altura-forma).
Después de realizar los CCA con valores de presencia-ausencia y abundancia, el valor ajustado de R2 fue mayor para los datos de presencia-ausencia (tabla 2), por lo que se utilizó esta matriz binaria para explicar la preferencia de hábitat y la coexistencia. Los resultados del CCA (fig. 5) indicaron que la paloma de collar turca presentó preferencia por sitios de forma irregular con poca diversidad de coberturas y árboles altos de bajo DAP (componente AF) y por sitios cercanos al borde urbano y poca complejidad arbórea (componente CAA) durante primavera y otoño. La mayor parte del año, el perico monje argentino mostró preferencia por sitios con gran complejidad arbórea y alejados del borde urbano (componente CAA), y durante el otoño por sitios grandes y heterogéneos (componente TH). El mirlo dorso canela mostró preferencia de hábitat constante durante el año de muestreo hacia sitios alejados del borde urbano, con forma irregular y no muy grandes con gran complejidad arbórea (componentes AF y CAA). La mayor parte del año, el estornino pinto mantuvo su preferencia de hábitat hacia sitios alejados del centro de la ciudad, en áreas verdes donde usualmente el estrato arbóreo es joven, por lo que es poco denso, de baja altura y bajo DAP (componente CAA), y mostró una preferencia por áreas verdes con gran extensión y variedad de estratos vegetales (componente TH) durante verano y otoño.
Tabla 2 Análisis de significancia del CCA usando valores de presencia-ausencia y abundancia.
| Variables de respuesta | Valor | Invierno | Primavera | Verano | Otoño |
|---|---|---|---|---|---|
| Presencia- ausencia | F | 2.80 | 2.06 | 2.41 | 2.23 |
| p | 0.001 | 0.001 | 0.001 | 0.004 | |
| R2 ajustado | 0.23 | 0.15 | 0.19 | 0.17 | |
| Abundancia | F | 1.93 | 1.78 | 1.84 | 1.75 |
| p | 0.039 | 0.008 | 0.049 | 0.046 | |
| R2 ajustado | 0.14 | 0.12 | 0.13 | 0.11 |
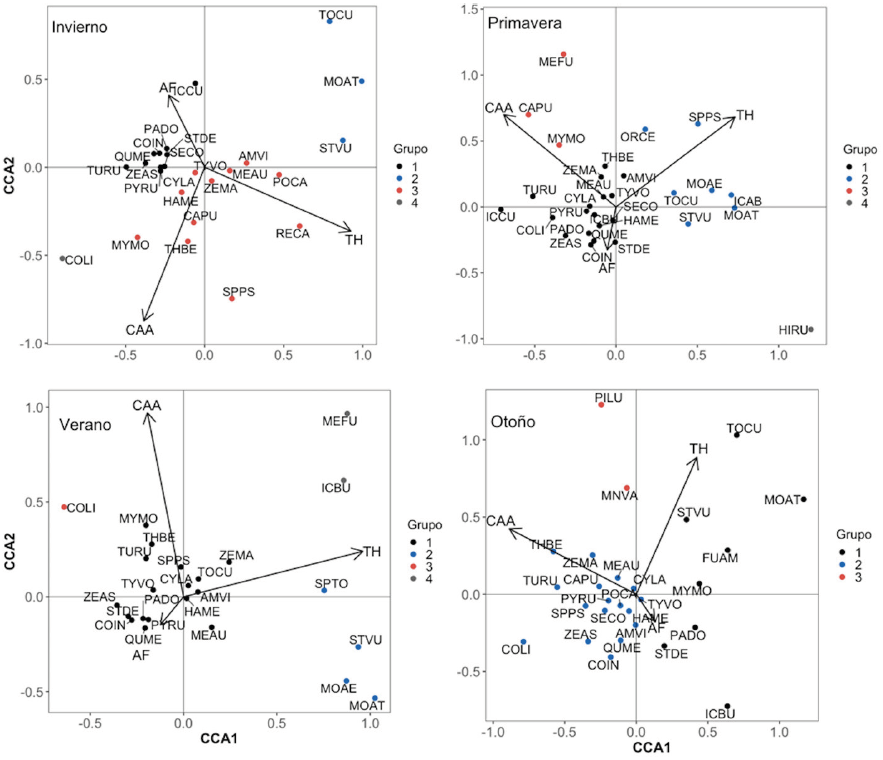
Figura 5 Análisis CCA para la preferencia de hábitat y coexistencia entre aves para las diferentes estaciones del año dentro de las unidades de muestreo en la ciudad de Querétaro. Los componentes principales se muestran como TH (tamaño-heterogeneidad), CAA (complejidad arbórea-antigüedad) y AF (altura-forma). Los grupos de especies relacionadas se muestran con diferentes colores. Los nombres de las especies aparecen con su ID (ver tabla S1, material suplementario).
La paloma de collar turca presentó coexistencia durante casi todo el año con otras 2 especies de columbiformes: la tortolita cola larga Columbina inca y la paloma de alas blancas Zenaida asiatica, además del zanate mayor Quiscalus mexicanus y el gorrión común Passer domesticus (fig. 5). El perico monje argentino tuvo coexistencia en su ocupación con pocas especies locales y en cada estación estas especies fueron diferentes, por lo que no se observó un patrón de coexistencia. El mirlo dorso canela presentó coexistencia con pocas especies locales, únicamente con el saltapared cola larga Thryomanes bewickii coexistió durante verano y otoño, y el papamoscas cardenalito Pyrocephalus rubinus en primavera y otoño (fig. 5). El estornino pinto mantuvo coexistencia con el tordo cabeza café Molothrus ater y con el tordo ojos rojos M. aeneus (fig. 5).
Discusión
A una década de sus primeros reportes, la abundancia y la ocupación de las especies estudiadas han incrementado en las áreas verdes de la ciudad de Querétaro, especialmente para la paloma de collar turca. En uno de los últimos estudios que se realizó sobre especies invasoras en áreas verdes de la ciudad de Querétaro (Pineda-López et al., 2013), la paloma de collar turca solo se registró en 12% de los sitios muestreados y no se observó durante el verano y el otoño, mientras que en el presente estudio se registró en 79% de los sitios a lo largo de todo el año. Además, en el mismo estudio, el perico monje argentino no fue registrado, mientras que los resultados actuales muestran su presencia de manera abundante durante todo el año. Esto puede ser explicado por la alimentación generalista y la gran adaptación de la paloma de collar turca a ambientes urbanos (Bendjoudi et al., 2015; Camacho-Cervantes y Schondube, 2018; Romagosa, 2012); para el perico monje argentino, por su plasticidad conductual que le permite colonizar diferentes rangos geográficos y sus estrategias reproductivas como los nidos comunales que aumentan su tasa de sobrevivencia (Blackburn et al., 2009). La mayor abundancia observada de la paloma de collar turca coincidió con su temporada de reproducción en primavera (Romagosa, 2012), cuando se pudieron confirmar 4 nidos de paloma sobre eucaliptos y fresnos.
La variación en la ocupación del perico monje argentino puede ser debida a la variación de disponibilidad de alimento entre estaciones, ya que es una especie con alimentación generalista (Aramburú, 1997; Ramírez-Albores y Aramburú, 2017; Tinajero y Rodríguez-Estrella, 2015). En este estudio se le observó alimentarse de vainas de huizache (Acacia sp.) y frutos de guayaba (Psidium guajava) que ocurren en diferentes meses del año (Malda-Barrera et al., 2016). Los huizaches son una especie nativa abundante en las zonas externas de la ciudad, lo cual facilitaría que el perico monje argentino se desplace fuera de la zona urbana para invadir áreas rurales y naturales. Por ello, es importante el monitoreo de sus poblaciones y considerar acciones para evitar su propagación (MacGregor-Fors et al., 2011).
El mirlo dorso canela fue registrado durante todo el año, a diferencia de lo reportado en el estado de Hidalgo donde presentó amplias diferencias de abundancia a lo largo del año y sin registros durante el invierno (Pacheco, 2017). Esta especie presentó su mayor abundancia y ocupación en su temporada de reproducción durante primavera y verano (Carbó-Ramírez et al., 2015; Pineda-López y Malagamba-Rubio, 2009), cuando se observaron individuos jóvenes. Las fluctuaciones de abundancia y ocupación de la especie pueden ser debido a la detectabilidad, ya que durante la temporada reproductiva se encuentra más activa y es más fácil detectarla visual y auditivamente (Iknayan et al., 2014).
La ocupación del estornino pinto fue más extensa durante su temporada de reproducción en primavera, que es cuando las bandadas se separan para buscar pareja (Álvarez-Romero et al., 2008; Kaufman, 1996). Por otro lado, su mayor abundancia puede estar relacionada con la llegada a la ciudad de individuos jóvenes durante el otoño, cuando se pueden dispersar mayores distancias (Cabe, 1993; Kessel, 1953).
La paloma de collar turca mostró preferencia durante la mayor parte del año por sitios con árboles altos y además en primavera y otoño hacia sitios periurbanos con baja complejidad arbórea. En un estudio similar en áreas urbanas de España, se determinó que la presencia de árboles en áreas verdes es importante para la paloma y prefiere sitios en la zona periurbana (Bermúdez-Cavero, 2020). Sería importante considerar otras variables como el tránsito humano y vehicular, el cambio de recursos disponibles en cada sitio, la temperatura y otro tipo de uso de suelo como el residencial, comercial, industrial y recreativo como se ha hecho en otros estudios (Bermúdez-Cavero, 2020; MacGregor-Fors y Schondube, 2011).
La preferencia de hábitat del perico monje argentino hacia sitios con árboles de gran DAP, altura y densidad foliar, que son características que podrían facilitar la construcción de sus nidos compartidos, coincide con lo observado en otros países como Italia y Argentina (Di Santo et al., 2017; Romero et al., 2015); sin embargo, en otras ciudades como Durango, este perico parece no seleccionar los árboles de mayor altura (Rodríguez-Matutino et al., 2018). La preferencia del mirlo dorso canela por la complejidad arbórea concuerda con lo descrito anteriormente por otros autores (Jackman y Scott, 1975; Pacheco, 2017; Pineda-López et al., 2013), por lo que la presencia de árboles de gran altura, densidad foliar y DAP son importantes para la especie, sobre todo durante su temporada de anidación porque les confiere protección. La preferencia de hábitat del estornino pinto por sitios extensos y con variedad de coberturas coincide con lo observado en otros estudios, donde la presencia de pasto y árboles son importantes para su alimentación y nidificación (Feare, 1984; Kessel, 1953).
La paloma de collar turca compartió sitios con otras especies tolerantes al ambiente urbano como la paloma de alas blancas, la tortolita cola larga, el gorrión común y el zanate mayor (Carbó-Ramírez y Zuria, 2011). Si bien existen registros de interacciones negativas entre la paloma de collar turca y la de alas blancas (Bonter et al., 2010; Pineda-López y Malagamba-Rubio, 2011; Romagosa, 2012), en este estudio no se registraron comportamientos agresivos hacia otras especies, lo que sugiere únicamente coexistencia entre especies por preferencia de hábitats similares. Debido a que es una especie altamente urbana, es posible que esté explotando recursos alternativos disponibles en lugar de competir con las aves locales, como se observó en Jalisco (Camacho-Cervantes y Schondube, 2018) y en EUA (Green et al., 2020; Koenig, 2020).
La baja coexistencia del perico monje argentino con otras especies ya ha sido registrada anteriormente en EUA, donde se sugiere que la especie tiene baja influencia en la comunidad de aves, así como en algunos estados mexicanos (Appelt et al., 2016; Muñoz-Jiménez y Álcantara-Carbajal, 2017). Durante la temporada de mayor ocupación del mirlo dorso canela, este co-ocurrió especialmente con el papamoscas cardenalito y el colibrí pico ancho, que son especies bastante comunes en las áreas verdes de la ciudad (Malagamba-Rubio et al., 2013).
La coexistencia del estornino pinto con el tordo cabeza café y el tordo ojos rojos no es inusual, ya que son especies con la que suele compartir su espacio de alimentación (Sauer et al., 2017). Por otro lado, no se encontró coexistencia del estornino pinto con otras especies con las que se han reportado agresiones, como el gorrión doméstico, la golondrina tijereta, el mirlo dorso canela y el carpintero cheje (Álvarez-Romero et al., 2008; Pérez-Arteaga y Monterrubio-Rico, 2016), posiblemente porque estas especies locales tienen distinta preferencia de hábitat o porque existe un desplazamiento de estas especies por parte del estornino. Cabe señalar que durante el otoño se observaron agrupaciones de estorninos en algunas unidades de muestreo donde también estaba presente el carpintero cheje sin registrar agresiones interespecíficas, sin embargo, el análisis no mostró estas coexistencias como estadísticamente significativas.
En conclusión, la paloma de collar turca y el perico monje argentino presentan una abundancia y ocupación amplia en áreas verdes a casi 10 años de sus primeros registros para la ciudad de Querétaro, por lo que se sugiere considerar a estas especies en un crecimiento poblacional evidente. De continuar con esta tendencia de crecimiento, en algunos años serán aún más abundantes y en el caso del perico monje argentino, es muy probable que cause daños en la estructura urbana y se disperse hacia zonas periurbanas y rurales, donde podría causar daños a cultivos y convertirse en una especie plaga, por lo que se reitera la propuesta de controlar sus poblaciones (MacGregor-Fors et al., 2011). Por su parte, el mirlo dorso canela y el estornino pinto no muestran evidencia de crecimiento poblacional, por lo que posiblemente ambas especies mantienen poblaciones estables. Las especies estudiadas presentan preferencias ambientales diferentes que varían a través del año. La coexistencia de estas especies se presentó de manera irregular durante el año con especies comunes en el medio urbano y, en el caso de la paloma de collar turca y el estornino pinto, con especies locales de gremios similares.











 text new page (beta)
text new page (beta)


