Introducción
Los estuarios son de los ecosistemas más productivos de la zona costera, están controlados por procesos hidrológicos, meteorológicos y físicos que varían en diferentes escalas de tiempo (Brito, 2012), en las que ocurren condiciones estuarinas particulares que condicionan los patrones biológicos y ecológicos (Taljaard et al., 2009). De esta manera, los estuarios pueden ser vistos como un mosaico de hábitats en los que se manifiestan gradientes ambientales a los que se acoplan los ensamblajes de organismos acuáticos que incluyen a los peces (Sheaves, 2009). Aún con esta variabilidad ambiental natural, los hábitats estuarinos funcionan como áreas prioritarias de alimentación, crianza y refugio para los animales acuáticos (Needles et al., 2015).
Hasta ahora las explicaciones sobre los procesos abióticos y bióticos se han propuesto con base en estuarios que tienen una comunicación permanente con el mar; pero recientemente se reconoce que estos procesos son diferentes en los estuarios aislados temporalmente por una barra arenosa, que son llamados ciegos o de boca obstruida; en éstos, la dinámica de apertura y cierre de la boca estuarina es otro factor clave para explicar los procesos ecológicos de la biota que los ocupan (Schallenberg et al., 2010). Otra diferencia es que en los estuarios ciegos los procesos ambientales son más variables e impredecibles, lo que dificulta reconocer patrones ecológicos temporales estables (Taljaard et al., 2009). Hasta ahora se ha destinado poca atención a los estuarios ciegos y los procesos ecológicos de sus comunidades en el golfo de México, a pesar que se pueden reconocer al menos 2 decenas de estos sistemas acuáticos en el litoral veracruzano. El estuario laguna El Llano junto con laguna La Mancha forman una región marina prioritaria (Arriaga-Cabrera et al., 1998), por su biodiversidad de aves es el sitio RAMSAR 136 y se ha catalogado como una Área Importante para la Conservación de las Aves (Arizmendi y Márquez-Valdelamar, 2000), pero los peces no se han incluido entre los valores naturales de estos hábitats; por lo anterior, esta contribución describe los ensamblajes de peces en el estuario ciego laguna El Llano, relacionándolos a la dinámica hidrológica durante mayo 2013 a mayo 2014.
Materiales y métodos
El estuario laguna El Llano (ELEL) se localiza en 19°38’25.22” y 19°40’05.41” N, 96°23’54.44” y 96°24’39.44” O, en el municipio de Actopan, Veracruz (Fig. 1). Es un cuerpo de agua de 226 ha, la profundidad en los márgenes internos es menor a 1 m de profundidad, pero en el canal central alcanza un intervalo de profundidad de 2 a 4 m. El clima de la zona es cálido sub-húmedo con lluvias en verano (Aw2) (García, 2004); la precipitación media anual alcanza 1,286 mm, mientras que la temperatura media anual es de 24 °C; la temporada cálida o de “secas” transcurre entre abril y junio, la temporada de lluvias entre julio y octubre, mientras que la temporada fría del año sucede entre diciembre y marzo, cuando la temperatura ambiental disminuye y prevalecen corrientes de vientos fríos boreales, de ahí que se denomine como temporada de “nortes” (Morán-Silva et al., 2005). El ELEL es peculiar respecto a otros estuarios de esta región del golfo de México, su geomorfología muestra un canal alargado que hace conexión con el mar mediante una boca estuarina, pero de noviembre a enero ahí se forma una barra arenosa que lo aísla del océano. Como otros estuarios ciegos, el ELEL no se puede clasificar de acuerdo a definiciones tradicionales, por lo que aquí se usa la definición de Potter et al. (2010) que alude al cierre temporal de la boca estuarina y a la posibilidad que este evento provoque condiciones de hipersalinidad en el agua.
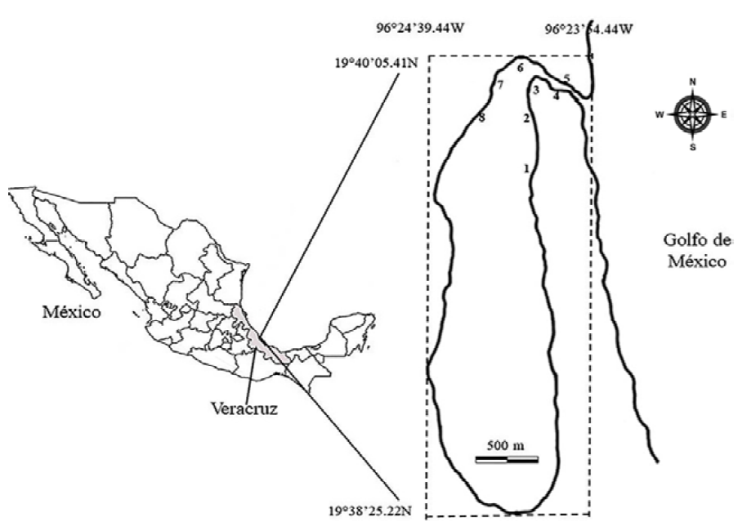
Figura 1 Ubicación del estuario laguna El Llano (ELEL) municipio de Actopan, Veracruz, México. Los números indican los 8 sitios de muestreo (SM1 - SM8) en los que se recolectó desde mayo 2013 a mayo 2014.
Los registros hidrológicos y las recolectas de los peces fueron realizados de mayo 2013 a mayo 2014; las recolectas se realizaron en 8 sitios de muestreo (SM): 4 se ubicaron cercanas a riberas de mangle rojo Rhizophora mangle y de mangle negro Avicennia germinans, caracterizadas por fondos lodosos y cercanas a arrecifes del ostión Crassostrea virginica, (SM1 - SM4); las otras 4 se ubicaron en sedimentos arenosos (SM5 - SM8) cercanas a la boca estuarina (Fig. 1); en mayo 2013, los SM7 y SM8 se ubicaron sobre la barra arenosa que selló la boca estuarina. El muestreo se restringió a profundidades menores de 1.2 m, debido a la variación de la altura de la columna de agua en el canal central, de 2 m en temporada de sequía a 4 m en temporada de lluvias y a la profundidad (> 1 m) del horizonte limo-arcilloso del sustrato. Los sitios de muestreo se ubicaron geográficamente con un GPS Garmin 10X GPS, en cada uno se registró el oxígeno disuelto (mg/L) y la temperatura del agua (°C) con un oxímetro Oakton DO 300 series, la salinidad (UPS) con un refractómetro Vista A366ATC, la turbidez con un turbidímetro La Motte 2020 (UNT), pH con un pHmetro Oakton pH 110 Meter, y la profundidad (cm) fue registrada con una sonda Echotest II Plastimo. Las categorías de salinidad se definieron con base en la propuesta del sistema de Venecia (Ito, 1959).
Los peces fueron recolectados con una red tipo chinchorro de 25 m de longitud, por 2 m de alto y luz de malla de 6.35 mm; en cada SM se procuró una superficie de arrastre efectiva de 300 m2. Todos los especímenes se colocaron en hielo y se fijaron en etanol al 70%. En el laboratorio se lavaron, se fijaron con formalina al 5% y se almacenaron en etanol al 70%. Los ejemplares se identificaron de acuerdo con Castro-Aguirre et al. (1999), Carpenter (2002) y Miller et al. (2009); cada pez se midió con una escala en longitud patrón (LP) hasta 0.1 mm; el peso total (PT) se midió con una balanza electrónica Cole-Parmer Simmetry con precisión de 0.001 g.
Parámetros hidrológicos. Los registros de las variables hidrológicas por SM se transformaron a raíz cuadrada para disminuir el efecto en los cálculos de las magnitudes en las que se midieron, luego se estimó su similitud con el coeficiente de Bray-Curtis, produciendo una semimatriz de similitud, con esta se ejecutó un análisis de ordenación mediante la técnica de escalamiento multidimensional no-métrico (NMDS) que produce una gráfica que representa el parecido de las condiciones hidrológicas entre los meses de muestreo, para este análisis se usó el software PRIMER V6 (Clarke y Warwick, 2001).
El análisis comunitario consistió en la estimación mensual de parámetros ecológicos con los registros de las abundancias y biomasas de las especies en los sitios de muestreo, la riqueza de especies se expresó como la cantidad de especies registradas por mes, la diversidad (H’) según Shannon-Wienner estimada con los logaritmos en base decimal de la abundancia de las especies y la dominancia mensual en la comunidad con el índice de Simpson. Para cada especie se calculó la abundancia relativa (AbRel%), la biomasa relativa (BiomRel%) y la frecuencia de ocurrencia (FrecRel%); se clasificó a las especies por su presencia, como permanentes si se registraron con más de 75 FrecRel%, constantes entre 51 a 74 FrecRel%, ocasionales entre 26 y 50 FrecRel% y las raras, con menos de 25 FrecRel%. Con la suma de los valores de abundancia relativa, biomasa relativa y frecuencia de ocurrencia se definió el índice de valor de importancia (VI), como una medida combinada que integra a los 3 parámetros para estimar la contribución de cada especie a la dominancia en la comunidad.
La categoría ecológica de especie se asignó con los criterios de Potter et al. (2015); esta clasificación se ajustó a las especies recolectadas con base en su abundancia, la frecuencia de ocurrencia y el periodo de uso del estuario, las categorías utilizadas fueron: marinas migrantes (MM), marinas ocasionales (MO), especies estuarinas (EE), especies catádromas (EC) y especies dulceacuícolas ocasionales (DO). Se calculó el valor de importancia mensual para cada categoría ecológica (VIg), que proporciona una medida integrada de su importancia global, se estimó a partir de las contribuciones relativas de cada categoría ecológica con la fórmula VIg = 0.33 (a + b + c), donde: a = porcentaje de especies por gremio, b = porcentaje de abundancia por gremio y c = porcentaje de biomasa por gremio (Harrison y Whitfield, 2008).
Las abundancias de las recolectas por SM y por mes se transformaron a raíz cuadrada y se sometieron a un análisis similar al empleado para los registros de las variables hidrológicas; en este caso, el gráfico producido por la prueba NMDS presentó la similitud entre las composiciones de especies mensuales, éstas se agruparon por su mayor parecido y los conjuntos resultantes se consideraron como un ensamblaje; el análisis de similitudes de una vía (Anosim) se usó para probar si los ensamblajes de peces fueron diferentes, además la técnica Simper se aplicó para determinar la contribución de cada especie a la medida de disimilitud entre los ensamblajes, estos análisis también se ejecutaron con el programa PRIMER 6 (Clarke y Warwick, 2001).
Resultados
Con base en la tendencia mensual de los parámetros físicos y químicos del agua, los eventos que afectan el comportamiento hidrológico del ELEL se resumen como sigue. El muestreo de mayo 2013 ocurrió al final del período de boca estuarina cerrada. El aislamiento provocado por la barrera arenosa se evidenció en el aumento de la salinidad hasta 76 UPS, el pH fue ligeramente alcalino, las aguas bien oxigenadas y la turbidez en niveles bajos. Por información de los lugareños, se sabe que la boca estuarina del ELEL se cierra anualmente entre noviembre y mayo. Para julio de 2013 ya estaba abierta; el intercambio mareal, que en la zona es semidiurno y micromareal, determinó un nivel euhalino con predominio de condiciones marinas, la temperatura del agua aumentó por encima de 30 °C, aguas bien oxigenadas y niveles bajos de turbidez; estas condiciones predominaron en el estuario hasta agosto 2013.
En septiembre, durante la temporada de lluvias, la dilución de la salinidad llegó a nivel mesohalino (15 UPS como mínimo), provocado por la intensidad de las lluvias y la formación de meteoros atmosféricos (una tormenta tropical y un huracán). En este lapso, se manifestaron las condiciones más estuarinas y se registraron los mayores niveles de turbidez. A partir de octubre se recuperó la dominancia marina, este mes marcó el inició de la temporada de nortes, que para 2013 ocurrió con episodios de vientos de intensos entre diciembre y enero (en ocasiones mayores a 120 km/h) acompañados de lluvias; en diciembre la salinidad disminuyó a 21 UPS y la temperatura del agua descendió notablemente (mínima de 22°C). La suma de estos eventos atmosféricos impidió que la boca estuarina se sellara, manteniéndose abierta parcialmente, lo que permitió intercambio mareal y que la salinidad fuese similar a la marina de enero a mayo, en ausencia de aportes de agua dulce continental (Fig. 2).
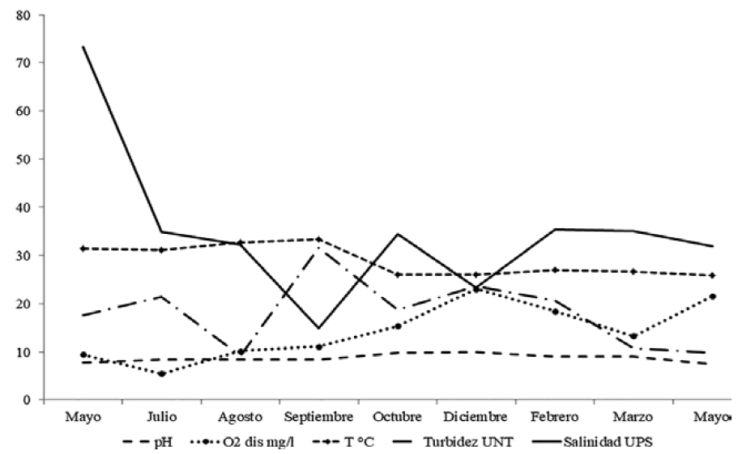
Figura 2 Variación mensual promedio de los parámetros fisicoquímicos del agua en ELEL, Actopan, Veracruz (periodo mayo 2013 a mayo 2014).
La descripción anterior se confirmó con la comparación mensual de la similitud entre las variables hidrológicas, el gráfico de NMDS (Fig. 3) mostró la formación de un grupo de mayor similitud entre los meses con condiciones más aproximadas a las marinas (julio, agosto, octubre 2013); otro conjunto se formó con los meses que describen las condiciones de boca semicerrada entre las temporadas de nortes y el inicio de sequía (diciembre 2013, febrero, marzo y mayo 2014), en este análisis se separó claramente mayo 2013, bajo condiciones de boca cerrada e hipersalinidad y septiembre 2013, cuando se registró la salinidad menor y las características más estuarinas; el nivel de estrés de la prueba (0.05) indica que esta ordenación es aceptable.
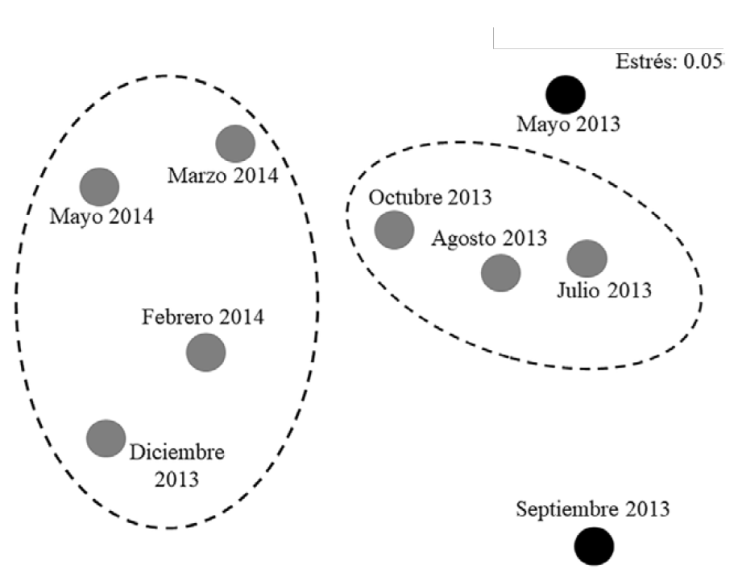
Figura 3 Plot de ordenación NMDS, a partir de una matriz de similitud construida con el coeficiente de Bray-Curtis, se compararon los parámetros hidrológicos mensuales de la Laguna del Llano, Veracruz.
En el período de estudio se recolectaron 3,643 organismos con una biomasa de 11,018.5 g; pertenecientes a 37 especies, agrupadas en 32 géneros, de 23 familias y 10 órdenes. Las familias con mayor número de especies fueron: Carangidae, Gerreidae (4), Eleotridae y Gobiidae (3), los registros mensuales de los parámetros comunitarios se muestran en la Tabla 1.
Tabla 1 Parámetros comunitarios mensuales de los peces en el ELEL durante mayo 2013 a mayo 2014.
| Mes | Riqueza de especies |
Biomasa g | Abundancia | Diversidad H' (log 10) |
Equidad J´ | Dominancia Simpson D |
|---|---|---|---|---|---|---|
|
|
|
|
|
|
|
|
La mayor abundancia se registró en febrero 2014 con 1,625 organismos y en julio 2013 la menor con 122; la mayor biomasa (2,976.61 g) en septiembre 2013 y la menor en mayo 2014 con 361.26 g; en mayo 2013 en condiciones hipersalinas, destacó la presencia de P. mexicana con 169 organismos de los 216 recolectados. Las especies más abundantes fueron: Anchoa mitchilli (1,171), Eucinostomus melanopterus (444), Diapterus rhombeus (398) y Mugil cephalus (218). Las especies que contribuyeron con la mayor biomasa fueron: A. mitchilli (1,290.8 g) seguida de M. cephalus (1,115.9 g) y las especies con menor biomasa fueron Symphurus plagiusa (2.3 g) y Myrophis punctatus (0.63 g) (Tabla 2).
Tabla 2 Listado de especies de peces en el ELEL acomodadas por su valor de importancia. CE: Categoría ecológica, MM: marina migrante, MO: marina ocasional, EE: especie estuarina, EC: especie catadróma, DO: dulceacuícola ocasional; CO: categoría de presencia, P: permanente, C: constante, O: ocasional, R: rara; AB: abundancia; BIOM: biomasa; ABREL%: abundancia relativa; BIOMREL%: biomasa relativa; FRECREL%: frecuencia relativa; VI: valor de importancia.
Los valores de diversidad más altos se registraron en septiembre y marzo, con 2.13 y 2.02 decits/ind respectivamente, en contraste la diversidad más baja se registró en mayo 2013 0.72 decits/ind.
Con base en el valor de importancia, las especies dominantes durante el estudio fueron: A. mitchilli, E. melanopterus, D. rhombeus y M. cephalus; éstas aportaron el 63% de la abundancia y el 35% de la biomasa, las primeras 10 especies dominantes sumaron el 81.68% de la biomasa relativa y el 64% de la biomasa relativa; de éste grupo, sólo P. octonemus se presentó con menos de 50% de FO.
En términos de categorías ecológicas, las especies marinas migrantes (MM) no fueron las más numerosas (11) pero aportaron el 66% de la abundancia y el 51.3% de la biomasa, destacando los gerreidos D. rhombeus y E. melanopterus. Además de M. cephalus, también A. mitchilli fue una especie abundante pero de presencia constante (FO 66%); la categoría marina ocasional (MO) contribuyó con la mayor riqueza específica (17), con el 21% de la abundancia y el 35% de la biomasa, de esta categoría, 11 especies resultaron como raras y de tallas pequeñas, P. octonemus aportó la mayor abundancia (304 orgs.), en tanto que S. barracuda la mayor biomasa (1,185.25 g). Se recolectaron 6 especies estuarinas (EE) de las familias Gobiidae y Eleotridae que contaron para el 5.7% de la abundancia y el 6.5% de la biomasa; las 2 especies catádromas (EC) fueron Centropomus ensiferus y C. parallelus, esta última se presentó de manera constante en el ELEL y se recolectaron 49 individuos con una biomasa de 585.2 g. Se recolectó a P. mexicana como la única especie dulceacuícola en mayo 2013 junto con M. cephalus, C. parallelus y L. griseus, bajo condiciones de hipersalinidad y boca estuarina cerrada.
Las especies MM contribuyeron con el mayor VIg en todos los meses posteriores a la apertura de la boca estuarina, particularmente entre julio y septiembre. Durante el estado de boca estuarina semicerrada, también destacó la aportación de las especies estuarinas, con valores VIg aproximados a los de la categoría MO; solo en mayo 2013 se registró al gremio dulceacuícola (Fig. 4).
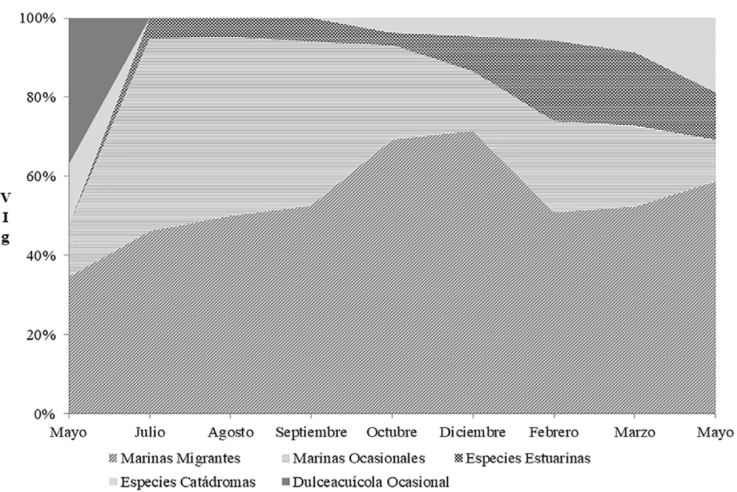
Figura 4 Contribución mensual al valor de importancia por gremio ecológicos (VIg) por categorías ecológicas en el estuario laguna El Llano, Veracruz, entre mayo 2013 a mayo 2014.
El análisis NMDS diferenció 3 ensamblajes: 1) formado solo por mayo 2013 (MY2013), 2) por julio, agosto, septiembre y octubre 2013 (grupo secas-lluvias 2013, SLL2013), y 3) por diciembre 2013, febrero, marzo y mayo de 2014 (grupo nortes-secas, NORSEC). El nivel de estrés (0.04) indicó que la diferencia en la similitud entre estos grupos de meses es aceptable (Fig. 5).
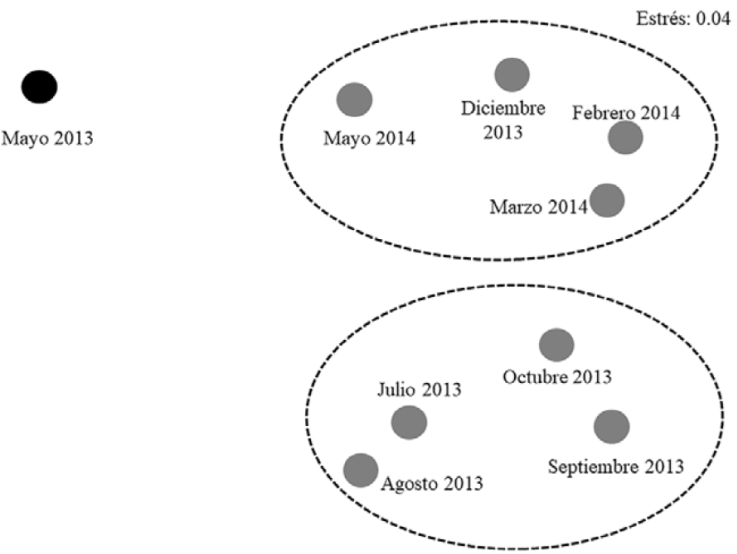
Figura 5 Análisis NMDS, construido a partir de una matriz de similitud constituida por el Coeficiente de Bray-Curtis, para agrupar la composición mensual de las especies de peces como ensamblajes en la laguna del Llano, Veracruz.
Los resultados de Anosim indican que las diferencias en la composición de los ensamblajes determinados por NMDS fueron significativas (R = 0.854; p < 0.05); la baja riqueza de especies del ensamblaje MY2013 presentó diferencias muy evidentes respecto a los 2 restantes, con el análisis Simper se estimó que entre los ensamblajes SLL2013-NORSEC, la disimilitud fue del 80.69%, las especies que contribuyeron a esta diferencia fueron: A. mitchilli, E. melanopterus, M. curema, M. cephalus, D. rhombeus, P. octenemus, C. spilopterus, H. jaguana, E. smaragdus y L. griseus; los porcentajes de disimilitud por especie estimados por este análisis se presentan en la Tabla 3.
Discusión
A diferencia de los estuarios de boca abierta permanente, los estuarios ciegos están sujetos a periodos estacionales, intermitentes o prolongados de aislamiento al mar; además por ser de superficie pequeña (< 250 ha) sus procesos hidrológicos también son controlados por las fluctuaciones de las mareas, que junto con los procesos oceánicos y atmosféricos influyen en la dinámica de apertura y cierre de la boca estuarina (Perissinotto et al., 2010). Considerando que en el ELEL no hay aportes fluviales importantes y la descarga principal de agua dulce sucede en la temporada de lluvias debido a los escurrimientos de las serranías cercanas y de un arroyo de drenaje efímero, las variaciones del comportamiento hidrológico entre 2013 y 2014 lo definen como un estuario parcialmente sellado (Snow y Taljaard, 2007).
En los estuarios ciegos es común encontrar riquezas de especies bajas tal como sucede en el ELEL y otros de la región como laguna La Mancha (42 especies, Castro-Aguirre y Mora-Pérez, 1984), el ELEL (46 especies, Morales, 1984), laguna San Agustín (33 especies, Sánchez, 1989) y laguna Grande-laguna Chica (22 especies, Aguirre-León et al., 2014) que contrastan con los reportes de estuarios con comunicación permanente al mar como el “Sistema Lagunar de Alvarado” (107 especies, Chávez-López et al., 2015), laguna de Sontecomapan (52 especies, Rodríguez-Varela et al., 2010), Tuxpan-Tampamachoco (200 especies, González-Gándara et al., 2012), laguna de Términos (86 especies, Ayala-Pérez et al., 2012) y laguna Pueblo Viejo (72 especies, Zárate-Hernández et al., 2012).
La baja riqueza de especies en los estuarios ciegos se explica por el estrés natural que imponen las variaciones de la salinidad relacionadas a la duración del período de apertura de la boca y las variaciones de los flujos estacionales de agua dulce. James et al. (2007) y Vasconcelos et al. (2015) proponen que estos factores funcionan como un filtro ambiental que regula la invasión de especies y define los ensamblajes que colonizan estos hábitats.
Bajo condiciones de hipersalinidad se registró un ensamblaje de 4 especies: P. mexicana, M. cephalus, C. parallelus y L. griseus; es la primera vez que se les reporta en México en estas condiciones. La mayor abundancia de P. mexicana marcó la diferencia en las comparaciones con los otros ensamblajes; en general, a las especies dulceacuícolas se les considera como visitantes en tránsito o accidentales, incapaces de vivir exitosamente en los estuarios (Whitfield, 2015), pero su presencia es común en los ensamblajes de peces en estuarios del golfo de México, con riqueza específica baja y en cantidades también bajas de abundancia y biomasa (Chávez-López et al., 2015).
El número de especies de este ensamblaje es propio del final de una temporada ambientalmente restrictiva para los peces, se ha reportado que cuando estas temporadas se prolongan por varios años, todos los peces desaparecen del sistema; por ejemplo, en el estuario Seekoei de Sudáfrica ocurrió la muerte masiva de por lo menos 6,000 individuos de 11 especies a una salinidad de 98 UPS (Whitfield et al., 2006); en el estuario ciego Sine Saloum de Senegal a 130 UPS, también sucedió una disminución drástica de la biodiversidad, pero ocurrió la modificación paulatina de las características ecológicas de las poblaciones y la alteración de la composición de especies hasta su desaparición (Vorwerk et al., 2003). Entonces cuando la salinidad va en aumento, es común que los ensamblajes de peces estén formados por pocas especies comparados con estuarios mesohalinos (Simier et al., 2004) porque solo sobreviven las especies con capacidad fisiológica para aclimatarse a la condición hipersalina; ejemplos de especies de gran tolerancia son: Aldrichetta forstieri, Leptatherina wallacei y Oreochromis mossambicus, capaces de sobrevivir a 122 UPS en el estuario Sta. Lucia de Sudáfrica (Whitfield et al., 2006).
La tolerancia a las salinidades extremas en el agua se explica por combinaciones de procesos bioquímicos y morfológicos descritos en otras especies de peces dulceacuícolas y marinos, como un sistema de secreción de carbohidratos en el intestino (Laverty y Skadhauge, 2015), que permite la precipitación de calcio y aumenta la capacidad de absorber el cloruro de sodio del agua hipersalina (Whittamore, 2012). Otras investigaciones consideran la reducción de la permeabilidad branquial mediante la regulación de los niveles de proteínas aquaporinas en los epitelios branquiales (Tipsmarck et al., 2010; Verkman, 2011), que se relacionan con el aumento de las tasas de ingestión de agua en los peces que colonizan aguas salinas (Nordlie, 2006); otras evidencias indican que disminuye la permeabilidad iónica de la superficie corporal y de las células secretoras de iones de las branquias, que son esenciales para eliminar grandes cantidades de sales en hábitats marinos e hipersalinos (González, 2012).
Las especies marinas son las más numerosas y abundantes tanto en los estuarios abiertos como en los temporalmente cerrados, en estos últimos la duración y temporalidad de los periodos de apertura-cierre del estuario no permiten identificar patrones de presencia estacional (James et al., 2018). En el ELEL, las especies marinas ocasionales de tolerancia baja a los cambios de salinidad fueron más numerosas en los meses posteriores a la desintegración de la barra arenosa. Whitfield (2015) señaló que estas especies generalmente son visitantes en tránsito o accidentales que usan el estuario de manera oportunista y solo dominan cuando los aportes de agua dulce son limitados (Hoeksema y Potter, 2006), en tanto que las especies marinas migrantes poseen mayor tolerancia a los cambios de salinidad e incluso usan el estuario secuencialmente como parte de su ciclo de vida, ejemplos de estas especies en el ELEL fueron: A. mitchilli, E. melanopterus, D. rhombeus y M. cephalus, que también dominaron los ensamblajes en los que se presentaron. Las diferencias entre los gremios de secas-lluvias y nortes-secas se determinaron precisamente por la variación en la abundancia de las especies dominantes marinas migratorias y la contribución de algunas especies marinas ocasionales de las familias Carangidae, Clupeidae y Sphyraenidae.
La riqueza específica aumentó en la temporada de lluvias, a salinidades mesohalinas y turbidez alta. En el ensamblaje de secas-lluvias se registró la mayor abundancia de especies bentófagas como: E. saurus, D. rhombeus y E. melanopterus, además de especies estuarinas de las familias Gobiidae y Eleotridae, la presencia de este gremio alimenticio se puede relacionar a aumentos de la producción bentónica ocasionada por los nutrientes acarreados por el agua y cuya influencia puede mantenerse en los meses siguientes; este enriquecimiento orgánico natural es subsidiado por los episodios de descarga de agua dulce que se ha demostrado que mantienen y estimulan la productividad biológica en los estuarios (Gillson, 2011; Netto et al., 2012).
La apertura de la boca estuarina condicionó la composición de los ensamblajes de peces en el ELEL; a diferencia de estuarios de comunicación permanente con el mar, el estancamiento y la hipersalinización del agua actuaron como un filtro ambiental para especies con alta tolerancia como las que formaron el ensamblaje de mayo 2013. Con la desintegración de la barra arenosa, la renovación del intercambio de agua con el mar y la ausencia de aportes de agua dulce, se identificaron ensamblajes de peces en los que abundaron las especies de origen marino que se reclutan al estuario en fases jóvenes para aprovecharlo como zona de refugio, de alimentación y de crianza, reafirmando los servicios ecosistémicos que aportan estos hábitats acuáticos para la biodiversidad.











 text new page (beta)
text new page (beta)


