Introducción
México ocupa el quinto lugar en diversidad de anfibios (Alvarado-Díaz et al., 2013; González-Hernández et al., 2014; Parra-Olea et al., 2014), siendo alrededor de 60% de las especies endémicas. Sin embargo, el endemismo no es homogéneo, éste se concentra principalmente en las islas del golfo de California, la Sierra Madre del Sur (SMS) de Guerrero y Oaxaca y en el Cinturón Volcánico Transmexicano (Grismer, 2002). La gran complejidad topográfica de México ha creado 2 importantes centros de diversificación donde se forma una gran cantidad de especies endémicas: el Cinturón Volcánico Transmexicano (CVT) y la Depresión del Balsas-Tepalcatepec (Flores-Villela, 1991; Luna-Vega, 2008). El CVT está constituido por alrededor de 8,000 estructuras volcánicas (Demant, 1978) a lo largo de aproximadamente 1,000 km de longitud, y de acuerdo a fechamientos isotópicos, esta región se formó durante el Mioceno medio y tardío (Ferrari et al., 1999). El CVT está dividido en 3 sectores con respecto a su geología y características tectónicas: occidental, central y oriental (Demant, 1978; Pasquaré et al., 1988). Particularmente, el sector occidental está localizado entre la costa del Pacífico y la triple conjunción formada por la intersección de los graben Zacoalco, Chapala y Colima (Allan, 1986 en Gómez-Tuena et al., 2007). Gómez-Tuena et al. (2007) dividieron el CVT en 4 episodios evolutivos: 1) la instauración de un arco de composición intermedia en el Mioceno medio y tardío, 2) un episodio máfico del Mioceno tardío, 3) un episodio silícico de finales de Mioceno que llega a ser bimodal en el Plioceno temprano, y 4) la reinstauración de un arco con gran variabilidad composicional a partir del Plioceno tardío. Durante este último episodio se formaron algunas de las montañas y conos volcánicos de la Cuenca del Río Santiago (CRS) en el centro de Jalisco, siendo estos de reciente formación geológica (1.8-3 Ma; Ferrari et al., 1999, 2012; Gómez-Tuena et al., 2007).
Del mismo modo que los episodios geológicos, los eventos climáticos que han ocurrido en la historia de esta región han ocasionado la diferenciación y radiación de una gran cantidad de especies (Flores-Villela, 1991). Dichos eventos han producido cambios en la demografía y diversificación de las especies de montaña en diferentes regiones (Hewitt, 1996; Castoe et al., 2009; Ornelas et al., 2013; Shepard y Burbrink, 2008). Se han propuesto diferentes teorías para explicar la historia evolutiva de los taxones de zonas altas de México. Por ejemplo, Bryson (2011) y Bryson et al. (2011) consideran que el desplazamiento y expansión de la vegetación de las tierras altas a través de México durante los ciclos glaciales del Pleistoceno pudieron haber permitido la dispersión de taxones de los sitios altos, lo cual resultó en el contacto entre taxones previamente aislados y la colonización de nuevos hábitats. Se ha probado que las poblaciones de distintos grupos taxonómicos restringidas a hábitats montañosos presentan mayores niveles de divergencia genética en relación con otras poblaciones (Guarnizo y Cannatella, 2013; McCormack et al., 2008; Shepard y Burbrink, 2008, 2009), lo que sugiere que las tierras bajas que se encuentran entre los sistemas montañosos, funcionan como barreras de aislamiento que impiden el flujo génico (Shepard y Burbrink, 2008, 2009). A pesar del alto nivel de endemismo y divergencia genética potencial, en ciertos grupos se han realizado pocos trabajos explorando la diversificación histórica en taxones de zonas montañosas en México (Bryson et al., 2011; O’Neill et al., 2013; Velo-Antón et al., 2013; Wiens et al., 2007).
Los anfibios presentan un conjunto de características biológicas como son: baja vagilidad, vulnerabilidad ante cambios ambientales y baja tolerancia a factores climáticos extremos (Flores-Villela, 1993), que junto con la topografía accidentada de México, en particular del CVT, hacen un modelo ideal para esclarecer patrones históricos de diversificación. Particularmente, es posible investigar eventos de colonización y plantear hipótesis biogeográficas en especies codistribuidas sobre posibles eventos comunes de vicarianza y dispersión. En zonas con poca información geológica, los resultados de estudios filogeográficos son muy importantes para esclarecer procesos, aunque es complicado obtener un resultado robusto (Castoe et al., 2009; Riddle y Hafner, 2006). Sin embargo, en zonas donde la información geológica se encuentra disponible, como es el caso de la región oeste del CVT, es posible encontrar concordancia entre la historia de la tierra y la historia de los taxones.
Las estimaciones de tiempos de divergencia en conjunto con la inferencia filogenética son métodos ampliamente utilizados y tienen un importante uso al proveer información relevante para esclarecer los patrones de diversificación entre los grupos (Castoe et al., 2009; Ho y Phillips, 2009). Las estimaciones de tiempos de divergencia se han utilizado como una herramienta de la filogeografía para investigar la evolución de las especies, proponiendo teorías de vicarianza y dispersión, e identificando procesos geológicos y climáticos que han influido en los procesos evolutivos de diferentes grupos biológicos (Lanteri y Confalonieri, 2003), como por ejemplo anfibios, aves, insectos, mamíferos, reptiles, peces, plantas, etc. (de Sá et al., 2012; Ericson et al., 2014; Glazko y Nei, 2003; Li et al., 2012; Morris et al., 2007; Reznick et al., 2017; Ruiz-Sánchez y Specht, 2013; Townsend et al., 2011; Zakharov et al., 2004). Es por esto que los resultados obtenidos de las estimaciones de tiempos de divergencia han colaborado en gran medida a tener un mejor entendimiento de cómo y porqué se han diversificado distintos grupos. Originalmente, las estimaciones de tiempos de divergencia se hacían para poblaciones de una sola especie, sin embargo, un enfoque superior a ésto es comparar escenarios filogeográficos con especies codistribuidas que proporcione más información y provea un mayor sustento de hipótesis para esclarecer patrones filogeográficos (Avise, 2009; Castoe et al., 2009; Gutiérrez-García y Vázquez-Domínguez, 2011). El presente estudio explora las relaciones filogenéticas entre los individuos de distintas poblaciones de 10 especies de anfibios de las zonas altas de la CRS, en los estados de Jalisco y Nayarit. Las especies estudiadas son: Isthmura belli, Spea multiplicata, Hypopachus variolosus, Dryophytes eximius, D. arenicolor, Incilius occidentalis, Eleutherodactylus nitidus, Craugastor occidentalis, C. augusti y Lithobates neovolcanicus. Específicamente, se estiman los tiempos de divergencia entre poblaciones y se infieren procesos geológicos que pudieron haber influido en la historia evolutiva de los taxones estudiados.
Materiales y métodos
Se recolectaron muestras de 33 individuos pertenencientes a 10 especies de anfibios (siguendo la taxonomía presentada por Frost, 2018; tabla 1) entre el 10 de septiembre y el 10 de octubre del 2015 en un gradiente altitudinal desde los 1,400 hasta los 1,915 m snm en zonas altas de 10 cerros y volcanes de la Cuenca del Río Santiago en los estados de Jalisco y Nayarit, México (fig. 1). Los ejemplares recolectados fueron preservados en alcohol al 70% mientras que los tejidos provenientes de falanges se preservaron en alcohol anhidro. Los ejemplares se depositaron en la Colección Herpe-tológica de la Universidad Michoacana (CHUM; Permiso SGPA/DGVS/00655/1). Adicionalmente, se utilizaron 32 muestras de las mismas especies provenientes de poblaciones externas al área de estudio. Dichas muestras provienen de los estados de Colima, Guerrero, Jalisco, Michoacán, Nayarit, Sinaloa y Sonora de la Sierra Madre Occidental (SMOc), Planicie Costera (PC) y Sierra Madre del Sur tomadas de la colección de tejidos del Amphibian and Reptile Diversity Research Center (ARDRC), University of Texas at Arlington. También se utilizaron 23 secuencias tomadas de GenBank para fortalecer el análisis (tabla 1). Basándonos en múltiples filogenias, incluimos algunos grupos hermanos de las especies encontradas en los volcanes (de Sá et al., 2012; García-París et al., 2003; Mendelson et al., 2011; Pyron y Wiens, 2011; Wiens et al., 2009).2015
Tabla 1 Ejemplares recolectados y utilizados en el análisis para el cálculo de las estimaciones de tiempos de divergencia (señalados con un asterisco) depositados en la Colección Herpetológica de la Universidad Michoacana (CHUM). También se incluyen los individuos tomados de Herpetological Collections at the University of Texas at Arlington (ARDRC) y las secuencias tomadas del GenBank.
| Taxón | Localidad | Voucher | Coordenadas | Número de acceso GenBank | Base de datos |
| Aneides lugubris | Tapanatepec, Oaxaca | L75820 | GenBank | ||
| Dryophytes eximius | El Tejacate, Oaxaca | MZFC 4814 | 17°13.80’N, 097°0.00’O | AY843856 | GenBank |
| Incilius marmoreus | El Mezquital, Durango | UTA: A-13032 | 23°36’59.832” N, 04°21’26.208” O | HM563957 | GenBank |
| Incilius mazatlanensis | Catemaco, Veracruz | MZVZ 132967 | NA | HM563958 | GenBank |
| Incilius occidentalis | Alamos, Sonora | UTA: A-13543 | NA | HM563962 | GenBank |
| Incilius occidentalis | Norte de Sonora | JAC 24762 | NA | JQ947893 | GenBank |
| Incilius valliceps | Baja California | MZFC JRM 3868 | NA | HM563971 | GenBank |
| Lithobates catesbeiana | USA | NA | NA | AY210399 | GenBank |
| Lithobates chiricahuensis | NA | NA | NA | KM523313 | GenBank |
| Lithobates forreri | Virginia, USA | NA | 38°41’36” N, 79°05’44” O | KU194581 | GenBank |
| Lithobates neovolcanica | Virginia, USA | KU 194536 | 39°11’48” N, 78°47’30” O | KX269310 | GenBank |
| Plethodon dunni | El Paisano Veracruz | pdun5 | NA | AY183763 | GenBank |
| Plethodon punctatus | Edo de México | 67638 | NA | AY378078 | GenBank |
| Plethodon virginia | Apizaco-Chignahuapan, Puebla | 75901 | NA | AY378049 | GenBank |
| Isthmura bellii | Atoyac, Guerrero | MVZ 143784 | 17°42’12.463” N, 100°4’16.3524” O | AY864689 | GenBank |
| Isthmura bellii | Ciudad Guzman, Jalisco | MVZ 143795 | NA | AY864691 | GenBank |
| Isthmura bellii | Raices, Edo de México | MVZ 143803 | NA | AY864687 | GenBank |
| Isthmura bellii | Charo, Michoacán | GP 048 | NA | AF451194 | GenBank |
| Aquiloeurycea cephalica | Zurumbueno, Michoacán | IBH 22603 | NA | AF451195 | GenBank |
| Pseudoeurycea leprosa | Sinaloa | IBH 22406 | NA | KP900069 | GenBank |
| Pseudoeurycea longicauda | Carolina del Sur, USA | IBH 22247 | NA | KP900053 | GenBank |
| Scaphiopus couchii | NA | MVZ161886 | NA | JX564894 | GenBank |
| Spea multiplicata | Chignahuapan, Puebla | NA | NA | EU285643 | GenBank |
| *Craugastor augusti | Cerro Cuautepetl, Jalisco | JQH 192 | 20°37’49.7” N, 104°1’44.2” O | MF535935 | CHUM |
| *Craugastor augusti | Volcán Tequila, Jalisco | JQH 285 | 20°48’45.5” N, 103°50’53.7” O | MF535936 | CHUM |
| *Craugastor augusti | Sangangüey, Nayarit | JQH 320 | 21°27’32” N, 104°44’24.3” O | MF535937 | CHUM |
| *Craugastor augusti | Cerro Alto, Nayarit | JQH 385 | 21°27’15.4” N, 104°58’25.6” O | MF535938 | CHUM |
| *Craugastor augusti | Volcán Ceboruco, Nayarit | JQH 504 | 21°7’5.3” N, 104°30’3.3” O | MF535939 | CHUM |
| *Craugastor occidentalis | Bosque la Primavera, Jalisco | JQH 166 | 20°35’34.3” N, 103°31’43.9” O | MF535940 | CHUM |
| *Craugastor occidentalis | Cerro Cuautepetl, Jalisco | JQH 202 | 20°37’51.55” N, 104°1’42.96” O | MF535941 | CHUM |
| *Craugastor occidentalis | Sangangüey, Nayarit | JQH 322 | 21°27’24.12” N, 104°44’20.97” O | MF535942 | CHUM |
| *Craugastor occidentalis | Cerro Alto, Nayarit | JQH 337 | 21°27’0” N, 104°58’4.3” O | MF535943 | CHUM |
| *Craugastor occidentalis | Volcán Tepetiltic, Nayarit | JQH 420 | 21°15’11.6” N, 104°42’57.41” O | MF535944 | CHUM |
| *Craugastor occidentalis | Cerro Grande, Nayarit | JQH 443 | 21°10’16.4” N, 104°44’22.1” O | MF535945 | CHUM |
| *Craugastor occidentalis | Volcán Ceboruco, Nayarit | JQH 451 | 21°8’0.41” N, 104°30’9.09” O | MF535946 | CHUM |
| *Eleutherodactylus nitidus | Cerro Alto, Nayarit | JQH 378 | 21°27’16.7” N, 104°58’27.6” O | MF535947 | CHUM |
| *Eleutherodactylus nitidus | Volcán Tepetiltic, Nayarit | JQH 397 | 21°15’10.2” N, 104°42’51.1” O | MF535948 | CHUM |
| *Eleutherodactylus nitidus | Cerro Grande, Nayarit | JQH 445 | 21°10’5.1” N, 104°44’32.2” O | MF535949 | CHUM |
| *Eleutherodactylus nitidus | Volcán Ceboruco, Nayarit | JQH 481 | 21°7’5.3” N, 104°30’3.3” O | MF535950 | CHUM |
| Eleutherodactylus sp. | Cerro Cuautepetl, Jalisco | JQH 249 | 20°37’45.69” N, 104°1’37.44” O | MF535951 | CHUM |
| *Dryophytes arenicolor | Sierra de San Juan, Jalisco | JQH 7 | 20°19’45.98” N, 103°13’26.32” O | MF535952 | CHUM |
| *Dryophytes arenicolor | Cerro Viejo, Jalisco | JQH 110 | 20°23’54.5” N, 103°25’2.6” O | MF535953 | CHUM |
| *Dryophytes arenicolor | Cerro Cuautepetl, Jalisco | JQH 227 | 20°37’44.04” N, 104°1’27.8” O | MF535954 | CHUM |
| *Dryophytes arenicolor | Sangangüey, Nayarit | JQH 305 | 21°27’23.08” N, 104°44’24.99” O | MF535955 | CHUM |
| *Dryophytes arenicolor | Volcán Tepetiltic, Nayarit | JQH 441 | 21°15’11.34” N, 104°42’57.68” O | MF535956 | CHUM |
| *Dryophytes arenicolor | Volcán Ceboruco, Nayarit | JQH 484 | 21°7’8.1” N, 104°29’51.5” O | MF535957 | CHUM |
| *Dryophytes eximius | Cerro Viejo, Jalisco | JQH 53 | 20°23’47.2” N, 103°25’47.2” O | MF535958 | CHUM |
| *Dryophytes eximius | Sangangüey, Nayarit | JQH 303 | 21°27’34.6” N, 104°44’35.76” O | MF535959 | CHUM |
| *Dryophytes eximius | Volcán Tepetiltic, Nayarit | JQH 437 | 21°15’10.26” N, 104°42’57.03” O | MF535960 | CHUM |
| *Hypopachus variolosus | Cerro Viejo, Jalisco | JQH 118 | 20°23’59.1” N, 103°24’45.9” O | MF535961 | CHUM |
| *Incilius occidentalis | Cerro Cuautepetl, Jalisco | JQH 180 | 20°39’12” N, 104°3’1.6” O | MF535962 | CHUM |
| *Lithobates neovolcanicus | Cerro Viejo, Jalisco | JQH 34 | 20°23’47.2” N, 103°25’21.2” O | MF535963 | CHUM |
| *Lithobates neovolcanicus | Cerro Cuautepetl, Jalisco | JQH 183 | 20°39’12” N, 104°3’6” O | MF535964 | CHUM |
| *Isthmura bellii | Cerro Viejo, Jalisco | JQH 83 | 20°21’47.1” N, 103°25’57.2” O | MF535965 | CHUM |
| *Spea multiplicata | Cerro Viejo, Jalisco | JQH 100 | 20°23’47” N, 103°25’6.7” O | MF535966 | CHUM |
| Craugastor sp. | Carretera a Ixtlahuacan, Colima | JAC 28321 | 19°14’45.6” N, 103°46’48.36” O | MF535967 | ARDRC |
| Craugastor sp. | Villa Union-Concordia, Sinaloa | JAC 30595 | 23°16’23.16” N, 106°7’12” O | MF535968 | ARDRC |
| Craugastor augusti | 2.2 km N Cartagenas, Jalisco | JAC 23346 | 21°59’7.152” N, 103°20’49.56” O | MF535969 | ARDRC |
| Craugastor augusti | Tepalcatepec-Coalcoman, Michoacán | JAC 24786 | 18°47’41.028” N, 103°8’46.5” O | MF535970 | ARDRC |
| Craugastor augusti | Agua Fria, Colima | JAC 28298 | 19°18’44.388” N, 104°40’14.772” O | MF535971 | ARDRC |
| Craugastor occidentalis | 9.4 km S de Autlán, Jalisco | JAC 23910 | 19°41’18.312” N, 104°23’43.872” O | MF535972 | ARDRC |
| Craugastor occidentalis | Tecolapa, Colima | JAC 30503 | 19°3’7.92” N, 103°47’2.65” O | MF535973 | ARDRC |
| Eleutherodactylus sp. | Tapalpa, Jalisco | JAC 28612 | 20°17’25.296” N, 103°36’17.64” O | MF535974 | ARDRC |
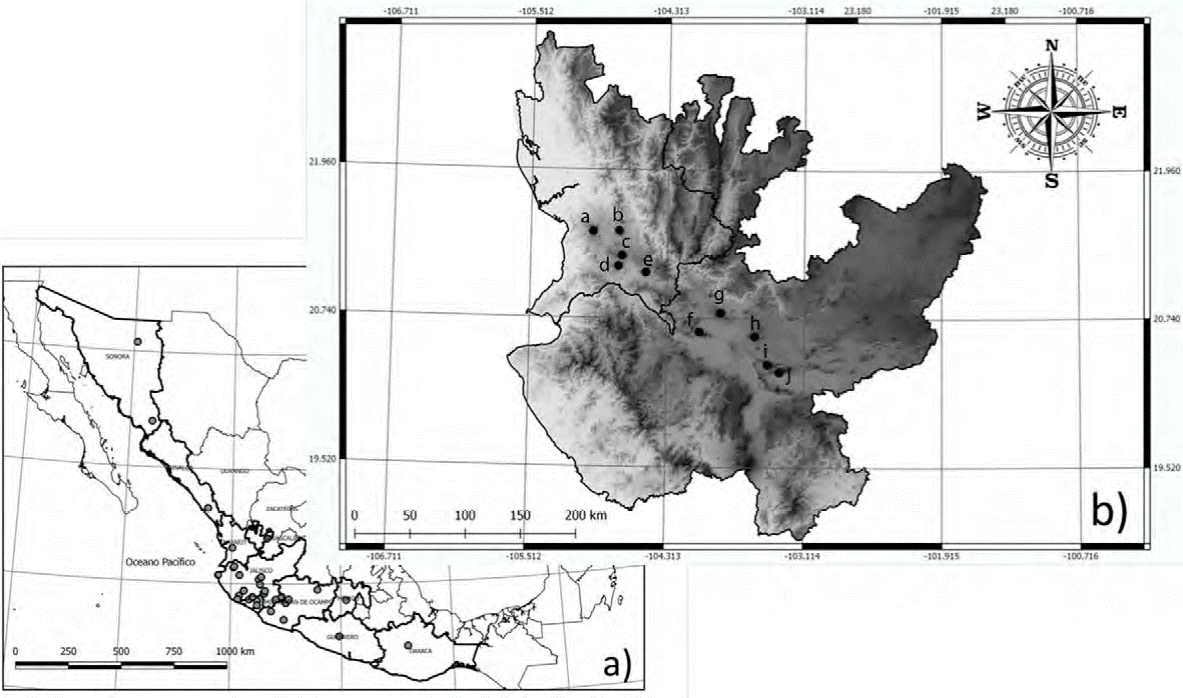
Figura 1 Localización del área de estudio. a) En círculos grises se muestran las localidades externas a los sitios de colecta; b) en círculos negros se muestran los 10 cerros y volcanes pertenecientes a la Cuenca del Río Santiago en Jalisco y Nayarit, donde se realizaron las recolectas: a = cerro Alto; b = Sangangüey; c = volcán Tepetiltic; d = cerro Grande; e = volcán Ceboruco, Nayarit; f = cerro Cuauhtépetl; g = volcán de Tequila; h = bosque La Primavera; i = cerro Vielo; j = San Juan Cosala, Jalisco.
El ADN fue extraído del tejido muscular usando el protocolo de perlas magnéticas de Rohland y Reich (2012). A los tejidos se les agregó 100 μl de Lysis buffer y 5 μl de proteinasa K (al tejido difícil de disolver se adicionó 10 μl de proteinasa K extra), después fueron incubados a 55 oC por 2 horas; sin embargo, el periodo de incubación, en algunos casos, requirió de 24 horas adicionales. La purificación del ADN se hizo con Serapure (160 ml), las muestras fueron limpiadas usando 2 enjuagues de alcohol (25 ml) y dejándolas en una solución de Tris pH 8 (50 ml). Amplificamos un fragmento del gen cytb con una longitud de 385 pb con el forward primer, MVZ15 (Moritz et al., 1992) y el reverse primer H15149 (Irwin et al., 1991) mediante PCR. Se eligió un gen mitocondrial por ser ADN no recombinante, por su origen matrilineal y debido a su relativamente rápida tasa de evolución factor adecuado para esclarecer procesos de especiación recientes (Antonelli et al., 2009; Dirienzo y Wilson, 1991). Las reacciones de PCR se hicieron en volúmenes de 25 μl (12.5 μl de green taq, 1 μl de forward primer, 1 μl de reverse primer, 2 μl de ADN y 8.5 μl de agua ultrapura). El perfil de ciclo térmico que se utilizó para los anfibios incluye 39 ciclos de 94 °C de desnaturalización, 48 °C de hibridación y 72 °C de elongación. Los productos de PCR fueron visualizados en geles de agarosa y secuenciados con protocolos estándar asociados con química de terminación BigDye® (Applied Biosystems, Foster City, CA, EUA), en las instalaciones de genómica de UTA (University of Texas at Arlington, EUA; gcf.uta.edu). Las secuencias se ensamblaron y se limpiaron en el programa Sequencher 5.4.1 (Gene Codes Corporation, Ann Arbor, MI, EUA). Una vez limpias, las secuencias fueron alineadas de forma automática en el programa MEGA versión 7 (Kumar et al., 2016) y de manera manual para verificar el alineamiento y hacer correcciones.
Tabla 2 Estimaciones de tiempos de divergencia obtenidas por inferencia bayesiana. Se muestra la media, los límites inferior y superior de los intervalos de credibilidad del 95% en unidades de millones de años.
| Nodo | Inferior | Media | Superior |
| Origen de Isthmura belli | 9.59 | 20.23 | 34.3 |
| Origen de Spea multiplicata | 20.42 | 21.47 | 25.96 |
| Origen de Incilius occidentalis | 10.37 | 17.23 | 28.2 |
| Origen de Hypopachus variolosus | 15.15 | 17.14 | 19.1 |
| Origen de Eleutherodactylus nitidus | 13.76 | 19.6 | 31.36 |
| Origen de Craugastor occidentalis | 22.82 | 25.59 | 39.23 |
| Origen de Craugastor augusti | 22.82 | 25.59 | 39.23 |
| Origen de Lithobates neovolcanicus | 6.25 | 12.27 | 20.44 |
| Origen de Dryophytes eximius | 13.63 | 14.3 | 16.4 |
| Origen de Dryophytes arenicolor | 13.63 | 14.3 | 16.4 |
| Origen de Craugastor | 26.53 | 41.31 | 61.19 |
| Origen de Eleutherodactylus | 26.53 | 41.31 | 61.19 |
Las estimaciones de tiempos de divergencia se realizaron en el programa BEAST v.1.8.4 (Drummond et al., 2006) usando un reloj molecular relajado no correlacionado lognormal, con el modelo de Yule y constriñendo nodos de los órdenes y de las familias, basándonos en filogenias previas (de Sá et al., 2012; García-París et al., 2003; Hillis y Wilcox, 2005; Marjanovic y Laurin, 2014; Mendelson et al., 2011; Parra-Olea, 2002; Pyron y Wiens, 2011; Wiens et al., 2009) e incluimos como grupos externos a Aquiloeurycea cephalica, Plethodon dunni, P. punctatus, P. virginia, Pseudoeurycea leprosa, P. longicauda, Eleutherodactylus teretistes, Incilius marmoreus, I. mazatlanensis, I. valliceps, Lithobates catesbeiana, L. chiricahuensis, L. forreri y Scaphiopus couchii. La selección del mejor modelo de evolución molecular fue a través del programa jModel Test v.2.1.9 (Darriba et al., 2012). El análisis se corrió con 20 millones de generaciones, almacenando muestras cada 1,000 generaciones. Los resultados se visualizaron en TRACER v.1.6 para verificar que el tamaño de muestra efectivo (ESS) fuese adecuado. Una vez obtenidos los árboles se eliminó el 10% con un límite de probabilidad posterior de 0.5 y para obtener un árbol consenso se usó el programa TreeAnnotator v.1.8.4 (Drummond et al., 2012). Se utilizaron edades mínimas de 7 fósiles para calibrar: 1) Rhinella marina (Wilson, 1968) fechado en 10.3-13.6 Ma durante el Mioceno, utilizado para calibrar el nodo de Incilius; 2) Craugastor sp. fechado en 22.8-23 Ma (Serrano-Sánchez et al., 2015) el cual es el ancestro más reciente y cercano del que se tiene registro dentro de México; 3) Eleutherodactylus sp. (Poinar y Canatella, 1987) fechado en 13.7-20.4 Ma durante el Mioceno, utilizado para calibrar a las especies de este género debido a la carencia de un fósil más cercano a México; 4) Hyla miocenica (Tedford et al., 1987) fechado en 13.6-16 Ma durante el Mioceno, utilizado para calibrar las especies del género Hyla; 5) Amphiuma jepseni (Rose, 1981) fechado en 56.8-61.7 Ma durante el Paleoceno, utilizado para el nodo de la familia Plethodontidae, ya que esta especie es del grupo hermano de esa familia; 6) Rana sp. (White, 1942) fechado en 16-20.4 Ma durante el Mioceno utilizado para el nodo de Lithobates ya que es el fósil más antiguo para el género; 7) Spea neuter (Kluge, 1966) fechado en 20.4-24.8 durante el Mioceno, utilizado para el género Spea, ya que es un ancestro común de dicho género. Además de los fósiles, se incluyeron calibraciones secundarias para algunos nodos. Específicamente, se incluyeron 2 dataciones secundarias para calibrar el nodo de los anuros (155 Ma) y de Hypopachus (17.4 Ma; de Sá et al., 2012; Pyron y Wiens, 2011). Para todas las calibraciones con fósiles se utilizaron parámetros de distribución lognormal, mientras que para todas las calibraciones secundarias se usaron parámetros de distribución normal.
Resultados
En general, la probabilidad posterior inferida para las divergencias entre las especies fue alta (fig. 2). Los resultados de las estimaciones de tiempos de divergencia que se reportan a continuación están basados en intervalos de credibilidad del 95%. Todas las divergencias entre especies, exceptuando a Craugastor, ocurrieron antes del Mioceno y la mayoría de las divergencias intraespecíficas ocurrieron durante el Mioceno, Plioceno y Pleistoceno. De las 10 especies de anfibios en las que se basa este trabajo, 9 presentan tiempos de divergencia intraespecíficos muy grandes, la mayoría durante el Mioceno. Sin embargo, esto debe tomarse con precaución debido a que los intervalos de credibilidad del 95% en muchos casos son grandes, debido probablemente a que solo se utilizó un marcador y a que el muestreo no está completo. La divergencia dentro de Isthmura bellii fue hace aproximadamente 9.7 (3.9-18.1 Ma; fig. 2) en donde se originaron 2 clados, el primero compuesto por las poblaciones del sur de Jalisco en la zona geológica conocida como el Graben de Colima y el segundo grupo compuesto por las poblaciones del CVT y de la SMS. Por otro lado, dentro de Spea multiplicata, la primera divergencia ocurrió hace 6.9 (1.7-14.9) Ma entre poblaciones de Sonora y del CVT, mientras que para Incilius occidentalis la divergencia calculada entre clados del CVT, SMOc y SMS fue de 2.8 (0.78-6.23) Ma. Dentro del clado de H. variolosus, la primera divergencia ocurrió hace 17.1 (15.1-19.1) Ma entre un individuo de Colima y un clado compuesto por los individuos del CVT del centro y del oeste. El tiempo de divergencia estimado entre Dryophyte eximius y Dryophyte arenicolor fue calculado en 14.3 (13.6-16.4) Ma. Dentro de las ranas de desarrollo directo, Eleutherodactylus nitidus forma 2 clados con divergencia durante el Mioceno, hace 12.4 (6.6-21) Ma. El primer clado está conformado por el CVT y la SMS mientras que el segundo clado por la CRS y la Cuenca del Río Ameca (CRA). Dentro del clado de Eleutherodactylus la divergencia entre las diferentes especies comenzó en el Mioceno hace 14.9 (7.8-25) Ma. Por los tiempos de divergencia obtenidos podemos sugerir que los 4 individuos incluyendo al del cerro Cuauhtépetl pertenecen a especies diferentes. El clado de Craugastor occidentalis presenta 2 grupos con un periodo de divergencia de 17.7 (9-27) Ma, durante el Mioceno. El primero es del oeste del CVT, dentro del cual comienza su divergencia entre los 4.9 (1.5-15.1) Ma en el Plioceno. El segundo grupo de C. occidentalis está formado por las poblaciones de la SMS y de la PC con tiempos de divergencia hace 11 (4.7-18.6) Ma. El segundo grupo de Craugastor está constituido por C. augusti, quien presenta una primera divergencia hace 14 (7.5-22) Ma en el Mioceno donde se separaron 2 clados, uno de ellos involucra a todos los de las SNN con divergencia hace 5 (1-12) Ma durante el Plioceno. El segundo grupo de C. augusti está conformado por 2 subgrupos, el del CVT y el de la SMS. Dentro de Lithobates neovolcanicus obtuvimos una divergencia en el Mioceno hace 8.4 (3.2-15) Ma entre el clado de la SMS y el CVT.
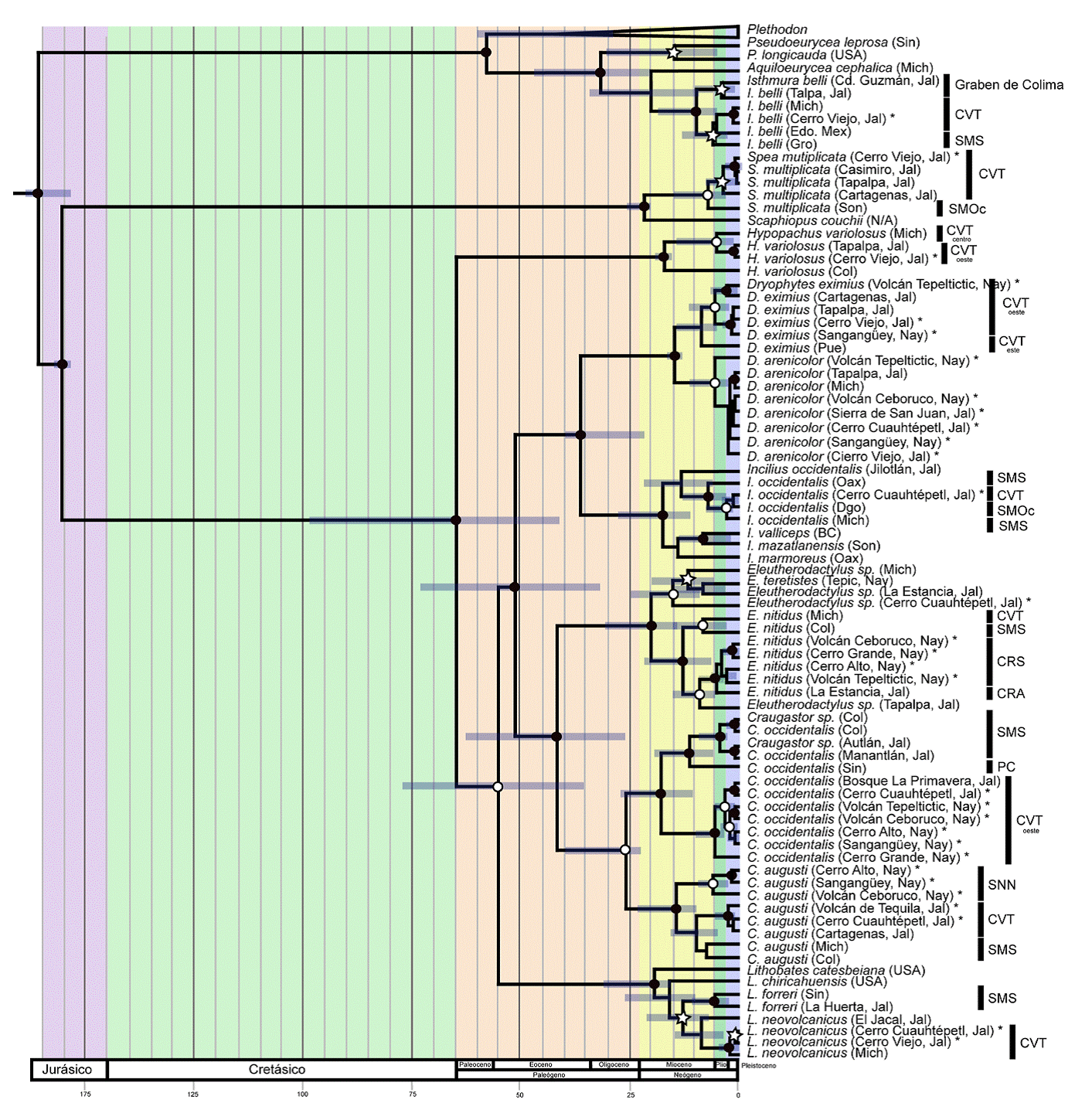
Figura 2 Estimación de los tiempos de divergencia (Ma) inferidos para las especies de anfibios de las zonas montañosas en la zona oeste del Eje Neovolcánico, usando un análisis filogenético bayesiano con reloj molecular relajado. Los nodos representan la media estimada, mientras que las barras azules representan los intervalos de credibilidad del 95% de los tiempos de divergencia. La probabilidad posterior está representada por círculos negros = ≥ 0.99, círculos blancos = ≥ 90% ≤ 98 y estrellas ≥ 70 ≤ 89. BC = Baja California, Col = Colima, Dgo = Durango, Edo. Mex = Estado de México, Gro = Guerrero, Jal = Jalisco, Mich = Michoacán, Nay = Nayarit, Oax = Oaxaca, Pue = Puebla, Sin = Sinaloa, Son = Sonora, Ver = Veracruz, CVT = Cinturón Volcánico Transmexicano, SMS = Sierra Madre del Sur, SMOc = Sierra Madre Occidental, CRS = Cuenca de Río Santiago, CRA = Cuenca del Río Ameca, PC = Planicie Costera, SNN = Sierras Neovolcánicas Nayaritas.Las especies recolectadas en los cerros y volcanes de la Cuenca del Río Santiago están marcadas con un asterisco.
Discusión
Los patrones encontrados en las especies de anfibios estudiadas sugieren que los eventos de diversificación ocurrieron principalmente durante el Neógeno, probablemente influenciados por los eventos volcánicos de la región, inferido por los tiempos estimados y la concordancia geográfica. Estos mismos patrones filogeográficos se han encontrado en otras especies donde la formación del CVT (Castoe et al., 2009; Crawford et al., 2007; Devitt, 2006), así como otras regiones montañosas y eventos geológicos (Castoe et al., 2003; Crawford y Smith, 2005; Parra-Olea et al., 2004) han jugado un papel sumamente importante en la historia evolutiva de los taxones. En diferentes regiones fisiográficas encontramos estructura entre clados de especies, lo que sugiere que regiones como el CVT, la SMS y la SMOc presentan zonas bajas que los separan entre sí y que funcionan como barreras.
Los tiempos de divergencia entre poblaciones de algunas de las especies coinciden en algún momento con episodios volcánicos que ocurrieron en el CVT, sin embargo la mayoría de los tiempos de divergencia inferidos tienen intervalos de credibilidad muy amplios y se necesitarían más datos (otros marcadores y/o más especies o muestras) para tener resultados más robustos. Entre estos episodios, destacan los del episodio máfico del Mioceno tardío, que para Isthmura bellii probablemente afectó a Cerro Viejo hace 9-10.5 Ma, lo cual puede explicar la separación entre los individuos de Jalisco a pesar de su cercanía. Después, al norte de Colima y alrededor del lago de Chapala hubo actividad volcánica alrededor de 3.5-6 Ma lo cual puede explicar la divergencia dentro del clado del Graben de Colima, mientras que en la zona centro del CVT, hubo actividad volcánica hace aproximadamente 3.4-6 Ma, lo que podría explicar la divergencia del clado del CVT. Al igual que en I. bellii, la primera divergencia del grupo SMOc de CVT en S. multiplicata pudo deberse al vulcanismo silícico que ocurrió en el Mioceno tardío, aunque también pudo deberse a la formación de algunas cuencas como la de los ríos Mezquital y Santiago, que interrumpieron la conexión entre la SMOc y la zona oeste del CVT. Esta interrupción geográfica resultó en el aislamiento entre poblaciones de diferentes grupos (abejas, Anducho-Reyes et al., 2008; escarabajos, Salinas-Moreno et al., 2004; serpientes, Bryson et al., 2011). Los patrones biogeográficos de Coleoptera encontrados en trabajos como el de Corona et al. (2007) sugieren que la SMOc y la zona oeste del CVT están estrechamente relacionadas. Greenbaum et al. (2011) encontraron el mismo patrón que nosotros para H. variolosus. Ellos señalan que hubo divisiones entre los clados de la costa del Pacífico durante el Mioceno, con subsecuentes divergencias en el Plioceno y Pleistoceno. Los resultados de Incilius concuerdan con trabajos anteriores, donde para especies de sapos de tierras bajas en México (Mulcahy y Mendelson, 2000; Mulcahy et al., 2006), al igual que en otros anfibios, reptiles y mamíferos (Castoe et al., 2003; Pérez-Higareda y Navarro, 1980; Zaldívar-Riverón et al., 2004), se proponen eventos de vicarianza durante el periodo Mioceno-Plioceno, asociado con la formación de sistemas montañosos como el CVT sugiriendo que los sistemas montañosos funcionan como barreras efectivas que promueven la diversificación de los taxones.
Nuestros resultados sobre C. occidentalis concuerdan con los de Streicher (2012) quienes encontraron un patrón biogeográfico similar para dicha especie. La formación de 2 clados dentro de C. occidentalis sugiere la posibilidad de que esta especie pudiese haber quedado aislada en la zona oeste del CVT debido a los procesos de formación dentro de esta cadena montañosa. El arco volcánico andesítico que ocurrió en la zona norte de la sierra de Manantlán del CVT durante el Plioceno tardío, explica la separación dentro de ramas de la SMS, mientras que la separación del individuo de Sinaloa, posiblemente se deba a la barrera entre ambas regiones fisiográficas. El mismo patrón filogeográfico entre clados del CVT y de la SMS encontrado para C. augusti y L. neovolcanicus, corresponde al encontrado en otros trabajos con distintos taxones (Devitt, 2006; Mateos, 2005; Mateos et al., 2002; Mulcahy y Mendelson, 2000; Pauly et al., 2004; Zaldívar-Riverón et al., 2004). Las divergencias estimadas entre clados de la zona sur-oeste del CVT son muy similares entre grupos taxonómicos. Dichas divergencias entre los clados son atribuidas al efecto que causan el CVT y la SMS, ya que entre ambas regiones existe una zona de baja altitud que funciona como barrera ecológica para esta especie. Sin embargo, el clado de SNN de C. augusti indica tener otra historia, donde las poblaciones pudieron haber quedado aisladas debido probablemente al vulcanismo silícico que ocurrió en esta zona, conduciendo al aislamiento entre las 2 poblaciones cercanas donde no hubo vulcanismo.
En la zona oeste del CVT se han encontrado muchos endemismos en diferentes grupos (aves, García-Trejo y Navarro, 2004; mamíferos, Arroyo-Cabrales et al., 2015; mariposas, Escalante y Llorente, 1985; plantas, Steinmann, 2002) aunque solo una serpiente endémica del volcán Ceboruco (Canseco-Márquez et al., 2007). Las estimaciones de tiempos de divergencia en Lithobates son similares a las obtenidas por Wiens et al. (2009), sin embargo, estos autores no incluyeron a L. neovolcanicus dentro de su trabajo.
Así como Castoe et al. (2003) encuentran una alta diversidad en Atropoides nummifer de diferentes zonas fisiográficas, nosotros también lo hicimos contemplando otros taxones. Castoe et al. (2009) consideraron evaluar poblaciones de Cerrophidion godmani de zonas altas por presentar un periodo de divergencia mayor a 5 Ma, nosotros concordamos con esta acción. Del mismo modo y basándonos en Parra-Olea et al. (2005), I. bellii tiene un patrón geográfico complicado donde las interacciones entre poblaciones es desconocida y no fueron resueltas debido al bajo soporte y a la alta divergencia entre poblaciones de diferentes regiones fisiográficas. Con esos hallazgos, sumados a las divergencias estimadas en este trabajo, podríamos sugerir una revisión más detallada de la especie ya que algunas poblaciones podrían considerarse como especies diferentes. Del mismo modo, ejemplares recolectados en sistemas montañosos diferentes como son el CVT, SMS y SMOc, presentan una diversificación mayor a 5 Ma, tales son los casos de S. multiplicata, I. occidentalis, E. nitidus, C. augusti y L. neovolcanicus, por lo que sugerimos estudios filogeográficos detallados de estas especies. El caso del clado de SNN de C. augusti, indica tener una historia diferente donde las poblaciones pudieron haber quedado aisladas, lo cual pudo deberse al vulcanismo silícico que ocurrió en esta zona; debido a este evento particular, C. augusti del volcán Ceboruco pudo haberse diferenciado desde entonces. Por otro lado, la divergencia entre Gastrophryne e Hypopachus fue hace 17 Ma, durante el Mioceno (de Sá et al., 2012; Van der Meijden et al., 2007), por lo que el individuo de Colima debe pertenecer al género Gastrophryne, esta evidencia sugiere un error en la determinación de dicho individuo posiblemente al momento de su recolecta.
Contrario a lo que sucedió con la mayoría de las especies, Dryophytes eximius y D. arenicolor no se vieron afectadas en gran medida por los episodios geológicos del Mioceno y Plioceno debido, probablemente, a que son especies generalistas que se pueden encontrar en un amplio rango altitudinal. La divergencia calculada entre estas 2 especies corresponde a la obtenida por Bryson et al. (2014), quienes la estimaron en 15.8 Ma (8-24.3) y gran parte de las divergencias de ambas especies ocurrieron durante el Pleistoceno. A pesar de que la mayoría de divergencias entre especies ocurrieron en el Mioceno y Plioceno, pensamos que las fluctuaciones climáticas del Pleistoceno pudieron tener influencia en la diversificación de todas las especies de este trabajo, pero únicamente a nivel poblacional, ya que dichas poblaciones presentan un tiempo de divergencia muy corto dentro del CVT. Los resultados obtenidos concuerdan con trabajos anteriores resaltando la importancia de las tierras altas y su función como sitios promotores de diversificación.











 text new page (beta)
text new page (beta)


