Services on Demand
Journal
Article
Indicators
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista mexicana de biodiversidad
On-line version ISSN 2007-8706Print version ISSN 1870-3453
Rev. Mex. Biodiv. vol.78 n.2 México Dec. 2007
Ecología
Estudio poblacional del acocil Cambarellus montezumae (Crustacea: Decapoda: Cambaridae) en Xochimilco, México
Population study of the crayfish Cambarellus montezumae (Crustacea: Decapoda: Cambaridae) in Xochimilco, Mexico
Fernando Álvarez* y Rebeca Rangel
Colección Nacional de Crustáceos, Instituto de Biología, Universidad Nacional Autónoma de México, Apartado postal 70–153,04510 México , D.F., México.
* Correspondencia:
falvarez@servidor.unam.mx
Recibido: 09 septiembre 2005
Aceptado: 27 marzo 2007
Resumen
Se presenta un estudio poblacional del acocil Cambarellus montezumae en Xochimilco, México, basado en el análisis de 12 muestreos, de octubre de 2001 a mayo de 2002, en los que se colectaron 668 organismos. El intervalo de tallas registrado fue de 2.1 a 41.5 mm de longitud total. Los machos, que tuvieron tallas menores que las hembras, se distinguieron entre juveniles, forma I y forma II. La presencia constante de machos forma I y de hembras ovígeras, así como la presencia de tallas pequeñas en la mayoría de los muestreos, sugieren que existe una reproducción continua a lo largo del periodo estudiado. Las estimaciones de crecimiento, basadas en un análisis de progresión modal de los datos de frecuencias de tallas, resultaron en una tasa diaria promedio de 0.084 mm, o una tasa promedio mensual de 2.535 mm. Las tallas de la primera reproducción fueron 24 mm de longitud total para hembras y 21 mm para machos, que se alcanzarían entre 248 y 284 días de edad. La estimación de mortalidad, a través del cálculo de Z (tasa instantánea de mortalidad), indica que hay una alta mortalidad durante los primeros 2 meses de vida y que sólo el 4% de la población alcanza las tallas reproductivas. No se encontró ninguna relación entre número de C. montezumae colectados con temperatura, concentración de oxígeno disuelto y pH.
Palabras clave: Crustacea, Cambaridae, Cambarellus montezumae, Xochimilco.
Abstract
A population study of the crayfish Cambarellus montezumae in Xochimilco, Mexico, is presented. The study is based on the analysis of 12 samplings, from October 2001 to May 2002, in which 668 organisms were collected. The size range recorded was 2.1 to 41.5 mm total length. The males had smaller sizes than females, and were classified as juveniles, form I and form II. The constant presence of form I males and ovigerous females, together with the presence of small sized individuals in most of the samples suggest that there is a continuous reproduction during the study period. The growth estimates, based on a modal progression analysis of length–frequency data, resulted in a mean daily growth rate of 0.084 mm, or a mean monthly rate of 2.535 mm. The sizes at first reproduction were 24 mm total length for females and 21 mm for males, attained between 248 and 284 days of age. The mortality estimate, computed as Z (instantaneous mortality rate), shows that there is a high mortality during the first two months of life and that only 4% of the population is reaching reproductive sizes. No relation was found between number of C. montezumae collected and temperature, dissolved oxygen concentration and pH.
Key words: Crustacea, Cambaridae, Cambarellus montezumae, Xochimilco.
Introducción
En México, los acociles de la familia Cambaridae se dividen en 3 géneros: Cambarellus (de Saussure, 1857); Orconectes Cope, 1872 y Procambarus Ortmann, 1905. Dentro del género Cambarellus, el subgénero del mismo nombre agrupa 10 especies que se distribuyen exclusivamente en México; en el norte (Nuevo León, Coahuila y Chihuahua), en la vertiente del Pacífico (Sinaloa, Nayarit, Jalisco, Colima, Michoacán) y en la región central (Jalisco, Michoacán, Guanajuato, Querétaro, Hidalgo, Distrito Federal, Estado de México, Morelos, Puebla y Tlaxcala). Cambarellus (Cambarellus) montezumae (de Saussure, 1857) es una de las especies de crustáceo decápodo dulceacuícola con mayor área de distribución; ocupa una gran extensión del centro del país, desde el lago de Chapala, Jalisco, hacia el este, hasta los lagos cráter de Puebla, (Rojas et al., 2002). Cambarellus montezumae se encuentra en ríos, lagos, presas, bordos y canales, asociada a las raíces de la vegetación riparia en los primeros 50 cm de profundidad.
A pesar de que es una especie de amplia distribución muy familiar para los pobladores de varias regiones a lo largo del eje neovolcánico, quienes la pescan y consumen regularmente, y a su potencial importancia dentro de las tramas tróficas, sólo existen unos cuantos estudios sobre su biología y en general se desconocen todas sus características poblacionales (Castañón–Cervantes et al., 1996; Rojas et al., 2002; Rangel, 2004).
Se ha mostrado que los acociles pueden modificar las cadenas tróficas al cambiar su tipo de alimentación (Nystrom et al., 1996), puesto que pueden consumir cantidades importantes de macrofitas (Lodge y Lorman, 1987; Nystrom y Strand, 1996), servir de presa a una amplia variedad de organismos (Foster y Slater, 1995; Davis et al., 1999; Hinojosa–Garro y Zambrano, 2004), así como ser depredadores tanto de vertebrados como de invertebrados en los cuerpos de agua donde se encuentran (Foster y Slater, 1995; Nystrom et al., 2001; Sagova, 2002). Considerando esta importancia multifactorial de los acociles dentro de los sistemas dulceacuícolas y la falta de datos sobre C. montezumae específicamente, se realizó el presente estudio que tuvo como objetivo hacer una caracterización poblacional de la especie en el sistema lacustre de Xochimilco, Distrito Federal. Para realizar los muestreos se eligió la Pista de Remo y Canotaje Virgilio Uribe, lugar de fácil acceso y relativamente conservado.
Materiales y métodos
Se diseñó un programa de 12 muestreos de acociles en el canal de Cuemanco, que se inició el 30 de octubre de 2001 y concluyó el 9 de mayo de 2002. Luego de un reconocimiento, se estableció la estación de muestreo en el canal de entrenamiento. Para hacer las muestras comparables se estandarizó el esfuerzo de colecta, tomándolas con una red de cuchara de 30 x 37 cm, durante una hora, de 10:00 a 11:00 AM, en la orilla del cuerpo acuático. Se empleó un oxímetro (Orion D–120) para medir tanto la concentración de oxígeno disuelto (mg/l) como la temperatura (°C) del agua; se tomó una muestra de agua para medir el pH en el laboratorio (pH–metro Corning 430). Las muestras de acociles se fijaron en alcohol al 70%.
Se midió la longitud total (LT) (punta del ácumen al margen posterior del telson) y la longitud del cefalotórax (LC) (punta del ácumen al margen medio posterior del caparazón). Se utilizó un vernier con precisión de 0.5 mm para los organismos mayores de 15 mm y un microscopio estereoscópico Olympus SZH–10 para los menores de 15 mm.
Todos los organismos fueron sexados y se determinó el estadio del ciclo de vida del macho (juvenil, forma I o adulto en estado reproductivo; forma II o adulto no reproductivo) de acuerdo al desarrollo de los procesos apicales del primer par de pleópodos y de los ganchos de los isquios del tercero y cuarto par de pereiópodos (Rojas, 2003). Adicionalmente, se midieron las hembras ovígeras y para estimar la fecundidad se contó el número de huevos, obteniéndose el diámetro de 5 por puesta, para lo cual se utilizó el microscopio de disección y una reglilla micrométrica. Algunas hembras capturadas en cópula se mantuvieron en el laboratorio hasta que los huevecillos fueron depositados en los pleópodos. Esto se realizó con el fin de aumentar el tamaño de muestra de hembras ovígeras, ya que se colectaron en raras ocasiones.
Para determinar si existía alguna relación entre los parámetros abióticos (temperatura, pH y concentración de oxígeno disuelto) y la abundancia de organismos y entre la talla y fecundidad de las hembras ovígeras, se realizaron regresiones lineales. Los valores promedio se presentan con su desviación estándar.
El análisis de crecimiento se realizó con el método de progresión modal, es decir, siguiendo las modas en muestreos subsecuentes para determinar el crecimiento de una cohorte a través del tiempo. La composición por tallas se obtuvo al graficar los datos de frecuencia en clases de talla de 3 mm. El intervalo de clase se fijó de tal manera que redujera la dispersión de los datos. Para identificar las modas en cada distribución, se descompuso la distribución en sus componentes gaussianos siguiendo el método de Battacharya (Battacharya, 1967). Una vez obtenidas las modas para todas las distribuciones de talla, se procedió a hacer ajustes lineales que consideraran por lo menos 3 puntos y en los que la pendiente no rebasara una tasa de crecimiento de 3.2 mm/mes (Álvarez et al., 1987). La tasa de crecimiento máxima de 3.2 mm/mes se adoptó después de tener 120 organismos en el laboratorio durante 3 meses para determinar el incremento y frecuencia de muda. Para calcular la tasa de crecimiento se consideraron 71 mudas de individuos que mudaron 2 o más veces. El incremento de muda varió de 0.015 a 5.2 mm, con un promedio de crecimiento mensual de 1.874 ± 1.315 mm. De esta manera, la tasa máxima de crecimiento considerada en este estudio fue el promedio más una desviación estándar.
Para obtener la tasa de mortalidad instantánea (Z) se calculó la edad de cada talla, derivando estos datos del análisis de crecimiento. Se realizó un ajuste exponencial negativo basado en el modelo: Nt = N0 e–Zt, en donde Nt es el número de individuos vivos al tiempo t; N0, el número inicial de individuos en la población; e, la base de los logaritmos naturales; Z, la tasa instantánea de mortalidad; y t, tiempo (Ricker, 1975). El cálculo de la tasa de mortalidad inició con la máxima frecuencia, que se da a los 12 mm LT o 150 días de edad, a partir de la cual se obtiene una pendiente negativa. La estimación de Z se tomó como el valor absoluto de la pendiente de la regresión y se expresa sobre una base diaria.
Resultados
La descripción de los parámetros abióticos registrados es como sigue: el pHvarió entre 8.4 en noviembre y 10.13 en diciembre  ; la concentración de oxígeno disuelto fluctuó entre 0.25 mg/l en abril y 14.8 mg/l en diciembre
; la concentración de oxígeno disuelto fluctuó entre 0.25 mg/l en abril y 14.8 mg/l en diciembre  ; y por último, la temperatura del agua fluctuó de 13.1 °C en enero a 25.3 °C en abril
; y por último, la temperatura del agua fluctuó de 13.1 °C en enero a 25.3 °C en abril  . La abundancia de los organismos no se relacionó con ninguno de los tres parámetros ambientales considerados (pH, r2 = 0.072; concentración de oxígeno disuelto, r2 = 0.001; temperatura, r2 = 0.037).
. La abundancia de los organismos no se relacionó con ninguno de los tres parámetros ambientales considerados (pH, r2 = 0.072; concentración de oxígeno disuelto, r2 = 0.001; temperatura, r2 = 0.037).
Se capturaron 668 organismos a lo largo de los 12 muestreos, de los cuales 381 fueron hembras y 287 machos; se obtuvo una proporción de 1:1.3 machos por hembra, lo que difiere significativamente de una razón sexual de 1:1 ( = 13.22, P < 0.05). El mayor número de individuos se capturó en el mes de octubre del 2001 con 122 organismos en total, lo cual correspondió a la primera colecta; en febrero y mayo del 2002 se obtuvo el menor número de organismos (31; Fig. 1).
= 13.22, P < 0.05). El mayor número de individuos se capturó en el mes de octubre del 2001 con 122 organismos en total, lo cual correspondió a la primera colecta; en febrero y mayo del 2002 se obtuvo el menor número de organismos (31; Fig. 1).

Las tallas de los organismos capturados variaron de 2.1 a 41.5 mm LT (Fig. 2). Respecto a los machos, de 2.1 a 25.8 mm LT fueron juveniles; de 16.6 a 30.6 mm LT, machos forma II, y de 21.1 a 36.9 mm LT, machos forma I (Fig. 3). Los machos juveniles se presentaron durante todo el periodo de muestreo; no obstante, hubo una reducción en los meses de febrero, abril y mayo, mientras que de octubre a enero se encontró el mayor número de estos individuos. En cuanto a los machos forma I y forma II, al igual que los juveniles, siempre estuvieron presentes, aunque en menor número con respecto a los machos juveniles; su número se incrementó particularmente en el periodo febrero–abril.


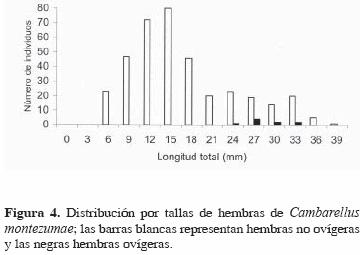
En el caso de las hembras, su talla varió de 6.1 a 41.5 mm LT. Las hembras más grandes (38 – 41.5 mm LT) aparecen en los meses de febrero, marzo y abril. En cuanto a las hembras ovígeras, éstas fueron encontradas en los meses de enero, febrero, marzo, octubre y noviembre; su talla varió de 24.0 a 40.5 mm  (Figs. 4, 6) (Figura 4, 5 y 6). La fecundidad fluctuó de 12 a 120 huevecillos
(Figs. 4, 6) (Figura 4, 5 y 6). La fecundidad fluctuó de 12 a 120 huevecillos  ; habiendo una correlación significativa y positiva entre el número de huevos y la talla de la hembra (r = 0.869, P <0.001) (Fig. 6). El diámetro de los huevecillos fue de 1.25 a 1.55 mm, el cual sólo varió de 0.1 a 0.2 mm de diámetro de un huevo a otro pertenecientes a una misma hembra; la mayoría de los huevos fueron esféricos; sin embargo, se encontraron algunos ovales, el tamaño de éstos fue de 1.46 x 1.55 mm.
; habiendo una correlación significativa y positiva entre el número de huevos y la talla de la hembra (r = 0.869, P <0.001) (Fig. 6). El diámetro de los huevecillos fue de 1.25 a 1.55 mm, el cual sólo varió de 0.1 a 0.2 mm de diámetro de un huevo a otro pertenecientes a una misma hembra; la mayoría de los huevos fueron esféricos; sin embargo, se encontraron algunos ovales, el tamaño de éstos fue de 1.46 x 1.55 mm.

El análisis de crecimiento basado en el método de progresión modal comprendió el seguimiento de 4 cohortes (Fig. 5). La primera cohorte se siguió durante 5 muestreos (75 días) de diciembre a febrero obteniéndose una tasa de crecimiento de 0.106 mm/día o 3.2 mm/mes. La segunda cohorte se siguió durante 3 muestreos (60 días) en enero y febrero, resultando en una tasa de crecimiento de 0.066 mm/día o 2 mm/mes. La tercera cohorte, seguida durante 3 muestreos (60 días) de febrero a abril, representa una tasa de crecimiento de 0.1 mm/día o 3.0 mm/mes. Finalmente, la cuarta cohorte seguida de marzo a mayo durante 3 muestreos (75 días), representa una tasa de crecimiento de 0.066 mm/día o 2 mm/mes. El promedio de las 4 tasas de crecimiento fue de 0.084 mm/día o 2.535 mm/mes.
La tasa instantánea de mortalidad tuvo un valor de –0.0401. El ajuste de la curva exponencial negativa (Fig. 7) sugiere una mortalidad muy alta durante los primeros 2 meses de vida. Extrapolando para obtener un valor inicial del número de individuos en la población (1064 individuos), se obtiene que a los 150 días ha sobrevivido apenas el 20.3%, 2.7% a los 320 días y el 0.05% a los 460 días. La talla mínima de las hembras ovígeras es de 24 mm LT; sin embargo, la talla a la que el 50% de las hembras son ovígeras es de 32.5 mm LT que se alcanza hacia los 390 días de edad.

Discusión
Dentro de los canales de Xochimilco, C. montezumae puede ser una de las especies dominantes de invertebrados nativos. Como se mostró en este estudio, los acociles estuvieron siempre presentes durante el invierno y la primavera. La abundancia de acociles, aunque tuvo valores bajos, siempre se mantuvo por arriba de 30 individuos hasta un máximo de 120. Hay que considerar que se muestreó tan sólo una zona de orilla del canal de entrenamiento de la pista de canotaje de Cuemanco de aproximadamente 10 m de largo por 1 m de ancho. Si se considera que hay 203 kilómetros de canales en el sistema Xochimilco (Gaceta Oficial del Distrito Federal, 2006), esto puede sugerir que C. montezumae es realmente una especie abundante a lo largo de las orillas de los canales, donde exista vegetación riparia. Desafortunadamente no existe ningún dato previo sobre abundancia y su variación a lo largo del año para esta especie con el cual se puedan hacer comparaciones.
En la composición de tallas de C. montezumae por muestreo se aprecia que en 7 muestreos se capturaron organismos que midieron entre 3 y 6 mm LT, mientras que en 6 las tallas fueron entre 6 y 9 mm LT y en 5 ocasiones organismos de 9 a 12 mm LT. El patrón sugiere entonces que a lo largo del estudio hay pulsos de reclutamiento que reflejan una actividad reproductiva continua. Aunado a esto, se encontraron hembras ovígeras en 5 meses distintos (octubre, noviembre, enero, febrero y marzo) sugiriendo una reproducción continua a lo largo del periodo estudiado.
Con respecto a los machos, en todas las muestras se encontraron tanto juveniles como machos forma I y II. Este patrón también sugiere que no existe estacionalidad en los patrones de reproducción de la especie. Quizá la reproducción se acentúa durante el verano, pero ciertamente ocurre todo el año como se ha observado en muestreos depositados en la Colección Nacional de Crustáceos, del Instituto de Biología, hechos de junio a septiembre. Es importante señalar que los machos forma II tienen tallas intermedias entre los juveniles y los forma I. De esta forma, se puede pensar que los machos de C. montezumae pasan por la forma II sólo una vez durante el ciclo de vida. En otras especies con tamaños corporales más grandes, los machos pueden mudar de forma I a forma II durante épocas en que no habrá reproducción (invierno), de tal manera que los machos forma II pueden tener las tallas más grandes en la población (Holdich, 2002) y de hecho ser dominantes durante los meses no reproductivos (Payne y Price, 1983).
Las hembras pueden ser ovígeras a partir de los 24 mm LT (Holdich, 2002), sugiriendo también que ésta es la talla de la primera reproducción, resultado que también se obtuvo en este estudio. El bajo número de hembras ovígeras encontradas se puede deber a que éstas se esconden en madrigueras profundas para proteger los huevecillos, de tal manera que es difícil colectarlas. La escasez de hembras ovígeras en las muestras de acociles de otras especies (Rodríguez, 2003) muestra que este posible comportamiento se comparte en todo el grupo.
El diámetro de huevo mostró una variación reducida de 1.25 a 1.55 mm, siendo en su mayoría esféricos. Se colectaron hembras portando huevecillos en varias etapas de madurez, los primeros fueron amarillos, luego rojos y finalmente, negros u oscuros. El número de huevecillos en la puesta varió considerablemente de 12 a 120. Es muy probable que las hembras con bajo número de huevos hayan perdido un alto porcentaje de ellos durante la colecta. El valor de fecundidad máxima obtenido en este estudio es comparable al que registran Arana–Magallón et al. (1998), quienes encuentran una fecundidad máxima de 124 huevecillos en hembras que alcanzaron 50 mm LT en las presas de Atlangatepec, Apizaquito y Buenavista en el estado de Tlaxcala.
Las tasas de crecimiento calculadas fluctuaron entre 0.066 y 0.106 mm por día, con un promedio de 0.084 mm/día, lo que equivale a 2.535 mm/mes. Asimismo, los resultados del análisis de crecimiento sugieren que los acociles de Xochimilco pueden alcanzar la madurez sexual tanto en hembras como en machos en 285 días o en 9 meses y medio aproximadamente, considerando una talla de eclosión de 3 mm LT. Esto sugiere que la talla mínima de captura debería estar por arriba de 30 mm para permitir que todos los organismos tuvieran al menos una oportunidad de reproducirse.
El análisis de mortalidad muestra que C. montezumae en Xochimilco vive aproximadamente 15 meses en condiciones naturales, ya que en nuestro laboratorio se han mantenido por cerca de 2 años. Aún cuando se descarta que haya procesos de inmigración o emigración que pudieran estar afectando la estimación de mortalidad, es posible que la tasa calculada esté sobre estimada debido a una ausencia en los muestreos de los individuos más grandes de la población. Las mayores tallas registradas por Arana–Magallón et al. (1998) en Tlaxcala fueron de 50 mm LT para hembras y 46 mm LT para machos, que son mayores que las de Xochimilco en donde la talla máxima para hembras fue de 41.5 mm LT y para machos de 37 mm LT. Sin embargo, el intervalo de tallas obtenido no refleja que haya un sesgo en el muestreo. Rodríguez (2003) registra para Procambarus bouvieri en la presa Caltzontzin, en Uruapan, Michoacán, una tasa de mortalidad mensual de –0.1463. De este cálculo resulta que 31% de la población de P. bouvieri alcanza la madurez sexual, mientras que sólo la alcanza el 4% de la población de C. montezumae en Xochimilco.
Los 3 parámetros de calidad del agua considerados no tuvieron una relación significativa con la abundancia de C. montezumae. Igualmente Arana–Magallón et al. (1998) registran condiciones físico–químicas similares en su estudio realizado con la misma especie en 3 embalses en Tlaxcala. La concentración de oxígeno disuelto en las aguas someras de las presas osciló entre 5 y 7.5 mg/l con un promedio de 6 mg/l; en tanto el pH varió entre 7.6 y 9 manteniéndose alrededor de 8 la mayor parte del año, 10 cual es comparable con los valores de Xochimilco. En cambio en la temperatura, en el estudio de los 3 embalses, se obtiene un promedio de 17 a 18 °C con una mínima de 10 °C y máxima de 25 °C, lo cual confirma que C. montezumae puede desarrollarse en temperaturas muy bajas. Rodríguez–Serna y Carmona–Osalde (2002) demostraron que C. montezumae tiene una mayor tasa de ingesta y eficiencia de asimilación de alimento a 17 °C que a 23 °C, apoyando también la preferencia de esta especie por temperaturas por debajo de 20 °C.
Literatura citada
Álvarez, F., A. Gracia y L. A. Soto. 1987. Crecimiento y mortalidad de las fases estuarinas del camarón rosado Penaeus (Farfantepenaeus) duorarum Burkenroad, 1939 en la laguna de Términos, Campeche. Anales del Instituto de Ciencias del Mar y Limnología, Universidad Nacional Autónomade México 14:115–137. [ Links ]
Arana–Magallón, F., R. Pérez–Rodríguez y A. Malpica–Sánchez. 1998. Cambáridos de tres embalses del estado de Tlaxcala, México (Crustacea: Decapoda). Revista de la Sociedad Mexicana de Historia Natural 48:23–35. [ Links ]
Battacharya, C. G. 1967. A simple method of resolution of a distribution with gaussian components. Biometrics 23:115–135. [ Links ]
Castañón–Cervantes, O., E. G. Escamilla–Chimal y C. C. García–Rivera. 1996. El cultivo del acocil. Ciencia y Desarrollo 130:76–80. [ Links ]
Davis, C. J., J. G. Miner y J. M. Wojdak. 1999. Potential effects of the round goby (Neogobius melanostomus) on crayfish (Orconectes rusticus) in Lake Erie. International Association for Great Lakes Research: Great Lakes, Great Science, Great Cities. Program and Abstracts. p. A–25. [ Links ]
Foster, J. y F. M. Slater. 1995. A global review of crayfish predation with observations on the possible loss of Austropotamobius pallipes in the Welsh Wye due to crayfish plague. Louisiana State University Printing Office, Baton Rouge. p. 589–613. [ Links ]
Gaceta Oficial del Distrito Federal. 2006. Acuerdo por el que se aprueba el programa de manejo del área natural protegida con carácter de zona de conservación ecológica: Ejidos de Xochimilco y San Gregorio Atlapulco. 11 de enero de 2006. [ Links ]
Hinojosa–Garro, D. y L. Zambrano. 2004. Interactions of common carp (Cyprinus carpio) with benthic crayfish decapods in shallow ponds. Hydrobiologia 515:115–122. [ Links ]
Holdich, D. M. 2002. Biology of freshwater crayfish. Blackwell Science, Oxford. 702 p. [ Links ]
Lodge, D. M. y J. G. Lorman. 1987. Reduction in submerged macrophyte biomass and species richness by the crayfish Orconectes rusticus. Canadian Journal of Fisheries and Aquatic Sciences 44:591–597. [ Links ]
Nystrom, P. y J. Strand. 1996. Grazing by native and an exotic crayfish on aquatic Macrophytes. Freshwater Biology 36:673–682. [ Links ]
Nystrom, P., C. Bronmark y W. Graneli. 1996. Patterns in benthic food webs: a role for omnivorous crayfish? Freshwater Biology 36:631–646. [ Links ]
Nystrom, P., O. Svensson, B. Lardner, C. Bronmark y W. Graneli. 2001. The influence of multiple introduced predators on a littoral pond community. Ecology 82:1023–1039. [ Links ]
Payne, J. F. y J. O. Price. 1983. Studies on the life history and ecology of Orconectes palmeri palmeri (Faxon). In Freshwater crayfish. V., C. R. Goldman (ed.), AVI, Westport, Connecticut. p. 183–191. [ Links ]
Rangel, R. 2004. Estudio poblacional de Cambarellus montezumae en la Pista de Remo y Canotaje "Virgilio Uribe", Xochimilco; México, D.F. Tesis, Facultad de Ciencias, Universidad Nacional Autónoma de México, México, D.F. 50 p. [ Links ]
Ricker, W. E. 1975. Computation and interpretation of biological statistics of fish populations. Bulletin of the Fisheries Research Board of Canada 191:1–382. [ Links ]
Rodríguez, I. T. 2003. Conservación y manejo de Procambarus bouvieri en la presa Caltzontzin, Uruapan, Michoacán. Tesis Maestría, Facultad de Biología, Universidad Michoacana de San Nicolás de Hidalgo, Morelia, Michoacán, 81 p. [ Links ]
Rodríguez–Serna, M. y C. Carmona–Osalde. 2002. Balance energético del acocil Cambarellus montezumae (Saussure) (Crustacea: Astacidea: Cambaridae): pérdida de energía en la tasa metabólica. Universidad y Ciencia 18:128–134. [ Links ]
Rojas, Y. 2003. Revisión taxonómica de las especies de Cambarellus (Cambarellus) (Crustacea: Decapoda: Astacidae: Cambaridae): Análisis morfológico. Tesis Maestría, Posgrado en Ciencias Biológicas, Universidad Nacional Autónoma de México, D.F. 179 p. [ Links ]
Rojas, Y., F. Álvarez y J. L. Villalobos. 2002. Morphological variation in the crayfish Cambarellus (Cambarellus) montezumae (Crustacea: Decapoda: Cambaridae). In Modern approaches to the study of Crustacea, E. Escobar–Briones and F. Álvarez (eds.). Kluwer Academic/Plenum, New York. p. 311– 317. [ Links ]
Sagova, M. 2002. Interactions between crayfish, benthic invertebrates, macrophyte roots and sediment in a littoral zone. Archiv fur Hydrobiologie 155:645–665. [ Links ]














