Services on Demand
Journal
Article
Indicators
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista mexicana de biodiversidad
On-line version ISSN 2007-8706Print version ISSN 1870-3453
Rev. Mex. Biodiv. vol.77 n.2 México Dec. 2006
Ecología
Selección de refugios por tres especies de murciélagos frugívoros (Chiroptera: Phyllostomidae) en la Selva Lacandona, Chiapas, México
Roost selection by three frugivorous bats (Chiroptera: Phyllostomidae) in the Lacandon Forest, Chiapas, Mexico
David Ortiz–Ramírez1 *, Consuelo Lorenzo1, Eduardo Naranjo1 y Livia León–Paniagua2
1 El Colegio de la Frontera Sur, Unidad San Cristóbal Carretera Panamericana y Periférico Sur s/n, San Cristóbal de Las Casas, Chiapas, México.
2 Departamento de Biología Evolutiva, Facultad de Ciencias, Universidad Nacional Autónoma de México, México D. F.
*Correspondencia:
dortiz@posgrado.ecosur.mx
Recibido: 09 marzo 2005
Aceptado: 29 junio 2006
Resumen
Se describen las características estructurales de altura, cobertura y diámetro de árboles refugio, así como las características microambientales de temperatura y la humedad, en dos sitios de la Selva Lacandona, Chiapas, donde estuvieron presentes 3 especies de murciélagos filostómidos frugívoros, Artibeus lituratus, Carollia perspicillata y Sturnira lilium. Se localizaron y describieron 11 refugios diurnos mediante la búsqueda sistemática de árboles en ambas localidades; como método complementario se empleó la telemetría. Las tres especies de murciélagos filostómidos utilizaron como árboles refugio aquéllos de gran altura y diámetro y con más de una cavidad, localizados en áreas de bosque tropical maduro o en estado de sucesión avanzado. Igualmente, las tres especies utilizaron como refugio árboles con valores de humedad por debajo de la encontrada en el exterior (81.04 ± 6.88%, en el interior, comparada con 93.56 ± 4.50% en el exterior). No se encontró que la temperatura fuera una característica importante para la selección de árboles refugio en estos murciélagos tropicales.
Palabras clave: uso de refugios, características estructurales y microambientales, telemetría, Carollia perspicillata, Sturnira lilium, Artibeus lituratus.
Abstract
In 2 different sites of the Lacandon Forest, Chiapas, Mexico, structural characteristics of tree roosts, such as height, cover, and diameter were described and evaluated. Microenvironmental traits (temperature and moisture) were also assessed in each roost where 3 species of phyllostomid bats Artibeus lituratus, Carollia perspicillata and Sturnira lilium were present. Eleven day–roosts were located and described after a systematic search of trees in both sites. Telemetry was also used as complementary method. Bat species preferred large roost–trees and with more than one cavity. All the roosts were located in areas of mature tropical forest or in advanced sucesional stages. The species preferred roosts in trees with lower values of moisture than those in the exterior (means with standard deviation) (81.04 ± 6.88%, on the inside against 93.56 ± 4.50% on the outside). Temperature was not an important trait for roost selection on trees for any of the bats studied.
Key words: roost use, structural characteristics, microenvironment, telemetry, Carollia perspicillata, Sturnira lilium, Artibeus lituratus.
Introducción
Las condiciones y eventos asociados con la selección de refugios diurnos por parte de los murciélagos son elementos importantes en su ecología y evolución (Kunz, 1982). Los refugios diurnos (cuevas o árboles) proveen a los murciélagos con sitios para su reproducción, hibernación y crianza, y son sitios tranquilos para la ingesta y digestión del alimento. De igual manera estos sitios brindan protección contra depredadores, promueven las relaciones entre los miembros de la población y proporcionan un ambiente térmicamente estable, minimizando las fluctuaciones en las variables ambientales (Morrison, 1979; Fenton, 1983; Kurta, 1985).
La selección y uso de refugios por parte de los murciélagos está influenciada por factores intrínsecos (preferencias basadas en necesidades metabólicas, preferencia por sitios descubiertos o cerrados, experiencia previa, economía energética en relación al tamaño corporal, organización social, selección sexual, etcétera), como factores extrínsecos a los animales (forma del refugio, abundancia y disponibilidad de sitios, riesgos de depredación, distribución y abundancia de los recursos alimentarios, ambiente físico, etcétera; Fenton, 1970; Humphrey, 1975; Gaisler, 1979; Kunz, 1982; Brigham et al., 1997; Kerth et al., 2000). Sin embargo, estos factores extrínsecos no responden el por qué los murciélagos ocupan sitios temporales o permanentes, si se benefician de utilizar el mismo refugio o si la falta de albergues alternos los lleva a permanecer en ellos por largos periodos de tiempo (Barbour y Davis, 1969; Lewis, 1995).
Estudios ecológicos detallados han demostrado que los murciélagos de climas templados presentan preferencias muy particulares en cuanto a las características de sus refugios, como la altura del árbol, especie, etapa de crecimiento, cobertura y distancia del refugio a la fuente de agua más cercana (Barclay y Brigham, 1996; Sedgeley y O'Donnell, 1999; Kunz y Lumdsen, 2003). Cuando los murciélagos utilizan refugios con características no aptas para la colonia su éxito reproductivo decae (Brigham y Fenton, 1986).
En trabajos sobre la selección de refugios por murciélagos en el neotrópico se menciona de manera somera la utilización de refugios en árboles por especies presentes en nuestro país (Medellín, 1988). En zonas tropicales se ha registrado que especies como Artibeus lituratus, A. jamaicensis, Carollia perspicillata, C. brevicauda, Sturnira lilium, Trachops cirrhosus, Tonatia silvicola y Vampyrodes caraccioli prefieren tener sus refugios dentro de cavidades que se forman de ramas o en el centro de los árboles, ya que estas cavidades ofrecen protección contra el ambiente y depredadores (Morrison, 1979; Morrison y Handley Jr., 1991; Kalko et al., 1999).
Artibeus lituratus, C. perspicillata, y S. lilium se han encontrado en refugios tanto naturales como artificiales (Lemke, 1978; Kunz et al., 1983; Gannon et al., 1989), compartiéndolos con otras especies (Graham, 1988; Medellín, 2003). Sin embargo, no se han descrito con profundidad las características de sus refugios (Reid, 1997). Recientemente se ha observado que S. lilium utiliza cuevas como refugio nocturno; no obstante, se ha demostrado su escasa presencia en las mismas, lo que supone la utilización de otro tipo de refugio durante el día (Wohlgenant, 1994; Fenton et al., 2000; Evelyn y Stiles, 2003).
Artibeus lituratus, C. perspicillata y S. lilium, pertenecen a la familia Phyllostomidae, y son las especies más abundantes de murciélagos neotropicales (Ortega y Arita, 1999), las cuales juegan un papel ecológico muy importante como dispersores de semillas (Estrada y Merrit, 1993; Iudica y Bonaccorso, 1997; Medellín et al., 2000; Shulze et al., 2000). El conocer los mecanismos por los cuales A. lituratus, C. perspicillata y S. lilium seleccionan su refugio es de gran importancia para su conservación y la de las especies con las que cohabitan. El objetivo de este trabajo es describir los parámetros físicos y ambientales que determinan la utilización del refugio diurno (árboles) de las especies arriba mencionadas en dos sitios de la Selva Lacandona, Chiapas.
Materiales y métodos
El estudio se realizó en dos localidades ubicadas al noreste del estado de Chiapas, dentro de la región de la Selva Lacandona: 1) Reserva de la Biosfera Montes Azules (REBIMA) con vegetación de selva alta y selva mediana, y 2) Ejido Playón de la Gloria (EPDG), frente a la REBIMA, con mosaicos de vegetación de selva alta y selva mediana, pastizales inducidos, cultivos de temporal (maíz, frijol y chile) y plantaciones de cacao (Orellana, 1978). Ambos sitios se encuentran entre los 16° 08'56'' y 16° 10' 08'' N y los 90° 53' 57 y 90° 54' 59'' O (Fig. 1). El clima predominante es el cálido húmedo con una temperatura media anual superior a los 22° C, con baja oscilación térmica anual. La precipitación anual alcanza valores superiores a los 1,500 mm, y hasta los 3000 mm (Orellana, 1978).
Se efectuaron 7 salidas de 15 días de duración, durante los meses de enero a julio de 2004. Para la búsqueda y localización de los refugios se recorrieron 5 senderos dentro de la región de la REBIMA de 4 kilómetros cada uno, y de igual manera, en sitios con vegetación secundaria dentro del EPDG. Se trató de recorrer la misma distancia en ambos sitios, para abarcar un área de búsqueda similar. Para la captura de los murciélagos se utilizaron 3 redes de niebla de 12 metros de longitud, en zonas donde se observó actividad y 2 en donde se ubicaron árboles utilizados como refugios. Los murciélagos se identificaron utilizando las guías de campo de Medellín et al. (1997) y Reid (1997).
Como método complementario a los recorridos se utilizó la telemetría. A un individuo de cada una de las 3 especies en estudio se le implantó un radiotransmisor (BD–2N, Holohil Systems Ltd. Ontario) con pegamento quirúrgico (SkinBond, Pfizer) en la parte central del dorso. Los transmisores tenían una vida útil de 20 días aproximadamente y pesaban 0.43 gramos, menos del 5% de la masa corporal del individuo de la especie mas pequeña, como lo es S. lilium que pesa entre 13 y 18 gramos (Aldridge y Brigham, 1988). Una vez instalado el radiotransmisor, se dejaron en libertad en el sitio de captura. A la mañana siguiente se verificó el sitio de percha diurno de manera directa, rastreando al individuo mediante el uso de dos radiorreceptores y antenas (Telonics TR–4 y Telonics RA–14). Se inició la búsqueda de los individuos radiomarcados en el sitio de captura, y se rastreó en dirección norte–sur y este–oeste, con la finalidad de abarcar una mayor área y de localizar con rapidez al individuo y a su refugio. Este rastreo se realizó durante los 15 días de campo, ya que es el tiempo en el que el transmisor suele desprenderse (Aldridge y Brigham, 1988).
Los árboles refugio localizados se marcaron con cintas de colores y sus características se evaluaron de acuerdo con diferentes variables. Para la determinación de la(s) especie(s) de murciélagos ocupantes del refugio, se colocaron redes de niebla en la entrada. La altura de la entrada, se obtuvo con la ayuda de flexómetros, arneses y cuerdas. Del árbol refugio se consideraron especie, diámetro a la altura del pecho (DAP) y cobertura, que fue tomada como las dos distancias perpendiculares máximas de sombra tomando el tronco del árbol como eje y altura.
Las variables ambientales, temperatura mínima, máxima y ambiental, así como la humedad mínima, máxima y ambiental se registraron en el interior y exterior del refugio; estas variables fueron registradas utilizando dos higrómetros – termómetros digitales (Radioshack Mod. 63–1032) y se obtuvieron colocando los dispositivos día y noche, y dentro y fuera del refugio, registrándose a la mañana siguiente las temperaturas y humedades máximas y mínimas, almacenadas en la memoria del termómetro. La temperatura y humedad ambiental se registraron durante 5 días consecutivos a la misma hora (9:00 AM, hora en que se registró la temperatura media), a partir del primer día de captura de los murciélagos. Por lo tanto, estos datos representan valores diarios (durante 24 hrs.).
Con el fin de identificar los factores no ambientales que determinan la selección del refugio se midieron las variables DAP, cobertura, altura, distancia al refugio y número de cavidades en todas las especies de árboles que se encontraban dentro de un radio de 10 m del árbol refugio, con un DAP mayor a 16 cm (Evelyn y Stiles, 2003; Swier, 2003). La distancia entre los refugios y la posición exacta de los mismos fue registrada por medio de un geoposicionador satelital manual (Garmin Ventrure, GPS). Las variables temperatura y humedad de los refugios se compararon por medio de la prueba de t pareada, para determinar si existen diferencias entre las condiciones microambientales de la totalidad de los refugios y entre cada una de las tres especies de murciélagos. Asimismo, por medio de un análisis de varianza de una vía (ANOVA) se realizaron comparaciones entre las características físicas (DAP, altura, número de cavidades y cobertura) de los refugios habitados y los árboles de la periferia, así como para cada una de las especies. Se aplicó posteriormente el análisis de intervalos de Bonferroni entre las variables ambientales (temperatura y humedad) por especie de murciélago en todos los refugios, con el fi n de conocer entre las combinaciones de estas variables, las que son estadísticamente significativas. Los análisis estadísticos fueron realizados en el programa estadístico SPSS versión 10 (SPPS, 1999).
Resultados
Localización de refugios. A lo largo de este estudio se recorrió un área de 1100 ha, donde se registró un total de 11 refugios en árboles, 7 dentro de REBIMA, y 4 en EPDG. La telemetría fue efectiva para la localización de murciélagos en 5 de los refugios y los 6 restantes fueron localizados realizando caminatas. Cinco refugios estuvieron ocupados por S. lilium ( 1 en REBIMA y 4 en EPDG), 5 por C. perspicillata (4 en REBIMA y 1 en EPDG), y 3 por A. lituratus (en REBIMA; Fig. 1). Se encontraron también otras especies compartiendo el refugio; la mayoría, pertenecientes a la familia Emballonuridae. Sin embargo, en el refugio 6 se encontraron 3 especies de filostómidos S. lilium, C. perspicillata y Choeroniscus godmani (Cuadro 1). Comparación de la humedad y temperatura entre refugios. Los murciélagos se encontraron con mayor frecuencia en refugios con una menor humedad interior que exterior (en promedio 93% en el exterior y 81% en el interior; Cuadro 2). En la comparación estadística de las variables temperatura y humedad, considerando la totalidad de los datos, presentaron variaciones significativas la humedad mínima exterior (HMIE) comparada con la humedad mínima interior (HMII; t54 = 3.47, P = 0.001), la humedad máxima interior (HMAI) comparada con la humedad máxima exterior (HMAE; t54 = 6.69, P <0.001) y la humedad ambiental interior (HAMI) comparada con la ambiental exterior (HAME; t54 = 6.77, P <0.001).

En relación con la temperatura, al comparar las variables internas con las externas de los 11 refugios sin agruparlos por especie, solamente la temperatura mínima al interior (TMII) difirió significativamente de la mínima exterior (TMIE; t54=–2.43, P = 0.01).
Humedad y temperatura en los refugios por especie. Se encontró con mayor frecuencia a A. lituratus en refugios con mayor humedad (90.1%), así como con mayor fluctuación de temperaturas (de 20.4 °C a 24.3 °C, con una diferencia de 3.98 °C). En comparación, S. lilium se observó en refugios con menor porcentaje de humedad (81.9%), y temperaturas más elevadas que A. lituratus y C. perspicillata (25.9 °C en comparación con A. lituratus, 24.3 °C y C. perspicillata, 25.9 °C ). Carollia perspicillata es la especie que se observó en refugios con valores intermedios de humedad (86.1%, Cuadro 2). Sin embargo, estas comparaciones no fueron estadísticamente significativas.
Se observaron diferencias significativas entre los valores de humedad internas y externas para C. perspicillata (HMAE–HMAI t19 = 3.815, P = 0.001; HAME–HAMI t19 = 2.666, P = 0.015), para S. lilium (HMAE–HMAI t19 = 3.376, P = 0.003; HAME–HAMI t19 = 5.008, P <0 .001) y para A. lituratus (HMAE–HMAI t14 = 4.855, P <0 .001; HAME–HAMI t14=3.488, P = 0.004). La temperatura no mostró diferencias significativas entre el interior y el exterior del refugio, excepto la temperatura máxima donde se encontró que sí existieron diferencias para S. lilium con TMAE – TMAI (t19=2.19, p=0.04) (Cuadro 3).
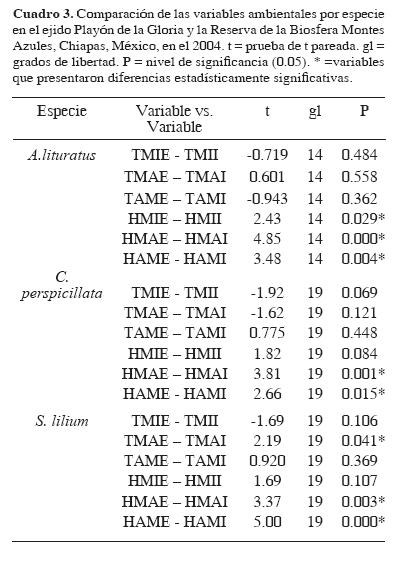
En el análisis de varianza de las condiciones ambientales de los refugios utilizados por las 3 especies de murciélagos, se encontró que existen diferencias en las condiciones ambientales entre el interior y el exterior del refugio para cada una de las especies.
En las variables ambientales exteriores se encontraron diferencias en la temperatura mínima (F = 6.885, g.l. = 54, P = 0.002), en la humedad mínima (F = 8.708, g.l.= 54, P = 0.001), en la humedad máxima (F = 5.388, g.l.= 54, P = 0.007) y en la humedad ambiental (F = 6 .689, g.l. = 54, P = 0.003); para las variables ambientales interiores se encontraron diferencias en la temperatura mínima (F = 5.518, g.l. = 54, P = 0.007); en la humedad mínima (F = 7.446, g.l. = 54, P = 0.001) y en la humedad ambiental (F = 8.118, g.l. = 54, P = 0.001), del análisis de la interacción de las variables con las 3 especies. El análisis de intervalos de Bonferroni mostró que A. lituratus presentó diferencias en las condiciones ambientales registradas al exterior del refugio, tales como TMIE, HMAE y HAME. En las condiciones al interior del refugio, para la especie A. lituratus se encontró que la TMII influye significativamente; en cambio, para S. lilum, las condiciones HMII, HMIE y HAMI fueron las de mayor relevancia (Cuadro 4).
Comparación de las variables físicas de la totalidad de los refugios. Se compararon las variables físicas de los refugios ocupados por cada una de las especies de murciélagos (DAP, altura y cobertura), para establecer cuál de éstas está más relacionada con la utilización de un árbol como refugio. Las diferencias en los valores observados de altura de los árboles entre las 3 especies de murciélagos no son significativas. Sin embargo, la diferencias son mayores en el diámetro de los árboles ocupados por A. lituratus respecto a las 2 especies restantes, con un promedio (entre paréntesis, desviación estándar) de 2.61 m (± 1.09) para A. lituratus, 1.32 m (± 0.32) para C. perspicillata y 1.65 m (± 0.48) para S. lilium, en comparación con 0.58 m (± 0.71) para el resto de los árboles disponibles no utilizados. El análisis de varianza reveló que no existen diferencias significativas entre la totalidad de los refugios encontrados (11) con respecto a la altura del árbol (F = 0.257, P = 0.779, n =11), la cobertura del árbol (F = 0.675, P = 0.536, n =11), y el diámetro del árbol (F = 3.497, P = 0.081, n = 11), ocupados por las especies en estudio.
Comparación entre los refugios de las tres especies y los árboles disponibles. Al comparar los valores obtenidos mediante análisis de varianza de las variables diámetro (log), altura, cobertura y número de cavidades de los árboles refugio respecto a los árboles disponibles, se observó que para A. lituratus y C. perspicillata, el diámetro y el número de cavidades de los árboles fueron estadísticamente diferentes. Para S. lilium las diferencias fueron estadísticamente significativas para las 4 variables que fueron registradas (Cuadro 5).
En cuanto a la altura de los árboles utilizados, las 3 especies de murciélagos utilizaron árboles con una mayor altura con respecto al resto de los árboles disponibles. A. lituratus se encontró en árboles con alturas promedio de 24 m (± 1.73), y C. perspicillata y S. lilium se encontraron en árboles con alturas promedio de 27 m (± 7.31), en comparación con la matriz de árboles disponibles que tuvieron una altura promedio de 17.4 m (± 7.26).Se encontraron diferencias significativas sólo para S. lilium (t24 = 3.324, P = 0.003).
Las distancias entre los refugios variaron respecto a los árboles disponibles. Se encontró que A. lituratus fue observada en refugios separados por distancias mayores, comparada con las otras especies, encontrándose en sitios más abiertos pero con árboles con diámetro mayor a 16 cm. Al contrario, C. perspicillata y S. lilium, se observaron en sitios con vegetación más cerrada y en donde el número de árboles con diámetros mayores a 16 cm era escaso.
Discusión
Los refugios diurnos de las 3 especies de murciélagos se encontraron principalmente dentro de oquedades en los troncos de los árboles. Para cada especie de murciélago, la selección del refugio se relacionó con la presencia y disponibilidad de oquedades en árboles dentro de una matriz de vegetación (Kunz y Lumdsen, 2003). Las condiciones ambientales al interior de los refugios son de importancia para la selección y uso de los mismos. La condición humedad, fue la variable que tuvo el mayor peso después de los análisis estadísticos realizados con base a las diferencias encontradas, por lo cual se expone como la variable que determina el uso o desuso de un refugio. Lo anterior no ocurre con algunas especies de murciélagos insectívoras de regiones neárticas que presentan estados de hibernación o sopor, en donde la temperatura es el principal factor de selección de los refugios (Swier, 2003). Cabe hacer notar que existe un número reducido de estudios de este tipo en especies de murciélagos neotropicales, los cuales se han centrado en la descripción física de la cavidad y la identificación de la especie vegetal utilizada (Fenton et al., 2000).
Los refugios utilizados por A. lituratus presentaron una mayor humedad en su interior en comparación con la que se registró para C. perspicillata y S. lilium, debido a que presentaron una mayor cantidad de cavidades con aperturas al exterior, lo que probablemente esté asociado con la humedad exterior (que en ocasiones llegó arriba del 90%). Al contrario, los refugios de C. perspicillata y S. lilium presentaron una sola cavidad y apertura al exterior, lo que puede relacionarse con un microclima menos húmedo en comparación con el exterior. Las diferencias de humedad dentro y fuera de los refugios utilizados por las 3 especies de murciélagos indican que existe una utilización preferencial del refugio, determinada por la humedad interna (menor a la exterior) de la cavidad presente en el árbol. La humedad relativa dentro de los refugios es de vital importancia en la fisiología del murciélago, ya que en porcentajes tolerables, facilita la gestación y la termorregulación de los murciélagos; sin embargo, en elevados porcentajes promueve la deshidratación (Kunz y Lumdsen, 2003).
En el aspecto físico del refugio, se observó que las especies estudiadas se encontraron con mayor frecuencia en árboles con un diámetro mayor a los árboles disponibles no utilizados, en cuyos valores se encontraron diferencias estadísticamente significativas. Este es un factor que determina la selección del refugio para las 3 especies. Árboles con un gran diámetro proveen de mayor número de sitios de refugio potenciales debido a que existe una estrecha relación entre ésta variable y el número de cavidades. Como consecuencia, se han registrado colonias numerosas de murciélagos en el interior de árboles de gran altura y diámetro (Lindenmayer et al., 1993, Bennet et al., 1994, Swier, 2003). Además, S. lilium, C. perspicillata y A. lituratus prefirieron árboles de gran altura, generalmente mayores al resto de los árboles de la periferia, localizados en zonas de bosque maduro o de estadios sucesionales avanzados donde son abundantes los árboles de gran altura y diámetro. Asimismo, solamente para S. lilium se encontraron diferencias significativas en los valores obtenidos en cobertura del árbol refugio, por lo que es probable que prefiera árboles con follaje que minimice al máximo la entrada de luz hacia el interior del mismo, debido que utiliza refugios con una entrada mucho más amplia (Wohlgenant, 1994; Fenton et al., 2000). En este punto cabe hacer notar que no se encontraron refugios en árboles muertos con una gran cantidad de luz entrando por la parte superior.
Las características físicas del refugio, como el diámetro y/o número de aperturas al exterior de la cavidad, su diámetro y altura del árbol donde se encuentra, pueden tener un efecto directo sobre las condiciones de los refugios utilizados, en particular la humedad dentro de las cavidades. Con lo anterior, se plantean 2 aspectos a considerar; el primero es que los murciélagos utilizan cavidades disponibles que reúnan alguna de las condiciones ambientales requeridas por las mismas especies de murciélagos, y el segundo implica que los murciélagos utilicen cavidades que reúnan ambas condiciones, tanto físicas como ambientales; ciertas características físicas, a su vez, pueden afectar las condiciones ambientales, como la humedad dentro de la cavidad.
Lo anterior refleja la vulnerabilidad de los refugios temporales así como la necesidad de la continua movilidad de la colonia, lo que concuerda con estudios en zonas templadas (Hurst y Lacky, 1999). Para murciélagos gregarios, el tener acceso a cavidades grandes puede llegar a ser un requerimiento básico durante las etapas de reproducción y lactancia. Se ha registrado que en un solo refugio pueden encontrarse más de 10 individuos, lo cual es común en otras regiones del Neotrópico en S. lilium y C. perspicillata (Cloutier y Thomas, 1992; Fenton et al., 2000; Evelyn y Stiles, 2003).
Es importante la protección que brindan los refugios a la depredación, ya que en el refugio 9, habitado por S. lilium y Saccopteryx bilineata, se encontró una culebra voladora (Spilotes pullatus), la cual merodeaba en la parte alta del refugio. Sin embargo, no logró entrar al refugio por la falta de ramas por donde reptar dentro de la cavidad, lo que hace importante la selección de este tipo de sitios por parte de los murciélagos y otros animales. Al contrario, A. lituratus se refugia tanto en cavidades como en el exterior sobre lianas o entre cañaverales (Morrison, 1979; Morrison, 1980), por lo que tiene una mayor probabilidad de ser depredado por aves, serpientes, murciélagos carnívoros y mamíferos medianos, como tlacuaches (Didelphidae), martuchas (Potos flavus) y coatíes (Nasua narica; Fenton, 1983; Kurta, 1985). Las 3 especies de murciélagos de estudio fueron registradas en árboles que presentaban un gran número de epífitas y lianas, lo cual hace más críptica la entrada al refugio. Lo anterior se ha encontrado en otras partes del Neotrópico y parece reducir significativamente el riesgo de depredación (Evelyn y Stiles, 2003).
Las 3 especies de murciélagos de estudio han sido denominadas generalistas, las cuales pueden tener sus refugios diurnos en diversos substratos, ya sea naturales o hechos por el hombre (Kunz, 1982). En este trabajo sólo se encontraron refugios de S. lilium y A. lituratus en árboles. C. perspicillata fue también encontrada en alcantarillas bajo la carretera y en cuevas, lo que demuestra la plasticidad de estas especies (Kunz, 1982).
Los 3 murciélagos estudiados utilizan como refugio ciertas especies de árboles que pueden llegar a presentar una oquedad natural en su centro, sin que exista preferencia por alguna especie en particular; por ejemplo, Metopium browniei Pseudobombax ellipticum, Manilkara zapota y Pouteria reticulata, lo que concuerda con estudios previos (Evelyn y Stiles, 2003). En particular, S. lilium y C. perspicillata ocupan árboles como Manilkara zapota, Brosimum alicastrum y Pouteria reticulata, mientras que A. lituratus se refugia en Ficus sp. y Alophilus comunia, los cuales fueron también utilizados en regiones de selva baja en la región de Calakmul (Evelyn y Stiles, 2003), y en selva alta en Belice donde se refugian en Pimenta officinalis y Guazuma ulmifolia (Fenton et al., 2000). Este trabajo permitió tener un acercamiento al establecimiento de los parámetros físicos (altura, diámetro, cobertura y número de cavidades) y ambientales (temperatura y humedad) requeridos para la utilización del refugio diurno de S. lilium, A. lituratus y C. perspicillata.
Agradecimientos
A los pobladores del Ejido Playón de la Gloria. Al M. en C. Felipe Ruan S., al Biol. Jorge Bolaños C. por su ayuda en el trabajo de campo. A los programas de apoyo de maestría PATM y PIFOP de ECOSUR, San Cristóbal de Las Casas, Chiapas. Al CONACyT por la beca otorgada al primer autor. Dos revisores anónimos hicieron comentarios importantes que mejoraron en gran medida este manuscrito.
Literatura citada
Aldridge, H. D. y R. M. Brigham. 1988. Load carrying and maneuverability in an insectivorous bat: a test of the 5% "rule" of radio–telemetry. Journal of Mammalogy 69:379–382. [ Links ]
Barbour, R. W. y W. H. Davis. 1969. Bats of America. University Press, Lexington, Kentucky. 286 p. [ Links ]
Barclay, R. M. y R. Brigham. 1996. Bats and forest symposium. Ministry of Forests, Victoria. British Columbia. 45 p. [ Links ]
Bennet, A. F., L. F. Lumsden y A. O. Nicholls. 1994. Tree hollows as a resource for wildlife in remnant woodlands: spatial and temporal patterns across the northern plains of Victoria Australia. Pacific Conservation Biology 1:222–235. [ Links ]
Brigham, R. y M. B. Fenton. 1986. The influence of roost closure on the roosting and foraging behavior of Eptesicus fuscus (Chiroptera, Vesperilionidae). Canadian Journal of Zoology 64:1128–1133. [ Links ]
Brigham, R., M. J. Vonhof, R. M. Barclay y J. C. Gwilliam. 1997. Roosting behavior and roost site preferences of forest dwelling California bats (Myotis californicus). Journal of Mammalogy 78:1231–1239. [ Links ]
Cloutier, D. y D. W. Thomas. 1992. Carollia perspicillata. The American Society of Mammalogists. Mammalian Species 417:1–9. [ Links ]
Estrada, A. y D. Merrit Jr. 1993. Bat species richness and abundance in tropical rainforest fragments and in agricultural habitats in Los Tuxtlas, Mexico. Ecography 24:94–102. [ Links ]
Evelyn, M. J. y D. A. Stiles. 2003. Roosting requirements of two frugivorous bats (Sturnira lilium and Artibeus intermedius) in fragmented neotropical forest. Biotropica 35:405–418. [ Links ]
Fenton, M. B. 1970. Population studies of Myotis lucifugus (Chiroptera: Vespertilionidae) in Ontario. Life Sciences Contributions Royal Ontario Museum 77:1–34. [ Links ]
Fenton, M. B. 1983. Roosts used by the African bat Scotophilus leucogaster (Chiroptera: Vespertilionidae). Biotropica 15:129–132. [ Links ]
Fenton, M. B., M. J. Vonhof, S. Bouchard, S. A. Gill, D. S. Johnston, F. A. Reid, D. K. Riskin, K. L. Standing, J. R. Taylor y R. Wagner. 2000. Roost used by Sturnira lilium (Chiroptera: Phyllostomidae) in Belize. Biotropica 32:729–733. [ Links ]
Gaisler, J. 1979. Ecology of bats. In Ecology of small mammals, D. M. Stoddart (ed.). Chapman Hall, London, p. 281–342. [ Links ]
Gannon, M. R., M. R. Willig y J. Knox Jones Jr. 1989. Sturnira lilium. The American Society of Mammalogists. Mammalian Species 333:1–5. [ Links ]
Graham, G. 1988. Interspecific associations among Peruvian bats at diurnal roost and roost sites. Journal of Mammalogy 69:711–720. [ Links ]
Humphrey, S. 1975. Nursery roost and community diversity of neartic bats. Journal of Mammalogy 56:321–346. [ Links ]
Hurst, T. y M. Lacky. 1999. Roost selection, population size and habitat use by a colony of Rafinesque's bigeared bats (Corynorhinus rafinesquii). American Midland Naturalist 142:363–371. [ Links ]
Iudica, C. A. y F. J. Bonaccorso. 1997. Feeding of the bat, Sturnira lilium, on fruits of Solanum riparium influences dispersal of this pioneer tree in forests of northwestern Argentina. Studies of Neotropical Fauna Enviroment 32:4–6. [ Links ]
Kalko, E., D. Friemel, C. O. Handley, Jr. y H. U. Schnttzier. 1999. Roosting and foraging behavior of two neotropical gleaning bats Tonatia silvicola and Trachops cirrhosus (Phyllostomidae). Biotropica 31:344–353. [ Links ]
Kerth, G., K. Weissmann y B. König. 2000. Day roost selection in female Bechtein's bats (Myotis bechteinii): a field experiment to determine the influence of roost temperature. Oecologia 8:1–15. [ Links ]
Kunz, T. 1982. Roosting ecology of bats. In Ecology of bats, T. H. Kunz (ed.). Plenum, New York, p. 1–55. [ Links ]
Kunz, T. H. y L. F. Lumsden. 2003. Ecology of cavity and foliage roosting bats. In Bat ecology, T. H. Kunz y M. B. Fenton (eds.). University of Chicago Press, Illinois, p.156–189. [ Links ]
Kunz, T. H., P. V. August y C. D. Burnett. 1983. Harem social organization in cave roosting Artibeus jamaicensis (Chiroptera: Phyllostomidae). Biotropica 15:133–138. [ Links ]
Kurta, A. 1985. External insulation available to a non–nesting mammal, the little brown bat (Myotis lucifugus). Comparative Biochemistry and Physiology 82:413–420. [ Links ]
Lemke, T. O.1978. Predation on bats by Epicrates cenchris cenchris in Colombia. Herpetological Review 9:47. [ Links ]
Lewis, S. E. 1995. Roost fidelity of bats: A review. Journal of Mammalogy 76:481–496. [ Links ]
Lindenmayer, D. B., R. B. Cunningham, C. F. Donnely, M. T. Tanton y H. A. Nix. 1993. The abundance and development of cavities in Eucalyptus trees: a case of study in the montane forest of Victoria, southeastern Australia. Forest Ecology and Management 60:77–104. [ Links ]
Medellín, R. A. 1988. Prey of Chrotopterus auritus, with notes on feeding behavior. Journal of Mammalogy 69:841–844. [ Links ]
Medellín, R. A. 2003. Diversity and conservation of bats in Mexico: research, priorities, strategies and actions. Wildlife Society Bulletin 31:87–97. [ Links ]
Medellín, R., H. T. Arita y O. Sánchez. 1997. Identificación de murciélagos de México. Clave de campo. Publicaciones Especiales 2. Asociación Mexicana de Mastozoología, A. C., México, D.F. 83 p. [ Links ]
Medellín, R., M. Equihua y M. A. Amín. 2000. Bat diversity and abundance as indicators of disturbance in neotropical rainforest. Conservation Biology 14:1666–1675. [ Links ]
Morrison, D. W. 1979. Apparent male defense of tree hollows in the fruit bat Artibeus jamaicensis. Journal of Mammalogy 60:11–15. [ Links ]
Morrison, D. W. 1980. Foraging and day roosting dynamics of canopy fruit bats in Panama. Journal of Mammalogy 61:20–29. [ Links ]
Morrison, D. W. y C. O. Handley Jr. 1991. Roosting behavior. In: Demography and natural history of the common fruit bat, Artibeus jamaicensis, in Barro Colorado Island, Panama, C. O. Handley Jr., D. E. Wilson, y A. L. Gardner (eds.). Smithsonian Institution Press, Washington, D. C., p. 131–136. [ Links ]
Orellana, L. R. 1978. Relaciones clima–vegetación en la región Lacandona, Chiapas. Tesis Facultad de Ciencias, UNAM, México, D.F. 78 p. [ Links ]
Ortega, J. y H. T. Arita. 1999. Structural and social dynamics of harem groups in Artibeus jamaicensis (Chiroptera: Phyllostomidae). Journal of Mammalogy 80:1173–1185. [ Links ]
Reid, F. A. 1997. A field guide to the mammals of Central America and Southeast Mexico. Oxford University Press, New York. 334 p. [ Links ]
Sedgeley, J. A. y C. F. O'Donnell. 1999. Roost selection by the long–tailed bat, Chalinolobus tuberculatus, in temperate New Zealand rainforest and its implications for the conservation of bats in managed forests. Biological Conservation 88:261–276. [ Links ]
Shulze, M. D., N. E. Seavy y D. F. Whitacre. 2000. A comparison of the phyllostomid bat assemblages in undisturbed Neotropical forest and in forest fragments of a slash–and–burn farming mosaic in Peten, Guatemala. Biotropica 32:174–184. [ Links ]
SPSS 1999. Spps for windows, release 10.0.1. Standard Version. U. S. A. [ Links ]
Swier, V. J. 2003. Distribution, roost site selection and food habits of bats in eastern South Dakota. Master of Science Thesis. South Dakota State University, South Dakota. 79 p. [ Links ]
Wohlgenant, T. J. 1994. Roost interactions between the common vampire bat (Desmodus rotundus) and two frugivorous bats (Phyllostomus discolor and Sturnira lilium) in Guanacaste, Costa Rica. Biotropica 26:344–348. [ Links ]














