Introducción
En la búsqueda de nuevos tratamientos para el alivio del dolor se han investigado numerosos compuestos de origen natural, incluyendo los denominados productos naturales botánicos.1 El género Eupatorium (tribu Eupatorieae, familia Asteraceae) comprende cerca de 1200 especies distribuidas en regiones tropicales de América, Europa, África y Asia.2,3
Aproximadamente 69 especies de éste género se distribuye a lo largo del Estado de Michoacán (Figura 1). La especie arsenei B. L. Rob. [Ageratina arsenei (B. L. Rob.) R. M. King & H. Rob.] (Figura 2) es una de ellas. El análisis químico preliminar por resonancia magnética nuclear de extractos hexánicos de flores de nueve especies nativas (Eupatorium spp), permitió determinar que las familias químicas principales son cromenos y terpenos.4,5Diferentes especies de éste género han mostrado poseer efecto anti-inflamatorio,6,7 otras presentan actividad analgésica, 8-11 sin embargo, no existen datos sobre la probable actividad nociceptiva del género arsenei, estudiado en el presente trabajo.
Figura 1 Estado de Michoacán de Ocampo, diferentes especies del género Eupatorium se distribuyen en el 69% de su territorio.
Por otro lado, el dolor tiene un papel preponderante en la protección de los seres vivos contra el daño al tejido por estímulos mecánicos, químicos y térmicos, sin la experiencia del dolor no puede haber reflejo protector, ni miedos, ni prevención de riesgos.12,13 La Asociación Internacional del Estudio del Dolor (IASP), define al dolor como "una experiencia sensorial y emocional desagradable asociada a un daño tisular real o potencial, o descrita en términos de dicho daño".14 Las sensaciones dolorosas pueden explicarse sobre la base de los sustratos neuronales que median las funciones sensoriales; afectivas y nociceptivas. La rama sensorial permite la localización espacial, temporal y la cuantificación de la intensidad del estímulo nocivo.15 El término dolor incluye al proceso fisiológico denominado nocicepción, el cual incluye cuatro fenómenos neurofisiológicos: la transducción, la trasmisión, la modulación y percepción del estímulo.16 Este proceso se inicia con la detección de estímulos nocivos por medio de los nociceptores.
Los analgésicos no esteroidales son ampliamente usados en el tratamiento del dolor debido a que bloquean la producción de prostaglandinas al inhibir a las enzimas responsables de su síntesis, la ciclo-oxigenasa 1 y 2 (COX-1, COX-2).17 Las prostaglandinas estimulan los nociceptores produciendo dolor localizado.
En la búsqueda de nuevos tratamientos para el alivio del dolor se requiere del uso de modelos animales, los cuales han permitido que la investigación básica haya generado conocimientos sobre del sistema nociceptivo por lo cual, estos modelos son imprescindibles. En este sentido, un modelo de dolor es el procedimiento por el cual se valora la reacción de un animal ante un estímulo nocivo de naturaleza variada o en una situación patológica inducida.18 De igual manera los estudios genéticos, electrofisiológicos y farmacológicos nos ayudan a dilucidar los mecanismos moleculares que subyacen a la detección, codificación y modulación de los estímulos nocivos que generan el dolor.19
Se han descrito diferentes modelos experimentales en rata que permiten valorar el efecto analgésico; entre ellos se encuentran los modelos químicos, térmicos, mecánicos y eléctricos. Entre los modelos químicos de dolor encontramos la prueba de formalina, carragenina, y ácido acético, modelos térmicos como retirada de cola (tail-flick), plato caliente (hot-plate) e inmersión de la cola en agua caliente, modelos mecánicos como las pruebas de presión de patas o cola y modelos eléctricos que emplean ligeras descargas eléctricas.14,20,21 Tomando en cuenta los antecedentes anteriores, el presente trabajo tuvo como objetivo esclarecer si el extracto hexánico de flor de Eupatorium arsenei posee actividad analgésica.
Material y método
Recolección de la planta y preparación del extracto
La especie E. arsenei fue colectada en el km 24 de la carretera federal No 15, México-Morelia, en las coordenadas N19° 39.414 ́, W100° 59.713; una muestra fue depositada en el herbario del Instituto de Ecología de Pátzcuaro, Michoacán, (No. 04143). Un lote de flores (285g) secadas a la sombra fueron sometidas a extracción por maceración con 1.5 litros de hexano (JT Baker) durante tres días, posteriormente se eliminó el disolvente mediante el uso de un rotavapor R114 (BUCHI), con lo que se obtuvo 30g de extracto.
Análisis del extracto por Resonancia Magnética Nuclear (RMN)
El extracto de flor de E.arsenei se analizó por Espectroscopia de RMN, en un equipo Varian Mercury Plus a 400 MHz empleando cloroformo deuterado (CDCl3) como disolvente y tetrametilsilano (TMS) como referencia interna.
Animales
Se emplearon ratas hembras de la cepa Wistar de 9 semanas (180-240 g), provenientes del bioterio "Claude Bernard" de la Benemérita Universidad Autónoma de Puebla. Los animales fueron alojados en cajas de acrílico individuales, con agua purificada y alimento (Harlan Tekland Global Diets) ad libitum, ciclo de luz/oscuridad de 12/12 horas, temperatura de 24±2 °C y 45±10 % de humedad. Durante su estancia se manipularon todos los días durante 3 minutos hasta el día de prueba para habituarlas al experimentador y disminuir el estrés. El cuidado y manejo de los sujetos experimentales se realizó bajo los lineamientos del Reglamento del Comité para el Cuidado y Uso de los Animales de Laboratorio de la Benemérita Universidad Autónoma de Puebla (2007), el cual establece el cumplimiento de la Norma Oficial Mexicana "Especificaciones técnicas para la producción, cuidado y uso de los animales de laboratorio" (NOM-062-ZOO-1999). 22
Prueba de retirada de la cola
Un gramo de extracto hexánico de flor de E. arsenei fue disuelto en 15 mililitros aceite de sésamo (Mitsuky), la mezcla se mantuvo en agitación constante (PC-32 Corning) a temperatura ambiente (22 °C) durante 12 horas. La dosis administrada a los sujetos de experimentación fue de 200 mg/kg (n= 8), el grupo vehículo fue administrado con 0.6 mL de aceite de sésamo (n= 8). Como control positivo se empleó Meloxicam (Boehringer Ingelheim), el cual fue administrado a una dosis de 5 mg/kg (n= 8), a partir de una solución de 15mg/1.5 mL, y el grupo control (n= 9) con 0.10 mL de solución salina isotónica (Pisa), todos los tratamientos fueron administrados por vía intraperitoneal. Tomando en cuenta las dosis y las concentraciones de los tratamientos, los volúmenes administrados son equivalentes para los grupos vehículo y solución salina.
Antes de realizar la prueba, los animales fueron habituados a la caja de restricción 5 días previos durante 30 minutos, en intervalos de 10 minutos. Para la prueba se empleó el equipo Tail-flick meter LE 7106 (Panlab Harvard Apparatus). Los animales fueron inmovilizados por medio de una caja de restricción de acrílico, la radiación térmica fue ajustada a 50 °C, el haz de luz se aplicó a 3 cm del inicio de la cola. En este modelo, cuando el animal mueve la cola, al sentir el estímulo doloroso, el haz térmico incide sobre una celda fotoeléctrica y apaga la fuente de radiación, automáticamente el contador de tiempo se detiene y registra la latencia en segundos.
El día de prueba se realizaron tres mediciones basales antes de la administración de las sustancias con un intervalo de tiempo de 10 minutos entre cada una. Después de la administración, se hicieron mediciones cada 10 minutos hasta completar 90. Posteriormente, las mediciones se realizaron cada hora, hasta completar 12 horas.9,10 Al finalizar el experimento, todos los animales fueron devueltos a las cajas de cautiverio y observados durante 7 días para determinar posibles reacciones adversas por los tratamientos.23 En el presente diseño la latencia obtenida en el grupo administrado con el vehículo fue comparada con la latencia obtenida con el grupo administrado con el extracto y, la latencia obtenida en el grupo administrado con solución salina fue comparada con la obtenida en el grupo administrado con meloxicam.
Frotis vaginales
El objetivo de esta prueba es determinar si las diferentes fases del ciclo estral influyen en la nocicepción. Para este análisis se emplearon los sujetos experimentales que formaron el grupo administrado con el vehículo y el grupo al que se le administró solución salina, 17 ratas en total. La toma de muestra se realizó a los 90 minutos y a las 6 horas después de la administración de los tratamientos. Con ayuda de un asa bacteriológica se realizó un raspado suave en el canal vaginal, una vez obtenidas las muestras se depositaron en un portaobjetos sobre una gota de solución salina isotónica, se fijaron con calor y se tiñeron con la técnica rápida de hematoxilina-eosina (Sigma). Posteriormente se observaron al microscopio de campo claro (Carl Zeizz) a 40X.
Autopsias
Las autopsias se realizaron 8 días después a la administración de los tratamientos, lo que permitió observar si los animales presentaban cambios en la ingesta de agua y alimento o conductas dolorosas como encorvamiento, vocalizaciones y postración.23 Los sujetos fueron elegidos al azar (uno de cada grupo) y sacrificados con una sobredosis (55mg/kg) de pentobarbital sódico (Aranda) se examinó macroscópicamente el corazón, los pulmones, los riñones, el hígado y los intestinos.
Análisis estadístico
Los tiempos de latencia de los diferentes grupos así como los tiempos de latencia respecto a la fase del ciclo estral fueron analizados por medio de una prueba estadística no paramétrica de Kruskal-Wallis. Se aceptó que hubo diferencia estadística significativa cuando el valor de la p fue menor o igual a 0.05.
Resultados y discusión
Análisis espectroscópico de RMN
Para determinar la naturaleza y abundancia de los componentes del extracto hexánico de flores de E. arsenei, se realizó un espectro de RMN de 1H (Figura 3) que permitió observar señales típicas de compuestos de tipo cromeno4,24 (Figura 4) como componentes mayoritarios.

Figura 3 Espectro de RMN de 1H del extracto hexánico de flor de E. arsenei a 400 MHz en CDCl3. Entre 5.40 y 7.90 ppm se apreciaron las señales pertenecientes a los protones vinílicos y aromáticos, así como las señales simples del sistema gem-dimetilo en aproximadamente 1.40 ppm.
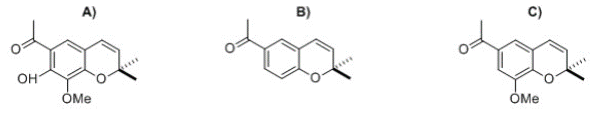
Figura 4 Estructuras presentes en el extracto hexánico de flores E. arsenei. A) 7-Hidroxi-8-metoxi-6-acetil-2, 2-dimetilcromeno. B), 6-acetil-2, 2-dimetilcromeno. C), 8-metoxi-6-acetil-2, 2 dimetilcromeno.
Los tiempos de latencia de los grupos controles se mantuvieron constantes durante toda la prueba. El comportamiento de estos grupos es determinante, ya que no solo permiten comparar los valores obtenidos con el grupo experimental, sino que nos permite constatar que los animales no sufren el fenómeno de hiperalgesia debido a una lesión provocada por la aplicación del estímulo térmico, puesto que hay presencia de inflamación local que puede alterar el umbral del dolor y que se manifestaría por una disminución en los tiempos de latencia o bien habituación que se evidenciaría con un aumento en los tiempo de latencia.25 El modelo animal de dolor agudo denominado "sacudida de cola" consiste en colocar la cola del animal bajo una fuente de radiación térmica que produce dolor, el animal evita el dolor moviendo la cola.20 Para que se lleve a cabo el movimiento reflejo, el estímulo térmico es codificado por las aferencias de las fibras C que inervan la piel de la cola, estas aferencias están localizadas en la lámina superficial del asta dorsal de los segmentos sacro 3 y coxígeo 3 de la médula espinal que hace sinapsis con interneuronas y, éstas a su vez, con motoneuronas de los segmentos lumbar 4 y coxígeo 2 que inervan tres grupos de músculos que controlan el movimiento de la cola; el abductor caudal dorsal, el extensor caudal medial y extensor lateral.26 Por otro lado, existen reportes que indican que los derivados de cromenos son altamente afines a la enzima COX-2,27 responsable de la síntesis de prostaglandinas.28,17 García y cols,10 propusieron un modelo in silico en el cual se realiza un acoplamiento entre la COX-2 y un derivado de cromeno, concluyendo que la interacción es posible. Además, la presencia de este tipo de derivados se ha relacionado con el efecto analgésico y anti-inflamatorio.29 De esta manera, el efecto analgésico del extracto de E. arsenei podría deberse a los abundantes derivados de cromenos metoxilados y su posible interacción con la enzima COX-2.(Figura 5).

Figura 5 El extracto hexánico de flor de E. arsenei a una dosis de 200 mg/kg mostró actividad analgésica en la prueba de dolor. En la gráfica se muestran las medianas de cada grupo a través de las 12 horas del experimento. La prueba estadística no paramétrica de Kruskal-Wallis aplicada en cada intervalo de tiempo, reveló diferencias estadísticas significativas. El efecto analgésico del extracto se observa a partir de los 30 minutos después de la administración comparado con el grupo administrado con el vehículo (**p=0.01). Esta diferencia se mantiene hasta la hora 7. El efecto analgésico del meloxicam (5mg/kg) aparece 50 minutos después de la administración, el efecto se mantiene hasta la octava hora, al comparar las latencias de éste grupo con las del grupo que recibió solución salina isotónica se encontró diferencias estadísticas significativas (##p=0.01).
Frotis vaginales
En este análisis, sólo se emplearon las ratas de los grupos que se administraron con solución salina y vehículo debido a que el procedimiento para la obtención de la muestra puede causar estrés en los animales el cual puede influir en la nocicepción30,31,32 y alterar los resultados de los grupos administrados con el extracto y el meloxicam, fueron tomados en dos momentos diferentes durante el experimento debido a que el proestro y estro duran 12 horas.33 Se observó que la fase del ciclo estral en el que se encuentre la rata no influye en la percepción del estímulo doloroso.(Figura 6)
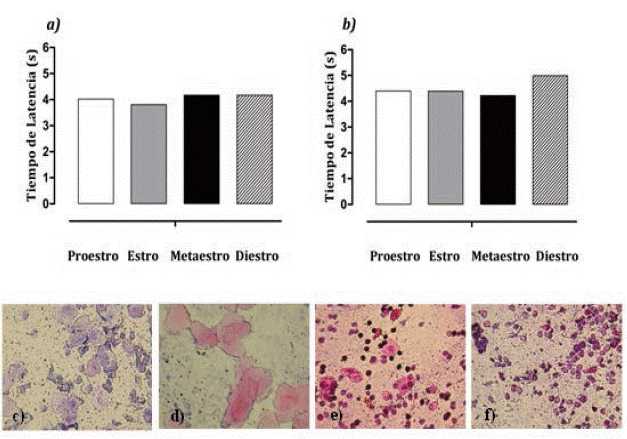
Figura 6 En las gráficas a) y b) se muestra las medianas de los tiempos de latencia de los sujetos de experimentación que formaron los grupos SSI (n = 9) y del grupo vehículo (n = 8). La prueba estadística no paramétrica de Kruskall Wallis, reveló que no existe diferencia estadística significativa entre los grupos. Los frotes se realizaron a los 90 minutos (p= 0.01) y a las 6 horas (p = 0.03) para determinar la fase del ciclo estral en el que se encontraban las ratas durante la prueba de sacudida de cola. Las características celulares de cada una de las fases del ciclo estral encontradas fueron en c) Proestro, células cornificadas nucleadas, d) Estro; células epiteliales cornificadas, e) Metaestro, células epiteliales cornificadas y leucocitos y f) Diestro, leucocitos. Tinción Hematoxilina & Eosina. 40x.
El uso de ratas hembras en experimentos de dolor es causa de controversia, debido a la posible influencia de las hormonas la percepción dolorosa.30,31,32 Los resultados obtenidos sugieren que las diferentes fases del ciclo estral, y su relación con las concentración plasmática de hormonas hipotalámicas y ováricas34 de las ratas no intervinieron en la nocicepción, resultados similares han sido reportados por otros autores.35,36,10
Autopsias
Ninguno de los sujetos experimentales mostró lesiones o depósitos de las diferentes sustancias administradas. El análisis macroscópico se realizó con ayuda de una lupa.
Conclusiones
El 6-hidroxi-8-metoxi-6-acetil-2, 2-dimetilcromeno, el 6-acetil-2, 2-dimetilcromeno y el 8-metoxi-6-acetil-2 dimetilcromeno son los compuestos más abundantes en el extracto hexánico de flores de E arsenei, el cual posee propiedades analgésicas cuando es evaluado en el modelo térmico de dolor agudo en rata a una dosis de 200 mg/kg. Respecto a influencia de las diferentes fases del ciclo estral de la rata sobre la nocicepción los resultados obtenidos sugieren que son fenómenos independientes, son pertinentes más estudios en los cuales la administración del meloxicam y del extracto se realicen en fases determinadas del ciclo.











 text new page (beta)
text new page (beta)



