Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista mexicana de ciencias farmacéuticas
Print version ISSN 1870-0195
Rev. mex. cienc. farm vol.44 n.3 Ciudad de México Jul./Sep. 2013
Trabajo científico
El aceite de pescado protege contra el daño gástrico generado por la administración de indometacina y adiciona su actividad anti-inflamatoria a la indometacina en la rata
Fish oil protects against indomethacin-induced gastric injury and adds indomethacin's anti-inflammatory action in the rat
Aracely Evangelina Chávez-Piña,1 Martha Patricia González-García,2 Juan Miguel Jiménez-Andrade3
1 Laboratorio de Farmacología, Programa Institucional de Biomedicina Molecular, Escuela Nacional de Medicina y Homeopatía, Instituto Politécnico Nacional
2 Departamento de Farmacología, Centro de Investigación y de Estudios Avanzados, Instituto Politécnico Nacional
3 Unidad Académica Multidisciplinaria Reynosa Aztlán, Universidad Autónoma de Tamaulipas
Correspondencia:
Dra. Aracely Evangelina Chávez Piña
Guillermo Massieu Helguera no. 239
Fraccionamiento "La Escalera", Ticomán
México, D.F. C.P. 07320
Teléfono: 11(+52)57296000 ext. 55583
E mail: achavezp@ipn.mx, arapina@yahoo.com
Fecha de recepción: 25 de febrero de 2013.
Fecha de recepción de modificaciones: 05 de junio de 2013.
Fecha de aceptación: 22 de julio de 2013.
Resumen
El efecto gastroprotector del aceite de pescado se ha identificado en diversos estudios. Sin embargo, su mecanismo de acción no ha sido completamente dilucidado. El objetivo de este trabajo fue evaluar el mecanismo gastroprotector del aceite de pescado en el daño gástrico generado por indometacina y estudiar si existe modificación del efecto anti-inflamatorio de indometacina. El aceite de pescado previno las lesiones gástricas inducidas por indometacina, no revirtió la inhibición de PGE2 pero si bloqueó parcialmente el incremento de LTB4 inducido por indometacina. El aceite de pescado suma su efecto anti-inflamatorio a la indometacina.
Nuestros resultados sugieren que una disminución en los niveles gástricos de LTB4 está involucrada en el mecanismo gastroprotector del aceite de pescado en el daño gástrico generado por indometacina. Además, la administración de aceite de pescado suma su efecto anti-inflamatorio a la indometacina.
Palabras clave: aceite de pescado; indometacina; daño gástrico; inflamación.
Abstract
Several clinical and pre-clinical studies have demonstrated the protective effect of supplementation of fish oil. However its mechanism of action has not been fully elucidated.
The aims of this study were to examine the gastroprotective mechanism of fish oil and whether fish oil affects the anti-inflammatory effect of indomethacin.
Fish oil prevented gastric lesions induced by indomethacin. Fish oil did not reverse the indomethacin-induced reduction of PGE2 gastric levels. In contrast, fish oil partially prevented the indomethacin-induced increase in LTB4 gastric levels. Finally, fish oil had an anti-inflammatory effect by itself and adds it to the anti-inflammatory effect of indomethacin.
Our results suggest that a decrease in gastric LTB4 levels is involved in the gastroprotective effect of fish oil against indomethacin-induced damage. Furthermore, the supplementation of fish oil adds its anti-inflammatory effect to indomethacin's.
Key words: Fish oil; indomethacin; gastric injury; leukotriene; inflammation.
Introducción
Los anti-inflamatorios no esteroideos (AINEs) como la aspirina e indometacina se prescriben ampliamente para el tratamiento del dolor y la inflamación.1,2 Sin embargo, el uso crónico de estos fármacos puede estar asociado a la generación de daño gástrico.3 Por lo tanto, desde hace tiempo ha surgido la necesidad clínica de encontrar terapias seguras para el manejo del dolor y la inflamación sin causar daño gástrico.
Estudios clínicos y preclínicos han reportado el efecto gastroprotector del aceite de pescado en úlceras inducidas por diversos agentes como etanol,4,5 aspirina,6,7 indometacina,8 dexametasona,9 estrés inducido por frío10 y ligación del píloro.7 A pesar de los numerosos estudios que demuestran un efecto gastroprotector del aceite de pescado, el mecanismo de acción subyacente no ha sido completamente elucidado. Debido a esto, creemos que este estudio proporcionará las bases científicas sobre el uso del aceite de pescado.
Recientemente, nuestro grupo de trabajo mostró que el ácido docosahexaenoíco (DHA), un ácido graso poli-insaturado omega-3 que se encuentra como compuesto mayoritario en el aceite de pescado, protege contra el daño gástrico inducido por indometacina en la rata. Además, nosotros reportamos que el mecanismo gastroprotector del DHA no ocurre a través de la modulación de PGE2 pero si a través de la prevención parcial del incremento de LTB4 generado por indometacina en tejido gástrico.3 Sin embargo, el aceite de pescado contiene otros ácidos grasos poli-insaturados por lo cual, se podría sugerir un mecanismo adicional o diferente al que presentó el DHA.
Estudios previos han demostrado que la administración crónica de aceite de pescado reduce la inflamación en diversos modelos experimentales.11, 12, 13 Sin embargo, se desconoce si la administración de aceite de pescado podría inhibir o potenciar el efecto anti-inflamatorio de los AINEs.
Por lo tanto, los objetivos de este trabajo fueron evaluar el mecanismo gastroprotector del aceite de pescado en el daño gástrico generado por indometacina y determinar si el efecto anti-inflamatorio de la indometacina se mantiene o incrementa al administrarlo con aceite de pescado.
Material y métodos
Fármacos
El aceite de pescado (F8020) e indometacina (I7378) se compraron en Sigma Aldrich (St. Louis, MO, USA).
Animales
Todos los experimentos se realizaron en ratas Wistar hembra (180-220 g) provenientes del bioterio del Centro de Investigación y de Estudios Avanzados del IPN (Cd. de México, México). Todos los procedimientos que se realizaron en ratas y su cuidado se llevaron a cabo de acuerdo a la Norma Oficial Mexicana para el Cuidado y Manejo de Animales de Experimentación (N0M-062-Z00-1999) y de acuerdo a las regulaciones internacionales para el cuidado y uso de animales de laboratorio. Además, todos los experimentos se llevaron a cabo bajo las guías de "Estándares éticos para investigación en animales".14 El tamaño de muestra por grupo fue en promedio de seis animales. Las ratas tuvieron libre acceso a alimento estándar de laboratorio y agua. Las ratas se mantuvieron en cajas con una rejilla en el piso y se mantuvieron en ayuno 18 horas previas al experimento, sin embargo se les permitió libre acceso a agua.
Efecto gastroprotector del aceite de pescado en el daño gástrico inducido por indometacina
Se formaron cuatro grupos experimentales, a las ratas se les administró oralmente solución salina 0.9% (0.5 ml/100 g) o aceite de pescado (0.5 ml/100 g) durante nueve días. Al décimo día, las ratas recibieron la misma dosis de aceite de pescado o solución salina y dos horas después se les administró indometacina (30 mg/kg, p.o.) o bicarbonato de sodio al 5% (vehículo). Tres horas después, las ratas se sacrificaron en una cámara de C02. Se removió el estómago y se abrió a lo largo de la curvatura mayor. El área de lesión de daño gástrico se determinó en ciego, midiendo el largo y ancho de cada lesión. La suma del área de cada lesión en el cuerpo del estómago se reportó como áreas de lesiones gástricas (mm2).15
Medición de los niveles endógenos de PGE2 y LTB4
Los grupos que se formaron recibieron solución salina o aceite de pescado (0.5 ml/100 g; p.o.) durante 10 días. En el último día de tratamiento, a las ratas se les administró indometacina (30 mg/kg; p.o.) o vehículo. Tres horas después, las ratas se sacrificaron en una cámara de C02. Se removió el estómago y se tomó una muestra del cuerpo del estómago, que fue pesada y se agregó a un tubo eppendorf que contenía 1 ml de buffer de fosfatos (10 mmol/l; pH 7.4). Cada muestra de tejido se cortó finamente durante 30 segundos e inmediatamente se colocó en baño maría con movimiento (37°C) durante 30 minutos. Las muestras se centrifugaron (9000 g) durante 1 minuto, y el sobrenadante se congeló y se almacenó a -70°C hasta su análisis. La concentración de PGE2 y LTB4 se determinó en el sobrenadante por medio de un ensayo de inmunoabsorción ligado a enzimas (EIA kit Cayman Chemical Co.).
Inflamación en la pata de la rata inducida por carragenina
Se utilizó el modelo inflamación inducida por carragenina en la pata de la rata para evaluar el efecto anti-inflamatorio de aceite de pescado, indometacina y la combinación de aceite de pescado más indometacina. Se marcó la piel de la pata derecha de la rata sobre el maléolo lateral, el volumen de la pata se midió utilizando un pletismómetro (Ugo Basile Modelo 7140, Comerio, Italia). A las ratas se les administró oralmente vehículo o aceite de pescado (0.5 ml/100 g, p.o.) durante 10 días. En el día 10, a las ratas se les administró indometacina (30 mg/kg, p.o.) o vehículo. Sesenta minutos después, se inyectó subcutáneamente carragenina (100 µl al 1%, en solución salina estéril) en la pata derecha de la rata. Durante seis horas después de la administración de carragenina se midió el incremento de volumen de la pata derecha de la rata. La persona que realizó estos experimentos desconocía los tratamientos recibidos en cada grupo.16
Análisis estadístico
Todos los datos se presentan como la media ± EEM. Las comparaciones entre los grupos se realizaron usando un análisis de varianza de una vía seguido de una prueba de Neuman's Keuls's. Una diferencia estadísticamente significativa se consideró cuando se observó una P ≤ 0.05.
Resultados y discusión
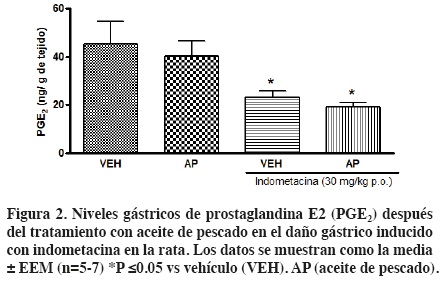
Nuestros resultados mostraron que tanto el tratamiento crónico con aceite de pescado o vehículo por si solos no generaron daño gástrico (Figura 1). En contraste, la administración aguda de indometacina (30 mg/kg, p.o.) indujo un incremento significativo en las lesiones gástricas (23.0 ± 3.3 mm2) comparado con el vehículo. El pretratamiento con aceite de pescado previno las lesiones gástricas inducidas con indometacina aproximadamente en un 60% (9.3 ± 2.2 mm2) (Figura 1). Para elucidar el posible mecanismo de acción del efecto gastroprotector del aceite de pescado se determinaron los niveles gástricos de PGE2 y LTB4 por ELISA. Los niveles de PGE2 en los grupos bajo tratamiento solamente con aceite de pescado (40.2 ± 6.1 ng/ g de tejido) fueron similares a las condiciones basales (45.3 ± 9.2 ng/ g de tejido). El daño con indometacina disminuyó significativamente los niveles de PGE2 (23.1± 2.6 ng/ g de tejido). A pesar de que el pretratamiento con aceite de pescado disminuyó el daño gástrico inducido por indometacina este no previno la disminución de PGE2 (19.2 ± 1.9 ng/ g de tejido) (Figura 2).

Por otro lado, los niveles gástricos de LTB4, se incrementaron significativamente después del daño generado con indometacina (9.5 ± 1.2 ng/ g de tejido), comparado con el vehículo (4.3 ± 1.1 ng/ g de tejido) y la administración sola de aceite de pescado (5.9 ± 0.7 ng/ g de tejido). Interesantemente el pretratamiento con aceite de pescado bloqueó el incremento de LTB4 inducido por la administración de indometacina (4.9 ± 0.3 ng/ g de tejido) (Figura 3).

Por otro lado, los niveles gástricos de LTB4, se incrementaron significativamente después del daño generado con indometacina (9.5 ± 1.2 ng/ g de tejido), comparado con el vehículo (4.3 ± 1.1 ng/ g de tejido) y la administración sola de aceite de pescado (5.9 ± 0.7 ng/ g de tejido). Interesantemente el pretratamiento con aceite de pescado bloqueó el incremento de LTB4 inducido por la administración de indometacina (4.9 ± 0.3 ng/ g de tejido) (Figura 3).
Por último, determinamos el efecto anti-inflamatorio de cuatro tratamientos distintos seguidos de la administración de carragenina en la pata derecha de la rata. La administración de carragenina incrementó el volumen de la pata progresivamente. La administración aguda de indometacina (30 mg/kg, p.o.) o la administración crónica de aceite de pescado (0.5 ml/100 g durante 10 días) disminuyó el edema inducido por carragenina (Figura 4A).
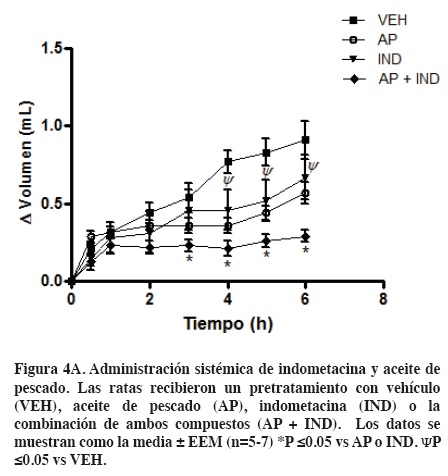
El análisis del porcentaje de inflamación indicó que la combinación de la administración aguda de indometacina y la administración crónica de aceite de pescado genera la adición de los efectos anti-inflamatorios de cada fármaco administrados de manera individual y éste es similar en magnitud al efecto observado cuando se administró cada uno de los agentes por separado (Figura 4B).

Los resultados del presente trabajo mostraron que además del efecto gastroprotector del aceite de pescado en el daño gástrico inducido por indometacina, el efecto antiinflamatorio del aceite de pescado y de indometacina se suman en el edema generado en la pata de la rata por carragenina.
Estos resultados son similares a reportes anteriores donde se observó que el aceite de pescado induce un efecto gastroprotector contra el daño gástrico generado por diversos estímulos nocivos como etanol,4, 5 aspirina,6, 7 indometacina,8 dexametasona,9 estrés debido a frío10 y ligadura del píloro.7
En nuestro estudio el daño gástrico generado por la administración de indometacina fue evaluado, después de administrar oralmente aceite de pescado durante 10 días. Nuestros resultados muestran que este tratamiento generó un efecto gastroprotector contra el daño producido por indometacina.
En cuanto al mecanismo involucrado en la gastroprotección del aceite de pescado, la PGE2 protege a la mucosa gástrica a través de un aumento en la secreción de moco y bicarbonato.6, 17
Sin embargo, en nuestro trabajo el aceite de pescado protege contra el daño gástrico sin prevenir la disminución de PGE2 inducida por indometacina. Probablemente, otros mecanismos de gastroprotección puedan estar involucrados en el efecto del aceite de pescado. En este contexto, un estudio previo reportó que el tratamiento con aceite de pescado durante cinco días, administrado dos veces al día, disminuye la secreción de ácido y pepsina en el modelo de úlceras generado por ligadura del píloro.7
Por otro lado, el daño gástrico generado por indometacina se ha asociado con un incremento en el LTB4 gástrico.18 Asimismo, un incremento en el LTB4 gástrico induce la acumulación de leucocitos en la microcirculación gástrica que se encuentra alrededor de las úlceras.18 Además esta adherencia de leucocitos predispone a la mucosa gástrica a sufrir daño.19, 20 En nuestro estudio, la administración de aceite de pescado previno el incremento en el LTB4 inducido por indometacina. Este resultado es similar a lo que nuestro grupo reportó recientemente, donde el ácido docosahexaenoíco (DHA) no bloquea la disminución de LTB4 inducida por indometacina.3 Probablemente el DHA se encuentre participando en esta modulación del LTB4 y por lo tanto del daño gástrico. Sin embargo, se requieren más estudios para elucidar completamente la modulación de los niveles gástricos de LTB4 por el aceite de pescado.
El aceite de pescado contiene otros ácidos grasos poli-insaturados omega-3 como el ácido eicosapentaenoíco (EPA). Además, se ha reportado que la resolvina E1, la cual se sintetiza a partir de EPA, interacciona con el receptor de LTB4 como un agonista parcial y atenúa la señal pro-inflamatoria que deriva el agonista completo. Por lo tanto, la generación de resolvinas podría explicar parcialmente el mecanismo gastroprotector del aceite de pescado.19
En este estudio además evaluamos el efecto anti-inflamatorio del aceite de pescado en el modelo de inflamación por carragenina en la pata de la rata. Interesantemente, la administración de aceite de pescado generó un efecto anti-inflamatorio. Estos resultados concuerdan con reportes previos, donde se ha demostrado el efecto anti-inflamatorio de los ácidos grasos poli-insaturados omega-3 en diversas enfermedades.20, 21
Este es el primer reporte donde se evalúa el efecto anti-inflamatorio del aceite de pescado en combinación con indometacina. En reportes previos, algunas combinaciones de anti-inflamatorios con productos naturales han demostrado incrementar el efecto anti-inflamatorio comparado con la administración independiente de los fármacos; por ejemplo, la combinación de citral con naproxeno genera un efecto antinociceptivo sinérgico y al mismo tiempo produce una seguridad gástrica comparada con naproxeno solo.22 Sin embargo, no todas las combinaciones potencian el efecto terapéutico.
Por ejemplo, el efecto antinociceptivo de aspirina y acetaminofén disminuyó cuando se combinaron con glucosamina.23 La mezcla de fármacos con productos naturales es una alternativa terapéutica que se encuentra en auge para disminuir los efectos adversos de los fármacos y al mismo tiempo mantener los efectos terapéuticos. En nuestro estudio, la combinación de aceite de pescado con indometacina incrementa la seguridad gástrica sin modificar el efecto anti-inflamatorio de indometacina.
Conclusiones
El efecto anti-inflamatorio de indometacina y aceite de pescado se suman al administrarse concomitantemente. Además, la combinación de aceite de pescado con indometacina previene el daño gástrico generado por el AINE a través de la disminución en los niveles gástricos de LTB4.
Agradecimientos
Los autores agradecen el apoyo para realizar este proyecto al Instituto Politécnico Nacional a través de los proyectos SIP-20131157y SIP-SNI-2011/01 y al Consejo Nacional de Ciencia y Tecnología por el proyecto CONACyT 178027.
Referencias
1. Boelsterili UA, Redinbo MR, Saitta K. Multiple NSAID-induced hits injure the small intestine: underlying mechanism and novel strategies. Toxicol Sci. 2012; 131:654-667. [ Links ]
2. Wallace JL. Nonsteroidal anti-inflammatory drugs and gastroenteropathy: the second hundred years. Gastroenterology. 1997; 112:1000-1016. [ Links ]
3. Pineda-Peña EA, Jiménez-Andrade JM, Castañeda-Hernández G, Chávez-Piña AE. Docosahexaenoic acid, an omega-3 polyunsaturated acid protects against indomethacin-induced gastric injury. Eur J Pharmacol. 2012; 697 (1-3):139-143. [ Links ]
4. Faust T, Redfern JS, Lee E, Feldman M. Effects of fish oil on gastric mucosal 6-keto-PGF1 alpha synthesis and ethanol-induced injury. Am J Physiol. 1989;257: 9-13. [ Links ]
5. Leung FW. Prostaglandins mediate fish oil protection against ethanol-induced gastric mucosal injury in rats. Dig Dis Sci. 1994; 39:893. [ Links ]
6. Faust TW, Redfern JS, Podolsky I, Lee E, Grundy SM, Feldman M. Effects of aspirin on gastric mucosal prostaglandin E2 and F2 alpha content and n gastric mucosal injury in humans receiving fish oil or olive oil. Gastroenterology. 1990; 98:586-591. [ Links ]
7. Bhattacharya A, Ghosal S, Bhattacharya SK. Effect of fish oil on offensive and defensive factors in gastric ulceration in rats. Prostaglandins Leukot Essent Fatty Acids. 2006; 74 (2):109-116. [ Links ]
8. Güzel C, Ulak G, Sermet A, Cicek R, Ulak M. Effect of fish oil on indomethacin-induced gastric lesions in rats. Arzneimittelforschung. 1995; 45:1172-1173. [ Links ]
9. Manjari V, Das UN. Effect of polyunsaturated fatty acids on dexamethasone-induced gastric mucosal damage. Prostaglandins Leukot Essent Fatty Acids. 2000; 62:85-96. [ Links ]
10. Ulak G, Cicek R, Sermet A, Güzel C, Ulak M, Denli O. Protective effect of fish oil against stress-induced gastric injury in rats. Arzneimittelforschung.1995; 45:1174-1175. [ Links ]
11. Camuesco D, Gálvez J, Nieto A, Comalada M, Rodríguez-Cabeza ME, Concha A, Xaus J, Zarzuelo A. Dietary olive oil supplemented with fish oil, Rich in EPA and DHA (n-3) polyunsaturated fatty acids, attenuates colonic inflammation in rats with DSS-induced colitis. J Nutr. 2005; 135:687-694. [ Links ]
12. Kremer JM, Bigauoette J, Michalek AV, Timchalk MA, Lininger L, Rynes RI, Huyck C, Zieminski J Bartholomew LE. Effects of manipulating dietary fatty acids on clinical manifestations of rheumatoid arthritis. Lancet. 1985; 184-187. [ Links ] Ruan D, So SP. Screening and identification of dietary oils and unsaturated fatty acids in inhibiting inflammatory prostaglandins E2 signaling in fat stromal cells. BMC Complement Altern Med. 2012; 12:143.
13. Ruan D, So SP. Screening and identification of dietary oils and unsaturated fatty acids in inhibiting inflammatory prostaglandins E2 signaling in fat stromal cells. BMC Complement Altern Med. 2012; 12:143. [ Links ]
14. Zimmermann M. Ethical guidelines for investigations of experimental pain in conscious animals. Pain. 1983; 16:109-110. [ Links ]
15. Wallace JL, McKnight W, Reuter BK, Vergnolle N. NSAID-induced gastric damage in rats: requirement for inhibition of both cyclooxygenase 1 and 2. Gastroenterology. 2000; 119:706-714. [ Links ]
16. Ortiz MI, Gonzalez-Garcia MP, Ponce-Monter HA, Castaneda-Hernandez G, Aguilar-Robles P. Synergistic effect of the interaction between naproxen and citral on inflammation in rats. Phytomedicine. 2010; 18 (1):74-79. [ Links ]
17. Wallace JL. Prostaglandins, NSAIDs and gastric mucosal protection: why doesn't the stomach digest itself? Physiol Rev. 2008; 88 (4):1547-1565. [ Links ]
18. Asako H, Kubes P, Wallace J, Gaginella T, Wolf RE, Granger DN. Indomethacin-induced leukocyte adhesion in mesenteric venules: role of lipoxygenase products. Am J Physiol. 1992; 262:903-908. [ Links ]
19. Muller WA. Leukocyte-endothelial-cell interactions in leukocyte transmigration and the inflammatory response. Trends Immunol. 2003; 24: 327-334. [ Links ]
20. Arita M, Ohita T, Sun YP, Elangovan S, Chiang N, Serhan CN. Resol vin E1 selectively interacts with leukotriene B4 receptor BLT1 and ChemR23 to regulate inflammation. J Immunol. 2007; 178 (6):3912-3917. [ Links ]
21. Kris-Etherton PM, Harris WS, Appel LJ. Fish consumption, fish oil, omega-3 fatty acids, and cardiovascular disease. Circulation. 2002; 106:2747-2757. [ Links ]
22. Wang C, Harris WS, Chung M, Lichtenstein AH, Balk EM, Kupelnick B, Jordan HS, Lau J. n-3 Fatty acids from fish or fish-oil supplements, but not alpha-linolenic acid, benefit cardiovascular disease outcomes in primary- and secondary-prevention studies: a systematic review. Am J Clin Nutr. 2006; 84:5-17. [ Links ]
23. Tallarida RJ, Cowan A, Raffa RB. Antinociceptive synergy, additivity, and subadditivity with combinations of oral glucosamine plus nonopioid analgesics in mice. J Pharmacol Exp Ther. 2003; 307(2):699-704. [ Links ]














