Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista mexicana de ciencias farmacéuticas
Print version ISSN 1870-0195
Rev. mex. cienc. farm vol.44 n.3 Ciudad de México Jul./Sep. 2013
Trabajo científico
Actividad biológica de extractos metanólicos de Heliotropium amplexicaule
Biological activity of methanol extracts by Heliotropium amplexicaule
Catalina Leos-Rivas,1 Ma. Julia Verde-Star,1 Delia Elva Cruz-Vega,2 Ma. Porfiria Barrón-González,1 Catalina Rivas-Morales,1 Azucena Oranday-Cárdenas1
1 Facultad de Ciencias Biológicas, Universidad Autónoma de Nuevo León, México
2 Escuela de Medicina y Ciencias de la Salud ITESM, Monterrey, N.L, México
Correspondencia:
Dra. Catalina Leos Rivas
Facultad de Ciencias Biológicas
Universidad Autónoma de Nuevo León
Pedro de Alba s/n Cd. Universitaria, San Nicolás de los
Garza, Nuevo León, México.
Teléfono: 01(81)14939311, Fax: 01(81)83525011
e-mail: catalinaleosrivas@yahoo.com
Fecha de recepción: 21 de noviembre de 2012.
Fecha de recepción de modificaciones: 02 de julio de 2013.
Fecha de aceptación: 20 de agosto de 2013.
Resumen
Heliotropium amplexicaule es una planta perteneciente a la familia Boraginacea con antecedentes de contenido de compuestos con interés farmacológico. En este estudio se investigó la actividad biológica de los extractos metanólicos de raíz, tallo, flor y hojas de H. amplexicaule sobre diferentes microorganismos. Los resultados mostraron un efecto amebicida significativo de los extractos de raíz, tallo, flor y hojas sobre Entamoeba histolytica con CI50 de 2, 8, 36 y 114.2 μg/mL respectivamente; no mostraron actividad sobre las bacterias y dermatofitos probados. La citotoxicidad obtenida para raíz, tallo, hoja y flor sobre la línea celular Vero fue CI50 de: 250, 200, 175 y 150 μg/mL respectivamente; y la toxicidad para todos los extractos sobre A. salina fue de LD50 > 1,000 μg/mL.
Palabras clave: H. amplexicaule, E. histolytica, Boraginacea.
Abstract
Heliotropium amplexicaule is a plant belonging to the family Boraginacea with a content background of pharmacological interest compounds. In this study we have researched the biological activity of the methanol extracts of root, stem, flower and leaves of H. amplexicaule against different microorganisms. The results showed a significant amebicide effect on Entamoeba histolytica with IC50 of 2, 8, 36 and 114.2 μg/mL (root> stem> flower> leaf) they did not show any effect on bacteria and dermatophytes tested. On the Vero cell line showed IC50: 250, 200, 175 and 150 μg/mL (root, stem, leaf, and flower). The toxicity on A. saline was LD50> 1,000 μg/mL.
Key words: H. amplexicaule, E. histolytica, Boraginacea.
Introducción
La resistencia de los microorganismos a los antibióticos, aunado a los efectos secundarios causados por estos, ha favorecido la búsqueda de nuevos agentes de origen natural. Las plantas medicinales se han utilizado tradicionalmente por culturas indígenas, hoy en día se retoma esta práctica no solo en la conservación de sus tradiciones, sino también para el cuidado de la salud de la comunidad y el desarrollo de medicamentos.1 México es rico en biodiversidad y en la actualidad ya han sido identificadas más de 5,000 especies mexicanas con aplicaciones curativas.
Un problema de salud pública son las enfermedades parasitarias, principalmente la amibiasis, la cual es la responsable de 40 000 a 100 000 muertes anualmente a nivel mundial. Aunado a esto, el parásito E. histolytica (responsable de la enfermedad) ha desarrollado resistencia al metronidazol, droga utilizada comúnmente para tratar dicho padecimiento; y que además de presentar diversos efectos secundarios tiene propiedades carcinogénicas, teratogénicas y embriogénicas.2
Por tal motivo, en la actualidad se buscan alternativas con substancias de origen natural que posean la capacidad de atacar a las cepas resistentes y que al mismo tiempo, sean inocuas con el huésped. Recientemente se ha puesto mucha atención en los extractos de plantas utilizados en la medicina tradicional, el potencial antiprotozoario de las plantas como fuente de nuevos fármacos ha sido demostrado con ejemplos como la emetina, la quinina y la artemisinina, aislados de especies de plantas superiores;2 para poder llevar a cabo esto, se utiliza la investigación fitoquímica, cuyo objetivo principal es: aislar principios activos, identificarlos, determinar su estructura y encontrar sus posibles aplicaciones.
La familia Boraginaceae comprende alrededor de 130 géneros y 2600 especies distribuidas en zonas tropicales. Los compuestos que frecuentemente se reportan son: terpenos, alcaloides pirrolizados, flavonoides y naftoquinonas, existe evidencia del uso etnofarmacológico que se le da a algunas plantas de esta familia para combatir diversas enfermedades como diarreas, infecciones y parásitos intestinales.3,4,5 Perianayagam et al en 20126 evaluaron la actividad antimicrobiana de compuestos aislados del extracto etanólico de raíz de Trichodesma indicum reportando que el extracto mostraba una potente actividad contra S. aureus, B. subtilis y C. albicans con valores de CMI de 19.2 μg/mL y algunos de los compuestos aislados presentaron fuerte actividad antibacterial sobre S. aureus con CMI de 2.4 μg/mL. En Panamá la planta Bourreria spathulata de la misma familia, es utilizada en forma tradicional para tratar la malaria. En el 2012 Calderón et al 7 comprobaron dicha actividad para B. spathulata obteniendo una CI50 menor a 10 μg/mL.
Dentro de esta familia, el género Heliotropium es una conocida fuente de alcaloides pirrolizados, flavonoides y derivados aromáticos del geranilo, hay aproximadamente 250 especies distribuidas en ambos hemisferios.8 H. amplexicaule de este género es una planta perenne con tallos decumbentes y ramificados, sus hojas híspidas, alternas, lanceolado-elípticas, con borde ligeramente sinuoso, casi sésiles; de 15 a 30 cm de altura y 30 a 200 cm de diametro;9, 10 el objetivo de este estudio es determinar la actividad biológica del extracto metanólico de diversas partes de H. amplexicaule, así como su citotoxicidad y toxicidad.
Material y métodos
Material vegetal y preparación del extracto metanólico
La planta de H. amplexicaule (heliotropo) fue colectada en Monterrey, Nuevo León, México y un espécimen de la planta (identificación No 25527) fue depositado en el Herbario de la Facultad de Ciencias Biológicas, UANL. La planta fue secada a temperatura ambiente y se trituró en un molino manual (marca Victoria), 30 g de cada parte de la planta por separado (hojas, raíz, flor y tallo) se colocaron en agitación en 250 mL de metanol (CTR Scientific); los extractos fueron filtrados y evaporados hasta sequedad con presión reducida en un rotavapor (Yamato, modelo RE200).
Evaluación de la actividad antimicrobiana de los extractos en estudio
Con los extractos obtenidos se evaluó la actividad biológica sobre las bacterias Gram positivas B. cereus, E. coli, S. aureus y Gram negativas S. typhimurium, S. typhi, P. aeruginosa, E. cloacae, E. aerogenes, así como sobre los hongos dermatofitos T. tonsurans, T. rubrum, T. mentagrophytes, M. canis, M. gypseum, M. audouinii, M. cookie y una levadura C. albicans. El método empleado para el ensayo microbiológico fue el de difusión en placa, para evaluar la actividad, se prepararon soluciones de prueba con los extractos secos a una concentración de 40 mg/mL en metanol y se esterilizaron por filtración con membranas de 0.22 μm.11 Para la activación de bacterias se utilizó medio líquido C. Rivas.12
El método de difusión en placa se realizó colocando 10 μL de cada una de las soluciones de prueba sobre discos de papel filtro Whatman No. 1 en una placa con medio sólido C. Rivas, previamente inoculada con 100 μL de una suspensión bacteriana de 1x106 UFC o una azada con las diferentes cepas de hongos; se depositó también en un disco 10 μL del solvente utilizado para disolver el extracto como control negativo y 10 μL de un antibiótico o antifúngico como control positivo. Se incubó a 37 °C por 24 h para las bacterias y a 27 °C de 7-15 d para los hongos. Después de este período se midieron los halos de inhibición en mm para cada prueba.
Ensayo de Letalidad sobre Artemia salina
Los huevecillos de artemia fueron eclosionados e incubados por 48 h en agua de mar artificial (Instant Ocean). Se probaron cinco concentraciones: 0, 100, 300, 500 y 1,000 μg/mL; las cuales se prepararon a partir de los extractos metanólicos disolviéndolos en agua de mar artificial, el control positivo utilizado fue K2 Cr2 O7 al 5%. La prueba se realizó utilizando microplacas de 96 pozos, donde se depositaron 100 μL de agua salada artificial con 10 artemias en cada pozo. Las diferentes concentraciones de los extractos de H. amplexicaule fueron agregadas en volumenes de 100 μL, la microplaca fue incubada por 24 h a temperatura ambiente.13 Posteriormente, se contó el numero de organismos vivos y muertos para determinar la viabilidad y la dosis letal al 50 % (DL50). Se calculó la desviación estándar de tres experimentos independientes realizados por triplicado. El criterio de toxicidad fue el siguiente: Valores de DL50 > 1000 μg/mL (no tóxico), ≥ 500 ≤ 1000 μg/mL (toxicidad débil) y < 500 μg/mL (tóxico).14
Evaluación de la actividad amebicida de los extractos de H. amplexicaule sobre E. histolytica
La metodología se realizó de acuerdo a lo mencionado por Leos-Rivas et al.15 Partiendo de un cultivo de E. histolytica HM1-IMSS en medio TYI-S-3316 adicionado con 1 % de penicilina/estreptomicina y 10 % de suero de ternera en 5 mL, se utilizaron los tubos de 13x100 mm de boro silicato y tapón de rosca, inoculados a una densidad de 1 x 104 cel/mL. Se preparó una solución stock de los extractos metanólicos a una concentración de 40 mg/mL (p/v) disueltos en dimetil sulfóxido y esterilizados por filtración con una membrana de 0.22 μm (Millipore). Se probaron cinco concentraciones de c/u de los extractos de H. amplexicaule: 2, 20, 60, 100 y 200 μg/mL. Se incubaron por 6 d a 37 °C, después de esto la densidad fue determinada utilizando un hemocitómetro (Neubauer, Hausser Scientific). El control positivo utilizado fue metronidazol; el ensayo se realizó por triplicado y la concentración inhibitoria media fue determinada utilizando la prueba Probit.17
Citotoxicidad sobre células normales de mamífero
Fue utilizada la línea celular Vero de riñón de mono verde africano (American Type Culture Collection: CCL-81). Las células fueron cultivadas en medio M-199 (Gibco, cat. 11150-059) suplementadas con 4 % de suero fetal bovino, 100 U/mL de penicilina G y 100 μg/mL de estreptomicina a 37 °C en atmósfera húmeda con 5 % de CO2. Para el ensayo de citotoxicidad se utilizaron microplacas de 96 pozos con 3,000 cel/pozo en un volumen de 100 μL. La suspensión celular fue incubada a 37 °C en atmósfera húmeda con 5 % de CO2 por 24 h, después de este tiempo, a cada pozo se le adicionaron 100 del medio de cultivo con las diferentes concentraciones del extracto metanólico: 0, 100, 300, 500 y 1,000 μg/mL. El control positivo utilizado fue Tritón X-100 al 2.5 %, las microplacas se incubaron 24 h más, bajo las mismas condiciones. Posteriormente para determinar la citotoxicidad, se adicionaron a cada pozo 10 μL del reactivo Cell Titer-Blue (Promega, cat. G8080) y se incubaron por 2 h más y se determinó la absorbancia a 550 nm utilizando un lector de microplacas (Biotek, Modelo ELX800). Se estimó el porcentaje de viabilidad y la Concentración Inhibitoria 50 % (CI50). Se realizaron tres ensayos independientes por triplicado.
Pruebas Fitoquímicas
Se realizaron las siguientes pruebas químicas para la identificación parcial de grupos funcionales: la prueba de Liebermann-Burchard para determinar triterpenos y compuestos esteroidales, la prueba de Salkowski para determinar esteroles y metilesteroles, la prueba de Shinoda para compuestos de tipo flavonoide, la prueba de Baljet para sesquiterpenlactonas, la prueba de Dragendorff con la modificación de Munier y Machelobuf para la determinación de alcaloides, la prueba de bromo en tetracloruro de carbono para insaturaciones, la prueba del permanganato de Potasio, para dobles enlaces, la prueba de 2,4- Dinitrofenilhidracina para grupo carbonilo, la prueba de Molisch para azúcares, la prueba de NaOH para determinar lactonas, la prueba de Borntrager para determinar naftaquinonas y antraquinonas, la prueba del cloruro férrico FeCl3 para determinar oxihidrilos fenólicos, la prueba para la determinación de cumarinas y la prueba del bicarbonato de sodio para presencia de saponinas.18
Análisis Estadístico
El porcentaje de viabilidad para artemia fue transformado utilizando Arcosin O por el ensayo de normalidad (Kolmogorov-Smirnov), y la comparación fue realizada utilizando un análisis no paramétrico de varianza (si fue normal) o la prueba Kruskal-Wallis.19 Para el análisis estadístico fue utilizado el software SPSS, versión 10.0 (SPSS, Inc.).
Resultados y discusión
El proceso de extracción por maceración utilizado con las diferentes partes de la planta H. amplexicaule presentó rendimientos diferentes, donde, las hojas mostraron el mayor rendimiento con un 7.12 %, seguidos por las flores con un 5.13 %, el tallo con un 3.38 % y finalmente la raíz con un 3.28 %. Los extractos metanólicos de hojas, raíz, inflorescencias y tallos presentan actividad sobre E. histolytica HM1:IMSS con una CI50 de 114, 2, 36 y 8 μg/mL respectivamente (Tabla 1). Estos resultados sobre E. histolytica son consistentes con los reportados de Turnefortia densiflora, la cual mostró actividad con una CI50 de 69.1 μg/mL;20 así como los reportados con el extracto metanólico de B. officinalis (CI50 de 33 μg/mL),5 ambas plantas de la misma familia que H. amplexicaule.
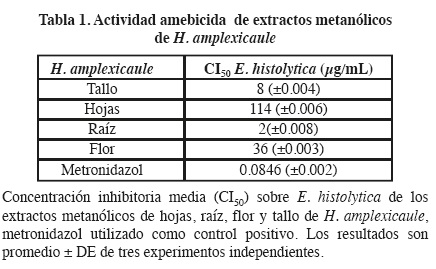
La toxicidad de los extractos metanólicos sobre A. salina mostraron una DL50 > 1,000 μg/mL (Tabla 1), de acuerdo al criterio utilizado,14 estos resultados nos indican que el extracto metanólico no tiene efecto tóxico en ninguna de las dosis probadas comparadas con el control positivo (K2 Cr2 O7 al 5 %) (P > 0.05).
La citotoxicidad de los extractos sobre células Vero presentaron una CI50 de: 150, 175, 200 y 250 μg/mL para flor, hoja, tallo y raíz, respectivamente. De estos resultados se destaca la especificidad del extracto metanólico de raíz ya que en este la CI50 para las células Vero es de 250 μg/mL y la CI50 para E. histolytica es de 2 μg/mL, por lo que resulta 125 veces menor la dosis de la raíz para obtener la CI50 de E. histolytica, seguido por el extracto de tallo (Figura 1). Sin embargo se recomienda que el H. amplexicaule (heliotropo) sea consumido por periodos cortos debido a que contiene alcaloides del tipo pirrolizidínicos que pueden causar daño en hígado.21, 10 Ninguno de los extractos mostró actividad antimicrobiana a una concentración de 40 μg/mL sobre los microorganismos probados, esto difiere con los reportados en Cordia curasabica, Cordia allidora y Cordia gilleti plantas de la misma familia22,23,24 en los cuales las CMIs obtenidas oscilan entre 62 y 1,000 μg/mL para bacterias Gram positivas y negativas.

Los resultados de las pruebas químicas realizadas a los extractos probados de H. amplexicaule, indicaron que contienen lactonas, fenoles, azúcares, terpenos, esteroles y alcaloides. El potencial terapéutico de las plantas de la familia Boraginaceae, ha sido demostrado y atribuido a compuestos fitoquímicos polares como compuestos fenólicos, quinonas y alcaloides,8 por lo que la actividad amebicida presentada por H. amplexicaule puede ser atribuida a la presencia de éstos compuestos.
Conclusiones
Los extractos metanólicos de H. amplexicaule poseen actividad amebicida relevante, mostrando selectividad de acuerdo a la toxicidad presentada sobre A. salina y la citotoxicidad sobre las células normales de mamífero utilizadas. Por lo que la planta mexicana H. amplexicaule tiene potencial para combatir infecciones gastrointestinales concentrándose los compuestos activos en la raíz.
Agradecimientos
Este trabajo es parte de la tesis doctoral de Catalina Leos Rivas con apoyo CONAYT No. 204599 y la Universidad Autónoma de Nuevo León (Proyecto PAICYT-CA1502-07).
Referencias
1. Chellaiah M, Muniappan A, Nagappan R, Savarimuthu I. Medicinal plants used by traditional healers in Kancheepuram District of Tamil Nadu, India. J Ethnobiol Ethnomed. 2006; 2:43. [ Links ]
2. Calzada F, Yépez-Mulia L, Aguilar A. In vitro susceptibility of Entamoeba histolytica and Giardia lamblia to plants used in Mexican traditional medicine for the treatment of gastrointestinal disorders. J Ethnopharmacol. 2006; 108:367-370. [ Links ]
3. da Silva S, Agra M, Tavares J, da-Cunha E, Barbosa-Filho J, da Silva M. Flavones from aerial parts of Cordia globosa (Jacq.) Kunth, Boraginaceae. Brazilian. J Pharmacognosy. 2010; 20(5):682-685. [ Links ]
4. Dodson C, Stermitz F. Pyrrolizidine Alkaloids from Borage (Borago officinalis) Seeds and Flowers. J Nat Prod. 1986; 49(4):727-728. [ Links ]
5. Mansour R, Saleh N. The Flavonoids of Alkanna orientalis. J Nat Prod. 1986; 49 (2):356-356. [ Links ]
6. Perianayagam J, Sharma S, Pillai K, Pandurangan A, Kesavan D. Evaluation of antimicrobial activity of ethanol extract and compounds isolated from Trichodesma indicum (Linn.) R. Br. root. J Ethnopharmacol. 2012; 142(1):283-286. [ Links ]
7. Calderón A, Simithy-Williams J, Gupta M. Antimalarial natural products drug discovery in Panama. Pharm Biol. 2012; 50(1):61-71. [ Links ]
8. Villarroel L, Torres R, Urzúa A, Reina M, Cabrera R, González-Coloma A. Heliotropium huascoense resin exudate: chemical constituents and defensive properties. J Nat Prod. 2001; 64(9):1123-1126. [ Links ]
9. Monti C, Novoa M, Vizcaíno C. Anatomía y Etnobotánica de Dos Especies de Boraginaceae de la Provincia Pampeana (Argentina) Usadas en Medicina Popular. Lat Am J Pharm. 2003; 22(3):197-201. [ Links ]
10. Dellow J, Bourke C, McCaffery. Blue heliotrope. Primefact. 2008; 653:1-5. [ Links ]
11. Koneman W, Allen S, Dowell V, Sommers M. Diagnostico Microbiológico. 1a edición. Ed. Médica Panamericana. 1989. p. 380-402. [ Links ]
12. Rivas Morales C, Salinas Carmona M, Galán Wong L, Medrano Roldán H. Operación unitaria para la propagación de Nocardia brasiliensis HUJEG-1 para la producción de proteasas con potencial biotecnológico Titulo de la Patente: No 252592 MPI MX/07/11/2007. [ Links ]
13. Meyer B, Ferrigni N, Putnam J. Brine shrimp: a convenient general bioassay for active plant constituents. Planta Med. 1982; 45(5):31-34. [ Links ]
14. Déciga-Campos M, Rivero-Cruz I, Arriaga-Alba M. Acute toxicity and mutagenic activity of Mexican plants used in traditional medicine. J Ethnopharmacol. 2007; 110(2):334-342. [ Links ]
15. Leos Rivas C, Verde Star M J, Osuna Torres L T, Oranday Cárdenas A, Rivas Morales C, Barrón González M P, Morales Vallarta M R, Cruz Vega D E. In vitro amoebicidal activity of Borage (Borago officinalis) extracto on Entamoeba histolytica. J Med Food. 2011; 14(7-8):866-869. [ Links ]
16. Diamond L. Entamoeba histolytica Schaudin 1903: from xenic to axenic cultivation. J Protozool. 1986; 33:1-5. [ Links ]
17. Finney D. Probit Analysis. 3rd ed. Cambridge, United Kingdom, Cambridge University Press. 1971. [ Links ]
18. Domínguez X. A. Métodos de Investigación Fitoquímica. 1a Edición. LIMUSA. México, D.F. 1973. [ Links ]
19. Zar J. Biostatistical Analysis. 3rd ed. Upper Saddle River, New Jersey, Prentice Hall. 1996. p. 180-185, 282-283. [ Links ]
20. Tapia-Pérez M, Tapia-Contreras A, Cedillo-Rivera R, Osuna L, Meckes M. Screening of Mexican medicinal plants for antiprotozoal activity—part II. Pharm Biol. 2003; 41(3):180-183. [ Links ]
21. McGuffin M, Hobbs C, Upton R, Goldberg A. American Herbal Products Association's Botanical Safety Handbook. Boca Raton, Florida, CRC Press. 1997. [ Links ]
22. Okusa P, Penge O, Devleeschouwer M, Duez P. Direct and indirect antimicrobial effects and antioxidant activity of Cordia gilletii De Wild (Boraginaceae). J Ethnopharmacol. 2007; 112(3):476-481. [ Links ]
23. Hernández T, Canales M, Terán B, Ávila O, Duran A, García A, Hernández H, Ángeles-López O, Fernández-Araiza M, Ávila G. Antimicrobial activity of the essential oil and extracts of Cordia curassavica (Boraginaceae). J Ethnopharmacol. 2007; 111(1):137-141. [ Links ]
24. Kloucek P, Svobodova B, Polesny Z, Langrova I, Smrcek S, Kokoska L. Antimicrobial activity of some medicinal barks used in Peruvian Amazon. J Ethnopharmacol. 2007; 111(2):427-429. [ Links ]














