Introducción
El estrés facilita, deteriora o no influye en las etapas de la memoria en ratas1-3 y humanos4, su efecto interviene en los circuitos cerebrales involucrados5,6. La respuesta depende de las características del estresor7, la duración y naturaleza de la tarea8-10, y factores fisiológicos del sujeto que influyen en las respuestas neuroendocrinas y conductuales11.
El estrés provoca liberación de corticosterona (C) por las glándulas suprarrenales12,13. Niveles de estrés alto o bajo deterioran la memoria y un nivel moderado la mejora14. La administración de C puede mejorar15 o deteriorar la memoria14,16,17, lo que depende de la dosis, la experiencia emocional o la fase de la memoria estudiada18,19.
La naturaleza de la tarea es importante. En el estudio de la memoria de procedimiento hemos utilizado dos tareas: la de evitación inhibitoria (EI) y el laberinto elevado en T (LET). En la EI, la administración del choque provoca que los animales aprendan a evitar el estímulo aversivo durante el entrenamiento. Con esta tarea se han estudiado diferentes estructuras cerebrales y la participación de sistemas de neurotransmisión como el colinérgico20,21. Anticolinérgicos como la escopolamina administrada intraperitonealmente22 o intraestriatal indujeron amnesia23. La escopolamina posentrenamiento no produjo amnesia en intensidades de 1 y 1.5 mA; con intensidades de 2 y 2.5 mA produjo amnesia22 y altas intensidades, 2.8 y 3.0 mA, no deterioraron la memoria. Se ha propuesto que con altas intensidades de choque, la actividad colinérgica no es necesaria para la consolidación24. Estudios realizados con agonistas GABAérgicos demostraron quela administración de muscimol indujo amnesia25 y potenció la amnesia inducida por escopolamina, con intensidades bajas26.
Los componentes aversivos de la tarea con el LET fueron comparados con estresores como la restricción de movimiento (R)27, estresor traumático para los roedores28 que activa el eje hipotálamo pituitario adrenal (HPA)27. La exposición pre entrenamiento a 6029 o 15 min de R30 deterioraron la memoria pero no la exposición posentrenamiento31. Estas dos tareas son consideradas aversivas por la presencia de los espacios abiertos y el choque, componentes considerados estresores intrínsecos32. La exposición al entrenamiento en LET activa el eje HPA33 y el choque en EI aumenta la concentración de C30, por lo que los resultados podrían interpretarse como la suma de los estresores intrínsecos más el estresor extrínseco con efecto en el entrenamiento.
La tarea de reconocimiento de objetos (RO) evalúa la memoria declarativa mediante la preferencia por la novedad34,35. Tiene la ventaja de que los ensayos pueden ser modificados para examinar diferentes componentes de la memoria, el efecto del estrés y la liberación de hormonas. Se ha propuesto que carece de estímulos aversivos por no requerir de privación de agua y comida36,37. El objetivo de este trabajo fue evaluar en una tarea de memoria de reconocimiento de objetos, el efecto del estrés por R (15 min) sobre la adquisición y consolidación de la memoria y estudiar la posible activación del eje HPA como consecuencia del entrenamiento de la tarea.
Método
Sujetos
Los experimentos fueron realizados siguiendo las normas establecidas por las guías de conducta ética en el cuidado y uso de animales no humanos de la Society for Neuroscience. Se utilizaron ratas Wistar machos adultos ingenuos experimentalmente (250-270 g) provenientes del bioterio de la Universidad Nacional Autónoma de México, FES-Iztacala. Los sujetos fueron alojados en el bioterio, con agua y alimento ad libitum, con un ciclo de luz-oscuridad (8:00 a 20:00 h), donde permanecieron en estas condiciones durante cinco días previos al experimento. Al inicio de los experimentos los sujetos (n = 56) se asignaron aleatoriamente a diferentes grupos. Los grupos experimentales que ejecutaron la tarea de memoria de reconocimiento recibieron una sesión de habituación de 10 min en la caja de reconocimiento libre de objetos un día previo al entrenamiento.
Aparatos
– Restrictores. Se emplearon contenedores de acrílico cilíndricos (Plas-Labs, Inc) con hoyos ajustables a la talla del sujeto experimental. Los sujetos fueron restringidos en un cuarto con luz natural durante 15 min.
– Lector de placas. Para medir la concentración de C se utilizó un lector de placas (H Reader 1 de HLAB), con filtro de 405 a 630 nm y una resolución de 0.0001 de absorbancia.
– Cámara de reconocimiento de objetos. Se empleó una cámara construida de PVC blanco (100 x 100 x 50 cm), con el piso cuadriculado (10 cm) que permitió colocar los objetos siempre a la misma distancia. Una cámara de circuito cerrado (AVTECH de 4 canales AVTECH AVC792DBKIT) grabó los ensayos de los sujetos con el fin de visualizar y hacer mediciones mediante un software para colección y análisis de datos Observer38.
– Objetos familiares y novedosos. Se utilizaron legos infantiles de plástico de color azul para los objetos familiares (Fig. 1A) variando el color y la forma para el objeto novedoso (Fig. 1B). La parte interna de los legos se saturaron de acrílico dental con el fin de que pesaran y la rata no los moviera.
– Tarea de RO. Las sesiones experimentales se realizaron entre las 8:00 y 11:00 h. En los ensayos de entrenamiento se colocó al sujeto en la cámara con dos objetos idénticos (F1 y F2) y se les permitió explorarlos en una prueba de familiarización durante 5 min. La exploración se definió como el acercamiento de los sujetos dirigiendo la nariz hacia los objetos en un rango de 2 cm o cuando olfateaban. Dar la vuelta a/o sentarse sobre el objeto no se consideraron una conducta de exploración39,40. El criterio de inclusión en el grupo fue que los sujetos exploraran por lo menos 10 s durante los ensayos de entrenamiento solo en los grupos que no hubieran sido expuestos a tratamiento antes del entrenamiento. En los grupos con tratamiento previo al entrenamiento, se respetaron los tiempos de exploración como efecto de este.

Figura 1 Objetos utilizados en la tarea de reconocimiento de objetos. A: objeto familiar (OF). B: objeto novedoso (ON).
En el ensayo de prueba después de un periodo de retardo de 24 h posteriores al entrenamiento se expuso a los sujetos a un objeto familiar (OF) y a un objeto novedoso (ON) durante 5 min.
Se registró el tiempo de exploración al objeto novedoso (TN) y al objeto familiar (TF) y se calculó un índice de discriminación para cada sujeto que se expresó como ID = 100 * (TN – TF)/(TN + TF), donde TF = tiempo dedicado a explorar al objeto familiar y TN = tiempo dedicado a explorar al objeto novedoso. El índice de discriminación (ID) mayor a cero, muestra que los animales exploraron más al ON que al OF, por lo que se considera buena memoria, mientras que una proporción cercana a cero indica que los animales exploraron el mismo tiempo a los dos objetos, lo que se considera deterioro de la memoria35,36.
Cuantificación de la corticosterona
Al concluir las sesiones experimentales, los sujetos se sacrificaron por decapitación entre las 8:00 y 11:00 h, se obtuvieron muestras de sangre del tronco (3 ml) que fueron centrifugadas a 3,000 rpm. Inmediatamente después el suero se mantuvo a –20 °C hasta, ser procesado, por medio de una prueba de enlace de inmunoensayo (Assay Designs, Catálogo n.º 900-097 EV, Ann Arbor, Michigan, EE.UU.); los resultados analíticos son expresados en ng/ml. El límite bajo de detección fue de 0.027 ng/ml y el porcentaje inter e intraensayo tuvo un coeficiente de variación de 5.3 y 9.87 respectivamente.
Procedimiento
Se utilizaron 32 sujetos asignados a cuatro grupos (n = 8) que recibieron los siguientes tratamientos: un grupo que ejecutó la tarea de RO; dos grupos que realizaron el entrenamiento de la tarea de RO con la diferencia que uno fue sometido a R antes del entrenamiento (estrés en la fase de adquisición) (R+RO) y otro fue entrenado e inmediatamente después sometido a R (estrés en la fase de consolidación) (RO+R); a un cuarto grupo se le administró 5 mg/kg intraperitoneal (ip) antes del entrenamiento para simular la C liberada por la exposición a R (C+RO). La prueba de memoria se realizó en todos los grupos 24 h después del entrenamiento. Los animales fueron sacrificados después de la prueba.
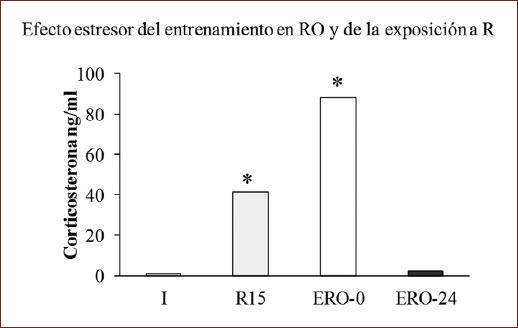
Adicionalmente se evaluó la liberación de C en plasma después de exponer a los sujetos al entrenamiento de RO para descartar que la sola exposición al entrenamiento active el eje HPA como ocurre en otras tareas33. Se asignaron 24 ratas a cuatro grupos (n = 6), que recibieron los siguientes tratamientos: un grupo intacto (I), sin ningún tratamiento, un grupo expuesto a 15 min de R sacrificado inmediatamente después (R15); otros dos grupos expuestos solo al entrenamiento en RO sacrificados 0 o 24 h después (ERO-0 y ERO-24).
Estadística
Dado que se confirmó la homogeneidad de las varianzas, para analizar los efectos en el total del TN y el ID entre grupos, se empleó un análisis de varianza de una vía (ANOVA), cuando hubo diferencias se utilizó una prueba post hoc de Honestly Significant Difference (HSD) de Tukey. Para analizar las diferencias entre TN y TF de cada grupo se realizaron pruebas de t de Student pareada. Como los datos de la concentración de C no presentaron homogeneidad de varianzas, se realizó una prueba de Kruskal-Wallis seguida de una prueba U de Mann-Whitney. Todos los análisis estadísticos se realizaron mediante el software STATISTICA® (versión 7).
Resultados
En la figura 2A se muestra el tiempo de exploración al objeto novedoso de los diferentes tratamientos. Se observaron diferencias significativas (F [3, 28] = 7.60; p < 0.001) entre los grupos. Los sujetos de los grupos R+RO y RO+R permanecieron menos tiempo explorando el ON (p < 0.01) respecto al que ejecutó la tarea sin R. La administración de C antes del entrenamiento no tuvo efecto. En la figura 2B se muestra el ID, se encontraron diferencias significativas entre los grupos (F [3, 28] = 5.37; p < 0.01); el grupo R+RO difirió de todos los grupos (p < 0.05), mostrando una menor discriminación al ON. Los grupos de RO+R y de C+RO no presentaron diferencias respecto a RO.

Figura 2 Gráficas que muestran a sujetos expuestos a restricción (R) antes o después del entrenamiento (R+RO, RO+R) o de la administración de corticosterona (5 mg/kg) (C+RO). A: media (± EEM) del tiempo de exploración al objeto novedoso (TN). B: media (± EEM) del índice de discriminación (ID) en la tarea de RO.*p < 0.01.†p < 0.05.
La prueba t de Student mostró que el grupo que ejecutó la tarea de RO sin ningún tratamiento exploró más el ON (t [7] = 3.53; p < 0.01). Hubo menor exploración de los objetos en los grupos que fueron sometidos a R o que recibieron C. No obstante, se observó que en el grupo de R+RO el TN y el TF fueron similares (t [7] = 0.2; p = 0.843). La exploración al ON fue mayor en los grupos que recibieron R después del entrenamiento o C (t [7 = 2.93; p < 0.05) (Fig. 3).
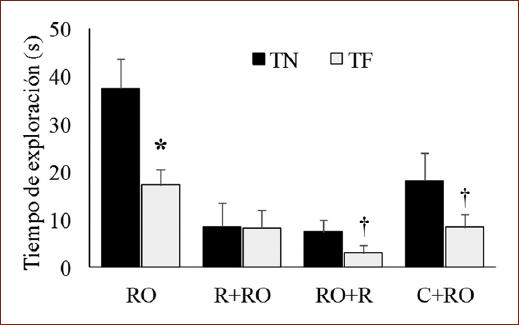
Figura 3 Medias (± EEM) del tiempo de exploración al objeto novedoso (TN) o al objeto familiar (TF) en sujetos sin restricción (RO), expuestos a restricción preentrenamiento o posentrenamiento (R+RO, RO+R) o 5 mg/kg de corticosterona (C) preentrenamiento (C+RO) que realizaron la tarea de RO.*p < 0.01 frente a TN de su grupo.†p < 0.05 frente a TN de su grupo.
La concentración de C en plasma presentó diferencias significativas entre los grupos (H [3, n = 31] = 15.727; p < 0.001). Los sujetos que fueron sometidos a R o a la administración de C antes del entrenamiento mostraron mayor concentración de C plasmática (p < 0.05), mientras que en el grupo expuesto a R posentrenamiento la concentración fue parecida al grupo RO (Fig. 4).

Figura 4 Medianas de la concentración de corticosterona (C) en plasma de sujetos que realizaron la tarea de reconocimiento de objetos sin restricción (RO), expuestos a restricción preentrenamiento o posentrenamiento (R+RO, RO+R) o 5 mg/kg de C preentrenamiento (C+RO).*p < 0.05 frente al grupo de RO.
Finalmente, la figura 5 muestra la concentración de C en plasma de los grupos expuestos al entrenamiento en RO o a la R 15 min; se observaron diferencias (H [4, n = 30] = 13.21; p < 0.05). Los grupos que recibieron R o el entrenamiento en RO y que fueron sacrificados inmediatamente después mostraron mayor concentración de C respecto al grupo intacto (p < 0.05), no así los que fueron sacrificados a las 24 h, lo que denota que el entrenamiento en la tarea de RO estimula al eje HPA de forma similar a la exposición a R cuando se registra inmediatamente.
Discusión
Nuestros resultados demostraron deterioro en la adquisición de la memoria de reconocimiento de los sujetos expuestos a R antes del entrenamiento, evaluados en la fase de prueba 24 h después, según el TN y el ID, parámetros empleados en esta prueba. Lo anterior es consistente con lo reportado en otros estudios41 donde demostraron que el efecto de R en RO provocó deterioro cuando se aplicó antes del entrenamiento y la fase de prueba se realizó en intervalos de 3 h, pero no cuando se realizó la prueba 5 min después. Efectos similares se encontraron en este laboratorio con la exposición a 15 min de R preentrenamiento y una demora de fase de prueba de dos horas que también provocó deterioro de la memoria de RO42. Como puede observarse para esta tarea las demoras entre la fase de entrenamiento y la prueba son determinantes para poder evaluar el ID y el TN43, ya que los intervalos largos pueden influir en la reducción del ID39; sin embargo, con esta tarea se pudieron observar efectos del estrés 24 h después. La exposición a R antes del entrenamiento se ha observado en otras tareas como LET, ya que 15 o 60 min de R ocasionaron deterioro de la memoria cuando el entrenamiento se realizó inmediatamente después29,30.
En la consolidación de RO no se observó un efecto significativo en el ID, lo que implica que los sujetos discriminaron en forma similar al grupo que realizó la tarea sin R. Cuando se compararon TN y TF durante la prueba, los sujetos del grupo RO+R visitaron más el ON, pero exploraron menos que el grupo sin R, esto puede estar relacionado con un efecto de ansiedad inducido por la caja utilizada para desarrollar la tarea, ya que los sujetos muestran menor tiempo de exploración. El efecto de R sobre la consolidación evaluado con el ID, coincide con los resultados obtenidos en otros estudios con 60 min de R precedidos por el entrenamiento en RO en ratones2.
Los sujetos a los que se les administró C preentrenamiento no presentaron deterioro de RO; efectos similares se han reportado en una tarea de alternación espacial18. La concentración en plasma medida 24 h después en los grupos que realizaron la tarea de RO aumentó solo en los grupos que fueron expuestos a R o C preentrenamiento. Esto implica que la sola elevación de C no es suficiente para generar cambios en la memoria de RO y aunque la concentración es similar parece que el efecto en la memoria dependió del momento de la presentación de la R.
Hay tareas que por sus características aversivas generan activación del eje HPA durante el entrenamiento31,33. En diversos estudios que utilizan la tarea de RO para evaluar la memoria emplean una caja cuadrada o rectangular, esta misma tarea se ha utilizado como campo abierto para evaluar la respuesta de ansiedad44,45.
El efecto del estrés por R en la adquisición de la memoria en RO se puede explicar por el estado emocional del animal durante el entrenamiento46. Existen estudios que relacionan la presentación de estresores como la restricción, cercanos a la fase de la adquisición con la expresión diferencial de receptores a glucocorticoides bajos y receptores a mineralocorticoides altos en hipocampo, que pueden generar alteración en el procesamiento de la información47. En nuestros resultados es probable que el efecto de la R se sume al estrés producido durante el entrenamiento en RO y que ambos modifiquen la codificación de la información emocional en las estructuras cerebrales involucradas durante la adquisición48.
Los resultados obtenidos en el ID y el TN sugieren que para que ocurra deterioro de memoria se requiere que los sujetos sean expuestos a la suma de factores estresantes; en este caso el estrés extrínseco producido por la R e intrínseco ocasionado por el entrenamiento en RO. En estas condiciones es probable que se modifique el estado emocional durante el entrenamiento en RO y sensibilice el eje HPA, de tal forma que durante la exposición en la sesión de prueba de RO se favorezca la liberación de C49.
La cercanía entre ambos estresores es fundamental, porque en otros estudios, cuando se administraron 60 o 75 min de R antes del entrenamiento en RO, no se vio efecto en la memoria,2 tampoco 60 min de R aplicados 24 h antes en la tarea de alternación espacial tuvieron efecto18.
En el presente estudio se observó mayo concentración de C en los animales evaluados inmediatamente después del entrenamiento, respecto a los evaluados 24 h después. Los resultados muestran que el entrenamiento en la tarea de RO activa la respuesta de estrés en los periodos inmediatos a la tarea y se comporta como un estresor que se restablece por retroalimentación negativa, ya que a las 24 h la concentración de C vuelve a condiciones basales.
Aunque los sujetos fueron habituados a la cámara 24 h antes del entrenamiento durante 10 min, la reexposición a la cámara de RO provocó activación del eje HPA el día del entrenamiento. El animal en el entrenamiento se enfrenta a dos objetos similares que son extraños o novedosos para él, la liberación de C es un índice importante de estrés en ratas y sugiere que el confinamiento en un ambiente nuevo es estresante50. La respuesta del sujeto a una cámara que durante la habituación estaba vacía y durante el entrenamiento se expone a dos objetos, implica un nuevo contexto, y es probable que esta exposición le provoque activación de la atención, la ansiedad y de factores relacionados con la respuesta de estrés como la liberación de glucocorticoides41,42.
Ennaceur39 considera que la tarea de RO se realiza en bajas condiciones de estrés y otros autores señalan que la habituación al contexto experimental reduce la respuesta de agitación51. Sin embargo, los resultados de nuestro estudio indican lo contrario, ya que la situación emocional del sujeto persiste en el entrenamiento de la tarea de RO, lo que permite disociar el estrés intrínseco, inherente a la tarea o situación de aprendizaje32, ya que la exposición solo al entrenamiento es comparable al efecto ocasionado por la R.
Conclusiones
Los resultados obtenidos en este estudio sugieren que 15 min de R antes del entrenamiento en RO deterioran la memoria declarativa a las 24 h y desencadenan la liberación de C en plasma. La inyección de C pre entrenamiento en dosis de 5 mg/kg reproduce las concentraciones plasmáticas bajo estrés, pero no tiene efecto sobre la memoria. Se demostró el efecto estresor del entrenamiento de la tarea de RO.











 text new page (beta)
text new page (beta)