1. Introducción
Actualmente se buscan nuevas fuentes de energía para evitar la dependencia que se tiene del petróleo, considerando que en un futuro no tan lejano se agotaran sus reservas. Los biocombustibles son una fuente de energía renovable producidos de biomasa que pueden sustituir al petróleo. Una de estas fuentes de biomasa son los aceites y grasas, los cuales no pueden emplearse de forma directa, ya que los grupos oxigenados son inestables y presentan poca fluidez a baja temperatura. Por lo tanto, se requiere la remoción del oxígeno de sus moléculas, lo cual puede lograrse mediante el proceso denominado hidrodesoxigenación (HDO). La remoción de oxígeno genera un hidrocarburo y agua como subproducto, o CO2 cuando procede por la vía de la descarboxilación [1, 2]. La ruta de reacción es influenciada por el catalizador usado y las condiciones de reacción. Para la HDO de triglicéridos se han evaluado los catalizadores tradicionalmente empleados en el hidrotratamiento del petróleo, tales como NiMo, CoMo y NiW sulfurados; pero esto trae consigo la contaminación con azufre del combustible obtenido. Por otro lado, metales nobles como el paladio y el platino han mostrado buena selectividad para la formación de hidrocarburos y óxidos de carbono; sin embargo, los metales nobles tienen precios elevados.
Como alternativa, en este trabajo se propone el uso de catalizadores de níquel soportado en una zeolita HZSM-22 con mesoporos generados postsíntesis para maximizar la dispersión de la fase metálica y además disminuir efectos difusionales inherentes a esta zeolita [3]. A continuación la zeolita modificada es incorporada en una matriz de alúmina a fin de hacer más fácil su manipulación, reduciendo la exposición a su posible toxicidad [4] y disminuyendo las pérdidas de material. Finalmente, los catalizadores obtenidos son evaluados en la reacción de HDO del ácido oleico.
2. Experimental
2.1. Modificación de la zeolita ZSM-22 y preparación de los catalizadores de níquel
La zeolita ZSM-22 se obtuvo de ACS materials. Como la zeolita todavía tenía agente estructurante se calcinó en dos etapas; la primera calcinación se realizó sin flujo gaseoso en una mufla vulcan a 520 °C por 6 h, y la segunda calcinación se realizó en un reactor continuo en forma de U a 550 °C por 6 h en flujo de oxígeno de 90 mL/min. A continuación la zeolita ZSM-22 se trató con una solución de NaOH 0.2 M por 30 min a 65 °C y posteriormente con una solución HCl 0.1 M a 65 °C por 6 h [5], se secó a 60 °C por 6 h y se intercambió con una solución de NH4NO3 0.1 M a 25 °C por 12 h. finalmente se calcinó a 550 °C por 5 h. Esta zeolita se etiquetó como ZSM-22Mes. Dada la dificultad de manipulación del polvo de zeolita y a fin de disminuir la exposición a su toxicidad [4], se procedió a incorporar la zeolita en una matriz de alúmina. El porcentaje de zeolita ZSM-22 Mes que se incorporó en la alúmina fue del 25 % y el precursor de γ-Al2O3 fue la bohemita Catapal B. El soporte se etiquetó como ZSM-22Mes- γ-Al2O3. Los catalizadores se prepararon por impregnación incipiente con las cargas nominales de Ni metálico: 1%, 2.5%, 5% y 7.5% a partir de una solución de Ni(NO3)2 6H2O, y fueron etiquetados como Ni(X)/ZSM 22Mes- γ-Al2O3 donde X=% en peso de Ni.-
2.2. Caracterización de los catalizadores
2.2.1. Difracción de rayos X (DRX)
El patrón de difracción de rayos X de polvos de la zeolita sin modificar, modificada y de los catalizadores, fue registrado usando un equipo SIEMENS-D5000 con radiación Cu Kα (λ = 1.54 Å). El patrón de difracción fue escaneado en el intervalo de 5 a 80° de 2θ con un tamaño de paso de 0.020° por minuto.
2.2.2. Propiedades texturales
El área específica, el volumen de poro y distribución del tamaño de poro de los soportes y de los catalizadores fueron obtenidos de las isotermas de adsorción-desorción de nitrógeno. Para el área específica con el método BET [6], la distribución de poros con el método BJH [7] y volumen microporoso obtenido por el método t-plot. Todas las muestras se trabajaron a 77 K con un equipo Micromeritics ASAP 2000. Previo a las mediciones de fisisorción, todas las muestras fueron pretratadas por al menos 24 horas a 370°C en vacío mecánico.
2.2.3. Microscopia electrónica de barrido-EDX
Para esta determinación se utilizó un microscopio de barrido Jeol JSM-5900 LV equipado con un aditamento EDX operando a 20 kV. Para cada muestra se realizó el análisis de diferentes zonas del catalizador. Los elementos presentes se identificaron de acuerdo a su línea K∝ y algunos su línea L∝. Los estándares utilizados fueron: Carbono (CaCO3), oxigeno (cuarzo), aluminio (Al2O3), silicio (sílice), fósforo (GaP), azufre (FeS2), Níquel (Ni metálico) y Molibdeno (Mo metálico).
2.2.4. Microscopia electrónica de transmisión
Para esta técnica, los catalizadores en forma de óxido de níquel se redujeron ex situ en flujo de H2 de 60 mL/min a 450 °C, y las muestras se dispersaron en heptano durante 20 min. La determinación de los cúmulos de níquel en los catalizadores Ni(1%)/ZSM-22Mes-γ-Al2O3, Ni(2.5%)/ZSM-22Mes-γ-Al2O3, Ni(5%)/ZSM-22Mes-γ-Al2O3 y Ni(7.5%)/ZSM-22Mes-γ-Al2O3, se realizó en un equipo Jeol modelo 2010 con un voltaje de aceleración de 200 kVolts, con una resolución de 1.9 Å punto a punto.
2.2.5. Espectroscopia infrarroja con transformada de Fourier
Para corroborar la presencia acidez de Brønsted en la zeolita ZSM-22 original, ZSM-22Mes y en el soporte ZSM- 22Mes-γ-Al2O3, se realizó el estudio de espectroscopia infrarroja con transformada de Fourier (FT-IR), se examinó la región de vibración de los grupos OHs en la zeolita ZSM- 22 original, ZSM-22Mes y en el soporte ZSM-22Mes-γ-Al2O3. Típicamente se pesaron 0.02 g de muestra para realizar una pastilla y se presionó a 4 Ton. Los espectros de infrarrojo se colectaron en un equipo Nicolet FT-IR Magna 760 usando una resolución de 2cm-1 y 100 barridos por espectro.
2.3. Actividad catalítica. Hidrodesoxigenación de ácido oleico
Las reacciones de hidrodesoxigenación se realizaron en un microreactor continuo de lecho fijo (Microactivity Reference). Previo a las reacciones los catalizadores se redujeron con las siguientes condiciones: T = 450 °C, en flujo de 50 mL/min de hidrógeno y mantenido así por 4 h. Las condiciones de reacción fueron las siguientes: la mezcla de alimentación fue una solución de 10 % ácido oleico en dodecano a un flujo de 0.25 mL/min, el peso del catalizador fue 0.1 g, el flujo de hidrógeno de 60 mL/min a una presión de 15 bar y 350 °C. Las muestras de los productos de reacción se tomaron cada 1 h y se analizaron en un cromatógrafo de gases equipado con una columna capilar HP-5.
3. Resultados y discusión
3.1. Difracción de rayos X (DRX)
Los patrones de difracción de rayos X muestran modificaciones en la estructura cristalina original de la ZSM-22 al ser tratada con NaOH y HCl, Los resultados se muestran en la figura 1. Los patrones de difracción de rayos X de la zeolita ZSM-22Mes indican que al tratarse la zeolita original con NaOH y posteriormente con HCl conserva su estructura cristalina aunque con la aparición de pequeños picos en 18°, 21.8° atribuidos a óxido de silicio (cristobalita) [8]. El ligero corrimiento hacia ángulos menores de algunos picos de DRX que se observa en la muestra ZSM-22Mes con respecto a la ZSM-22 hace suponer que algunas distancias interplanares aumentan y el volumen de celda se expande [9] repercutiendo en un ensanchamiento de las cavidades en la zeolita mesoporosa, situación que prevalece una vez incorporada la zeolita en la alúmina. Además, al depositarse la zeolita ZSM-22Mes en la matriz de alúmina, surgen los picos muy anchos en 37 y 45.8 ° correspondientes a la estructura de γ-Al2O3 [10].
Los difractogramas de los catalizadores de níquel con diferentes cargas metálicas depositados en el soporte ZSM- 22Mes-γ-Al2O3 (no mostrados aquí) no presentan los picos de difracción atribuibles al níquel metálico, solamente se observan los picos de la zeolita ZSM-22 y de la γ-Al2O3, siendo similares a los observados en la figura 1.
3.2. Propiedades texturales
Las isotermas de adsorción-desorción de las muestras ZSM-22 original, ZSM-22Mes tratada con NaOH y HCl, y la muestra ZSM-22Mes-γ-Al2O3, incorporada en la matriz de alúmina, se comparan en la figura 2. Se observa claramente el aumento del volumen de adsorción de nitrógeno al tratar a la muestra original, este aumento en la capacidad de adsorción es indicativo de la aparición de mesoporos tal como se ha reportado en la bibliografía [3, 5].
Las propiedades texturales se resumen en la tabla 1, en donde se presentan las áreas específicas obtenidas por el método BET, volumen microporoso obtenido por el método t-plot [11] y el diámetro de poro promedio obtenido por el método BJH de la zeolita ZSM-22 original, la zeolita ZSM- 22 mesoporosa (tratada con NaOH y HCl), la zeolita ZSM- 22 incorporada en la matriz de alúmina (ZSM-22-γ-Al2O3) y los catalizadores: Ni(1%)/ ZSM-22- γ-Al2O3, Ni(2.5%)/ ZSM-22-γ-Al2O3 Ni(5%)/ ZSM-22-γ-Al2O3, Ni(7.5%)/ ZSM-22-γ-Al2O3.

Figura 2 Isotermas de adsorción-desorción de las muestras: ZSM-22 original, ZSM-22Mes y ZSM-22- γ-Al2O3.
Tabla 1 Propiedades texturales de la zeolita ZSM-22 original, ZSM-22Mes y ZSM-22Mes γ-Al2O3 y los catalizadores de níquel.

El área superficial específica obtenida por el método de BET indica que la zeolita original HZSM-22 posee menor área, posiblemente atribuible a los depósitos de coque remanentes del proceso de calcinación. Se ha reportado que la zeolita ZSM-22 es una zeolita de baja área [12], fenómeno atribuido a que en la calcinación no se logra la eliminación completa del agente estructurante (1,6-diaminohexano o 1,8-diaminooctano), lo cual genera coque. Después, al tratarse con NaOH-HCl el área aumenta de 213 a 279 m2/g. Finalmente, al incorporar la zeolita en la matriz de alúmina el área disminuye. A este respecto debe considerarse que el contenido de zeolita H-ZSM-22 sobre γ-Al2O3es del 25 % en peso.
El tratamiento químico de la zeolita ZSM-22 con NaOH- HCl permitió en ésta la formación de mesoporos, a la vez que se observó un aumento del volumen microporoso. Por otra parte, la incorporación posterior en la matriz de alúmina causó una disminución del volumen microporoso que se mantuvo al impregnar con níquel.
Con respecto a la distribución de diámetro de poro, se corroboró la ausencia de mesoporos en la zeolita original, mientras que en la zeolita tratada se generaron mesoporos con un promedio de 35 Å. Al ser depositada la zeolita en la matriz de alúmina, el promedio de diámetro de poros cambia a 65 Å, el cambio puede atribuirse a una combinación de la mesoporosidad de la alúmina y la misma zeolita (tabla 1). Los cambios que se observan al depositar el níquel pueden ser resultado de un cubrimiento de los poros de la zeolita al aglomerarse el metal.
3.3. Microscopia electrónica de barrido-EDX
La microscopia electrónica de barrido informa sobre la morfología de los catalizadores y además permite realizar un análisis de los elementos constituyentes del catalizador. En la figura 3 Se muestra un ejemplo de una micrografía obtenida de la microscopia electrónica de barrido para el catalizador Ni(5%)/ ZSM-22Mes γ-Al2O3. Como se observa en esta figura, las partículas aglomeradas tienen dimensiones de 3 a 10 micrómetros. Dichas partículas están formadas por partículas zeolíticas y la γ-Al2O3. A la derecha de la misma la figura 3 se presenta un espectro de microanálisis por dispersión de energías de rayos X, en el cual se observan los picos correspondientes al aluminio, oxígeno, silicio y Ni. A partir de la integración de las áreas de un espectro de este tipo se cuantificó la cantidad de níquel impregnado en el soporte ZSM-22Mes-γ-Al2O3. Los valores obtenidos se muestran en la tabla 2.

Figura 3 Micrografia de la microscopia electrónica de barrido del catalizador Ni(5%)/ ZSM-22Mes- γ-Al2O3, y un espectro de microanálisis por dispersión de energías de rayos X.
3.4. Microscopia electrónica de transmisión
La micrografía presentada en la figura 4A muestra la incorporación de la zeolita ZSM-22Mes embebida en la matriz de alúmina, se observa la zeolita en forma de barra alargada y en la figura 4B se muestran algunas partículas de níquel de 5 a 10 nm de diámetro que solo se observan en la muestra que tiene 7.5 % en peso.
3.5. Espectroscopia infrarroja con transformada de Fourier
Los espectros de infrarrojo de las muestras ZSM-22 original, ZSM-22Mes y ZSM-22Mes-γ-Al2O3 de la figura 5 presentan una banda en 3600 cm-1 que se ha asignado a grupos OHs puenteados Si-OH-Al de acidez tipo Brønsted, mientras que la banda en 3745 cm-1 son grupos silanoles localizados en la superficie externa del cristal de zeolita [13]. La zeolita al tratarse en medio básico y luego en medio ácido genera otra banda en 3680 cm-1 asignada a especies aluminio extrared. Para el soporte ZSM-22-γ-Al2O3, además de las bandas atribuidas a la zeolita se observan las bandas características de las alúminas de transición, γ-Al2O3. Por ejemplo, la banda en 3730 cm-1 se atribuye a los grupos hidroxil puenteados entre aluminios en coordinación tetraédrica y octaédrica, mientras la banda de 3680 cm-1 corresponde a grupos hidroxilo tripuenteados con tres átomos de aluminio en coordinación octaédrica [14, 15].
3.5. Actividad catalítica. Hidrodesoxigenación de ácido oleico
La reacción de hidrodesoxigenación de ácido oleico con catalizadores de níquel a diferentes contenidos 1, 2.5, 5 y 7.5 % se realizó a 350°C en presencia hidrógeno a 15 bar de presión. La conversión de ácido oleico se presenta en la figura 6, en la cual se puede observar que la conversión aumenta al aumentar el porcentaje de níquel, pasando por un máximo y luego disminuye con el catalizador de 7.5 %. El hecho de que la conversión de ácido oleico tenga un máximo y luego disminuya puede atribuirse a que para la mayor carga metálica (7.5% Ni) la dispersión de la fase activa disminuye al aglomerarse en cúmulos grandes de níquel, que posiblemente se encuentran en la superficie externa de la zeolita ZSM-22Mes, tal como se pudo observar en la microscopia electrónica de transmisión.
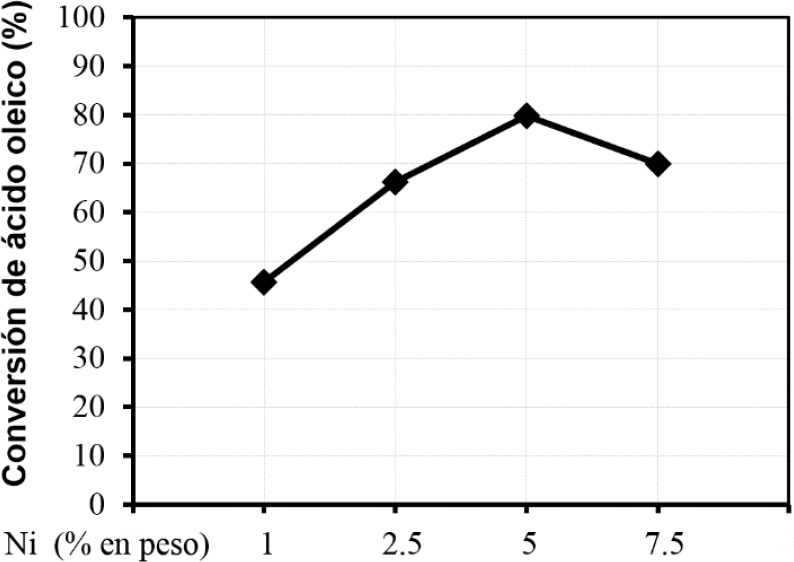
Figura 6 Conversión de ácido oleico en función de la carga de níquel soportado en el material ZSM-22 -γ-Al2O3.
Por otra parte, la selectividad de los catalizadores de níquel soportados en ZSM-22-γ-Al2O3 se presenta en la figura 7. Los principales productos de interés detectados en la reacción del ácido oleico fueron el heptadecano y el ácido esteárico. Adicionalmente se detectaron productos de hidrocraqueo cuya formación disminuyó al aumentar la cantidad de níquel en los catalizadores. Es de esperarse que existan productos de hidrocraqueo, debido que la zeolita ZSM-22Mes presenta acidez tipo Bronsted, tal como se mostró en los espectros de infrarrojo. La formación de heptadecano es favorecida con el catalizador de 1 % Ni. A medida que aumenta el contenido metálico, la conversión global del ácido oleico aumenta, resultado de la presencia de las reacciones de HDO y de la reacción de hidrogenación del doble enlace del ácido oleico para dar ácido esteárico. Esto es causado simplemente porque más fase metálica está presente. Por otro lado, Roh [16], Kandel [17] y Snare [18] proponen que la etapa de hidrogenación es un paso necesario para el proceso de descarboxilación y la obtención de heptadecano. Para las condiciones de reacción utilizadas en este trabajo, la formación de ácido esteárico se ve favorecida por la presión de hidrógeno (15 bar), y el níquel que es un metal con alta capacidad de hidrogenación para olefinas [19].

Figura 7 Selectividad hacia heptadecano y ácido esteárico en función de la carga de níquel soportado en el material ZSM-22Mes-γ-Al2O3.
Para el proceso de hidrodescarboxilación de los ácidos carboxílicos libres existen algunas propuestas del mecanismo de reacción [20, 21], las principales etapas involucradas son, la disociación del protón en el ácido carboxílico y la adsorción sobre el metal; adsorción de los carbonos α y β e interacción del oxígeno excedente de electrones con el metal; ruptura de los carbonos α y β metal; desorción del CO2 e hidrogenación del carbono β y desorción del hidrocarburo.
4. Conclusiones
El tratamiento sucesivo con NaOH-HCl generó mesoporos en la estructura de la zeolita ZSM-22 con mínima pérdida de la cristalinidad como lo muestran los difractogramas de rayos X y las micrografías de microscopia electrónica de transmisión. Al incorporarse en la matriz de alúmina la zeolita no perdió sus propiedades de acuerdo a la espectroscopía de infrarrojo. La impregnación de las diferentes cargas de níquel no genera cambios considerables en la estructura del soporte. La presencia de níquel solamente se detectó a carga de 7.5 % en peso en la microscopia electrónica de transmisión, pero no en la difracción rayos X, indicando una buena dispersión de los cúmulos de níquel y mayormente distribuido en la estructura de la zeolita y no en la alúmina. Con respecto a la actividad catalítica en la hidrodesoxigenación del ácido oleico, altas cargas de Ni promueven la hidrogenación del doble enlace del ácido oleico produciendo ácido esteárico, y solamente a bajas cargas, 2.5 % en peso de Ni, se mueve la selectividad hacia la reacción de hidrodesoxigenación para dar heptadecano como principal producto de reacción.











 text new page (beta)
text new page (beta)






