Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Superficies y vacío
Print version ISSN 1665-3521
Superf. vacío vol.25 n.3 Ciudad de México Sep. 2012
Cinética de adsorción de Propano y Propileno en zeolita 5A-K. Adsorción irreversible inusual de Propileno
Patiño-Iglesias M. E.
Instituto de Ciencias, Benemérita Universidad Autónoma de Puebla Blvd. 14 Sur y Blvd. Valsequillo, Ciudad Universitaria, Edificio 103 D CP 72570 Puebla, Puebla; México. Correspondencia: meptigl@yahoo.com
Aguilar-Armenta G.
Centro de Investigación, Facultad de Ciencias Químicas, Benemérita Universidad Autónoma de Puebla Blvd. 14 Sur y Av. San Claudio, Ciudad Universitaria CP 72570 Puebla, Puebla; México.
Recibido: 17 de diciembre de 2011
Aceptado: 12 de abril de 2012
Resumen
El presente estudio reveló algunos resultados muy interesantes en lo que se refiere a las interacciones colaterales molécula-molécula de la olefina adsorbida en el sólido, estableciéndose que en condiciones subcríticas de temperatura, las propias moléculas de propileno (C3H6), adsorbidas irreversiblemente, juegan el papel de centros activos para la adsorción subsiguiente. La medición de la cinética de adsorción de los hidrocarburos puros se realizó a distintas temperaturas en un sistema volumétrico de alto vacío. Se observó que en la muestra 5A-K, el proceso de la adsorción de C3H6 es de tipo activado, mientras que la cantidad adsorbida de propano (C3H8) es muy baja y totalmente reversible. Con base en los resultados obtenidos se supone que la muestra 5A-K puede ser un excelente adsorbente para la separación de mezclas C3H6/C3H8 a la temperatura de 150° C.
Palabras clave: Propano; Propileno; Zeolita; Adsorción activada; Adsorción reversible; Adsorción irreversible.
Abstract
This study reveals some interesting interactions among olefin-olefin molecules adsorbed onto the solid 5A-K at temperatures below the critic temperature. The irreversible adsorbed propylene molecules act as "active sites" for a second adsorption. The kinetic measurements of pure hydrocarbons were carried out at different temperatures using a glass high vacuum volumetric system. It was found that the adsorption process for propylene was of the activated type, whereas the adsorption uptake for propane was low and completely reversible. The obtained results allow the assumption that the 5A-K sample could be an excellent adsorbent for the separation of C3H6/C3H8 mixtures at 150° C.
Keywords: Propane; Propylene; Zeolite; Activated adsorption; Reversible adsorption; Adsorption irreversible.
1. Introducción
Actualmente, la separación de mezclas de olefinas y parafinas ligeras (propano-propileno y etano-etileno) se llevan a cabo por el método de destilación criogénica (-30 °C) y debido a que sus volatilidades relativas son demasiado bajas, los costos de producción son muy altos. Uno de los métodos alternativos más prometedores es el método de la adsorción selectiva de la olefina en adsorbentes modificados químicamente. Sin embargo, es posible también preparar adsorbentes que lleven a cabo esa separación por el mecanismo cinético o estérico[1]. El estudio de la adsorción de los hidrocarburos puros en adsorbentes microporosos, como las zeolitas, pueden proporcionar información muy valiosa sobre el comportamiento que estos hidrocarburos tendrían cuando se encuentren en forma de mezclas. Peterson y col. [2] informan que el propileno en la zeolita 5A se adsorbe selectivamente, propiedad que puede ser utilizada para la recuperación de esta olefina en flujos de mezclas con propano. En el trabajo [3] se informa que las mezclas de propileno-propano y etileno-etano pueden ser separadas en adsorbentes preparados por dispersión de AgNO3 sobre γ-Al2O3, SiO2 y MCM-41. En un trabajo previo nuestro, se estableció que una erionita natural intercambiada con Ag+ [4] podría ser un adsorbente efectivo para la separación de mezclas de propileno y propano a temperaturas comprendidas en el intervalo 50-80 °C y tiempos de contacto < 30 s.
En virtud de que no hemos encontrado trabajos publicados sobre la adsorción de estos hidrocarburos en zeolitas sintéticas intercambiadas con K+, nosotros consideramos interesante introducir, por intercambio iónico, cationes K+ en una zeolita 5A comercial (SUPELCO) y medir el comportamiento cinético de la adsorción de propileno y propano en dos muestras: 5A-K(1) y 5A-K(2). La modificación de la estructura microporosa de la zeolita sintética 5A con K+ podría, en principio, favorecer la separación de estos gases provocada por las interacciones específicas de la doble ligadura de la olefina con los cationes estructurales del material zeolítico, conocidas por el término en inglés de ϖ-complexation, así como podría provocar la aparición de los efectos estérico y/o cinético.
El presente estudio reveló algunos resultados muy interesantes en lo que se refiere a las interacciones colaterales molécula-molécula de la olefina en el sólido microporoso, estableciéndose que en condiciones subcríticas de temperatura, en particular a 20 °C, las propias moléculas de propileno adsorbidas irreversiblemente, juegan el papel de "centros activos" para la adsorción subsiguiente.
2. Experimental
La modificación química de zeolita 5A con K+ se llevó a cabo a presión atmosférica, colocando un 1 gramo de adsorbente 5A en una columna de vidrio y haciendo pasar a través de esta 250 ml de solución acuosa de KCl a la concentración de 0.1 N; de esta manera se obtuvo la muestra denominada 5A-K(1). La preparación de la muestra 5A-K(2) se realizó con 250 ml de KCl 0.05 N por 1 gramo de adsorbente. Posteriormente, la muestra se secó a temperatura ambiente. La medición de la cinética de adsorción de los hidrocarburos puros se realizó, a distintas temperaturas, en un sistema volumétrico de alto vacío, construido totalmente en vidrio Pyrex y equipado con válvulas libres de grasa. En todos los experimentos, la presión inicial Pin fue igual a 600 mb = 450 Torr. Las muestras se activaron a 350 °C al alto vacío: 1x10-4 Torr, la siguiente etapa fue ajustar el sistema a una determinada temperatura para llevar a cabo la medición de la curva cinética de la adsorción total (primera serie). La curva cinética de la adsorción reversible fue evaluada de la siguiente manera: una vez concluida la medición de la curva cinética de la adsorción total, el adsorbente fue sometido a evacuación a esa misma temperatura durante 3 h, repitiendo la medición de la curva cinética (segunda serie) en las mismas condiciones en que fue medida la curva cinética de la adsorción total. Con la finalidad de verificar la reproducibilidad de la adsorción reversible, posteriormente se vuelve a evacuar el adsorbente y se hace una tercera serie de medición. Si la primera curva cinética de la adsorción reversible (segunda serie) coincide con la segunda curva cinética de la adsorción reversible (tercera serie), se puede asegurar que la cantidad de sustancia adsorbida irreversiblemente permanece constante. Por último, la adsorción irreversible fue evaluada por la diferencia entre la cantidad total adsorbida (reversible + irreversible) y la cantidad adsorbida reversiblemente a una determinada temperatura.
3. Resultados y discusión
3.1. Propileno
En la Figura 1 se presentan las curvas cinéticas de la adsorción total (Tot. C3H6) y reversible (Rev. C3H6) en la muestra 5A-K(1) a 20 °C. El comportamiento de la adsorción reversible, a tiempos bajos de contacto, es muy interesante, porque es totalmente contrario al usualmente observado. Lo lógico hubiera sido que se observara, como en el caso de la zeolita original 5A, una disminución de la adsorción reversible comparada con la adsorción total, debido a la ocupación de determinados centros activos por las moléculas adsorbidas irreversiblemente. La Figura 1 muestra que la adsorción reversible aumentó después de haber quedado moléculas adsorbidas irreversiblemente. Sin embargo, a tiempos mayores a 1500 s (Figura 2) se observa lo esperado: adsorción total > adsorción reversible. Es decir, si se hubiera medido la adsorción en el estado de equilibrio (isotermas de adsorción) este fenómeno inusual no hubiera sido observado.


Con el fin de verificar la reproducibilidad de este resultado, las mediciones se repitieron dos veces con otras muestras de zeolita del mismo lote, obteniéndose resultados similares a los ya descritos. El comportamiento inusual de la adsorción reversible se observó también a 65 y 110 °C y desaparece a 150 °C.
Por otro lado, se comprobó también la reproducibilidad de la propia curva cinética de la adsorción reversible como se indicó en la parte experimental. Los resultados obtenidos revelaron que la segunda curva cinética de la adsorción reversible: Rev. (2), coincide con la primera: Rev. (1); como ejemplo véase la Figura 3 a 65 °C. Esto significa que la cantidad adsorbida irreversiblemente de C3H6 permaneció constante después de la primera curva cinética de la adsorción reversible, lo cual significa que no hubo una adsorción irreversible adicional.

La Figura 4 compara el comportamiento cinético de las muestras 5A-K(1) y 5A-K(2) a 20 °C, las cuales tienen distinta concentración de K+ (Tabla 1). Se observa que la adsorción total para estas muestras alcanza a sus correspondientes curvas de la adsorción reversible en los tiempos de ≈ 1500 s y 350 s, respectivamente. Estos resultados revelan una clara tendencia: mayor contenido de K+, más evidente es la manifestación de este efecto inusual. Este fenómeno puede obedecer a que como resultado de la quimisorción de C3H6 se forma un "complejo de adsorción" superficial, el cual a su vez puede modificar el campo eléctrico creado por los cationes vecinos, aumentando las interacciones adsorbato-adsorbato en las cercanías a este complejo. Es interesante que a 150 °C este fenómeno no se haya detectado, probablemente porque el "complejo de adsorción" no se formó a esta temperatura.


3.2. Propileno a distintas temperaturas
La Figura 5 muestra a diferentes temperaturas que el proceso de la cinética de adsorción de C3H6 en 5A-K(1) es de tipo activado, ya que la cantidad de sustancia adsorbida se incrementa al aumentar la temperatura. En el estado de equilibrio, como se esperaba, la cantidad de sustancia adsorbida disminuyó con el aumento de la temperatura (Figura 5a).


De acuerdo con los resultados obtenidos en la cinética de adsorción de C3H6 en 5A-K(1), se observó que a tiempos de contacto olefina-adsorbente en el intervalo de 1000-5000 s, los puntos experimentales a la temperatura de 20 °C alcanzan a distintos tiempos a las curvas de 65, 110 y 150 °C. La Figura 5b ilustra ese tiempo necesario en función de la temperatura para que la cantidad adsorbida de C3H6 a 20 °C cruce a la adsorción medida a temperaturas superiores. Del gráfico se observa claramente un comportamiento exponencial del tiempo con respecto a la temperatura, por lo tanto, el valor de la Ea puede determinarse mediante la siguiente ecuación:


La Figura 5c muestra una dependencia lineal de los datos de la figura 5b graficados en las coordenadas ln t = f(T-1). De tal forma que el valor de la Ea del proceso de adsorción de C3H6 en 5A-K(1), calculado a partir de la pendiente de la recta, es de 18 kJ/mol.

3.3. Propileno-Propano
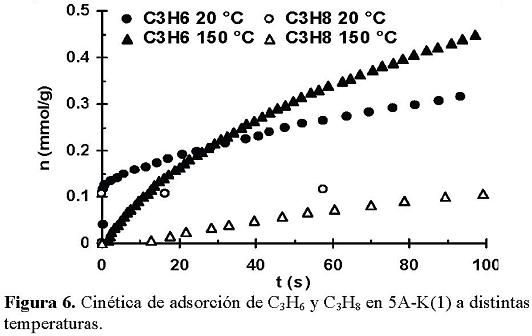
En la Figura 6 se observa que la muestra 5A-K(1) a diferentes temperaturas presenta una baja capacidad de adsorber C3H8 a diferencia de los resultados obtenidos para el C3H6. Por otro lado, también se puede ver una diferencia mayor entre las curvas cinéticas de adsorción de ambos hidrocarburos a la temperatura de 150 °C, que la observada a 20 °C. Cabe mencionar que lo poco que se adsorbe de C3H8 lo hace en forma totalmente reversible.
4. Conclusiones
El estudio cinético de la adsorción de propileno reveló que la adsorción reversible en 5A-K, a bajos tiempos de contacto, es mayor que la adsorción total. Este efecto inusual, en el caso de que exista adsorción irreversible, está relacionado con el grado de intercambio de Ca+2 por K+: mayor contenido de K+, más evidente es este efecto. A tiempos de contacto suficientemente altos y en el equilibrio, se observó el comportamiento común, es decir, mayor adsorción total que adsorción reversible. A pesar de que la zeolita 5A, así como sus diferentes formas intercambiadas parcial o totalmente con Na+ y K+, ha sido objeto de muchos estudios para su aplicación en distintos procesos de importancia industrial, los resultados aquí presentados son de mucho interés, ya que por primera vez se informa sobre el comportamiento cinético inusual del proceso de adsorción del propileno en muestras de zeolita 5A parcialmente intercambiada con K+ a bajos tiempos de contacto adsorbente-adsorbato. Fue establecido que el proceso de la adsorción total de propileno es de tipo activado y que a 150 °C la adsorción irreversible es despreciable. Por otro lado, se observó baja capacidad de la muestra de adsorber propano y, además, lo poco que se adsorbe lo hace en forma totalmente reversible. Con base en los resultados obtenidos se puede suponer, que la muestra 5A-K puede ser un excelente adsorbente para la separación de mezclas C3H6/C3H8 a la temperatura de 150 °C.
Agradecimientos
Los autores agradecen al Consejo Nacional de Ciencia y Tecnología (CONACyT) el apoyo financiero otorgado a María Eugenia Patiño Iglesias.
Referencias
[1]. R.T. Yang, Gas Separation by Adsorption Processes, College Press and World Scientific Publishers: River Edge, N. J.. 1, Chapter 1, (1997). [ Links ]
[2]. D. L. Peterson; F. Helfferich; R. K. Griep Proc.-Soc. Chem. Ind., Chem. Eng. Group J. Org. Chem., 217 (1968). [ Links ]
[3]. J. Padin; R. T. Yang Chem. Eng. Sci., 55, 2607 (2000). [ Links ]
[4]. G. Aguilar-Armenta; M. E. Patiño Iglesias, Langmuir, 18, 7456 (2002). [ Links ]














