Introducción
El aguacate (Persea americana Mill) variedad Hass, es uno de los productos más exitosos de la exportación agroalimentaria en México. En los últimos años la demanda mundial de este fruto se incrementado considerablemente (SIAP, 2021). Los frutos de aguacate son susceptibles a enfermedades postcosecha como la antracnosis y a la pudrición peduncular causada por varias especies de hongos incluyendo a Neofusicoccum parvum, Colletotrichum gloeosporioides Diaporthe sp. y Phomopsis perseae (Hartill y Everett, 2002; Santos et al., 2011; Twizeyimana et al., 2013). Las enfermedades de los frutos en postcosecha se manifiestan principalmente durante el proceso de maduración y se potencian debido a los daños mecánicos, desórdenes fisiológicos, temperatura inadecuada de almacenamiento, largos periodos de refrigeración, época de cosecha y edad del fruto, entre otros (Arpaia et al., 2018; Bowen et al., 2018).
La antracnosis es la fuente principal de pérdidas pre y postcosecha ya que ocasiona una reducción en la calidad y cantidad de los productos, y ocurre en la mayoría de las zonas productoras de aguacate del mundo (Silva-Rojas y Ávila-Quezada, 2011). Las pérdidas pueden llegar hasta el 100 % dependiendo del patógeno y las condiciones climáticas (Landero-Valenzuela et al., 2016). El principal método se basa en la aplicación de fungicidas químicos no biodegradables (Everett et al., 2011). Sin embargo, el empleo excesivo de plaguicidas sintéticos está ocasionando daños en la salud humana, el medio ambiente, la biodiversidad y la seguridad alimentaria, lo que ha provocado un rechazo generalizado hacia el control químico de plagas en la producción agrícola (Kniss y Coburn, 2015; Sarwar, 2015; Ibrahim, 2016). Esta problemática ha conducido a la búsqueda de nuevas alternativas para el manejo de enfermedades de plantas, que sean ecológicas y económicamente viables (Rios et al., 2016), y con ello, reducir el impacto negativo de los agroquímicos al medio ambiente (Companioni et al., 2019).
El control biológico de enfermedades de plantas, incluyendo patógenos fúngicos, ha sido considerado como un método alternativo viable para el control químico (Heydari y Pessarakli, 2010). En este sentido, varias especies del género Trichoderma son utilizadas como agentes de control biológico, debido a su adaptabilidad a diversas condiciones ecológicas (Druzhinina et al., 2011), así como a su habilidad antagónica, conocida como hiperparasitismo necrotrófico o micoparasitismo contra fitopatógenos (Kubicek et al., 2011). Además de los efectos beneficiosos que ocurren en las interacciones con agentes patógenos, especies de Trichoderma spp. presentan un efecto positivo en plantas mejorando sus propiedades como la biomasa, rendimiento y calidad, en la mayor parte de cultivos agrícolas en donde se utilizan (Mesa-Vanegas et al., 2019). Por otro lado, las especies del género Trichoderma muestran un alto nivel de diversidad genética y pueden ser utilizadas para producir una amplia gama de productos de interés comercial y ecológico (Lorito et al., 2010).
Por todo lo anterior, el objetivo de esta investigación fue caracterizar e identificar cepas de Trichoderma aisladas directamente del cultivo de aguacate en huertos comerciales en la localidad de Tanaxuri, Michoacán, así como determinar su efectividad en el control biológico de hongos causantes de pudriciones postcosecha de aguacate.
Materiales y métodos
Material vegetal y fitopatógenos
Se usaron frutos de aguacate Hass cosechados en estado de madurez fisiológica (21.5 % de materia seca, de acuerdo con los límites establecidos de la Norma Mexicana NMX-FF-016-SCFI-2006) en el año 2018 obtenidos del huerto orgánico Negrete, ubicado en la localidad de Tanaxuri, Michoacán (Latitud 19° 25’ 2’’ Norte, Longitud 102° 3’ 0’’ Oeste). Los fitopatógenos utilizados en la presente investigación (Neofusicoccum parvum, Colletotrichum gloeosporioides, Diaporthe sp. y Phomopsis perseae), fueron obtenidos del cepario del laboratorio de Fitopatología de la Facultad de Agrobiología de la Universidad Michoacana de San Nicolás de Hidalgo campus Uruapan Michoacán; aislados a partir de frutos de aguacate postcosecha colectados en huertos aguacateros en Uruapan Michoacán.
Aislamiento de cepas de Trichoderma
El aislamiento de cepas se realizó de acuerdo con la metodología propuesta por Ceja-Torres et al. (2000). Se colectaron muestras de 150 g de suelo y raíz (tomando de los primeros 15 cm de profundidad). De las raíces se realizaron cortes de 1 cm2 y, se desinfestaron con un lavado con hipoclorito de sodio al 2 % por 3 min, posteriormente los cortes se lavaron dos veces con agua destilada estéril agitando hasta lograr una mezcla homogénea y se colocaron en cajas petri con agar papa dextrosa (PDA, por sus siglas en inglés, BD Bioxon) suplementado con 0.025 mg/mL de cloranfenicol (Sigma) y se incubaron a 28 ºC durante 2 a 4 días. Los crecimientos obtenidos se transfirieron en nuevas cajas Petri con medio PDA, utilizando un asa de platino, posteriormente, se realizó el aislamiento de colonias individuales a través de cultivos monospóricos. Para los aislamientos a partir de muestras de suelo, se pesaron 10 g y se suspendieron en 90 mL de agua destilada estéril. Finalmente, se efectuaron diluciones seriadas hasta obtener una concentración de 1 x 103 conidios por mL. Se tomaron 20 μL de la dilución y se sembraron en cajas de Petri con medio PDA con 0.025 mg/ mL de cloranfenicol. Para asegurar la autenticidad y pureza de las cepas obtenidas, se realizaron cultivos monoconidiales como indica Samuels et al. (2006).
Caracterización e identificación de las cepas aisladas de Trichoderma
Caracterización morfológica. Tradicionalmente se examinaron i) características macroscópicas de la colonia (crecimiento radial, color del micelio, presencia de pigmentos difusibles, anillos concéntricos), y ii) características microscópicas (forma y tamaño de conidióforos, fialides, conidios y clamidosporas), basadas en Samuels et al. (2002 y 2012).
Identificación molecular. La identificación molecular se basó en la amplificación por PCR de fragmentos de la región del ADN (regiones ITS) y del factor de elongación 1-alfa (Tef 1-α). La extracción del ADN genómico se realizó empleando el protocolo descrito por Cenis (1992) . Para la amplificación por PCR se utilizaron los oligonucleótidos reportados por Chakraborty et al. (2010) para la región del ADNr [ITS1 (5´-TCCGTAGGTGAACCTGCGG-3´) e ITS4 (5´-TCCTCCGCTTATTGATATGC-3´)], y los reportados por Komon-Zelazowska et al. (2007) para el gen Tef 1-α [tef 728f (5´-CATCGAGAAGTTCGAGAAGG-3´) y tef 1R (5´-GCCATCCTT-GGGAGATACCAGC-3´)]. En cada reacción de PCR se utilizaron 20 ng de ADN, buffer 1 X, 3 mM de MgCl2, 0.2 mM de dNTPs, 0.6 µM de cada iniciador, 0.2 U de Taq polimerasa (Platinum® Taq DNA polymerase, Invitrogen), para un volumen final de 20 µL. Las condiciones de amplificación para ambos fragmentos incluyeron una desnaturalización inicial a 95 °C por 5 min, seguida de 35 ciclos a 94 °C por 1 min, 55 °C por 2 min, 72 °C por 1 min, y una extensión final a 72 °C por 10 min. Los fragmentos de ADN amplificados se recuperaron por electroforesis en gel agarosa al 2 %, teñido con bromuro de etidio y visualizado en transiluminador (marca: Labnet; modelo: TM-26) posteriormente los fragmentos se purificaron utilizando el kit “PureLinkTM Quick Gel Extraction and PCR Purification” (Invitrogen). Se obtuvo la secuencia en ambas direcciones de los fragmentos purificados (Laboratorio LANGEBIO - CINVES-TAV Irapuato, Gto.) y las secuencias se compararon, con las secuencias nucleotídicas de hongos de la base de datos del National Center Biotechnology Information (NCBI) empleando la herramienta BLASTN (http://www.ncbi.nlm.nih.gov/BLAST).
Evaluación in vitro de la capacidad antagónica de Trichoderma
Para conocer la capacidad de inhibición las cepas de Trichoderma sobre los hongos fitopatógenos empleados, se realizaron pruebas de confrontación, usando el protocolo descrito por Ibarra-Medina et al. (2010) con ligeras modificaciones. Se activaron las cepas monoconidiales a 28 °C durante 96 h en medio PDA. Para la confrontación, se colocaron discos de micelio de (5 mm de diámetro) de Trichoderma creciendo en PDA en un extremo de una caja de Petri y del hongo fitopatógeno en el extremo opuesto. Posteriormente, se incubaron a 28 ºC durante 7 días. Los ensayos se realizaron por triplicado. Se tomaron lecturas cada 12 h para determinar el número de horas al primer contacto entre las hifas del antagonista y el fitopatógeno, así como el comportamiento en general. Se midió el crecimiento de ambas colonias (cm) y se evaluó el porcentaje de inhibición del crecimiento micelial radial (ICR), basándose en la siguiente fórmula:
Donde: CREC= crecimiento radial de la cepa antagonista (cm), 6.5 = distancia en cm entre los puntos de siembra de las cepas de Trichoderma y el fitopatógeno.
Evaluación in vivo de la capacidad antagónica de Trichoderma harzianum (TSONM6)
Con el fin de realizar estudios de inhibición en el fruto de aguacate, se obtuvieron los conidios de la cepa que presentó mayor capacidad in vitro e identificada molecularmente T. harzianum y se procedió de acuerdo a la metodología propuesta por Ibarra-Medina et al. (2010) . Se cultivó T. harzianum en medio PDA a 28 ºC por siete días y se verificó la producción de conidios. Posteriormente, a la placa de Petri se le añadieron 10 mL de tween 80 estéril a una concentración al 0.1 % y se estrió con una espátula de Drigalsky para la recuperación de los conidios. Seguido de esto, se filtró la suspensión de conidios, recuperándose en un matraz Erlenmeyer de 50 mL, a través de una fibra de poliéster para eliminar restos de micelio. Los conidios se contabilizaron en cámara Neubauer y se mantuvieron en tween 80 a una concentración de 0.01 % a 4 ºC hasta su uso. Los hongos fitopatógenos se cultivaron en PDA, a 25 ºC por 7 días.
Posteriormente, para realizar el ensayo in vivo (frutos) se siguió el protocolo descrito por Janisewicz et al. (1988) , con algunas modificaciones. En condiciones controladas y en frutos uniformes en cuanto a tamaño y madurez fisiológica, se llevó acabo la inoculación de una concentración de 1 x 106 conidios por mL de T. harzianum en el área peduncular del fruto de aguacate con madurez fisiológica, previamente desinfestado (por inmersión en una solución de hipoclorito de sodio al 2 % durante 3 min, se enjuagaron con agua destilada estéril y se secaron por escurrimiento). Se realizó la inoculación de cada uno de los fitopatógenos colocando un disco de PDA de 5 mm con crecimiento activo en la misma zona en donde se inocularon los conodios de Trichoderma. Posteriormente, se incubaron por 7 días a 18 ± 2 °C a 95 % de humedad relativa. El experimento se dividió en cuatro grupos por triplicado. Tratamiento 1: Testigo (conidos de T. harzianum); Tratamiento 2: Testigo del fitopatógeno (disco de PDA con micelio de fitopatógeno); Tratamiento 3: Confrontación (conidios de T. harzianum más disco de PDA con micelio de fitopatógeno) y Tratamiento 4: Agua destilada estéril.
Al concluir el periodo de incubación se evaluó el efecto de los inóculos en las áreas pedunculares a través de la comparación de cortes longitudinales en los frutos y se determinó el porcentaje de daños basados en escalas de pudriciones de pedúnculo y cuerpo del fruto (Figura 1; Ochoa, 2014). Todos los experimentos se llevaron a cabo por triplicado.
Figura 1 Escala de porcentaje de pudrición del cuerpo del fruto (A) y del pedúnculo (B) del fruto de aguacate. Imagen adaptada del compilado de la guía realizada por Ochoa (2014) .
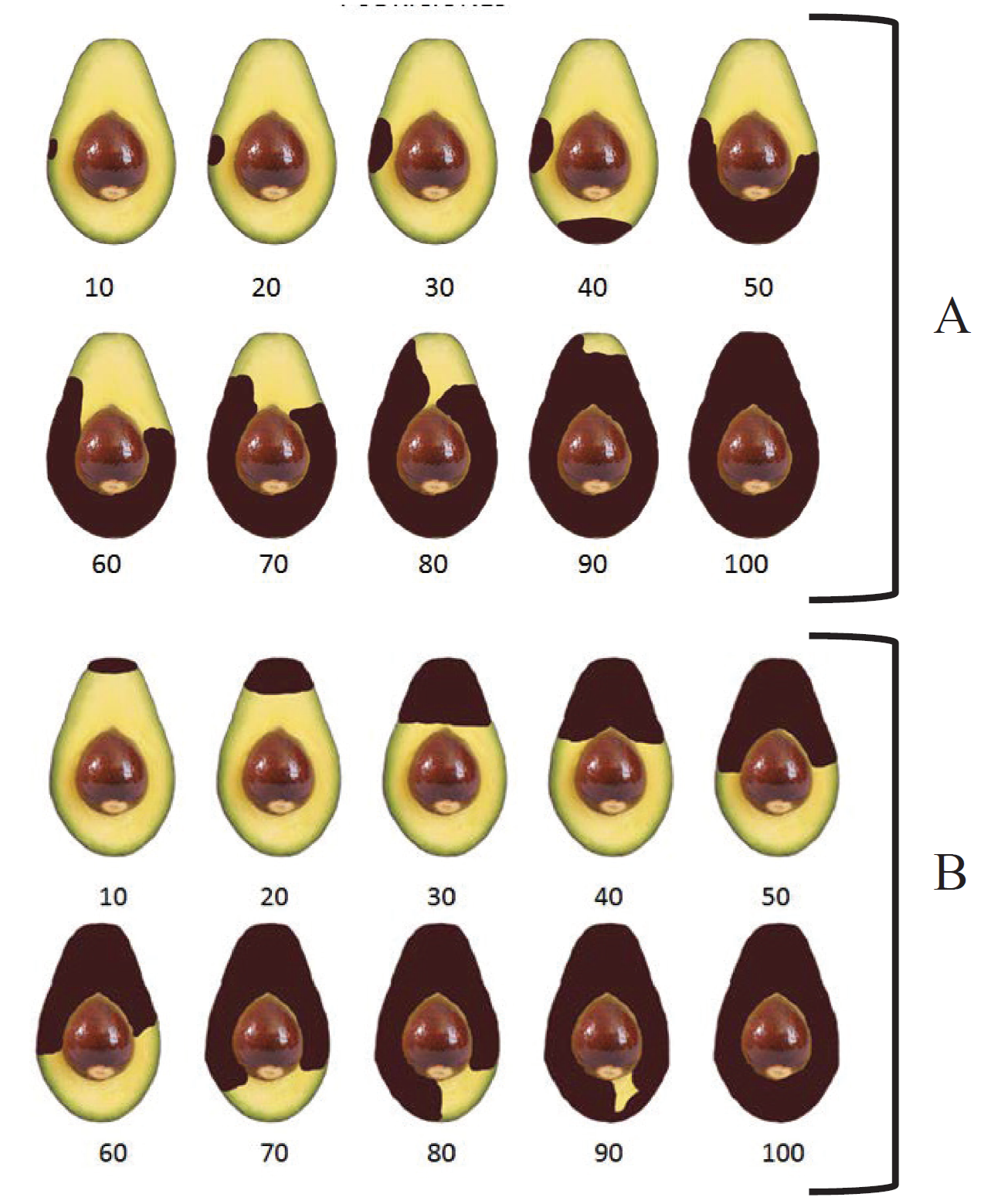
Figure 1. Rottage percentage scale of fruit body (A) and peduncle (B) of avocado fruit. Image adapted from the compilation of the guide made by Ochoa (2014) .
Análisis estadístico
Se llevó a cabo un diseño factorial. Los datos fueron sometidos al análisis de varianza (ANOVA), seguidos de la prueba de la mínima diferencia significativa (LSD) con un nivel de confianza del 95 %, usando el programa Statgraphics Centurion XVI (StatPoint Technologies, Inc., Warrenton, VA, USA). Todos los experimentos se llevaron a cabo por triplicado.
Resultados
Aislamiento e identificación de las cepas de Trichoderma
Se obtuvieron seis aislamientos de cepas nativas de suelo y raíz, de acuerdo con las características morfológicas (micro y macroscópicas) se identificaron como de Trichoderma sp. (Tabla 1). Se analizaron los conidios, fiálides, hifas y conidióforos presentes en el soma vegetativo. De acuerdo con la velocidad de crecimiento observada en cada aislado, se seleccionó la cepa TSONM6, para ser identificada molecularmente y utilizada en el ensayo in vivo. Al efectuar el análisis de la secuencia, se identificó como Trichoderma harzianum, mostrando un amplicón de 600 pb para ambos fragmentos, evidenciando una identidad del 99.59 y 96.43 % con ambos marcadores (ITS y gen Tef 1-α, respectivamente) (Tabla 2).
Table 1 Isolation and identification of native Trichoderma strains from Tanaxuri, Michoacán.
| Código | Material | Cepa identificada | Características microscópicas | Características microscópicas |
|---|---|---|---|---|
| TSONM1 | Suelo | Trichoderma spp. | Forma y color de la hifa fungica tipica, fialide (largas, delgadas, solitarias a lo largo del eje, asimetricas), forma y color de los conidioforos (diversas ramificaciones con aspecto piramidal), forma y color de los conidios (citriformes y subglobosos) y clamidosporas de forma individual. | Velocidad de crecimiento rapido, color del micelio que es eventualmente blanco y se torna verde intenso y abundante, con la formacion de masas conidiales en anillos concentricos. |
| TRONM2 | Raíz | Trichoderma spp. | ||
| TSONM3 | Suelo | Trichoderma spp. | ||
| TSONM4 | Suelo | Trichoderma spp. | ||
| TSONM5 | Suelo | Trichoderma spp. | ||
| TSONM6 | Suelo | Trichoderma harzianum* |
*Caracterizado molecularmente.
Evaluación in vitro de la capacidad antagónica de las cepas de Trichoderma
Los aislados de Trichoderma TSONM1, TRONM2, TSONM3, TSONM4, TSONM5 y T. harzianum presentaron diferentes niveles de actividad antagónica contra los fitopatógenos ensayados (N. parvum, C. gloeosporioides, Diaporthe sp. y P. perseae). La confrontación, permitió evidenciar a la cepa de T. harzianum con mayor capacidad antagónica frente a N. Parvum con 88.8 % de inhibición, misma que fue estadísticamente significativa al igual que la cepa TSONM3 Y TSONM5. Por otro lado, el resto de las cepas se mantuvieron en el rango del 73.8 al 77.2 % (Tabla 3), no observándose diferencias significativas entre ellas.
Table 3. Trichoderma strains in vitro inhibition percentage against phytopathogens.
| Cepa aislada | Porcentaje de inhibición | |||
|---|---|---|---|---|
| Neofusicoccum parvum | Colletotrichum gloeosporioides | Diaporthe sp. | Phomopsis perseae | |
| TSONM1 | 76.6 ± 1.6b | 75.0 ± 0.0a | 77.2 ± 2.5ab | 80.0 ± 2.9ab |
| TRONM2 | 73.8 ± 3.4b | 75.0 ± 0.0a | 75.5 ± 1.0b | 77.7 ± 2.5b |
| TSONM3 | 78.8 ± 4.2ab | 75.0 ± 0.0a | 78.3 ± 1.7ab | 84.4 ± 1.9a |
| TSONM4 | 75.0 ± 0.0b | 71.1 ± 1.0b | 76.1 ± 3.8b | 81.1 ± 2.5ab |
| TSONM5 | 77.2 ± 8.6ab | 72.7 ± 1.9ab | 80.0 ± 4.4ab | 83.3 ± 5.0ab |
| TSONM6 (Trichoderma harzianum) | 88.8 ± 5.4a | 73.8 ± 1.9ab | 82.2 ± 3.8a | 82.2 ± 5.4ab |
Letras diferentes en la misma columna indican diferencias significativas (p < 0.05).
En la confrontación de las cepas aisladas contra C. gloeosporioides (Tabla 3), se determinó que las cepas de mayor actividad antagónica fueron TSONM1, TRONM2 y TSONM3 con 75.0 % de inhibición, no mostrando diferencias significativas entre ellas al igual que las cepas TSONM5 y T. harzianum que formaron el mismo grupo pero que presentaron un 72.7 y 73.8 % de inhibición, respectivamente. En tanto a las cepas que dieron mayor inhibición en la confrontación de Diaporthe sp. (Tabla 3) fue T. harzianum con un 82.2 %, y de acuerdo al análisis estadístico fueron estadísticamente similares a las cepas TSONM1, TSONM3 y la TSONM5 al no mostrar diferencias significativas. Por último, en la confrontación con P. perseae (Tabla 3), las cepas TSONM1, TSONM3, TSONM4, TSONM5 y T. harzianum fueron estadísticamente iguales en cuanto a su actividad de inhibición, presentando porcentajes de inhibición entre 80.0 - 84.4 %. Se encontró que todas las cepas nativas de Trichoderma fueron efectivas al controlar a los cuatro hongos fitopatógenos. Sin embargo, es importante destacar que la cepa de T. harzianum mostró actividades de inhibición superiores al 80 % contra N. parvum, Diaporthe sp. y P. perseae, aunado a esto, al ser la cepa que se caracterizó molecularmente, se seleccionó para continuar con los estudios in vivo en el fruto de aguacate.
Evaluación in vivo de la capacidad antagónica de Trichoderma harzianum (TSONM6)
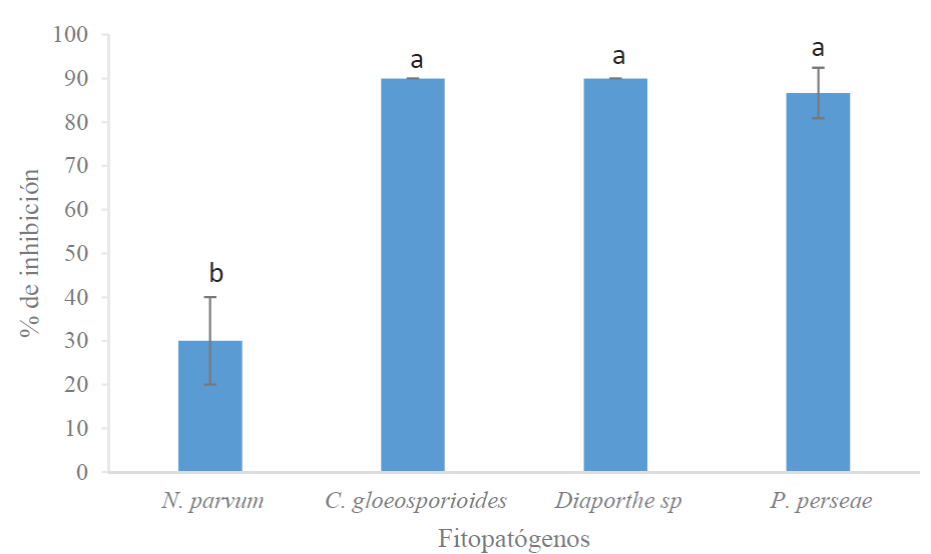
De acuerdo a la escala de porcentaje de pudrición del cuerpo del fruto y del pedúnculo del fruto de aguacate (Figura 1). Los hongos fitopatógenos mejor inhibidos por la cepa antagónica de T. harzianum a siete días de incubación fueron C. gloeosporioides, Diaporthe sp. y P. persea con aproximadamente 90 % de inhibición, no habiendo diferencia significativa entre ellos (p > 0.05) (Figura 2). La cepa de T. harzianum mostró menor eficiencia para inhibir a N. parvum cuyo porcentaje de inhibición fue de 30 %. Por otro lado, al comprobar el comportamiento de la cepa de T. harzianum y los fitopatógenos en frutos de aguacate, se demostró que N. parvum y P. perseae presentaron mayor agresividad en la forma de colonizar la pulpa en los frutos con pudrición de 83.3 y 66.7 %, respectivamente (Figura 3), y en menor medida C. gloeosporioides y Diaporthe sp. mostraron entre un 30 y 23.3% de pudrición, respectivamente (Figura 3). Por el contrario, en los frutos testigos en el cual se inoculó la cepa de T. harzianum, no se desarrollaron síntomas de pudrición.
Discusión
Aislamientos de Trichoderma
El aislamiento del género Trichoderma obtenido de los sitios de interés para este estudio, prevaleció en suelo como material de procedencia. Al igual que en el estudio de Zafari et al. (2013) , se aislaron cepas de Trichoderma lo cual sugiere que hay un amplio dominio de este género sin importar el cultivo ni las condiciones bióticas y abióticas. Trichoderma es fácilmente aislado del suelo por métodos convencionales, en gran parte debido a su rápido crecimiento, abundante conidiación, formación de clamidosporas y colonización de sustratos orgánicos, lo que facilita un rápido desarrollo en varios sustratos (Gupta et al., 2014). Sin embargo, el aislamiento de Trichoderma, puede deberse a varios factores limitantes, por lo que se puede atribuir a la época de invierno en que se efectuaron los muestreos, los cuales se caracterizan por temperaturas bajas y humedades relativas altas. Sin embargo, Trichoderma puede ser afectado por la interacción con diversos factores bióticos y abióticos (actividad de agua, temperatura, oxigenación y pH), mismos que comprometen su desempeño como biocontrolador (Santamarina et al., 2006; Martínez et al., 2013). Aunado a lo anterior, la cantidad de materia orgánica, así como las condiciones climáticas, edáficas y geográficas que se tienen en la región de Michoacán, pueden afectar el desarrollo y desempeño de Trichoderma. Wang et al. (2016) , mencionan que la ocurrencia de la especie de Trichoderma es modulada por varios factores incluyendo microclima, la disponibilidad de sustratos, así como también interacciones de complejos ecológicos.
Identificación de las cepas aisladas de Trichoderma
Aunque los microorganismos pueden ser identificados basados en sus caracteres morfológicos, las técnicas moleculares son hoy en día, más ampliamente utilizadas, y en general, son herramientas más aceptadas para la identificación ya que ofrecen información rápida y confiable para el estudio de identidad (Gajera y Vakharia, 2010). Las secuencias de espaciadores transcritos internos (ITS) y regiones como el factor de elongación 1-α (Tef 1-α) son las más utilizadas en la identificación, las cuales actúan como huellas dactilares en la identificación de los hongos (Fernández-Ortuño et al., 2010).
La amplificación del segmento de interés fue similar a lo obtenido por Alvarado-Marchena y Rivera-Méndez (2016) , quien aisló e identificó molecularmente cepas Trichoderma en áreas de producción de ajo y cebolla. Por la alta similitud obtenida en el alineamiento múltiple de las secuencias, se comprueba que los marcadores ITS y Tef 1-α son técnicas confiables para la identificación de Trichoderma spp. (Rios et al., 2016; Wang et al., 2016). El uso de la base de datos (Gen-Bank NBCI) demostró que, a través de la región amplificada de ADN de las cepas estudiadas, fue factible determinar la identidad que oscilaron entre 99.59 y 96.43 % con las especies identificadas como Trichoderma harzianum en la base de datos. Esta especie es usada ampliamente para el control biológico de patógenos de plantas (Steindorff et al., 2014; Troian et al., 2014).
Capacidad antagónica in vitro de las cepas de Trichoderma
El aislamiento de hongos por sí solo no es una garantía de que estos aislados sean buenos antagonistas, por lo que es necesario llevar a cabo estudios in vitro e in vivo para determinar su capacidad antagónica frente al fitopatógeno de interés (Hernández-Lauzardo et al., 2007). Además, evaluar su efectividad biológica en plantas bajo diferentes condiciones. Lo anterior, permitirá validarlos al momento de aplicarlos en ensayos en condiciones de campo (Hernández-Melchor et al., 2019). El crecimiento del antagonista de T. harzianum reflejó la habilidad de adaptarse a condiciones de crecimiento in vitro y de colonizar rápidamente un espacio determinado, resultados similares fueron obtenidos en el estudio de Singh et al. (2014) con cepas de Trichoderma spp. contra Colletotrichum falcatum Went. Lo que favoreció la inhibición del crecimiento de los hongos fitopatógenos, situación que se demostró en las primeras horas del enfrentamiento.
Krauss et al. (2010) mencionan que los bioensayos realizados con Trichoderma han sido efectivos y que, por su naturaleza, el control biológico no elimina, sino que reduce las poblaciones del patógeno y, como consecuencia, reduce la incidencia de la enfermedad. No obstante, a pesar de las potencialidades de estos antagonistas autóctonos, profundizar en el conocimiento de los mecanismos específicos a través de los cuales ejercen su acción, ayudará a mejorar su efectividad cuando sean aplicados como inoculantes microbianos (Villamil et al., 2015). Las propiedades antagónicas de Trichoderma hacia hongos patógenos se basan en la activación de múltiples mecanismos que incluyen la competencia por nutrientes y espacio, el micoparasitismo, la antibiosis, la promoción del crecimiento vegetal, e inducción de respuestas de defensa vegetal (Albes-de -Aguiar et al., 2014; Vargas-Hoyos y Gilchrist-Ramelli, 2015). La aplicación de Trichoderma es basada en el entendimiento de estos mecanismos de acción contra un largo set de bacterias y hongos, en ciertos casos infecciones virales (Keswani et al., 2014), lo que le permite ser un buen candidato para el control biológico debido a los diferentes modos de acción que tienen para inhibir el crecimiento de otros hongos.
Se ha reportado que Trichoderma excreta una variedad de metabolitos secundarios con la finalidad de inducir la comunicación molecular mediante la inducción de las señalizaciones químicas, contribuyendo al establecimiento de interacciones con otros microorganismos en diversas vías para el control de los patógenos (Keswani et al., 2014). Algunos de los metabolitos secundarios de importancia agrícola sintetizados por especies de Trichoderma se relacionan con compuestos volátiles y no volátiles con actividad antimicrobiana y defensa vegetal, destacando diterpenos tetracíclicos (harziandiona), sesquiterpenos (tricotecenos y tricodermina), y el triterpeno viridin (Zeilinger et al., 2016), que confieren sus propiedades como agente de biocontrol hacia organismos fitopatógenos (Asad et al., 2015; Chen et al., 2016).
Capacidad antagónica in vivo de Trichoderma harzianun (TSONM6)
La cualidad natural que ejercen los antagonistas sobre los diversos fitopatógenos en la actualidad a ganado utilidad, no obstante, para aplicarlos de forma exitosa es primordial discernir los diversos mecanismos de acción que presentan las cepas. Uno de los principales mecanismos es que, Trichoderma parasita las células del patógeno y degrada su pared celular, la retracción de la membrana plasmática y desorganización de citoplasma (Romero-Cortes et al., 2015), por la acción hidrolítica de enzimas como quitinasas y glucanasas; otro mecanismo reportado para este hongo es la antibiosis. Cabe mencionar que los metabolitos secundarios producidos por Trichoderma dependen del tipo de cepa y se han clasificado en tres categorías: 1) antibióticos volátiles como 6-pentil-α-pirona y aquellos derivados del isocianuro; 2) compuestos solubles en agua (ácido heptenoico) y 3) oligopéptidos ricos en ácido γ-aminobutírico (Khan et al., 2020; Thapa et al., 2020).
El daño ocasionado por los patógenos fúngicos en frutos postcosecha fue observado a diferentes grados, lo que se relaciona con una dependencia de factores extrínsecos tales como tiempo de exposición, temperatura y humedad. Aunado a estos factores se encuentra el ciclo vital propio de cada patógeno. No siempre se ha observado consistencia al extrapolar los resultados del laboratorio a condiciones in situ. Se han obtenido respuestas contradictorias cuando se trata de relacionar el daño celular en el fruto con el compuesto producido por el antagonista (Hernández-Lauzardo et al., 2007).
Domínguez-Guerrero et al. (2012) , encontraron que las diferentes especies de Colletotrichum spp. tienen gran variabilidad genética y molecular, causando que el grado de daño sea variable entre ellas. Por esta misma razón, Trinidad-Angel et al. (2017) observaron que los primeros signos de la antracnosis en la evaluación in vivo comenzaron a aparecer entre el tercer y cuarto día de incubación y el daño fue en aumento al comenzar la maduración del fruto. Lo que puede deberse a que se trata de una enfermedad latente; es decir, la infección se presenta en estados tempranos del desarrollo del fruto e incluso desde la floración, y se mantiene latente hasta que el fruto alcanza las condiciones óptimas como son la máxima producción de etileno, misma que desencadena eventos enzimáticos que estimulan el desarrollo del hongo, así como la disminución de la concentración de algunos compuestos que inhiben el desarrollo del mismo (Alarcón-Restrepo y Chavarriaga-Montoya, 2007).
Por otro lado, en este estudio se visualizó una mayor susceptibilidad a la infección por N. parvum. Ochoa (2014) menciona que, durante la maduración, los niveles de compuestos antifúngicos en el fruto declinan, lo que permite que se active el crecimiento del hongo. Las células más externas de la cutícula y de la pulpa son colonizadas, llevando el desarrollo de los síntomas. Considerando que la inoculación de fitopatógeno sobre los frutos tuvo una concentración de 1 x 106 de esporas por mL, sería importante considerar lo mencionado por Gupta et al. (2014) , donde describe que, en su mayoría, los productos comerciales del mercado se formulan con una concentración de antagonista entre 1 × 108 y 1 × 109 UFC esporas viables/gramo de producto formulado. Por lo que T. harzianum (TSONM6) podría ser una buena alternativa para el control biológico del aguacate en postcosecha.
Conclusiones
Se logró aislar e identificar a nivel género seis cepas de Trichoderma de raíz y suelo de cultivos de aguacate, con la capacidad de inhibir in vitro a los patógenos N. parvum, P. persea, C. gloeosporioides y Diaporthe sp. La cepa TSONM6, identificada molecularmente como Trichoderma harzianum, mostró la mayor capacidad antagónica principalmente contra los patógenos del aguacate C. gloeosporioides, Diaporthe sp. y P. persea. Por lo tanto, esta cepa puede utilizarse en frutos de aguacate postcosecha para el control de la antracnosis y así aumentar la calidad y cantidad de este cultivo, impactando significativamente en la economía. Sin embargo, aún falta discernir los mecanismos de acción precisos implicados en la actividad de esta cepa en el control biológico, lo que permitirá seleccionar cepas nuevas, eficaces y que a la vez facultará un uso adecuado en el cultivo de aguacate.











 text new page (beta)
text new page (beta)