Introducción
Los hongos ectomicorrícicos son un componente fundamental en el funcionamiento de los bosques (Baldrian, 2017), ya que favorecen la absorción de nutrientes; primordialmente N y P en suelos con baja fertilidad y contribuyen de forma significativa en el ciclo del carbono por medio de la descomposición de la materia orgánica en el suelo (Phillips et al., 2013; Shah et al., 2015). Además, ayudan a los árboles a desarrollarse en condiciones de estrés abiótico, como la sequía, y a protegerse de fitopatógenos. Debido a estos beneficios, las tecnologías de producción de árboles en vivero contemplan el establecimiento de la simbiosis árbol-hongo ectomicorrícico desde las primeras etapas fenológicas de las plantas; para que, de esta manera, se acrecienten las posibilidades de éxito de las plantas llevadas a su sitio definitivo de crecimiento. En el siglo pasado, la práctica habitual para poner en contacto a los hongos ectomicorrícicos con las plántulas era con el uso de “tierra de monte” en los sustratos (Aucina et al., 2007). De esta manera, las plántulas también se exponían a sus fitopatógenos; favoreciendo la presencia de enfermedades vegetales (Menkis et al., 2016).
Las técnicas modernas de producción de plantas en vivero incluyen el uso de sustratos solarizados o esterilizados junto con la inoculación (Casique et al., 2018); la cual implica la introducción de grandes cantidades de microorganismos en el suelo o sustrato y generalmente, en la proximidad de las radículas de las plántulas. Esta biotecnología permite la producción de plantas con crecimiento acelerado y resistentes ante factores bióticos y abióticos adversos habituales en los sitios a reforestar (Berruti et al., 2016). La inoculación micorrícica provoca efectos diversos de acuerdo a la especie vegetal; reportándose que las mayores posibilidades de éxito se presentan en coníferas, no-leguminosas arbustivas y pastos C4 (Hoeksema et al., 2010). Para acrecentar las posibilidades de éxito de la inoculación micorrícica, se recomienda conocer y manejar las principales interacciones entre los componentes de la microbiota que coloniza la rizosfera, endosfera y filosfera y, de esta manera, mejorar la sanidad vegetal y la productividad en los viveros (Vandenkoornhuyse et al., 2015; Hassani et al., 2018).
La esterilización de los sustratos, además de incrementar el crecimiento de las plantas por la eliminación de fitopatógenos, favorece el establecimiento de un microbioma diverso, representado por microorganismos benéficos (Marschner y Rumberger, 2004; Li et al., 2019). Estos microorganismos pueden ser bacterias fijadoras de nitrógeno y/o solubilizadoras de fosfatos, controladoras de enfermedades radicales y, en general, promotoras del crecimiento vegetal (Troelstra et al., 2001). Con base en lo anterior, el presente trabajo tuvo como finalidad determinar el papel de la esterilización del sustrato y de la inoculación de Pinus greggii Engelm. con esporomas del hongo ectomicorrícico L. laccata en el establecimiento de diversos organismos, representados por rizobacterias benéficas para el crecimiento vegetal.
Materiales y métodos
El germoplasma de P. greggii se colectó en el corredor de los volcanes Iztaccíhuatl y Popocatépetl, Puebla, México (límite extremo norte 98° 40’ 18’’ y 19° 28’ 2’’; límite extremo oeste 98° 46’ 40’’ y 19° 20’ 29’’; límite extremo este 98° 37’ 28’’ y 19° 16’ 16’’; límite extremo sur 98° 40’ 27’’ y 19° 14’ 36’’). Las semillas se esterilizaron con 30% H2O2 durante 20 min. El inóculo se preparó con esporomas de L. laccata provenientes de un bosque de pinos en San Pedro Nexapa, Ozumba, Estado de México (19º 8’12’’N y 98º 39’12’’O). Se separaron los estípites de los píleos, estos últimos se deshidrataron a 35 °C en un horno deshidratador de tipo bandeja (Jersa®) durante 4 días. Posteriormente, se molieron en un molino eléctrico (Thomas Scientific®, Modelo 4 Wiley Mill, EE.UU.) y pasó a través de un tamiz de abertura de 1 mm para obtener un tamaño de partícula homogéneo. El inóculo se almacenó a 5 °C. El experimento se estableció en condiciones de invernadero en las instalaciones del Colegio de Postgraduados, Campus Montecillo, Estado de México.
Diseño de tratamientos
Se establecieron 2 tratamientos: 1) testigo, P. greggii sin inocular y 2) P. greggii inoculado con L. laccata; en un diseño completamente al azar con 10 repeticiones.
Preparación del sustrato e inoculación
El sustrato consistió en una mezcla de arena, corteza de pino y suelo forestal en una proporción 2:2:1, se esterilizó tres veces (con un día de descanso entre cada esterilización), con vapor a una presión de 1.3 kg· cm-2 a 125 °C durante 5h. Las semillas se sembraron en tubos de plástico negro de 125 cm3 con el sustrato descrito. A las plantas del tratamiento inoculado se les adicionaron 108 esporas de L. laccata por planta, determinada esta concentración por observación al microscopio (60X) y con hematocitómetro. Se hicieron dos inoculaciones de esporas del hongo: la primera simultáneamente con la siembra y la segunda 60 días después. Las plantas fueron regadas diariamente con agua destilada estéril, durante seis meses.
Altura y peso seco de las plantas
A los 180 días después de la siembra, se cortaron las plantas y se determinó su longitud desde la base hasta la última acícula. Se colocaron en bolsas de papel y se secaron en un horno (Jersa ® deshidratador de tipo bandeja, México) a 70 °C, durante 3 días, para posteriormente ser pesadas en una balanza analítica (Sartorius, Entris II 1 mg).
Perfil metabólico de comunidades microbianas
Los perfiles metabólicos de las comunidades microbianas cultivables de ambos tratamientos (testigo e inoculado con L. laccata), se determinaron con las microplacas Biolog ™ EcoPlates (BIOLOG Inc., Hayward, CA) que contienen diferentes fuentes de carbono. Se utilizó el procedimiento adaptado de Garland y Mills (1991) , posteriormente se realizaron diluciones seriadas desde 10-1 a 10-4. Se utilizó la dilución 10-3, de esta se tomó una alícuota de 150 µL y se depositó en cada uno de los pocillos, en el pozo A1 únicamente se le agregó 150 µL de agua destilada. Las placas se incubaron a 28 °C y la absorbancia fue leída a 590 nm., usando un lector de microplacas (Synergy2 MCA Bio-Tek). Las mediciones se realizaron a las 24, 48, 72 y 96 h de la incubación.
Abundancia de bacterias fijadoras de nitrógeno y solubilizadoras de fosfatos
Se utilizó el procedimiento adaptado de Garland y Mills (1991) para obtener la solución madre, de la cual, realizaron diluciones seriadas de 10-1 a 10-6. Para el conteo de bacterias fijadoras de nitrógeno se utilizaron las diluciones 10-3, 10-4 y 10-5, mientras que para las solubilizadoras de fosfatos se usaron 10-2, 10-3 y 10-4. En ambos casos se tomaron 100 µL de cada dilución y se sembraron en placas de Petri con un total de cinco repeticiones por dilución. Los medios de cultivo utilizados fueron fuente combinada de carbono y Pikovskaya para fijadoras de nitrógeno y solubilizadoras de fosfatos, respectivamente. Se incubaron por 3 y 10 días a 27 oC, respectivamente.
Para el conteo de bacterias, en ambos medios de cultivo se seleccionó la dilución 10-4, por contener entre 30 y 300 colonias por caja de Petri. En medio Rennie se contaron las colonias totales, mientras que para las bacterias solubilizadoras de fosfatos se tomaron en cuenta aquellas que presentaron un halo de solubilización.
Análisis estadístico
Para el perfil metabólico de comunidades microbianas el promedio del desarrollo del color y el índice de Shannon- Weaver fueron analizados por ANOVA. Todos los análisis estadísticos sobre los microorganismos se realizaron con SAS versión 9.0 para Windows (SAS Institute Inc, Cary, NC, USA).
Resultados y discusión
Altura y peso seco de las plantas
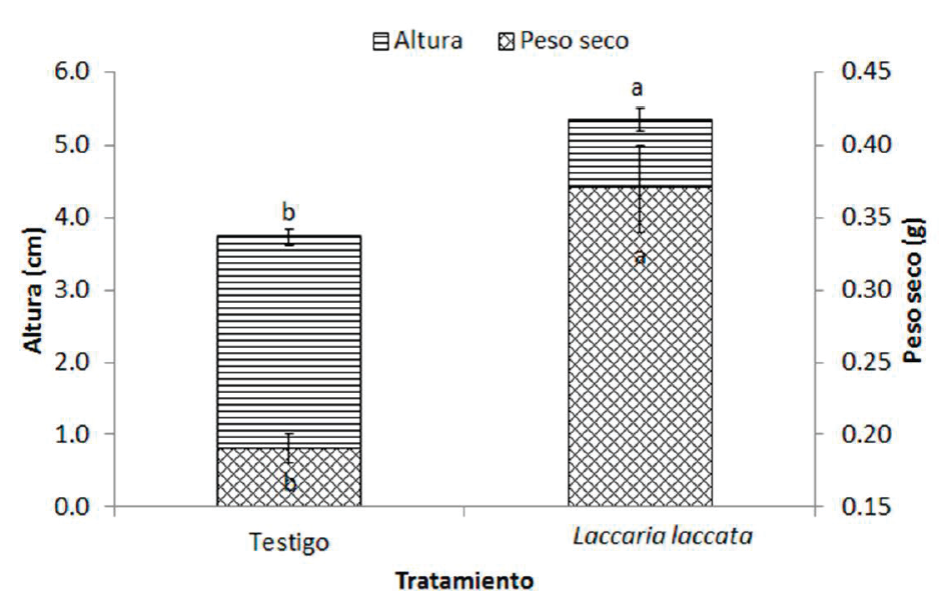
A los 180 días después de la siembra, las plantas del tratamiento inoculado con hongos ectomicorrícicos superaron en altura a las del testigo; con 5.4 y 3.7 cm (p<0.05), respectivamente. Mientras que en el peso seco se generaron valores de 0.19 g para el testigo y 0.37 g para el inoculado, como se muestra en la Figura 1. La inoculación con L. laccata aumenta el crecimiento de P. greggii; esto se ve reflejado en la altura y peso seco de las plantas. Un fenómeno similar en la altura de P. greggii fue observado por Rentería-Chávez et al. (2017) , usando la misma técnica (inóculo a partir de esporomas deshidratados) y carga microbiana en la inoculación (concentración de 107 a 108 esporas por g de inóculo) donde, después de 12 y 24 meses de la inoculación hubo diferencias estadísticas entre el tratamiento L. laccata y el testigo, en un sustrato con las mismas proporciones usadas en este trabajo. Lo cual indica que la influencia de la inoculación sobre el crecimiento de las plantas es constante en diversos estudios. Además, las plantas inoculadas son más resistentes al cambio de las condiciones ambientales que ocurren al trasplantarlas en campo, aumentando su índice de supervivencia (Valdés, 1986; Gómez-Romero et al., 2013).
Perfil metabólico de comunidades microbianas
La diversidad metabólica microbiana, evaluada con el índice de Shannon-Weaver (H’) a las 48 h de incubación, no mostró diferencias significativas entre tratamientos: 2.97 en el inoculado con L. laccata y 2.87 en el testigo (Figura 2a). Sin embargo, la inoculación con L. laccata afectó claramente la actividad metabólica microbiana (AMM). En general, la AMM fue mayor en el tratamiento inoculado, con una lectura de 0.3 comparada con 0.22 en el testigo, ambas a 590 nm (Figura 2b).
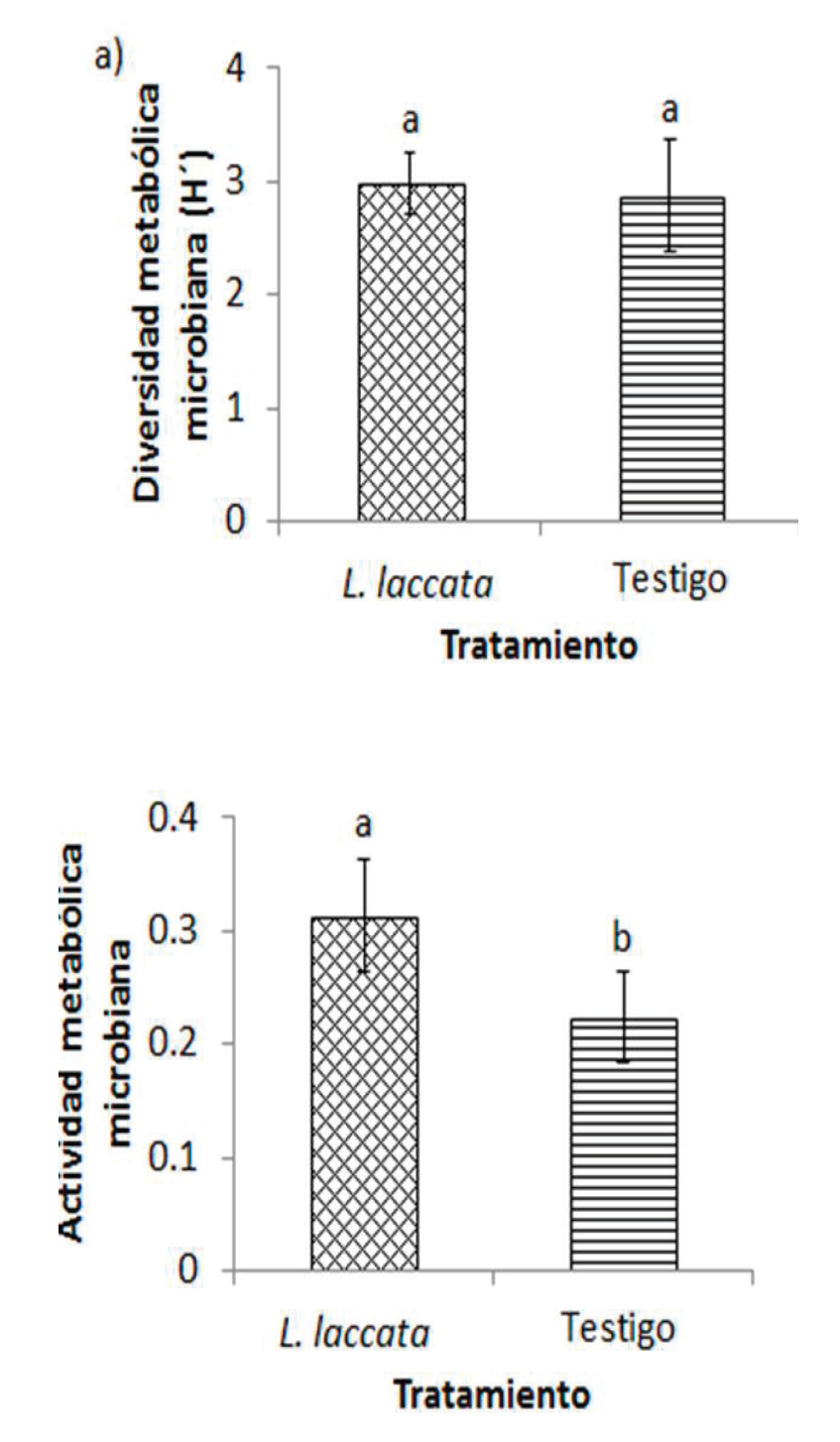
Figura 2 Diversidad (H´) y actividad metabólica microbiana en la rizósfera de Pinus
greggii inoculado con Laccaria laccata
y en el testigo sin inocular. Letras diferentes representan
diferencia estadísticamente significativa (Tukey, α= 0.05).
Figure 2. Diversity (H ‘) and microbial
metabolic activity (AMM) in the rhizosphere of Pinus
greggii inoculated with Laccaria
laccata and in the uninoculated control. Different
letters represent statistically significant difference (Tukey, α =
0. 05).
Se presentaron diferencias estadísticamente significativas entre tratamientos, para la mayoría de los grupos funcionales, a excepción de los polímeros. Para ambos tratamientos, las fuentes de carbono más utilizadas fueron las que se encuentran dentro del grupo funcional de los aminoácidos, seguidas de los carbohidratos, ácidos carboxílicos y cetónicos; mientras que las menos usadas en ambos casos, fueron los polímeros y las amidas y aminas (Figura 3).
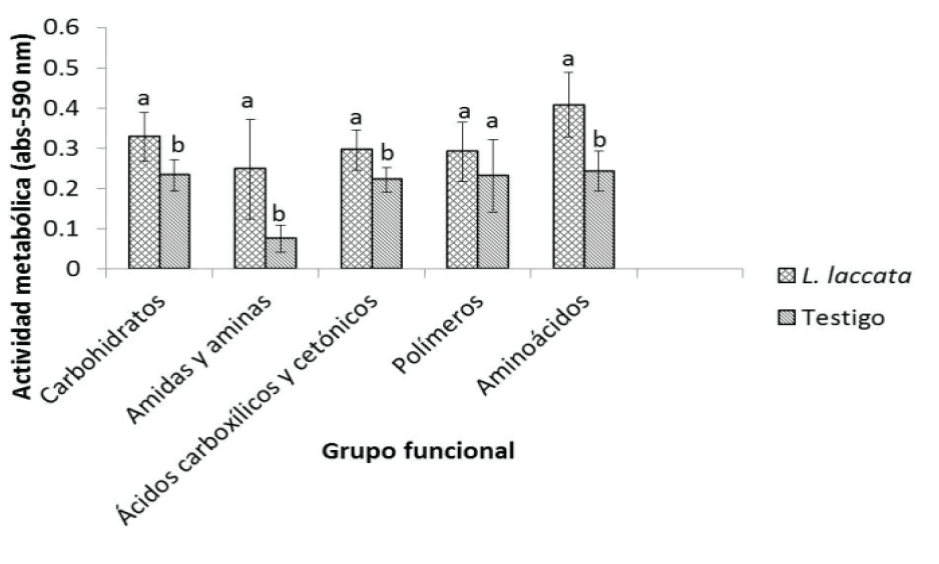
Figura 3 Actividad metabólica microbiana expresada en el uso de fuentes de carbono
correspondientes a cinco grupos funcionales en la rizósfera de
Pinus greggii inoculado con Laccaria
laccata y en el testigo sin inocular. Letras diferentes
representan diferencia estadísticamente significativa (Tukey, α=
0.05).
Figure 3. Microbial metabolic activity
expressed in the use of carbon sources corresponding to five
functional groups in the rhizosphere of Pinus
greggii inoculated with Laccaria
laccata and in the uninoculated control. Different
letters represent statistically significant differences (Tukey, α =
0. 05).
De acuerdo con Setälä (2000) , las plantas ectomicorrizadas transfieren mayores cantidades de fotosintatos al suelo comparado con las no micorrizadas; lo cual se encuentra relacionado con el crecimiento de la mayoría de los microorganismos en la rizósfera. Esto coincide con los resultados del presente trabajo, donde hubo mayor abundancia de microrganismos en los pinos inoculados con L. laccata en comparación con los testigos. Además, la ectomicorriza, entre sus múltiples funciones, ayuda a la formación y descomposición de materia orgánica que puede ser aprovechada por los microorganismos rizosféricos. Esto confirma que la materia orgánica en el suelo y/o sustrato, podría mejorar el acceso a nutrientes y energía para la proliferación de biomasa microbiana, lo que conduce a que los microorganismos degraden con mayor facilidad las fuentes de carbono (Wang et al., 2019). Tian et al. (2016) mencionan que los microorganismos con la capacidad de utilizar aminoácidos como fuente de carbono, inducen cambios en la actividad peptidasa del suelo, lo que acelera la descomposición de las proteínas de la materia orgánica, agilizando la rotación de nitrógeno orgánico. Efecto que se puede observar tanto en la altura como en la producción de biomasa del pino en este experimento.
Varios estudios han demostrado que los hongos ectomicorrícicos aumentan la formación de agregados del suelo, a través de exudados fúngicos y la hidrofobicidad del micelio (Zheng et al., 2014). Esta capacidad se encuentra relacionada con la atracción de microorganismos al micelio extrarradical (Zheng et al., 2014; Viollet et al., 2017). Wang et al. (2019) , observaron que la actividad metabólica microbiana de los ácidos carboxílicos, carbohidratos y amoniácidos es más elevada en los suelos que tienen mayor cantidad de agregados. Lo anterior sugiere que los hongos ectomicorrícicos no aportan dichos beneficios edáficos de manera aislada, sino en conjunto con el microbioma que se forma a partir de su inoculación. En resumen, tanto la diversidad como la actividad metabólica microbiana son indicadoras de la calidad del suelo (Wang et al., 2019). Por medio de esta información se pueden plantear estrategias de rehabilitación mediante incorporación de plantas vivas inoculadas con microorganismos adaptables al ambiente y; a su vez, realizar el seguimiento para evaluar la efectividad de la intervención (Ge et al., 2018).
Abundancia de bacterias fijadoras de nitrógeno y solubilizadoras de fosfatos
Dentro de los microorganismos que habitaban en ambos tratamientos, los de mayor importancia por su función, fueron las bacterias fijadoras de nitrógeno y las solubilizadoras de fosfatos. Los resultados señalaron diferencia significativa entre tratamientos, el tratamiento con inoculación tuvo mayor abundancia de bacterias fijadoras de nitrógeno que el testigo, con 90.4 y 63.2 x105 UFC g-1 de suelo, respectivamente. Comportamiento similar en el caso de las bacterias solubilizadoras de fosfatos, con 7 x105 UFC g-1 de suelo en el inoculado y 1.4x105 UFC g-1 en el testigo (Figura 4). Se sabe que hay un efecto positivo sobre la abundancia de bacterias cuando las plantas son ectomicorrizadas. No obstante, hay poco conocimiento acerca de los mecanismos de atracción que se llevan a cabo las raíces. Cumming et al. (2015) mencionan que se forma una comunicación tripartita (planta-hongo-bacteria), con el objetivo de mejorar el acceso a los nutrientes del suelo. Por ejemplo, la exudación de algunas sustancias orgánicas como ácido cítrico y ácido oxálico del micelio, promueve la colonización bacteriana en la micorrizósfera (Olsson y Wallander, 1998), mientras que las bacterias generan exudados como el auxofurano que estimulan el crecimiento del hongo y por ende de la planta (Cumming et al., 2015). Por ello, se dice que las raíces ectomicorrizadas influyen sobre la selección y abundancia de estas bacterias, debido a que el micelio recibe altas cantidades de carbohidratos provenientes de la fotosíntesis que realizan las plantas, lo cual genera una gran área de superficie para la colonización bacteriana (Marupakula et al., 2017).
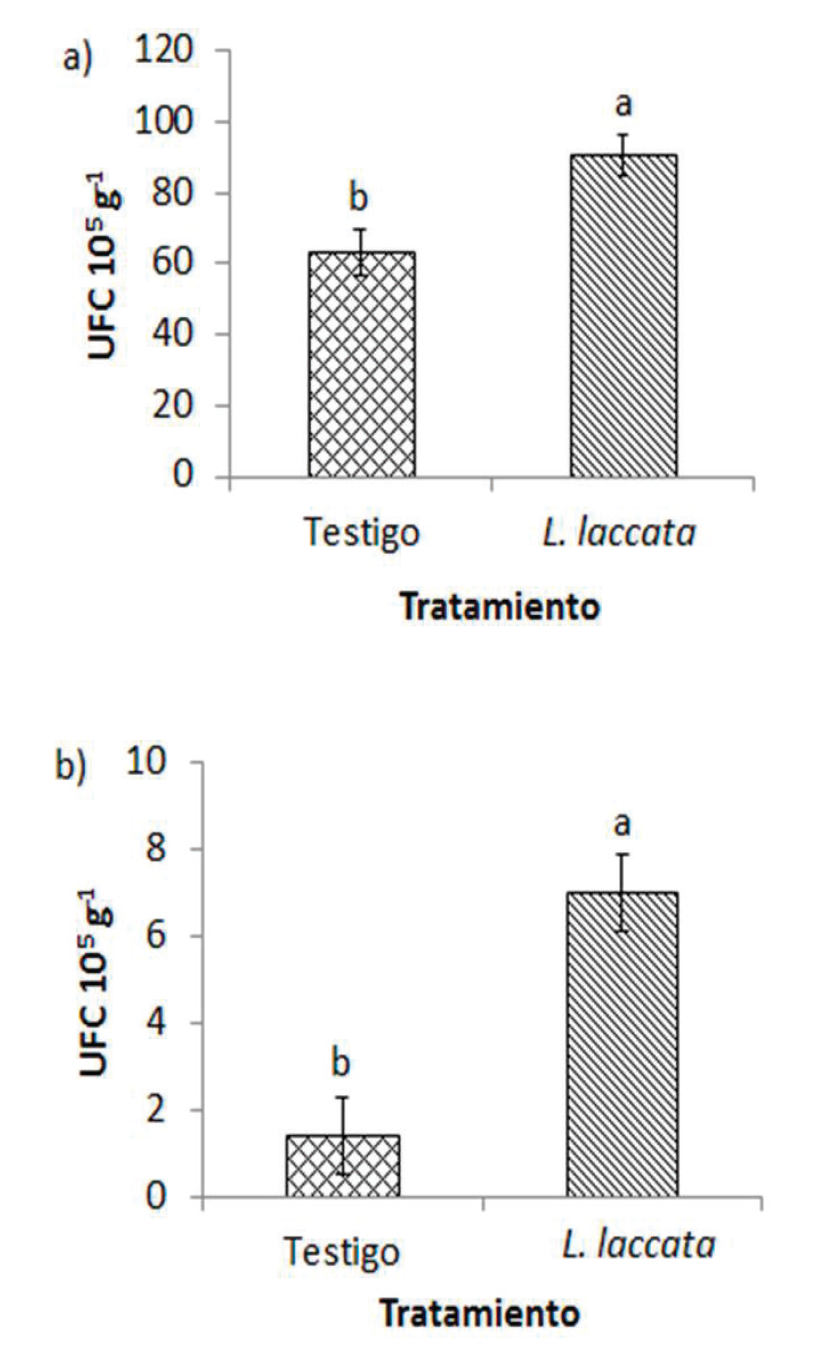
Figura 4 Tamaño de la población de bacterias solubilizadoras de fosfatos (a) y fijadoras de N
atmosférico de vida libre (b) en la rizosfera de Pinus
greggii inoculado con Lacaria laccata
y en el testigo sin inocular (Tukey, α= 0.05).
Figure
4. Population size of phosphate solubilizing bacteria (a)
and free-living atmospheric N-fixing (b) in the rhizosphere of
Pinus greggii inoculated with Lacaria
laccata and in the uninoculated control (Tukey, α = 0.
05).
A pesar de que las bacterias no fueron inoculadas directamente, se infiere que se encontraban en los esporomas de los hongos ectomicorrícicos al momento de su inoculación, puesto que no se realiza un proceso de desinfección a los cuerpos fructíferos, ya que esto impediría el desarrollo de ectomicorriza en las plantas. Kuppardt et al. (2018) mencionan que las raíces de las plantas seleccionan comunidades fúngicas y bacterianas que tienen efectos sobre su desarrollo y productividad. Además, algunas bacterias endófitas fijadoras de nitrógeno, como Gluconacetobacter diazotrophicus pueden encontrarse en varias especies de pinos, ayudándolos a desarrollarse en suelos pobres en este compuesto (Carrell y Frank, 2014).
Tomando en cuenta que el nitrógeno y el fósforo son los nutrientes que ocasionan mayores limitaciones en el crecimiento de las platas, parece predecible que los hongos ectomicorrícicos atraigan bacterias con la capacidad de asimilar dichos nutrientes. Marupakula et al. (2017) mencionan que al estudiar el microbioma asociado a las raíces de P. sylvestris colonizadas por diversos hongos ectomicorrícicos, algunos de los géneros representativos encontrados fueron Burkholderia y Bradyrhizobium; que tienen la capacidad de fijación de nitrógeno y/o solubilización de fosfatos (Bolívar-Anillo et al., 2016; Nápoles et al., 2018). Asimismo, Ekblad y Huss‐Danell (1995) , observaron que la influencia de la ectomicorriza aumenta la trasferencia de nitrógeno a los pinos. Esto puede indicar que, en términos generales, los hongos ectomicorrícicos atraen especies bacterianas con la facultad de promoción del crecimiento vegetal.
Conclusiones
El hongo ectomicorrícico L. laccata tiene efectos positivos sobre el desarrollo de P. greggii (altura y peso seco). Además, esta simbiosis aumenta la AMM de la rizósfera pero no influye en la diversidad de la misma. Las fuentes de carbono más utilizadas por los microorganismos rizosféricos de P. greggii, sin importar la inoculación, fueron los pertenecientes a los grupos funcionales aminoácidos, carbohidratos, y ácidos carboxílicos y cetónicos; mientras que los menos usados fueron los polímeros y las aminas y amidas. La simbiosis ecto- micorrícica proporciona el ambiente idóneo para la proliferación de bacterias fijadoras de nitrógeno y solubilizadoras de fosfatos, las cuales promueven el crecimiento del pino.











 text new page (beta)
text new page (beta)