Introducción
El síndrome de Rett (SR) es un trastorno del neurodesarrollo con modelo de herencia ligada al cromosoma X, que afecta casi exclusivamente al sexo femenino. La frecuencia estimada es de 1/10,000 recién nacidos vivos y la mayoría de los casos son esporádicos, causados por mutaciones de novo. Este síndrome fue descrito por el médico Andreas Rett en la década de 1960, y en 1999 se descubrió que ciertas variantes patogénicas en MECP2 se asociaban a este síndrome1,2. El gen MECP2 codifica para la proteína de unión a CpG metilada (MeCP2), que participa activamente en el desarrollo y la diferenciación neuronales3.
El SR es la causa más frecuente de discapacidad intelectual en el sexo femenino en todo el mundo. Aunque previamente se englobó dentro del espectro autista, hoy se reconocen claras diferencias. Si bien se presentan comportamientos similares a los del espectro autista, como conducta social anormal y falta de contacto visual durante la fase de regresión, después de este estadio y al aumentar la edad los pacientes con SR son más sociables y presentan mayor interacción visual4,5.
En el abordaje inicial de las pacientes de sexo femenino con sospecha de espectro autista es indispensable realizar en paralelo el diagnóstico clínico para SR, de acuerdo con los criterios establecidos por Neul et al6. Se clasifica en típico y atípico de la siguiente manera:
-
- Criterios para SR típico:
-
- Criterios para SR atípico o variante:
-
- Criterios mayores:
Pérdida parcial o completa de habilidades manuales intencionales adquiridas.
Pérdida parcial o completa del lenguaje hablado adquirido.
Anormalidades de la marcha: deterioro (dispráxico) o ausencia de la capacidad.
Movimientos estereotípicos de la mano, como retorcer/apretar las manos, aplaudir/golpear, articular o lavar/frotar.
-
- Criterios de exclusión para SR típico:
Trastornos respiratorios cuando está despierto.
Bruxismo cuando está despierto.
Patrón de sueño alterado.
Tono muscular anormal.
Trastornos vasomotores periféricos.
Escoliosis/cifosis.
Retraso del crecimiento.
Manos y pies fríos.
Risa/gritos inapropiados.
Respuesta disminuida al dolor.
Comunicac ión visual intensa: «señalar con el ojo».
En el curso de la condición se definen cuatro estadios:
Detención del neurodesarrollo (6-18 meses).
Regresión o deterioro rápido (1-4 años).
Pseudoestacionario (2-10 años).
Deterioro motor tardío (> 10 años).
En el estadio I se pueden observar hipotonía, retraso en el desarrollo motor, pérdida del contacto visual, retorcimiento de las manos y episodios de respiración apnéustica e hiperventilación6,7. El estadio II se presenta con un deterioro neurológico rápido; este estadio puede durar semanas o meses, y se caracteriza por cambios en el comportamiento, como pérdida de interacción social y de habilidades comunicativas, pérdida de lenguaje, y comienzan los movimientos estereotípicos de las manos (retorcerlas, aplaudir, lavarse o movimientos de la mano a la boca). Los pacientes también pueden tener anomalías de la respiración, crisis convulsivas y trastornos del sueño. En el estadio III puede haber una leve mejoría en el comportamiento y en las habilidades de comunicación; sin embargo, el deterioro mental y los movimientos estereotípicos de las manos continúan. Se pueden agregar rigidez, bruxismo y movimientos involuntarios de la lengua, crisis convulsivas y dificultad para la alimentación. En el estadio IV, la frecuencia de las crisis convulsivas puede disminuir, mientras que los problemas motores aumentan, incluidos la hipertonía, la distonía y la rigidez, e incluso algunos pacientes dejan de caminar6,7.
Dentro del abordaje inicial en un paciente con sospecha de SR, los diagnósticos diferenciales que se deben considerar son el síndrome de Angelman, la encefalopatía epiléptica infantil temprana y la variante congénita de SR8.
Las variantes patogénicas del gen MECP2 causan hasta el 95% de los casos de SR típico9. La confirmación diagnóstica de SR se realiza mediante la secuenciación del gen y el análisis de deleciones o duplicaciones. Sin embargo, no se han identificado mutaciones del gen MECP2 mediante secuenciación en el 3-5% de los pacientes que cumplen con los criterios de diagnóstico clínico de SR típico y en el 50-70% de los casos atípicos10.
El objetivo del presente reporte es describir dos casos de SR, uno de ellos con una variante en MECP2 no descrita previamente, y realizar una revisión de la literatura para el diagnóstico del SR.
Casos clínicos
Caso 1
Acude a la consulta un paciente de sexo femenino de 5 años, referida por neurología pediátrica, con microcefalia y regresión del desarrollo psicomotor a partir de los 3 años de edad. La paciente es producto de la segunda gesta de progenitores no consanguíneos, sin antecedentes heredofamiliares de relevancia. La madre refirió cursar un embarazo normoevolutivo. La paciente nació a las 38 semanas de gestación por vía cesárea iterativa, sin complicaciones perinatales y somatometría dentro de parámetros normales.
En la exploración física se encontraron los signos vitales dentro de los parámetros normales, con peso de 10.8 kg (5.1 desviaciones estándar [DE] por debajo de la media para su sexo y edad en la población mexicana), talla de 104 cm (en el percentil 20) y perímetro cefálico de 47 cm (3.1 DE por debajo de la media). La paciente cursaba con ataxia troncal, bruxismo y movimientos estereotipados de manos y boca. Se diagnosticó clínicamente SR típico con datos correspondientes al estadio III, ya que había presentado un periodo de regresión seguido por un periodo de estabilización y cumplía todos los criterios mayores10. Se inició un abordaje diagnóstico integral. El electroencefalograma mostró un foco irritativo de puntas y ondas agudas localizado sobre la región hemisférica izquierda de predominio frontal. En la resonancia magnética cerebral se observó un incremento en la amplitud de la cisterna prepontina y prebulbar, hipoplasia del cuerpo calloso y el resto de las estructuras del encéfalo normales para la edad de la paciente.
De acuerdo con el diagnóstico clínico de SR, se solicitó la secuenciación del gen MECP2. Tras la obtención del consentimiento de los padres, se extrajo ADN de sangre periférica, se realizó la amplificación de los exones 3 y 4 de MECP2 por reacción en cadena de la polimerasa y se llevó a cabo una secuenciación automatizada directa (tipo Sanger con Big Dye Terminator Cycle sequencing kit). Se realizó la secuenciación de los exones 3 y 4 debido a que la mayoría de las variantes patogénicas se encuentran en estos exones11.
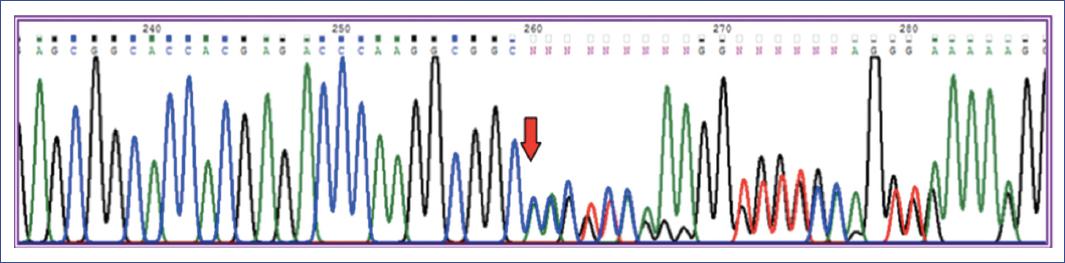
El análisis bioinformático se hizo con el programa BioEdit, lo que permitió identificar una variante en estado heterocigoto c.606delC (p.Thr203Argfs*7) (Fig. 1) que no ha sido reportada en las bases de datos de variantes del genoma humano (ClinVar, HGVD, HGMD, LOVD).
Caso 2
Acude a la consulta un paciente de sexo femenino de 17 años, referida para evaluación por síndrome dismórfico. La paciente es producto de la tercera gesta de progenitores no consanguíneos, la madre con antecedente perinatal de un aborto espontáneo del primer trimestre y un óbito de 28 semanas de gestación con malformación no especificada en la región cervicodorsal. Nació a las 38 semanas de gestación vía parto, sin complicaciones perinatales y somatometría dentro de los parámetros normales. A los 2 años de edad inició con regresión del desarrollo psicomotor, con pérdida del lenguaje y de la marcha. Previo a la valoración por genética fue diagnosticada y tratada como espectro autista. Es dependiente de silla de ruedas desde los 8 años. Actualmente muestra una discapacidad intelectual grave.
En la exploración física se encontraron los signos vitales dentro de los parámetros normales. Su peso es de 25 kg (11 DE por debajo de la media para su sexo y edad en población mexicana), la talla de 139 cm (3.7 DE por debajo de la media) y el perímetro cefálico de 49 cm (5.6 DE por debajo de la media). Se observan escoliosis grave, ataxia y movimientos estereotipados en las manos. Se diagnosticó clínicamente SR típico, ya que había cursado con un periodo de regresión seguido de un periodo de estabilización y cumplía todos los criterios mayores que corresponden al estadio IV del SR10. En el abordaje diagnóstico, el electroencefalograma mostró un fondo lento para la edad en rango theta, así como paroxismos de ondas agudas y punta aguda en la región frontal bilateral. En la resonancia magnética cerebral solo se observó microcefalia, sin identificar otras anomalías. De acuerdo con el diagnóstico clínico de SR, se solicitó la secuenciación de nueva generación del gen MECP2. Tras la autorización de los padres y la obtención del consentimiento informado, se extrajo ADN de sangre periférica, se amplificaron los cuatro exones y regiones flanqueantes del gen MECP2, y se llevó a cabo la secuenciación de ADN y electroforesis capilar. El análisis bioinformático se realizó con el programa BioEdit por comparación con la secuencia y se identificó una variante patogénica en estado heterocigoto c.880C>T(p.Arg294*) en MECP2, que resulta en la sustitución de una arginina en la posición 880 por un codón de paro. Este cambio ya ha sido descrito previamente como una variante patogénica asociada al SR12. Asimismo, se encontró una variante de nucleótido sencillo c.1233C>T(p.Ser411Ser) rs3027928, la cual se interpreta sin relevancia clínica.
Discusión
El SR se origina principalmente por mutaciones de pérdida de función en el gen MECP2, el cual codifica para la proteína MeCP2. Esta proteína de expresión pleiotrópica se encuentra altamente expresada en diferentes áreas del cerebro13, con función de activador y represor transcripcional, así como de regulación postranscripcional de genes relacionados con la actividad sináptica7,14. Se ha postulado que MeCP2 también contribuye al destino celular en la especificación y la migración neuronales durante el desarrollo cerebral, tanto en el periodo embrionario como en el posnatal15. El mecanismo neuropatológico que lleva a la regresión del neurodesarrollo aún no se comprende del todo. Sin embargo, se postula que la regresión no resulta de la neurodegeneración, sino que surge de una función neuronal alterada16.
El cuadro clínico asociado al SR se define por los criterios consensados por Neul et al6. La confirmación diagnóstica se realiza mediante secuenciación del gen MECP2. Sin embargo, esta metodología detecta del 90-95% de los casos de SR típico, mientras que el análisis de deleciones o duplicaciones detecta únicamente del 5-10%9. Por otro lado, no es posible identificar mutaciones en el gen MECP2 en el 3-5% de los pacientes que cumplen con los criterios clínicos diagnósticos de SR típico y en el 50-70% de los casos de SR atípico10. Se han reportado más de 900 variantes en el gen MECP211, pero existen ocho hotspots (p.Arg106Trp, p.Arg133Cys, p.Thr158Met, p.Arg168*, p.Arg255, p.Arg270, p.Arg294, y p.Arg306Cys) que constituyen más del 60% de los casos documentados10,17. En el 5% de los pacientes con SR no se logra identificar variantes patogénicas en MECP2, por lo que se han propuesto otros mecanismos moleculares causados por variantes patogénicas en WDR45, CTNNB1, CDKL5 y FOXG117,18. Asimismo, se han encontrado variantes en múltiples genes causantes de un síndrome similar al SR: STXBP1, TCF4, SCN2A, MEF2C y SHANK3, entre otros19.
La variante encontrada en el primer caso descrito, c.606delC (p.Thr203Argfs*7), no ha sido reportada previamente en bases de datos de variantes del genoma humano (ClinVar, HGVD, HGMD, LOVD). De acuerdo con los lineamientos establecidos por el American College of Medical Genetics and Genomics, se clasifica como una variante patogénica con un grado de evidencia muy sólido (PVS1), ya que se trata de una variante nula en el gen cuya pérdida de función resultante es un mecanismo conocido del SR20. El análisis predice que esta variante impide la síntesis de la proteína MeCP2 a partir de los dominios de represión transcripcional y de señal de localización nuclear. La presencia de esta variante del gen MECP2 en estado heterocigoto más el curso clínico de la paciente se consideran como evidencia suficiente para establecer el diagnóstico de SR.
La heterogeneidad clínica y genética del espectro de SR supone un reto diagnóstico. En la actualidad, con las nuevas técnicas de secuenciación y de bioinformática, más pacientes pueden contar con un diagnóstico genético certero, lo cual es primordial para un adecuado asesoramiento genético, opciones de tratamiento y perspectiva a futuro de los pacientes19.
Debido a que el 99.5% de los casos de SR son casos simplex, en los cuales existe una variante patogénica de novo en el caso índice, el riesgo de recurrencia para progenitores sanos es muy similar al de la población general, a pesar de que se han reportado muy pocos casos en la literatura de mosaicismo germinal21.
En cuanto a una relación genotipo-fenotipo, ha sido inconsistente y se postula que podría deberse al patrón de inactivación del cromosoma X. Pocas variantes patogénicas cuentan con una relación genotipo-fenotipo bien definida22, por lo que se ha propuesto que todos los pacientes con fenotipo de SR o similar a SR sean englobados en un espectro con heterogeneidad genética19.
Resulta primordial considerar una etiología genética en los pacientes con trastornos del neurodesarrollo, e incluso con trastornos del espectro autista23. Para los profesionales de la salud que evalúan pacientes con compromiso del neurodesarrollo podría ser relativamente sencillo sospechar el diagnóstico de SR. Sin embargo, el SR atípico puede suponer un desafío. Es importante confirmar la variante patogénica para brindar un asesoramiento genético integral, que comprende exponer la evolución natural de la patología y el pronóstico, e informar a los progenitores sobre los riesgos reproductivos, para que ellos puedan tomar una decisión informada relacionada con su futuro reproductivo y el manejo integral del paciente.
Los individuos con diagnóstico de SR requieren un seguimiento interdisciplinario por subespecialidades pediátricas como neurología, gastroenterología, neumología, cardiología, medicina física y rehabilitación, paidopsiquiatría y terapia familiar psicológica con evaluaciones periódicas. El objetivo primario del manejo longitudinal es disminuir el impacto de las complicaciones y del compromiso neuromuscular secundario, siempre en busca del máximo beneficio y la mejor calidad de vida de estos pacientes y sus familias.











 text new page (beta)
text new page (beta)