Introducción
La oxigenación por membrana extracorpórea (ECMO, extracorporeal membrane oxygenation) se define como el uso de un circuito de derivación cardiopulmonar para el soporte vital temporal de pacientes con insuficiencia cardiaca y/o respiratoria potencialmente reversible que no responden al tratamiento convencional. Establecida (gracias a las mejoras en biotecnología) para muchos aspectos relacionados no solo del síndrome de dificultad respiratoria aguda (SDRA), sino también para su uso en fases previas y posteriores a los trasplantes de órganos. Asimismo se puede utilizar como terapia de rescate para evitar los efectos nocivos de la ventilación mecánica y para rescatar alteraciones gasométricas extremas1.
Actualmente existen los circuitos ECMO veno-arterial (ECMO-VA) y ECMO veno-venoso (ECMO-VV), este último se puede utilizar en pacientes con un amplio espectro de patologías subyacentes que conducen a SDRA refractario. Las nuevas tecnologías con equipos y procedimientos más fáciles y confiables han permitido la expansión de ECMO-VV a muchas unidades de cuidados intensivos (UCI) alrededor del mundo. No obstante, aún hace falta una estimación adecuada de los efectos del uso de ECMO-VV en la tasa de complicaciones y el resultado de los pacientes sometidos a esta terapia junto con una evaluación de riesgo-beneficio con su uso2. Asimismo, la provisión del soporte nutricional (SN) adecuado puede ser un desafío en cualquier paciente que se someta a ECMO1,3.
Como antecedente, Lukas et al.4 realizaron un estudio retrospectivo de enero de 2005 a diciembre de 2007 para describir el uso, métodos y adecuación del SN en 48 pacientes que recibieron ECMO con duración media de ocho días, encontrando que en el periodo inicial de ECMO se entregaron cantidades bajas de nutrición (con el 18% de los requerimientos totales durante los primeros dos días, el 30% durante los primeros tres días y el 55% durante todo el periodo de soporte). No existieron diferencias significativas en cuanto a la adecuación nutricional entre los sobrevivientes y no sobrevivientes (52 frente a 61%; p = 0.345). Por lo tanto, este grupo de pacientes permanece sin cumplir sus objetivos calórico-proteicos, incurriendo así en desnutrición.
Las dos barreras más comunes para la entrega de nutrición enteral (NE) en pacientes con ECMO que Ridley et al. encontraron en 2015 en un estudio observacional, prospectivo y multicéntrico fueron el ayuno por procedimiento terapéutico y/o de diagnóstico y por altos volúmenes gástricos residuales. Dejando a los participantes con una media de ocho horas sin SN5.
Sin embargo la guía de la Sociedad Europea de Nutrición Enteral y Parenteral (ESPEN) en la unidad de cuidados intensivos de 2019 recomienda el uso de NE temprana en pacientes que reciben terapia ECMO con grado de recomendación B, consenso de expertos fuerte (95.65% de acuerdo), como primera opción de tratamiento6.
Riesgo nutricional y ECMO
En general los pacientes sometidos a ECMO tienen una estancia hospitalaria prolongada e inflamación sistémica significativa, esto en conjunto contribuye al desarrollo de desnutrición intrahospitalaria con resultados clínicos desfavorables, aumentando la mortalidad, empeorando la calidad de vida, mayor probabilidad de reingreso hospitalario después del alta, mayor fragilidad, riesgo de sarcopenia o debilidad adquirida y un mayor riesgo de adquirir infecciones agregadas7-9. Podemos definir e identificar la desnutrición usando los criterios propuestos por Gordon et al. (2019)8 en la Iniciativa de Liderazgo Global sobre Desnutrición (GLIM) (Tabla 1).
Tabla 1 Criterios fenotípicos y etiológicos para el diagnóstico de desnutrición
| Criterios fenotípicos* | Criterios etiológicos* | |||
|---|---|---|---|---|
| Pérdida de peso (%) | Índice de masa corporal | Masa muscular reducida† | Ingesta o asimilación de alimentos disminuida‡§ | Inflamación¶**†† |
| > 5% en los últimos 6 meses, o > 10% más en 6 meses | < 20 si < 70 años, o < 22 si > 70 años Asia: < 18.5 si < 70 años, o < 20 si > 70 años | Reducido por técnicas validadas de medición de la composición corporal† | < 50% de los RE > 1 semana, o cualquier reducción durante > 2 semanas, o cualquier condición GI crónica que afecte negativamente la asimilación o absorción de alimentos‡§ | Enfermedad aguda/lesión¶††o enfermedad crónica**†† |
*Requiere al menos 1 criterio fenotípico y 1 criterio etiológico para el diagnóstico de desnutrición.
†Índice de masa libre de grasa (kg/m2) mediante absorciometría de energía dual o estándares correspondientes utilizando otros métodos de composición corporal, como análisis de impedancia bioeléctrica, tomografía computarizada o resonancia magnética. Cuando no esté disponible o por preferencia regional, se puede utilizar el examen físico o las medidas antropométricas estándar, como la circunferencia del músculo del medio brazo o la pantorrilla. Los umbrales para la reducción de la masa muscular deben adaptarse a la raza (Asia). Las evaluaciones funcionales como la fuerza de agarre de la mano pueden considerarse como una medida de apoyo. ‡Considere los síntomas gastrointestinales como indicadores de apoyo que pueden afectar la ingesta o absorción de alimentos (p. ej., disfagia, náuseas, vómitos, diarrea, estreñimiento o dolor abdominal). Use el juicio clínico para discernir la gravedad según el grado en que se deteriora la ingesta o la absorción. Se debe tener en cuenta la intensidad, frecuencia y duración de los síntomas.§La asimilación reducida de alimentos/nutrientes se asocia con trastornos de mala absorción, como el síndrome del intestino corto, la insuficiencia pancreática y después de la cirugía bariátrica. También se asocia con trastornos como estenosis esofágica, gastroparesia y pseudoobstrucción intestinal. La malabsorción es un diagnóstico clínico que se manifiesta como diarrea crónica o esteatorrea. La malabsorción en aquellos con ostomías se evidencia por volúmenes elevados de producción. Use el juicio clínico o una evaluación adicional para discernir la gravedad en función de la frecuencia, la duración y la cuantificación de la grasa fecal y/o el volumen de pérdidas. ¶Enfermedad aguda/relacionada con lesiones. Es probable que la inflamación severa se asocie con una infección importante, quemaduras, traumatismo o traumatismo craneal cerrado. Es probable que otras afecciones agudas relacionadas con enfermedades/lesiones estén asociadas con inflamación leve a moderada. **Relacionado con enfermedades crónicas. La inflamación severa generalmente no se asocia con enfermedades crónicas. Es probable que la inflamación leve o moderada crónica o recurrente se asocie con enfermedad maligna, enfermedad pulmonar obstructiva crónica, insuficiencia cardiaca congestiva, enfermedad renal crónica o cualquier enfermedad con inflamación crónica o recurrente. Tenga en cuenta que la inflamación transitoria de grado leve no alcanza el umbral para este criterio etiológico. ††La proteína C reactiva puede usarse como una medida de laboratorio de apoyo. RE: requerimientos energéticos; GI: gastrointestinal. Adaptada de Jensen et al. 20198.
Evaluación nutricional en pacientes con ECMO
Actualmente no existe una herramienta de tamizaje nutricional específica para esta clase de pacientes, sin embargo debido al contexto clínico y al ambiente hospitalario podríamos seleccionar herramientas ya establecidas y validadas para pacientes en UCI. El tamizaje de riesgo nutricional (NRS-2002)10 es una herramienta utilizada frecuentemente en el ámbito intrahospitalario; sin embargo, su uso generalizado clasificaría a la mayoría de los pacientes críticos como «en riesgo» según los tres puntos de gravedad de la enfermedad por APACHE II mayor a 10. Por lo tanto, no proporciona ninguna selección significativa para los pacientes en UCI con riesgo nutricional11.
Heyland et al. en 2011, introdujeron la primera herramienta de evaluación de riesgo nutricional desarrollada y validada específicamente para pacientes de UCI, llamada NUTRIC score (Nutrition Risk In Critically Ill score), la cual utiliza un método de puntuación único para identificar a los pacientes que se benefician en mayor manera del apoyo nutricional agresivo dentro de las primeras 24-48 horas en la UCI o bien del ayuno12. No obstante, Coltman et al. sugieren que dicha herramienta puede tener una aplicación clínica limitada, ya que no incluye marcadores tradicionales de riesgo nutricional como índice de masa corporal (IMC), cambios en peso, ingesta oral o la evaluación física13.
Sin embargo, se ha asociado que un aumento en el NUTRIC score incrementa significativamente la mortalidad a 90 días en pacientes que reciben ECMO-VA14.
Nutrición enteral y ECMO
Como ya se mencionó, la ESPEN recomienda el uso de NE temprana en estos pacientes6. No obstante, ¿cuál es la razón por la que no se cumplen los requerimientos calóricos? Una revisión publicada en 2020 por Simões Covello et al.15 demostró que una de estas razones es la inestabilidad hemodinámica en general de los pacientes críticos que requieren aminas vasoactivas para el mantenimiento de la tensión arterial, causando así suspensión de la NE, ya que si bien no hay literatura disponible para establecer dosis seguras de estos fármacos y su relación con la NE, los autores destacan la existencia de una gran cantidad de controversias. En este sentido los signos clínicos (Fig. 1) siguen siendo los parámetros más importantes en la evaluación de la tolerancia a la NE en el paciente crítico.
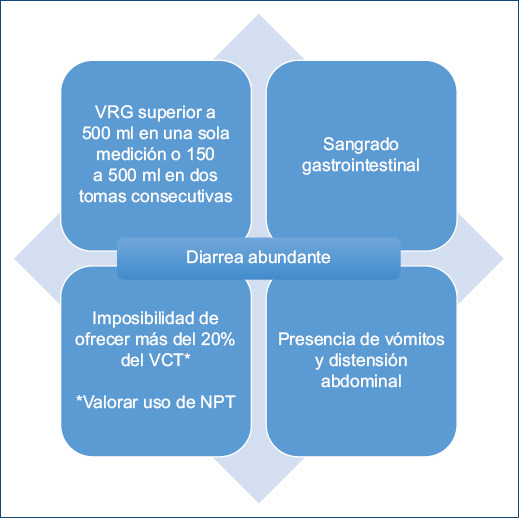
Figura 1 Problemas gastrointestinales comúnmente presentados en pacientes críticos (adaptada de Simoões Covello et al. 202015). VRG: volumen residual gástrico; VCT: valor calórico total; NPT; nutrición parenteral total.
NUTRIREA-2, el ensayo clínico más grande publicado en 2018, evaluó específicamente el uso de NE a 2,410 pacientes con ventilación mecánica y vasopresores (62% con choque séptico) para recibir NE temprana o nutrición parenteral (NP). De los 1,202 asignados al azar a NE, 19 (2%) desarrollaron isquemia mesentérica no oclusiva, en comparación con cinco de 1,208 (< 1%) asignados al azar al grupo de NP (p = 0.007). El grupo NE también presentó más vómitos, diarrea y pseudobstrucción colónica aguda, en comparación con el grupo de NP. Los pacientes asignados de forma aleatoria a NE recibieron 17.8 kcal/kg/día mientras recibían norepinefrina a una dosis media de 0.56 mg/kg/min, lo que sugiere que la introducción de NE «completa» durante dosis altas de norepinefrina puede aumentar progresivamente el riesgo de isquemia mesentérica, no obstante no es un hallazgo que pueda ser generalizable a volúmenes más bajos de NE y/o cantidades más bajas de vasopresores16.
Por lo anterior los intensivistas se muestran con temor y negación a iniciar NE temprana en choque circulatorio. Sin embargo, también se ha demostrado que existe tolerancia gastrointestinal en estados de choque y que el uso de la vía enteral tiene múltiples beneficios, entre ellos mantener la barrera de los enterocitos, disminuyendo la translocación bacteriana (disbiosis) y estimulando la inmunidad17. Se sugiere la evaluación clínica específica antes, durante y después de la terapia nutricional enteral, con un inicio de esta a dosis bajas (tróficas) para disminuir el riesgo de complicaciones y mejorar los resultados clínicos. Es importante destacar que no se recomienda la suspensión de la NE cuando los pacientes se encuentran en posición prono18.
Nutrición parenteral y ECMO
El uso informado de NP, ya sea sola o en combinación con NE, varía del 4 al 30% de los pacientes que reciben ECMO. Esta terapia ha sido tema de controversia, ya que existe la posibilidad de que la infiltración de lípidos en el oxigenador del ECMO provoque una falla de este19. No obstante, las membranas de nueva generación utilizadas en el circuito podrían anular este riesgo. Un ensayo in vivo publicado por Lindberg et al. en 2020 encontró que no existe diferencia significativa en cuanto a la acumulación de sustratos en el circuito de ECMO cuando se usan rutas parenterales para la administración de medicamentos y nutrición comparado con el control, por lo que el uso de NP en estos pacientes es cada vez más viable y seguro20. Debido a esto, si se considera que la NP es la única forma de nutrir al paciente según el contexto clínico, valdría la pena asegurarse de que se lleve a cabo una estrecha vigilancia del circuito cuando los pacientes reciben esta terapia, especialmente si se usan concomitantemente otros medicamentos que contienen lípidos21. El control regular de los triglicéridos también puede ayudar a determinar el riesgo y el punto en el que puede justificarse la NP sin lípidos. Se recomienda que para todos los pacientes con ECMO y NP se monitoree el oxigenador al menos una vez al día, evaluar los niveles de triglicéridos séricos para valorar si se requiere el uso de emulsiones lipídicas en la NP (> 400 mg/dl, suspender) y en caso de que se requiera dicha suspensión, considerar utilizar NP libre de lípidos con administración semanal de estos y vitaminas liposolubles diarias para prevenir deficiencias21.
En cuanto al uso de multivitamínicos y elementos traza en la NP, se recomienda administrar la ingesta diaria recomendada (IDR) de cada uno a no ser que se identifique la deficiencia de algún micronutrimento en específico para considerar administrar más de la IDR, o bien, teniendo en cuenta el estado metabólico agudo y la disfunción mitocondrial22 que existe en estos pacientes, se puede agregar algún micronutrimento en específico como terapia coadyuvante y con base en la clínica23 (Tabla 2).
Tabla 2 Características clínicas de los estados más comunes de deficiencia aguda de micronutrimentos que pueden manifestarse durante la atención en la unidad de cuidados intensivos
| Micronutrimento | Signos clínicos/enfermedad |
| Tiamina o vitamina B1 | Insuficiencia cardiaca congestiva, acidosis láctica |
| Ácido ascórbico o vitamina C | Escorbuto, choque séptico |
| Cobre | Arritmias, alteraciones inmunitarias |
| Selenio | Cardiomiopatía aguda |
| Zinc | Infecciones, retraso en la cicatrización de heridas |
Adaptada de Singer et al. 200922.
Requerimientos calórico-proteicos en pacientes con ECMO
No existe una recomendación sobre calorías y proteínas en particular para esta clase de pacientes21. Sin embargo, valdrá la pena considerar las guías ESPEN para pacientes críticamente enfermos en la toma de decisiones para la estimación del requerimiento calórico-proteico6. La entrega adecuada de energía y proteínas es posible en esta población, no obstante la subalimentación es común, especialmente en aquellos que están gravemente enfermos o tienen disfunción orgánica más severa24 (Tabla 3).
Tabla 3 Recomendaciones calórico-proteicas para pacientes adultos que reciben terapia de oxigenación con membrana extracorpórea
| Recomendación | Comentario | |
|---|---|---|
| Calorías | Uso de CI o ecuación de Schofield x 1.1-1.2 o 25-30 kcal/kg/día | IMC > 30: 11-14 kcal/kg peso actual/día |
| Proteínas | 1.5-2.0 g/kg/día (mínimo 1.2 g) | IMC > 30: ≥ 2.0g/kg peso ideal/día |
| Sodio | ≤ 2,000 mg/día | Basarse en el estado de hidratación del paciente |
IMC: índice de masa corporal; CI: calorimetría indirecta. Adaptada de Ulerich, 20141 y Bea, et al. 201819.
Energía y proteína
De manera inicial la NE debe preferirse sobre la NP6. Aunado a esto, para estimar la energía que se administrará se prefiere el uso de calorimetría indirecta, no obstante el uso de esta técnica es muy limitado y no está disponible en todos los centros hospitalarios. Sin embargo se pueden realizar cálculos para la estimación con la fórmula de Schofield, o bien estimar el cálculo en 25-30 kcal/kg/día1,6,9.
En cuanto al requerimiento proteico, la American Society for Parenteral and Enteral Nutrition (ASPEN) recomienda la administración mínima de 1.2 g/kg/día de proteína contemplando el peso actual del paciente con IMC en rangos normales y con dosis máximas de 2.0 g/kg/día (Tabla 3), todo con base en la evaluación clínica y el contexto actual del paciente, pudiendo iniciar con dosis mínimas e incrementar paulatinamente el requerimiento con base en las necesidades25,26.
Durante y después de la estancia en la UCI la terapia nutricional es esencial para minimizar la probabilidad de debilidad adquirida en UCI. Con frecuencia los objetivos nutricionales no se alcanzan en ninguna fase, por lo que debe prescribirse y controlarse la terapia nutricional personalizada, respetando los objetivos propuestos por el clínico encargado y según el contexto del paciente27 (Fig. 2).
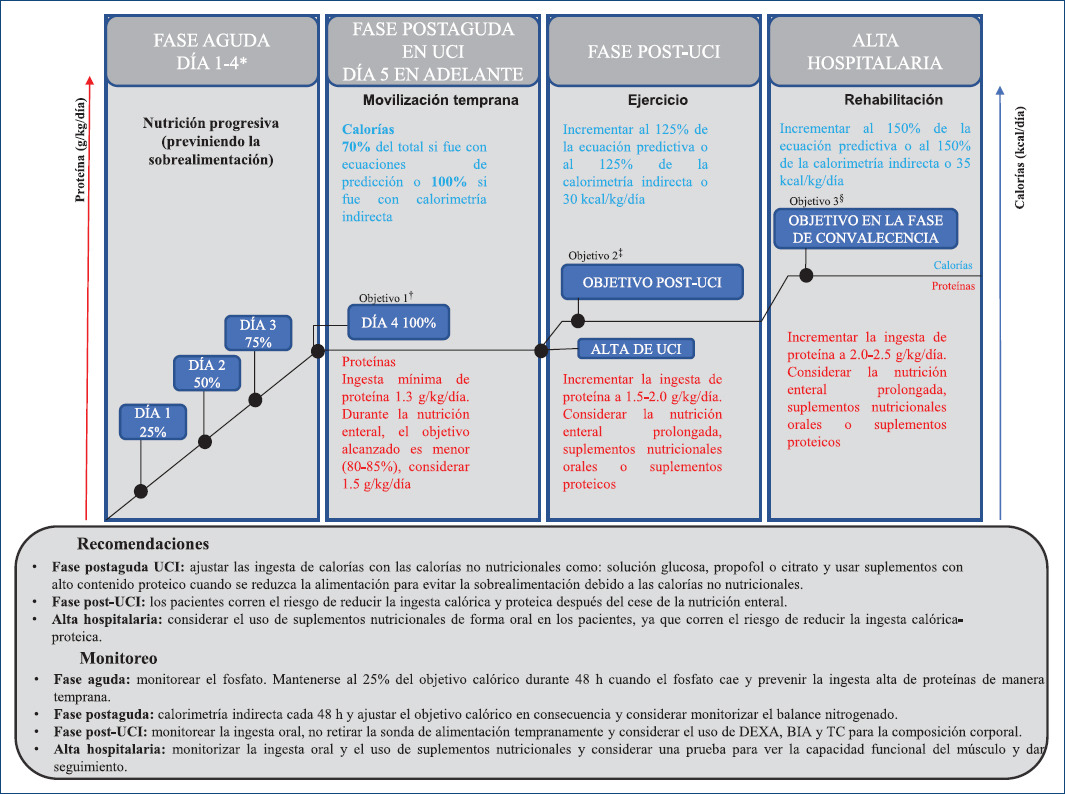
Figura 2 Enfoque práctico para proporcionar calorías y proteínas durante las fases de enfermedad crítica y convalecencia (adaptada de van Zanten et al. 201927). *Durante los primeros 3 días, las calorías y las proteínas progresan gradualmente para alcanzar el objetivo 1 en el día 4, por pasos, con un aumento diario del 25%. †El objetivo 1 es 1.3 g/kg/día de proteínas y para un 70% de los objetivos calóricos calculados o el 100% del objetivo cuando se mide por calorimetría indirecta. ‡El objetivo 2 debe cumplirse durante la enfermedad crítica crónica y después del alta de UCI en salas generales, para el objetivo 2, las calorías se incrementan al 125% de las ecuaciones predictivas o la calorimetría indirecta o 30 kcal/kg/día y para las proteínas 1.5-2.0 g/kg/día. §Después del alta hospitalaria, el objetivo 3 recomienda un aumento calórico más alto (150% de las ecuaciones predictivas o 35 kcal/kg/día) y una mayor ingesta de proteínas, de 2.0-2.5 g/kg/día. BIA: análisis de impedancia bioeléctrica; DEXA: absorciometría de rayos X de energía dual; TC: tomografía computarizada; UCI: unidad de cuidados intensivos.
Conclusión
En la actualidad, el uso del SN en pacientes con ECMO es controvertido. No obstante, se ha observado buena tolerancia con el uso de NE en dosis tróficas para mantener la barrera intestinal, evitando disbiosis y translocación bacteriana. Asimismo, el uso de NP continúa en constante debate, no solo su utilidad, sino también los riesgos que implica su incorporación debido a los cuidados del circuito. El SN durante y después de la estancia en UCI es de gran importancia, ya que existe un incremento de los requerimientos calóricos hasta del 150% (Fig. 2), por lo que el uso de suplementos nutricionales es de gran ayuda para este grupo poblacional. Sin embargo, debido a la escasez de información (ensayos clínicos y/o metaanálisis) no es posible emitir recomendaciones en cuanto a su uso en pacientes con ECMO. Todo dependerá del contexto clínico, el estado hemodinámico, siempre tomando como base las guías ESPEN/ASPEN para la práctica clínica diaria.











 text new page (beta)
text new page (beta)


