Introducción
La estimulación ventricular derecha desde ápex, septo o tracto de salida del ventrículo derecho (VD) tiene un efecto deletéreo sobre la contracción ventricular1-4. Este fenómeno puede condicionar el deterioro clínico en caso de disfunción ventricular previa2 e incluso la aparición de clínica de insuficiencia cardiaca3,4 o el desarrollo de una miocardiopatía inducida por estimulación5,6.
La estimulación hisiana (EH) es la forma más fisiológica de estimulación ventricular permanente. La EH ha demostrado ser capaz de reducir eventos adversos (miocardiopatía, insuficiencia cardiaca y mortalidad) en comparación con la estimulación desde ápex del VD7,8.
Desafortunadamente, existen diversos factores que limitan la generalización de la EH: progresión del bloqueo hacia zonas distales al electrodo, modesta tasa de implantes exitosos, umbrales elevados y posibilidad de aumento de umbrales de forma tardía en relación con microdislocación del electrodo9-11. Por último, la EH puede no ser factible en pacientes cuyo nivel de bloqueo se encuentre en la porción más distal del haz de His12.
Huang et al. han demostrado recientemente la posibilidad de realizar una estimulación fisiológica en el área de la rama izquierda, inmediatamente distal al haz de His13. La estimulación en el área de la rama izquierda del haz de His (ERI) permitiría capturar el sistema His-Purkinje distal al haz de His, manteniendo la sincronía ventricular. La ERI tendría la ventaja de presentar umbrales de estimulación más bajos, mayor estabilidad del electrodo y una detección de mayor amplitud14. La ERI se ha empleado con éxito en el contexto de necesidad de estimulación ventricular15, así como en la corrección de un bloqueo de rama izquierda, como alternativa a la terapia de resincronización cardiaca (TRC) convencional16. Sin embargo el número de pacientes incluidos en las publicaciones es reducido y aún no se ha estudiado de forma aleatorizada frente a la TRC convencional. Además, la evolución de parámetros analíticos, en particular de los péptidos natriuréticos (NT-proBNP), asociada a la ERI, no ha sido descrita hasta el momento en la literatura.
Por este motivo diseñamos un estudio que estudiara de forma prospectiva los parámetros clínicos, eléctricos, hemodinámicos y analíticos de pacientes sometidos a estimulación ventricular permanente desde el área de la rama izquierda, tanto en pacientes con indicación de estimulación convencional como de TRC.
Material y métodos
Población de estudio
Se incluyeron pacientes consecutivos remitidos a nuestra unidad para implante de un dispositivo de estimulación cardiaca permanente, tanto de marcapasos (MP) convencional como de un dispositivo de TRC. Los criterios de inclusión en el estudio fueron: a) edad > 18 años; b) indicación establecida para implante de dispositivo de estimulación ventricular permanente/TRC según las actuales guías de práctica clínica17, y c) capacidad para firmar el consentimiento informado.
Los criterios de exclusión del estudio fueron: a) bajo porcentaje de estimulación ventricular previsto (enfermedad del nodo sinusal); b) embarazo; c) alergia al contraste yodado, y d) incapacidad para seguir controles previstos en el estudio.
Protocolo de estudio
Los pacientes eran sometidos a un ecocardiograma y una analítica de sangre para estimar el NT-proBNP antes del implante del dispositivo. Una vez implantado se repetía tanto el ecocardiograma como la analítica transcurridas al menos cuatro semanas del implante. La primera visita postimplante se realizaba transcurridas 12 semanas desde el implante.
La clase funcional del paciente era asimismo valorada previa al implante y en la visita clínica a las 12 semanas del implante.
Implante del electrodo en el área de la rama izquierda
El implante del electrodo de estimulación en el área de la rama izquierda se llevó a cabo siguiendo la técnica descrita previamente por Huang et al.18. El electrodo empleado en todos los casos fue el 3830-69 SelectSecure (Medtronic Inc, Minneapolis, MN) y el catéter utilizado para ello el C315His (Medtronic Inc, Minneapolis, MN).
La ubicación del electrodo se comprobó mediante la proyección oblicua anterior izquierda y la penetración en el septo interventricular fue demostrada con el uso de contraste yodado (Fig. 1A). Para considerar la existencia de captura de la rama izquierda se emplearon los criterios descritos recientemente por Chen et al.19 (Fig. 1B, Fig. 2 A y B).

Figura 1 A: septograma que demuestra la correcta penetración del electrodo de estimulación en el septo interventricular. B: visualización del potencial de rama izquierda (canal de HISd).

Figura 2 A: estimulación septal profunda con captura de la rama izquierda, obteniendo un patrón morfológico de bloqueo completo de rama derecha del haz de His (BCRDHH). B: ejemplo de medición del tiempo de activación del ventrículo izquierdo (LVAT) para confirmar la captura del tejido específico de conducción en el área de la rama izquierda.
Valoración hemodinámica y electrocardiográfica
La valoración funcional del VI fue realizada mediante un ecocardiograma transtorácico (ETT) por un operador ciego al dispositivo implantado. Se realizó un ETT previo al implante y uno posterior, transcurridas al menos cuatro semanas de este. Se calculó la fracción de eyección del ventrículo izquierdo (FEVI) por el método de Simpson biplano.
Se recopilaron los electrocardiogramas (ECG) previos al implante e inmediatamente posteriores realizados con el polígrafo multicanal Cardiolab Prucka (GE Inc., Wisconsin, EE.UU.), así se obtuvieron los valores de anchura del complejo QRS (QRSd) previos y posteriores al implante, medidos ambos en milisegundos (ms). Por último, se obtuvo el tiempo de activación ventricular izquierdo (LVAT), medido desde el artefacto de estimulación hasta el pico de activación en las derivaciones V5 o V6 del ECG de superficie.
Seguimiento del dispositivo y valoración funcional
El seguimiento del dispositivo se realizó trascurridas 12 semanas desde su implante. Este fue llevado a cabo en la consulta de dispositivos por un cardiólogo electrofisiólogo. En dicha consulta también se valoró la clase funcional (CF) de la New York Heart Association (NYHA) del paciente posterior al implante.
Análisis estadístico
Se obtuvieron estadísticos descriptivos de frecuencia de las variables continuas estudiadas (media ± desviación estándar) y las variables categóricas (porcentaje). Antes de analizar los datos se procedió a comprobar la distribución normal de los datos empleando el test de Kolmogorov-Smirnov. Para las comparaciones entre variables cuantitativas continuas, se utilizó la prueba t de Student para muestras relacionadas.
El análisis estadístico se realizó con el programa SPSS, versión 25 (SPSS Inc.; Chicago, EE.UU.). Se consideraron estadísticamente significativos valores de p < 0.05.
Resultados
Se incluyeron inicialmente 58 pacientes consecutivos a los que se les realizó implante de un electrodo de estimulación en el área de la rama izquierda. De los pacientes inicialmente incluidos, se analizaron finalmente 50 debido a la incapacidad para implantar de forma exitosa el electrodo en cinco de ellos, a microdislocación del electrodo en otros dos pacientes, con pérdida de captura de rama izquierda y a la pérdida de seguimiento en un paciente por comorbilidad (neoplasia de páncreas).
Las características basales de los pacientes, así como los datos relativos al procedimiento se detallan en la tabla 1.
Tabla 1 Características basales de los pacientes*
| Variables | n (%) |
|---|---|
| Mujeres | 14 (28) |
| Edad (años) | 73 ± 9 |
| FRCV | |
| Hipertensión arterial | 35 (70) |
| Diabetes mellitus | 18 (36) |
| Dislipidemia | 33 (66) |
| Tabaquismo | 17 (34) |
| Cardiopatía previa | 34 (68) |
| Patología coronaria | 20 (40) |
| ECG basal | |
| Normal | 7 (14) |
| BCRIHH | 14 (28) |
| BCRDHH | 16 (32) |
| Ritmo estimulado por MP | 13 (26) |
| Clase funcional NYHA | |
| I | 13 (26) |
| II | 22 (44) |
| III | 14 (28) |
| IV | 1 (2) |
| Indicación | |
| MP convencional | 36 (72) |
| TRC | 14 (28) |
| Vía venosa acceso | |
| Subclavia | 13 (26) |
| Axilar | 37 (74) |
| Implante dispositivo | |
| Éxito inicial | 53 (91) |
| Duración implante (min) | 66 ± 22 |
| Tiempo escopia (min) | 9.11 ± 4.5 |
| Dosis escopia (cGycm2) | 1,700 ± 800 |
| Complicaciones | 0 (0) |
*Los valores expresan n (%) o media y desviación estándar.
FRCV: factores de riesgo cardiovascular; BCRIHH: bloqueo completo de rama izquierda del haz de His; BCRDHH: bloqueo completo de rama derecha del haz de His; MP: marcapasos; TRC: terapia de resincronización cardiaca; NYHA: New York Heart Association.
Parámetros eléctricos
Los parámetros eléctricos agudos y en el primer seguimiento del dispositivo (12 semanas) relativos al electrodo se detallan en la tabla 2. No se apreciaron diferencias significativas entre los umbrales medidos durante el procedimiento y los obtenidos al cabo de 12 semanas (0.69 vs. 0.62 V @ 0.4 ms; p = 0.13). Durante el seguimiento dos pacientes presentaron pérdida de captura de la rama izquierda, manteniendo captura miocárdica con umbrales inferiores a 0.5 V @ 0.4 ms. En ambos casos la radiografía de tórax no mostró evidencia de dislocación, por lo que se interpretó como una microdislocación del electrodo. Tras comentar la situación con los pacientes se decidió realizar una recolocación quirúrgica del electrodo, ya que ambos pacientes tenían indicación de un dispositivo de resincronización.
Estudio del electrocardiograma
La anchura basal media del QRS fue de 148 ± 21 ms. En 30 pacientes (60%) se evidenció algún trastorno de conducción intraventricular y en 13 pacientes (26%) un ritmo ventricular estimulado por marcapasos (Tabla 1). La ERI logró una reducción significativa de la anchura del complejo QRS, tanto al considerar de forma global a todos los pacientes de la muestra (148 ± 21 ms vs. 107 ± 11 ms; p = 0.029) como al estudiar de forma específica los pacientes con QRS prolongado basal (152 ± 18 ms vs. 108 ± 12 ms; p < 0.001). Al seleccionar aquellos pacientes con QRS basal estrecho (< 120 ms) no se apreció diferencias significativas entre ambos grupos (108 ± 8 ms vs. 105 ± 4 ms; p = 0.2).
Se analizó de forma específica los pacientes con trastorno de conducción intraventricular (Fig. 3). En aquellos con bloqueo completo de rama izquierda del haz de His (BCRIHH) la anchura del QRS se redujo de forma significativa con la ERI (157 ± 16 ms vs. 107 ± 11 ms; p < 0.001). En los pacientes con un bloqueo completo de rama derecha del haz de His (BCRDHH) la anchura del complejo QRS también se redujo de forma significativa con la ERI (137 ± 11 ms vs. 106 ± 9 ms; p < 0.001). Por último, en aquellos pacientes con un complejo QRS estimulado por un marcapasos, la ERI logró reducir de forma significativa la duración del QRS (163 ± 21 ms vs. 110 ± 11 ms; p < 0.001).

Figura 3 Anchura del complejo QRS obtenida mediante la estimulación desde el área de la rama izquierda en diversos subgrupos. BCRDHH: bloqueo completo de rama derecha del haz de His; BCRIHH: bloqueo completo de rama izquierda del haz de His; ERI: estimulación en el área de la rama izquierda; QRSd: anchura del complejo QRS.
El tiempo de activación medio del ventrículo izquierdo (LVAT) una vez realizada la ERI fue de 78 ± 11 ms.
Parámetros clínicos, analíticos y hemodinámicos
La CF basal media de los pacientes fue de 2.35 ± 0.7. La ERI logró una reducción significativa de la CF en el conjunto de la muestra estudiada (2.35 ± 0.7 vs. 1.8 ± 0.7; p = 0.03).
La medición de NT-proBNP previa y posterior al implante estuvo disponible en 36 pacientes sometidos a implante de MP. En estos pacientes se evidenció una reducción significativa de NT-proBNP transcurridos 78 ± 14 días (2,888.2 ± 510 pg/ml vs. 1,181 ± 130 pg/ml; p = 0.04) (Fig. 4).

Figura 4 Evolución de la concentración de péptido natriurético (NT-ProBNP) en los pacientes de nuestra serie. La concentración de NT-ProBNP se expresa en pg/ml. ERI: Estimulación en el área de la rama izquierda.
De forma global, la ERI logró un incremento significativo de la FEVI con respecto a la situación basal (52.1 ± 12% vs. 59.7 ± 9%; p < 0.001). Adicionalmente, se estudiaron de forma más detallada los siguientes subgrupos de pacientes: 1) pacientes con FEVI preservada y necesidad de estimulación ventricular; 2) pacientes con FEVI < 50% y necesidad de estimulación ventricular, y 3) pacientes con FEVI < 50% y presencia de asincronía ventricular (BCRIHH o miocardiopatía relacionada con estimulación ventricular permanente) (Fig. 5).
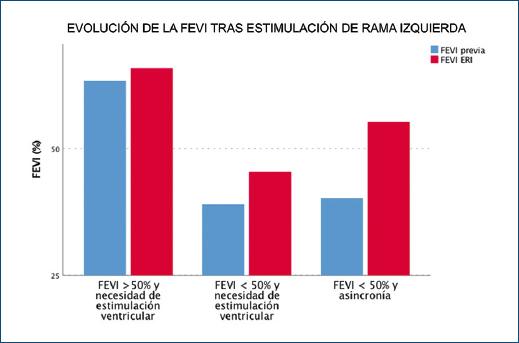
Figura 5 Evolución de la fracción de eyección del ventrículo izquierdo (FEVI) tras estimulación en el área de la rama izquierda en lo diversos subgrupos del estudio. ERI: Estimulación en el área de la rama izquierda.
En pacientes con FEVI preservada, así como en aquellos con FEVI < 50% sin asincronía de base no se aprecian diferencias de la FEVI entre la situación basal y el seguimiento a corto-medio plazo (63.4 ± 4% vs. 65.1 ± 5%; p = 0.12 y 39.1 ± 4% vs. 44 ± 5%; p = 0.06, respectivamente). Por su parte, en aquellos pacientes con FEVI < 50% y asincronía de base se evidenció un incremento significativo de la FEVI tras el implante del dispositivo de ERI (40.2 ± 7% vs. 55.2 ± 7%; p < 0.001).
Discusión
El presente estudio es la primera serie publicada sobre estimulación en el área de la rama izquierda proveniente de un centro español. Además, se trata del primer trabajo que analiza el efecto de la ERI sobre la concentración de los péptidos natriuréticos publicado hasta el momento actual.
La ERI es una técnica desarrollada durante los últimos años para lograr una estimulación ventricular más fisiológica. Una de sus fortalezas es la sencillez y reproducibilidad de la técnica que permiten una alta tasa de éxito en los implantes, con escasa dosis de escopia y sin incremento de las complicaciones13,15. Nuestros datos apoyan dicha afirmación, ya que en la mayoría de los pacientes intervenidos su logró un implante exitoso del electrodo (91%), sin que surgiera ninguna complicación aguda relacionada con el implante. Una ventaja adicional de la ERI en relación con la estimulación hisiana es la presencia de umbrales de estimulación más bajos y estables14, con menor necesidad de recolocación de electrodos en relación con incrementos bruscos de umbral. En nuestra serie el porcentaje de éxito en el implante fue similar al reportado en trabajos previos13. Los umbrales de estimulación fueron < 1 V @ 0.4 ms en la gran mayoría de los pacientes y tan solo en dos pacientes (4%) se tuvo que llevar a cabo una recolocación del electrodo de estimulación ventricular debido a la pérdida de captura de la rama izquierda, no de miocardio ventricular. En ambos casos el electrodo fue reposicionado sin complicaciones. Resulta de especial interés que el umbral de estimulación de miocardio ventricular de los electrodos microdislocados era < 0.5 V @ 0.4 ms a pesar de la pérdida de captura del sistema específico de conducción, por lo que los pacientes no sufrieron pérdida de captura en relación con la microdislocación.
Efecto de la ERI sobre los parámetros electrocardiográficos
La ERI ha demostrado en diversos trabajos ser capaz de acortar la duración del complejo QRS en comparación con la estimulación ventricular convencional (desde VD)20. Recientemente Vijayaraman et al.21 han demostrado que la ERI también es capaz de reducir la duración del complejo QRS en pacientes con indicación de un dispositivo de resincronización cardiaca. En nuestro estudio se mostró una reducción significativa de la duración del complejo QRS en aquellos pacientes con un complejo QRS basal prolongado, tanto en los pacientes con estimulación ventricular convencional como en aquellos con trastorno de la conducción intraventricular basal. De forma específica se analizaron por separado los pacientes con BCRDHH y BCRIHH demostrando en ambos subgrupos una reducción significativa de la duración del complejo QRS. La reducción en la duración del complejo QRS en el subgrupo de pacientes con BCRDHH coincide con la reportada por Vijayamaran et al.13,21. Estos datos podrían plantear en un futuro la capacidad de la ERI para realizar resincronización en pacientes con trastorno de conducción diferente al BCRIHH, máxime en pacientes con un intervalo PR prolongado.
El tiempo de activación del VI (LVAT) logrado con la ERI en nuestra serie fue similar al descrito en la literatura y cumple con la definición de captura de la rama izquierda18.
Parámetros clínicos, analíticos y hemodinámicos
La evolución clínica de pacientes con FEVI preservada sometidos a ERI fue analizada por Li et al.15. En dicho trabajo se confirmó la ausencia de deterioro clínico y de la FEVI en relación con la ERI. Por otra parte, la capacidad de mejorar la FEVI en los pacientes con indicación de TRC ha sido demostrada en diversos trabajos no aleatorizados21,22.
En nuestra serie destaca la ausencia de deterioro clínico en aquellos pacientes con CF I NYHA previa al implante, así como la mejoría significativa de la CF de los pacientes sometidos a ERI. Por el contrario, en el trabajo publicado por Tayal et al.4 se objetivó la aparición de clínica de IC de novo en un 10.4% de los pacientes sometidos a implante de un MP convencional. Además, de los pacientes que desarrollaron clínica de IC, la mayoría lo hicieron durante los primeros 30 y 180 días postimplante. En nuestra serie ningún paciente desarrolló clínica de IC de novo tras el implante del dispositivo.
La variación de la concentración de NT-proBNP lograda con la ERI no ha sido estudiada hasta el momento. Dicha variación se ha correlacionado en múltiples trabajos con la probabilidad de respuesta a la TRC convencional23. Nuestro trabajo demostró que la ERI fue capaz de reducir de forma significativa las cifras de NT-proBNP en el subgrupo de pacientes con elevación previa de NT-proBNP. Dicha reducción significativa de biomarcadores podría ser considerada como un marcador de probable respuesta favorable a la ERI.
Limitaciones
El trabajo que presentamos muestra diversas limitaciones: en primer lugar se trata de un trabajo unicéntrico con un tamaño muestral modesto, lo que limita la generalización de las conclusiones obtenidas. La concordancia con resultados obtenidos en otros estudios aporta aun así validez al presente trabajo. En segundo lugar, se trata de un estudio sin grupo control, por lo que podría estar incurriendo en sesgos; por este motivo serían necesarios trabajos con mayor tamaño muestral, grupo control y aleatorización, que permitieran confirmar las hipótesis derivadas de trabajos como el nuestro. Por último, se trata de un trabajo con un seguimiento clínico modesto, lo cual limita la posibilidad de detección de complicaciones tardías relacionadas con el electrodo de ERI, como podría ser el aumento brusco de umbrales, la pérdida de captura selectiva del His-Purkinje o bien una hipotética infección que requiriera la extracción del sistema. A pesar de lo breve del seguimiento, sí consideramos que se ha evaluado la fase de maduración del electrodo durante la cual la posibilidad de dislocación de este es mayor, sin que se haya puesto en evidencia un incremento de umbrales o una incidencia elevada de microdislocación/macrodislocación.
Conclusiones
El presente estudio demuestra como la ERI es factible en la mayoría de los pacientes en los que se intenta, sin asociarse a una mayor incidencia de complicaciones. La ERI no condiciona un efecto deletéreo sobre la FEVI a corto-medio plazo, tanto en pacientes con FEVI preservada como en pacientes con FEVI deprimida y necesidades de estimulación ventricular permanente. Además, en aquellos pacientes con FEVI deprimida en relación con fenómeno de asincronía ventricular (disfunción ventricular por estimulación ventricular o presencia de BCRIHH) la ERI permite lograr un efecto beneficioso en la FEVI, llegando a normalizarla en un buen número de pacientes probablemente por la restauración de la sincronía ventricular. La ERI logró asimismo una reducción significativa del NT-pro-BNP en aquellos pacientes con cifras basales elevadas











 text new page (beta)
text new page (beta)


