Introducción
La estenosis de venas pulmonares tiene una incidencia poblacional del 0.03%1, y puede ser congénita o adquirida (secundaria a procedimientos con ablación por radiofrecuencia, cirugía de las venas pulmonares anómalas y estados posquirúrgicos de Fontan, Mustard o Senning). Pueden estar involucradas una o varias venas pulmonares, y presentarse aislada o asociada a una cardiopatía2-5.
La estenosis congénita de venas pulmonares (ECVP) es una enfermedad cardiaca rara, difícil de diagnosticar y con frecuencia con alta mortalidad. Lo esperado es encontrar la estenosis entre la unión de la vena y el atrio izquierdo, o su asociación con hipoplasia difusa de las venas pulmonares, generalmente asociada con algunas lesiones cardiacas6.
La primera publicación se realizó en 1951 sobre un niño de 8 años que falleció como consecuencia de las complicaciones de la enfermedad7.
Hasta donde sabemos no existe otra publicación de algún paciente con ECVP sin conexión anómala de venas pulmonares y con secuestro pulmonar, por lo que presentamos nuestra experiencia de una paciente con esta patología.
Caso clínico
Niña nacida a las 30 semanas de edad gestacional con un peso de 1400 g, cianosis al llanto desde el nacimiento, falla a la alimentación y que ha presentado bronconeumonías de repetición.
Al año de edad, la exploración física revela peso de 6900 g, talla de 77 cm, frecuencia cardiaca de 148 latidos por minuto, frecuencia respiratoria de 70 respiraciones por minuto y presión arterial de 87/53 mmHg. Presenta acrocianosis al llanto. La saturación de oxígeno es del 83% al aire ambiente y del 85% con oxígeno. Aleteo nasal, deformidad torácica anteroposterior, sin soplos, 2R metálico, pulsos presentes y normales.
La radiografía de tórax mostró cardiomegalia con índice cardiotorácico de 0.64 e hilio pulmonar congestivo y líneas B de Kerley.
El electrocardiograma mostró una frecuencia cardiaca de 140 latidos por minuto, eje de A QRS- 150°, segmento S-T negativo en derivaciones derechas y crecimiento de cavidades derechas.
En ese momento se diagnosticó comunicación interauricular e hipertensión arterial pulmonar y a descartar conexión anómala de venas pulmonares. El tratamiento inicial consistió en captopril, furosemida y espironolactona.
El ecocardiograma mostró una comunicación interauricular de 10 mm, tipo seno venoso con cortocircuito mixto, hipertensión arterial pulmonar de 68 mmHg y estenosis de venas pulmonares izquierdas (por presentación la más frecuente)5 demostrada por eco-color con turbulencia y 25 mmHg de gradiente máximo (Fig. 1).

Figura 1 Ecocardiograma en color bidimensional, en el cual se observa una turbulencia en color en la vena pulmonar izquierda y crecimiento de las cavidades derechas. LA: atrio izquierdo; LV: ventrículo izquierdo; RA: atrio derecho; RV: ventrículo derecho; PV: vena pulmonar.
El cateterismo cardiaco (que es el estudio referente)5 demostró la comunicación interauricular, las cuatro venas pulmonares conectadas al atrio izquierdo, estenosis de venas pulmonares izquierdas y fístulas pulmonares derechas, con presión sanguínea de 100/46 mmHg con media de 64 mmHg (Fig. 2). La resistencia pulmonar fue de 7 UW y la sistémica de 9.1 UW.
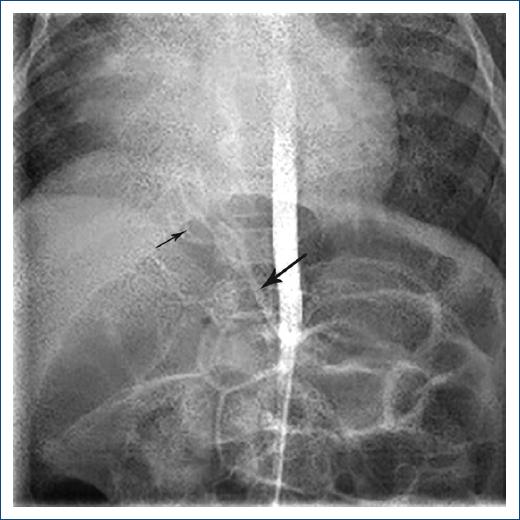
Figura 2 En el cateterismo cardiaco se observa una fístula arterial derecha (flecha gruesa) que emerge de la aorta abdominal hacia la base pulmonar derecha (secuestro) (flecha fina).
Tanto la angiografía de grandes vasos como la resonancia magnética mostraron la presencia de arteria aberrante con origen en la aorta abdominal, que irriga la porción media del lóbulo inferior derecho; se consideró secuestro pulmonar.
El ultrasonido abdominal mostró un vaso aberrante con origen en la aorta abdominal por arriba del tronco celíaco, y fístulas arteriovenosas confirmadas.
La tomografía computarizada mostró estenosis de las dos venas pulmonares izquierdas conectadas a la aurícula izquierda, ambas son confluentes de un solo tronco con estenosis de 1.9 mm de diámetro, formación de fistulas arteriovenosas originadas de un vaso arterial, ramificaciones de la aorta abdominal que cruzan el diafragma al lado derecho de la base pulmonar y se divide en dos pequeñas ramas que se anastomosan al vaso venoso (Fig. 3).

Figura 3 Tomografía computarizada en la que se observan la dilatación de las venas pulmonares izquierdas (flecha gruesa), que son confluentes, y el vaso aberrante (flecha fina).
Debido a que se decidió realizar una neumonectomía por el secuestro pulmonar (se descartó la posibilidad de colocar un oclusor vascular por cateterismo intervencionista para disminuir el flujo del secuestro pulmonar), se llevó a cabo una toracotomía posterolateral derecha y se encontró que el lóbulo inferior derecho estaba adherido a la pleura mediastinal; se realizó neumonectomía derecha, ampliación de la estenosis venosa pulmonar con ligadura y corte del vaso anómalo.
Ingresó a terapia intensiva, donde presentó hemorragia pleural (170 ml), acidosis respiratoria e hipoglucemia, sangrado a través de la cánula endotraqueal y derrame pleural de pulmón izquierdo. La paciente presentó insuficiencia respiratoria durante 8 minutos con bradicardia grave, sin respuesta al tratamiento.
La autopsia reveló múltiples malformaciones congénitas: estenosis de venas pulmonares izquierdas y malformación vascular arteriovenosa en la base del pulmón derecho, las cuales fueron corregidas quirúrgicamente. Se informó comunicación interauricular de 10 mm, hipertensión arterial pulmonar GI-II secundaria a enfermedad vascular pulmonar, hemosiderosis pulmonar e hipertrofia de cavidades derechas.
La causa de la muerte fue una hemorragia masiva pulmonar y mediastinal posoperatoria, hemotórax derecho, edema pulmonar y cerebral con degeneración hipóxico-neuronal.
Discusión
La ECVP es un problema alrededor de los días 28 a 30 de edad gestacional, en el momento en que ocurre la separación embrionaria de las venas pulmonares8. Las manifestaciones clínicas de esta patología son soplo diastólico o continuo, insuficiencia cardiaca derecha, bajo peso, dificultad respiratoria, neumonía crónica, hemoptisis, taquipnea, hipertensión y edema pulmonar1,2,9-11.
El diagnóstico se estableció con ecocardiografía Doppler-color, que mostró la ECVP y una importante obstrucción por arriba de 16 mmHg.
La velocidad del flujo no debe ser superior a 1.5 m/s y estudios previos han mostrado, en los ecocardiogramas realizados, una progresión significativa de la obstrucción, hipertrofia del ventrículo derecho y aumento de la presión sistólica de la arteria pulmonar2,3.
La ecocardiografía es un estudio específico estándar para el diagnóstico inicial de esta patología, pero con ciertas limitaciones: localización del flujo y alineación con el Doppler a 20° o menos (en pacientes con atresia pulmonar, el flujo sanguíneo podría ser menor)3,10.
El cateterismo es el método de referencia para las características de la estenosis, y el intervencionismo es útil en manos expertas, pero se considera una medida paliativa para el trasplante cardiopulmonar5.
La tomografía computarizada con reconstrucción tridimensional es la técnica de imagen complementaria de las estructuras de la anatomía del sistema vascular, así como de las venas pulmonares5. Si entendemos que es necesario disponer de los datos de la posición de las venas pulmonares con respecto al atrio para determinar el óptimo abordaje quirúrgico, las técnicas de imagen (ecocardiografía transesofágica, tomografía computarizada, resonancia magnética e imagen perfusoria) son esenciales para alcanzar la fineza en el diagnóstico final12,13.
La ECVP es un proceso patológico de engrosamiento muscular, proliferación-tortuosidad miofibroblástica de la neoíntima y alteración en la matríz extracelular, aumento de factor plaquetario, de factor vascular endotelial y de fibroblastos, con activación de receptores de la tirosina cinasa e hipertensión arterial pulmonar14,15.
El estudio patológico mostró inflamación granulomatosa y proliferación focal fibrosa de la íntima, la cual se describe como una enfermedad intraparenquimatosa2,4,8 (Fig. 4). El mecanismo de desarrollo no es bien entendido. Aparentemente, la ECVP es una lesión progresiva9,10,16.

Figura 4 El estudio patológico muestra inflamación granulomatosa y proliferación focal fibrosa de la íntima (Dra. De León-Bojorge, Dpto. Patología).
La ECVP se asocia con frecuencia a defectos cardiacos, como comunicaciones atriales o ventriculares, persistencia del conducto arterioso y ventrículos únicos (30-80%)1,3,4,6,7,17. La mayoría son de afección unilateral18,19. Nosotros no encontramos casos asociados con secuestro pulmonar.
La gravedad del caso dependerá del número de venas pulmonares afectadas, la magnitud de la obstrucción (30-46 mm/m2) y el tipo de lesión (tubular, constricción venosa arterial o lesiones múltiples hipoplásicas)2,20,21.
Los predictores para reintervención o incluso de mal pronóstico son diagnóstico tardío, antecedente de prematurez con distrés respiratorio, edad menor de 6 meses, peso inferior a 3 kg, hipertensión pulmonar, afección en la presión sistólica ventricular derecha o afección bilateral de las venas pulmonares, y cardiopatía congénita con cortocircuito de izquierda a derecha2,11,14,19,22,23.
Nuestra paciente cumplía varios factores de mal pronóstico: presencia de secuestro pulmonar asociado a hipertensión pulmonar, comunicación interauricular, antecedente de prematurez con peso bajo y diagnóstico al año de edad.
Los pacientes con estenosis o hipoplasia de venas pulmonares son de difícil manejo2,4,6,24,25. Algunas opciones se basan en el uso de betabloqueadores, digoxina, anticoagulantes, antiplaquetarios12, quimioterapia, oxígeno suplementario, bosentán para el manejo de la hipertensión pulmonar5, angioplastia con balón o colocación de stents (un desafío en niños) con sirolimus (rapamicina) para prevenir la estenosis (no son recomendables cuando las estenosis se localizan en los ostia venosos)18,26. Algunos autores consideran mejor la cirugía que el cateterismo por tener experiencias previas de reestenosis con el cateterismo16. En todo el mundo la experiencia es limitada para la intervención percutánea en niños12. Se requiere experiencia para las diferentes técnicas quirúrgicas: endovenectomía o venoplastia con utilización de pericardio o parches de safena, o marsupialización con pericardio, reparación con parche (técnica clásica) o sin sutura pericárdica (técnica actual)1,4,6,12,25-28. Nosotros todavía carecemos de experiencia para considerar algunas de estas técnicas. Muchos de estos procedimientos son paliativos hasta el tratamiento final de trasplante de corazón-pulmón16.
En todos estos pacientes hay una incidencia alta de reestenosis (50%), debido a la gran proliferación de la neoíntima, 4 a 8 semanas después del tratamiento1,2,8,9,17,28, lo cual presta la posibilidad a una segunda intervención antes de 6 meses, con reoperación del 40% y mortalidad del 30%29. Esto hace que el tratamiento de esta patología sea difícil y tenga un mal pronóstico8,9,21.
Se ha publicado una escala para el pronóstico posquirúrgico en cuanto a riesgo de reestenosis y reoperación que toma en cuenta el gradiente de obstrucción de las venas pulmonares, si la enfermedad es unilateral o bilateral, el aspecto de la lesión difuso o focal (lo más grave es atresia u oclusión) y si la técnica quirúrgica se lleva a cabo con o sin sutura29.
En cuanto al pronóstico, se ha reportado que en los prematuros la sobrevida a 2 años es del 43%, en los niños menores de 1 año la mortalidad es de alrededor del 65% y en los mayores de esa edad es del 17%16.
La mortalidad global a 7 meses del diagnóstico por insuficiencia cardiaca es del 44%5 y a 3 años es del 49%23. La sobrevida a 5 años en los grupos de Boston y Toronto fue del 58% y el 64%, respectivamente22. Con broncodisplasia pulmonar e hipertensión arterial pulmonar la cirugía es muy riesgosa y quizá se requiere cateterismo intervencionista previo16. Nuestra experiencia en una serie de pacientes es muy limitada.
Desde la primera cirugía correctiva de ECVP en 1971 hasta la fecha el pronóstico sigue siendo pobre.
La neumonectomía está indicada en casos con hemoptisis. El trasplante es otra opción, pero con las posibles complicaciones conocidas, como inmunosupresión, neoplasias y bronquitis obliterativa1,24.
En nuestra paciente, con diagnóstico de comunicación interauricular, había una sospecha clínica de obstrucción del lado izquierdo del corazón debido a los datos de hipertensión venocapilar pulmonar observados en la radiografía de tórax. El ecocardiograma apoyó el diagnóstico inicial.
Nosotros consideramos apropiada la corrección quirúrgica de la ECVP al mismo tiempo que llevar a cabo la neumonectomía, aunque desafortunadamente la paciente falleció debido a una hemorragia en el sitio de la incisión durante el posoperatorio inmediato.
Conclusiones
La estenosis de venas pulmonares debe ser descartada en todo niño prematuro con hipertensión pulmonar con o sin cardiopatía congénita, y debe realizarse un ecocardiograma en manos expertas para confirmar el diagnóstico.
Siempre, ante la sospecha de hipertensión venocapilar pulmonar, hay que revisar con ecocardiografía color y Doppler la luz de las venas pulmonares.
El tratamiento de la estenosis de venas pulmonares es uno de los mayores desafíos entre las enfermedades cardiovasculares. Se requiere experiencia interinstitucional.











 text new page (beta)
text new page (beta)


